プロトカドヘリン17は軸索の集団的な伸長をささえる
林 周一・竹市雅俊
(理化学研究所発生・再生科学総合研究センター 高次構造形成研究グループ)
email:林 周一,竹市雅俊
DOI: 10.7875/first.author.2014.122
Protocadherin-17 mediates collective axon extension by recruiting actin regulator complexes to interaxonal contacts.
Shuichi Hayashi, Yoko Inoue, Hiroshi Kiyonari, Takaya Abe, Kazuyo Misaki, Hiroyuki Moriguchi, Yo Tanaka, Masatoshi Takeichi
Developmental Cell, 30, 673-687 (2014)
神経回路の形成の過程において,機能的に同じグループに属するニューロンの軸索はまとまって伸長し束を形成するが,その際,軸索のあいだでどのような情報のやりとりが行われているのかについては不明な点が多い.筆者らは,この研究において,カドヘリンスーパーファミリーに属するプロトカドヘリン17が軸索の集団的な伸長をささえる役割をはたしていることを明らかにした.プロトカドヘリン17はマウスの扁桃体の特定のニューロンにおいて発現し,そのホモフィリックな活性により軸索どうしの接触部位に局在する.プロトカドヘリン17のノックアウトマウスでは,この扁桃体からの軸索が減少した.一方,プロトカドヘリン17を発現していない扁桃体のニューロンにプロトカドヘリン17を強制発現させると軸索の束の形成パターンが変化したことから,プロトカドヘリン17は軸索の集団的な伸長を制御していることが示唆された.in vitroにおける軸索の伸長を観察したところ,野生型の成長円錐はほかの軸索にそって伸長できたのに対し,プロトカドヘリン17を欠損させた成長円錐はほかの軸索と接触した箇所で運動を停止した.また,プロトカドヘリン17は細胞の接触部位にWAVE複合体を含むアクチン重合制御タンパク質を集結させ,細胞の接触部位の運動性を活性化することがわかった.この分子機構により,プロトカドヘリン17は軸索がほかの軸索に接触しながら伸長する運動をささえる役割をはたすと考えられた.
神経回路の形成の過程では,それぞれの軸索は脳において決められた経路にそって伸長し別のニューロンに到達する.その過程で,機能的に同じグループのニューロンの軸索は束を形成しながら伸長することが知られているが,となりあう軸索がどのように互いを認識し,また,どのような情報のやりとりが行われているのかについては明らかにされていなかった.
プロトカドヘリンはカドヘリンスーパーファミリーに属する膜タンパク質で,クラスター型プロトカドヘリンと非クラスター型プロトカドヘリンとに分けられる1).クラスター型プロトカドヘリンはゲノムにおいて直列に並ぶ複数の遺伝子コード領域(可変領域)から確率的に一部が選択され不変領域とともに転写されるしくみをもつ.一方,非クラスター型プロトカドヘリンは通常の遺伝子と同様のゲノム構造をもつ.クラスター型プロトカドヘリンの機能はながらく謎であったが,最近の研究により,プロトカドヘリンγは哺乳類の網膜および小脳においてニューロンの樹状突起の自己忌避反応を制御していることが示された2).非クラスター型プロトカドヘリンは脊椎動物の神経組織に広く発現しており,その変異はヒトのさまざまな精神疾患にかかわることが報告されている3).そのなかで,プロトカドヘリン8,プロトカドヘリン10,プロトカドヘリン17,プロトカドヘリン18,プロトカドヘリン19から構成されるδ2グループには,以下のような機能が報告されている.ゼブラフィッシュにおいてプロトカドヘリン19をノックダウンすると神経管形成期における細胞運動が阻害される4).プロトカドヘリン10ノックアウトマウスでは線条体のニューロンにおいて軸索の伸長が阻害される5).また,プロトカドヘリン10を培養細胞に発現させると細胞運動が活性化される6).これらのことから,δ2グループのプロトカドヘリンが細胞接着に依存して細胞運動を制御し,軸索の伸長などを制御していることが予想されたが,その分子機構は明らかにされていなかった.
この研究では,δ2グループのうち機能が未知であるプロトカドヘリン17に着目した.プロトカドヘリン17は発生期のマウスの脳において扁桃体などさまざまな領域に発現している.扁桃体は複数の神経核からなり,情動反応および記憶の制御にかかわる脳の領域である.筆者らは,プロトカドヘリン17が扁桃体の特定の神経核に発現し,そこから伸長する軸索どうしの接触部位にアクチン重合制御タンパク質を集結させることにより軸索の運動性を維持し,軸索の集団的な伸長をささえるのにはたらくことを明らかにした.
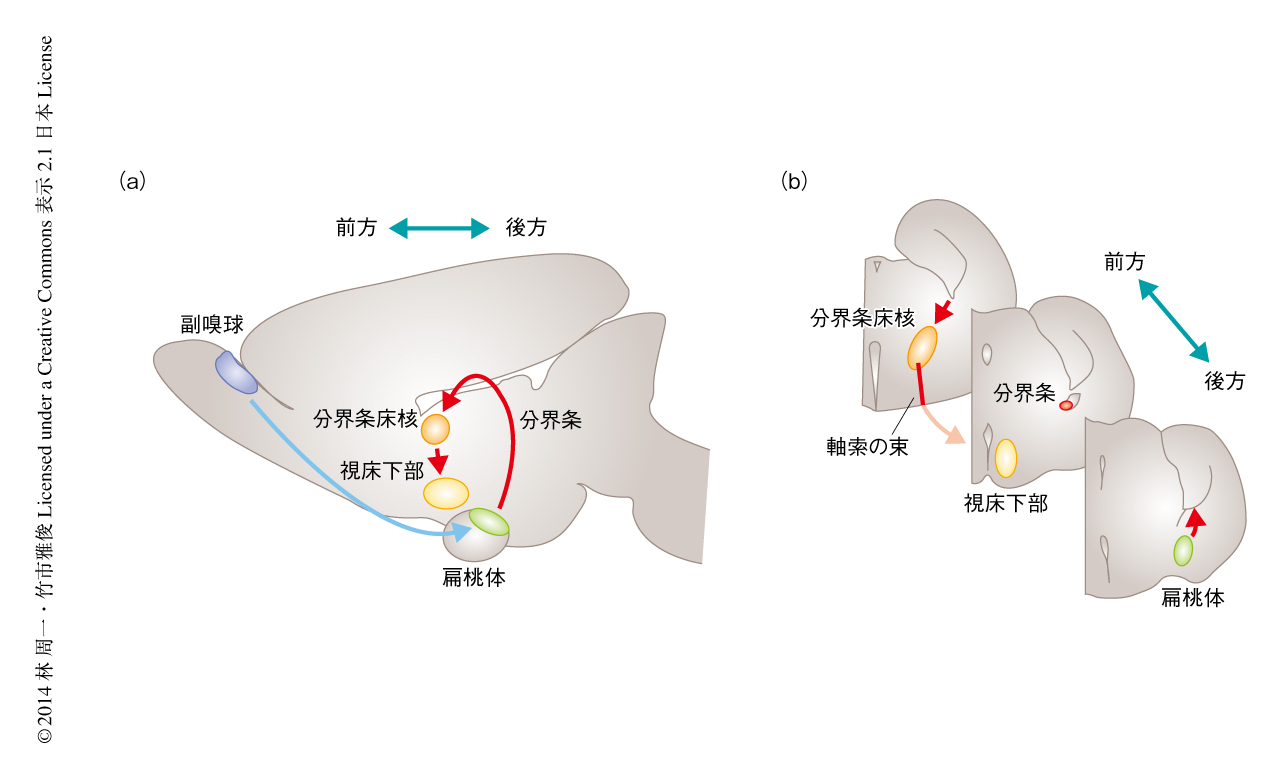
まず,in situハイブリダイゼーション法を用いてマウスの発生期におけるプロトカドヘリン17の遺伝子の発現を調べたところ,プロトカドヘリン17のmRNAは扁桃体の内側核や基底外側核に局在することがわかった.プロトカドヘリン17を認識する抗体を用いてその局在を調べると,プロトカドヘリン17は扁桃体から分界条をとおって視床下部の方面へ伸長する軸索に検出された7)(図1).プロトカドヘリン17を発現するニューロンのマーカーを探索したところ,プロトカドヘリン17は転写因子Lhx6を発現するニューロンの軸索,および,軸索ガイダンスタンパク質であるニューロピリン1を発現する軸索に発現していることがわかった.扁桃体の内側核においてLhx6を発現するニューロンは,分界条をとおって視床下部の方面へ投射することが報告されている.そこで,Lhx6に依存的に膜移行型の蛍光タンパク質が発現するようなレポーターマウスを作製しプロトカドヘリン17の局在を調べると,プロトカドヘリン17はLhx6陽性ニューロンの軸索に存在することが確認された.プロトカドヘリン17のノックアウトマウスを作製してその脳を観察したところ,扁桃体から視床下部の方面へ伸長する軸索は減少していた.プロトカドヘリン17ノックアウトマウスにおいて扁桃体の神経核の形成に異常はなく,また,細胞体からの距離が離れるにつれて軸索は減少したことから,プロトカドヘリン17は軸索の伸長に必要であることが示唆された.
その原因を探るため,in vitroにおいて,野生型マウスおよびプロトカドヘリン17ノックアウトマウスの扁桃体から軸索が伸長する過程を比較した.さきに述べたように,Lhx6に依存的に軸索を標識することにより,野生型マウスにおいてはプロトカドヘリン17を発現する軸索が,プロトカドヘリン17ノックアウトマウスにおいてはプロトカドヘリン17を欠損した軸索が,それぞれ蛍光標識される実験系を構築した.これらのマウスから扁桃体を取り出して培養し,組織片から伸長する軸索を蛍光ライブイメージング法により観察したところ,野生型の軸索はほかの軸索と接触してもその軸索にそって伸長をつづけたのに対し,プロトカドヘリン17を欠損した軸索はほかの軸索と接触すると伸長を停止した.このことから,プロトカドヘリン17は軸索どうしが接触しながら伸長をつづけるために必要なことが明らかになった.
子宮内電気穿孔法を用いて,本来はプロトカドヘリン17を発現しない扁桃体のニューロンにプロトカドヘリン17を強制発現させた.その結果,扁桃体から伸長する軸索の束の形成パターンが変化し,プロトカドヘリン17を強制発現させた軸索が内在性のプロトカドヘリン17をもつ軸索といっしょに伸長するようになった.この結果は,プロトカドヘリン17が軸索の集団的な伸長を制御していることを示した.また,この軸索の伸長パターンの変化は,細胞内ドメインの大部分を欠失した変異型のプロトカドヘリン17を強制発現したときにもひき起こされたことから,プロトカドヘリン17の細胞外ドメインによるホモフィリックな相互作用が軸索の束の形成パターンの制御に重要であることが明らかになった.しかし,細胞内ドメインを欠失した変異型プロトカドヘリン17の強制発現により軸索の過剰な凝集が起こったことから,プロトカドヘリン17の細胞外ドメインのもつ接着活性に対し,細胞内ドメインがそれを制御する役割のあることが示唆された.
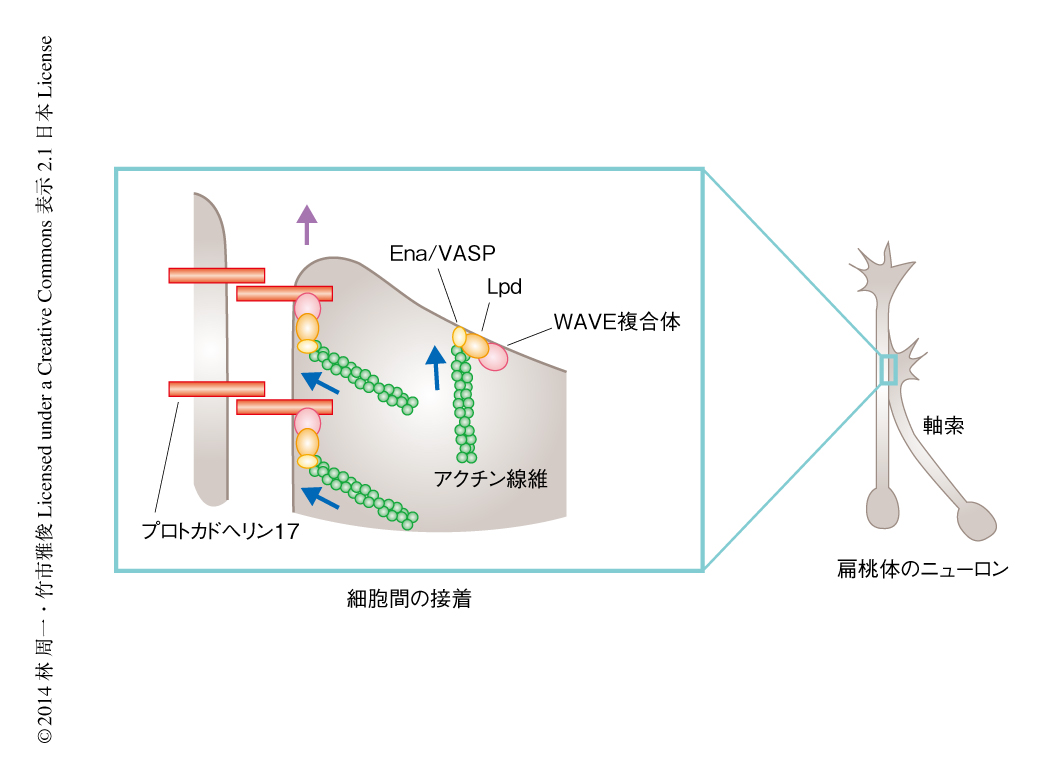
プルダウンアッセイ法と質量分析法を用いてプロトカドヘリン17と相互作用するタンパク質を探索したところ,アクチンの重合を制御するWAVE複合体の構成タンパク質であるNap1が同定された.WAVE複合体はWAVE,Nap1のほかSra1/Cyfip1,Abi-1を含み,アクチンの枝分かれ構造をつくるArp2/3を活性化することが知られている8).しかし,プロトカドヘリン17の下流においては,WAVE複合体はおもにLpdとの結合を介し,アクチン線維の伸長を制御するEna/VASP 9) を制御していることがわかった.実際に,プロトカドヘリン17陽性の成長円錐がほかのプロトカドヘリン17陽性の軸索と接触する部位では,プロトカドヘリン17とともにこれらアクチン重合タンパク質が共局在し,プロトカドヘリン17を欠損した成長円錐と軸索との接触部位では消失していた.プロトカドヘリン17を欠損した成長円錐がほかの軸索との接触部位で運動を停止するというさきの結果とあわせて考えると,プロトカドヘリン17は成長円錐と軸索との接触部位にWAVEを含むアクチン重合制御タンパク質を集結させることにより,成長円錐の運動性を維持していると考えられた.
軸索の先端と同様に活発な葉状仮足をもつヒトに由来するU251培養細胞を用いて,プロトカドヘリン17の機能をさらにくわしく調べた.このU251培養細胞を使うことにより,軸索においてはむずかしい,プロトカドヘリン17とアクチン重合制御タンパク質,細胞の運動性との関係を詳細に解析することが可能になった.その結果,細胞の接触部位ではプロトカドヘリン17とWAVE複合体とが相互作用し,さらに,WAVEとLpd,LpdとEna/VASPとが相互作用することにより,これらのアクチン重合制御タンパク質が濃縮されていることがわかった.さらに,これらのアクチン重合制御タンパク質の濃縮により,細胞の接触部位が葉状仮足と同じような独特の構造を獲得し,運動性が増加することが明らかになった.ノックダウン実験により,この接触部位の独特な構造の形成にはWAVE複合体およびLpdが必須であること,Ena/VASPは細胞の接触部位の運動性の増加に重要であることがわかった.Ena/VASPはアクチン線維の伸長を制御することから9),Ena/VASPによるアクチンの重合の制御が細胞の運動性の増加をひき起こすことが示唆された.
δ2グループのプロトカドヘリンは,EカドヘリンやNカドヘリンなどのクラシカルカドヘリンと同様にホモフィリックな作用を示すが,クラシカルカドヘリンに比べ弱い細胞接着しか誘導できないことが報告されている.この研究においても,プロトカドヘリン17はホモフィリックな作用により細胞の接触部位に濃縮したが,クラシカルカドヘリンが安定な接着を誘導するのに対して,Pcdh17はむしろ細胞の接触部位の運動性を向上させるという作用が明らかになった.
この細胞間の接着と運動の活性化という,いっけん両立のむずかしい機能をδ2グループのプロトカドヘリンがはたすことにより,細胞間の協調的な運動が生み出されているようであった.細胞間の接着と運動との関係においては,“細胞運動の接触阻止”(contact inhibition of locomotion)が知られている10).これは,運動している細胞どうしが接触すると,その細胞の先導端の運動が抑制されて細胞運動が停止するという現象であるが,この分子機構にはいまだ不明な点が多い.この研究において,プロトカドヘリン17を欠損した成長円錐がほかの軸索との接触部位で運動を停止した現象は接触阻止により説明が可能であった.野生型の成長円錐とほかの軸索との接触部位では,プロトカドヘリン17およびWAVEを含むアクチン重合タンパク質が濃縮し,接触阻止に拮抗することにより成長円錐の運動が維持されるのではないかと考えられた.実際に,培養細胞を使った実験では,プロトカドヘリン17により細胞の接触部位に葉状仮足と同様の構造が誘導され,接触部位の運動性が上昇した.以上の結果にもとづき,プロトカドヘリン17によりとなりあう軸索の運動性が維持されることにより,プロトカドヘリン17を発現する軸索の集団的な伸長がひき起こされるというモデルを提示した(図2).
略歴:2008年 東京大学大学院理学系研究科 修了,同年より理化学研究所発生・再生科学総合研究センター 研究員.
研究テーマ:プロトカドヘリンによる神経回路の形成の制御.
竹市 雅俊(Masatoshi Takeichi)
理化学研究所発生・再生科学総合研究センター グループディレクター.
研究室URL:http://www.cdb.riken.jp/ctp/
© 2014 林 周一・竹市雅俊 Licensed under CC 表示 2.1 日本
(理化学研究所発生・再生科学総合研究センター 高次構造形成研究グループ)
email:林 周一,竹市雅俊
DOI: 10.7875/first.author.2014.122
Protocadherin-17 mediates collective axon extension by recruiting actin regulator complexes to interaxonal contacts.
Shuichi Hayashi, Yoko Inoue, Hiroshi Kiyonari, Takaya Abe, Kazuyo Misaki, Hiroyuki Moriguchi, Yo Tanaka, Masatoshi Takeichi
Developmental Cell, 30, 673-687 (2014)
要 約
神経回路の形成の過程において,機能的に同じグループに属するニューロンの軸索はまとまって伸長し束を形成するが,その際,軸索のあいだでどのような情報のやりとりが行われているのかについては不明な点が多い.筆者らは,この研究において,カドヘリンスーパーファミリーに属するプロトカドヘリン17が軸索の集団的な伸長をささえる役割をはたしていることを明らかにした.プロトカドヘリン17はマウスの扁桃体の特定のニューロンにおいて発現し,そのホモフィリックな活性により軸索どうしの接触部位に局在する.プロトカドヘリン17のノックアウトマウスでは,この扁桃体からの軸索が減少した.一方,プロトカドヘリン17を発現していない扁桃体のニューロンにプロトカドヘリン17を強制発現させると軸索の束の形成パターンが変化したことから,プロトカドヘリン17は軸索の集団的な伸長を制御していることが示唆された.in vitroにおける軸索の伸長を観察したところ,野生型の成長円錐はほかの軸索にそって伸長できたのに対し,プロトカドヘリン17を欠損させた成長円錐はほかの軸索と接触した箇所で運動を停止した.また,プロトカドヘリン17は細胞の接触部位にWAVE複合体を含むアクチン重合制御タンパク質を集結させ,細胞の接触部位の運動性を活性化することがわかった.この分子機構により,プロトカドヘリン17は軸索がほかの軸索に接触しながら伸長する運動をささえる役割をはたすと考えられた.
はじめに
神経回路の形成の過程では,それぞれの軸索は脳において決められた経路にそって伸長し別のニューロンに到達する.その過程で,機能的に同じグループのニューロンの軸索は束を形成しながら伸長することが知られているが,となりあう軸索がどのように互いを認識し,また,どのような情報のやりとりが行われているのかについては明らかにされていなかった.
プロトカドヘリンはカドヘリンスーパーファミリーに属する膜タンパク質で,クラスター型プロトカドヘリンと非クラスター型プロトカドヘリンとに分けられる1).クラスター型プロトカドヘリンはゲノムにおいて直列に並ぶ複数の遺伝子コード領域(可変領域)から確率的に一部が選択され不変領域とともに転写されるしくみをもつ.一方,非クラスター型プロトカドヘリンは通常の遺伝子と同様のゲノム構造をもつ.クラスター型プロトカドヘリンの機能はながらく謎であったが,最近の研究により,プロトカドヘリンγは哺乳類の網膜および小脳においてニューロンの樹状突起の自己忌避反応を制御していることが示された2).非クラスター型プロトカドヘリンは脊椎動物の神経組織に広く発現しており,その変異はヒトのさまざまな精神疾患にかかわることが報告されている3).そのなかで,プロトカドヘリン8,プロトカドヘリン10,プロトカドヘリン17,プロトカドヘリン18,プロトカドヘリン19から構成されるδ2グループには,以下のような機能が報告されている.ゼブラフィッシュにおいてプロトカドヘリン19をノックダウンすると神経管形成期における細胞運動が阻害される4).プロトカドヘリン10ノックアウトマウスでは線条体のニューロンにおいて軸索の伸長が阻害される5).また,プロトカドヘリン10を培養細胞に発現させると細胞運動が活性化される6).これらのことから,δ2グループのプロトカドヘリンが細胞接着に依存して細胞運動を制御し,軸索の伸長などを制御していることが予想されたが,その分子機構は明らかにされていなかった.
この研究では,δ2グループのうち機能が未知であるプロトカドヘリン17に着目した.プロトカドヘリン17は発生期のマウスの脳において扁桃体などさまざまな領域に発現している.扁桃体は複数の神経核からなり,情動反応および記憶の制御にかかわる脳の領域である.筆者らは,プロトカドヘリン17が扁桃体の特定の神経核に発現し,そこから伸長する軸索どうしの接触部位にアクチン重合制御タンパク質を集結させることにより軸索の運動性を維持し,軸索の集団的な伸長をささえるのにはたらくことを明らかにした.
1.プロトカドヘリン17は扁桃体における軸索の伸長に必要である
まず,in situハイブリダイゼーション法を用いてマウスの発生期におけるプロトカドヘリン17の遺伝子の発現を調べたところ,プロトカドヘリン17のmRNAは扁桃体の内側核や基底外側核に局在することがわかった.プロトカドヘリン17を認識する抗体を用いてその局在を調べると,プロトカドヘリン17は扁桃体から分界条をとおって視床下部の方面へ伸長する軸索に検出された7)(図1).プロトカドヘリン17を発現するニューロンのマーカーを探索したところ,プロトカドヘリン17は転写因子Lhx6を発現するニューロンの軸索,および,軸索ガイダンスタンパク質であるニューロピリン1を発現する軸索に発現していることがわかった.扁桃体の内側核においてLhx6を発現するニューロンは,分界条をとおって視床下部の方面へ投射することが報告されている.そこで,Lhx6に依存的に膜移行型の蛍光タンパク質が発現するようなレポーターマウスを作製しプロトカドヘリン17の局在を調べると,プロトカドヘリン17はLhx6陽性ニューロンの軸索に存在することが確認された.プロトカドヘリン17のノックアウトマウスを作製してその脳を観察したところ,扁桃体から視床下部の方面へ伸長する軸索は減少していた.プロトカドヘリン17ノックアウトマウスにおいて扁桃体の神経核の形成に異常はなく,また,細胞体からの距離が離れるにつれて軸索は減少したことから,プロトカドヘリン17は軸索の伸長に必要であることが示唆された.
2.プロトカドヘリン17はほかの軸索にそった成長円錐の運動に必要である
その原因を探るため,in vitroにおいて,野生型マウスおよびプロトカドヘリン17ノックアウトマウスの扁桃体から軸索が伸長する過程を比較した.さきに述べたように,Lhx6に依存的に軸索を標識することにより,野生型マウスにおいてはプロトカドヘリン17を発現する軸索が,プロトカドヘリン17ノックアウトマウスにおいてはプロトカドヘリン17を欠損した軸索が,それぞれ蛍光標識される実験系を構築した.これらのマウスから扁桃体を取り出して培養し,組織片から伸長する軸索を蛍光ライブイメージング法により観察したところ,野生型の軸索はほかの軸索と接触してもその軸索にそって伸長をつづけたのに対し,プロトカドヘリン17を欠損した軸索はほかの軸索と接触すると伸長を停止した.このことから,プロトカドヘリン17は軸索どうしが接触しながら伸長をつづけるために必要なことが明らかになった.
3.プロトカドヘリン17を異所的に強制発現すると扁桃体における軸索の伸長のパターンが変化する
子宮内電気穿孔法を用いて,本来はプロトカドヘリン17を発現しない扁桃体のニューロンにプロトカドヘリン17を強制発現させた.その結果,扁桃体から伸長する軸索の束の形成パターンが変化し,プロトカドヘリン17を強制発現させた軸索が内在性のプロトカドヘリン17をもつ軸索といっしょに伸長するようになった.この結果は,プロトカドヘリン17が軸索の集団的な伸長を制御していることを示した.また,この軸索の伸長パターンの変化は,細胞内ドメインの大部分を欠失した変異型のプロトカドヘリン17を強制発現したときにもひき起こされたことから,プロトカドヘリン17の細胞外ドメインによるホモフィリックな相互作用が軸索の束の形成パターンの制御に重要であることが明らかになった.しかし,細胞内ドメインを欠失した変異型プロトカドヘリン17の強制発現により軸索の過剰な凝集が起こったことから,プロトカドヘリン17の細胞外ドメインのもつ接着活性に対し,細胞内ドメインがそれを制御する役割のあることが示唆された.
4.プロトカドヘリン17は軸索どうしの接触部位にWAVE複合体を含むアクチン重合制御タンパク質を集結させる
プルダウンアッセイ法と質量分析法を用いてプロトカドヘリン17と相互作用するタンパク質を探索したところ,アクチンの重合を制御するWAVE複合体の構成タンパク質であるNap1が同定された.WAVE複合体はWAVE,Nap1のほかSra1/Cyfip1,Abi-1を含み,アクチンの枝分かれ構造をつくるArp2/3を活性化することが知られている8).しかし,プロトカドヘリン17の下流においては,WAVE複合体はおもにLpdとの結合を介し,アクチン線維の伸長を制御するEna/VASP 9) を制御していることがわかった.実際に,プロトカドヘリン17陽性の成長円錐がほかのプロトカドヘリン17陽性の軸索と接触する部位では,プロトカドヘリン17とともにこれらアクチン重合タンパク質が共局在し,プロトカドヘリン17を欠損した成長円錐と軸索との接触部位では消失していた.プロトカドヘリン17を欠損した成長円錐がほかの軸索との接触部位で運動を停止するというさきの結果とあわせて考えると,プロトカドヘリン17は成長円錐と軸索との接触部位にWAVEを含むアクチン重合制御タンパク質を集結させることにより,成長円錐の運動性を維持していると考えられた.
5.細胞の接触部位はプロトカドヘリン17により葉状仮足と同様の運動性をもつ
軸索の先端と同様に活発な葉状仮足をもつヒトに由来するU251培養細胞を用いて,プロトカドヘリン17の機能をさらにくわしく調べた.このU251培養細胞を使うことにより,軸索においてはむずかしい,プロトカドヘリン17とアクチン重合制御タンパク質,細胞の運動性との関係を詳細に解析することが可能になった.その結果,細胞の接触部位ではプロトカドヘリン17とWAVE複合体とが相互作用し,さらに,WAVEとLpd,LpdとEna/VASPとが相互作用することにより,これらのアクチン重合制御タンパク質が濃縮されていることがわかった.さらに,これらのアクチン重合制御タンパク質の濃縮により,細胞の接触部位が葉状仮足と同じような独特の構造を獲得し,運動性が増加することが明らかになった.ノックダウン実験により,この接触部位の独特な構造の形成にはWAVE複合体およびLpdが必須であること,Ena/VASPは細胞の接触部位の運動性の増加に重要であることがわかった.Ena/VASPはアクチン線維の伸長を制御することから9),Ena/VASPによるアクチンの重合の制御が細胞の運動性の増加をひき起こすことが示唆された.
おわりに
δ2グループのプロトカドヘリンは,EカドヘリンやNカドヘリンなどのクラシカルカドヘリンと同様にホモフィリックな作用を示すが,クラシカルカドヘリンに比べ弱い細胞接着しか誘導できないことが報告されている.この研究においても,プロトカドヘリン17はホモフィリックな作用により細胞の接触部位に濃縮したが,クラシカルカドヘリンが安定な接着を誘導するのに対して,Pcdh17はむしろ細胞の接触部位の運動性を向上させるという作用が明らかになった.
この細胞間の接着と運動の活性化という,いっけん両立のむずかしい機能をδ2グループのプロトカドヘリンがはたすことにより,細胞間の協調的な運動が生み出されているようであった.細胞間の接着と運動との関係においては,“細胞運動の接触阻止”(contact inhibition of locomotion)が知られている10).これは,運動している細胞どうしが接触すると,その細胞の先導端の運動が抑制されて細胞運動が停止するという現象であるが,この分子機構にはいまだ不明な点が多い.この研究において,プロトカドヘリン17を欠損した成長円錐がほかの軸索との接触部位で運動を停止した現象は接触阻止により説明が可能であった.野生型の成長円錐とほかの軸索との接触部位では,プロトカドヘリン17およびWAVEを含むアクチン重合タンパク質が濃縮し,接触阻止に拮抗することにより成長円錐の運動が維持されるのではないかと考えられた.実際に,培養細胞を使った実験では,プロトカドヘリン17により細胞の接触部位に葉状仮足と同様の構造が誘導され,接触部位の運動性が上昇した.以上の結果にもとづき,プロトカドヘリン17によりとなりあう軸索の運動性が維持されることにより,プロトカドヘリン17を発現する軸索の集団的な伸長がひき起こされるというモデルを提示した(図2).
文 献
- Hulpiau, P. & van Roy, F.: Molecular evolution of the cadherin superfamily. Int. J. Biochem. Cell Biol., 41, 349-369 (2009)[PubMed]
- Lefebvre, J. L., Kostadinov, D., Chen, W. V. et al.: Protocadherins mediate dendritic self-avoidance in the mammalian nervous system. Nature, 488, 517-521 (2012)[PubMed]
- Kim, S. Y., Yasuda, S., Tanaka, H. et al.: Non-clustered protocadherin. Cell Adh. Migr., 5, 97-105 (2011)[PubMed]
- Biswas, S., Emond, M. R. & Jontes, J. D.: Protocadherin-19 and N-cadherin interact to control cell movements during anterior neurulation. J. Cell Biol., 191, 1029-1041 (2010)[PubMed]
- Uemura, M., Nakao, S., Suzuki, S. T. et al.: OL-Protocadherin is essential for growth of striatal axons and thalamocortical projections. Nat. Neurosci., 10, 1151-1159 (2007)[PubMed]
- Nakao, S., Platek, A., Hirano, S. et al.: Contact-dependent promotion of cell migration by the OL-protocadherin-Nap1 interaction. J. Cell Biol., 182, 395-410 (2008)[PubMed]
- Dong, H. W., Petrovich, G. D. & Swanson, L. W.: Topography of projections from amygdala to bed nuclei of the stria terminalis. Brain Res. Brain Res. Rev., 38, 192-246 (2001)[PubMed]
- Takenawa, T. & Suetsugu, S.: The WASP-WAVE protein network: connecting the membrane to the cytoskeleton. Nat. Rev. Mol. Cell Biol., 8, 37-48 (2007)[PubMed]
- Krause, M., Dent, E. W., Bear, J. E. et al.: Ena/VASP proteins: regulators of the actin cytoskeleton and cell migration. Ann. Rev. Cell Dev. Biol., 19, 541-564 (2003)[PubMed]
- Abercrombie, M.: Contact inhibition and malignancy. Nature, 281, 259-262 (1979)[PubMed]
著者プロフィール
略歴:2008年 東京大学大学院理学系研究科 修了,同年より理化学研究所発生・再生科学総合研究センター 研究員.
研究テーマ:プロトカドヘリンによる神経回路の形成の制御.
竹市 雅俊(Masatoshi Takeichi)
理化学研究所発生・再生科学総合研究センター グループディレクター.
研究室URL:http://www.cdb.riken.jp/ctp/
© 2014 林 周一・竹市雅俊 Licensed under CC 表示 2.1 日本