Nodalシグナルは刺胞動物ヒドラの出芽における2次軸の誘導に必須である
渡邉 寛・Thomas W. Holstein
(ドイツHeidelberg大学Centre for Organismal Studies,Department of Molecular Evolution and Genomics)
email:渡邉 寛
DOI: 10.7875/first.author.2014.119
Nodal signalling determines biradial asymmetry in Hydra.
Hiroshi Watanabe, Heiko A. Schmidt, Anne Kuhn, Stefanie K. Höger, Yigit Kocagöz, Nico Laumann-Lipp, Suat Özbek, Thomas W. Holstein
Nature, 515, 112-115 (2014)
刺胞動物のポリプの多くは側方出芽により分岐状のコロニーを形成する.側方出芽の際には1次軸に直交する2次軸にそった非対称性の確立により体幹部の一点から出芽が誘導される.側方出芽は刺胞動物において広くみられる形態形成の様式であるが,その分子機構はながらく不明であった.今回の研究において,刺胞動物にてNodal様のリガンドをコードするNdr遺伝子がはじめて同定され,淡水性のヒドラの出芽において2次軸にそった非対称性の確立に必須であることが明らかにされた.ヒドラにおいてNdrは予定出芽領域にて特異的に発現し,転写因子Pitxの局所的な発現の誘導を介して側方出芽を誘導した.また,Ndrの発現の誘導にはβカテニンシグナルが必須であることも明らかにされた.左右相称動物においてβカテニン-Nodal-Pitxシグナル伝達経路は,左右軸など2次軸のパターン化において保存された機能をもつことが知られている.同様のシグナル伝達経路が刺胞動物の側方分岐においても機能することが明らかにされたことは,βカテニン-Nodal-Pitxシグナル伝達経路が後生動物の進化の初期においてすでに獲得されており,2次軸の進化において重要な役割をはたした可能性を強く示唆した.
現在,われわれが目にする左右相称動物のほとんどは主要な体軸である前後軸(1次軸)をもつ.また,多くは前後軸に直交する2次軸(背腹軸および左右軸)をもつことにより形態的な左右相称性を示す.これらの基本的な体軸は,それぞれ,Wnt(前後軸),Bmp(背腹軸),Nodal(左右軸)によりパターン化されており,その機構は左右相称動物において広く保存されている.このことから,同様の分子機構は左右相称動物の共通祖先において獲得されたものと考えられている1,2).しかしながら,より単純な体制をもっていたであろう初期の後生動物において2次軸がどのように獲得されたのかについては,まだわかっていない.
今回,筆者らは,左右相称動物のもっとも近縁な姉妹群である刺胞動物を用いて3,4),2次軸の誘導の機構について解析した.刺胞動物は6億年ほどまえに左右相称動物の共通祖先から分かれたと考えられており,クラゲ,イソギンチャク,サンゴなどを含む.刺胞動物は明確な1次軸(口-反口軸)を示す放射相称動物であると一般的には認知されているが,完全な放射相称性はむしろまれであり,とくにポリプの世代において,内胚葉の形態や群体性ポリプの分岐パターンについて二放射相称性を示すことが知られている.淡水性のヒドラは組織学的に完全な放射相称性を示すポリプであり,刺胞動物のモデルとして長い研究の歴史がある.ヒドラは,体幹部からの側方出芽において,群体性ポリプと同様に二放射相称性のパターンを示すことが報告されている5).そこで,筆者らは,ヒドラの側方出芽をモデルとして,刺胞動物における二放射相称性のパターン化を制御する分子機構について解析した.
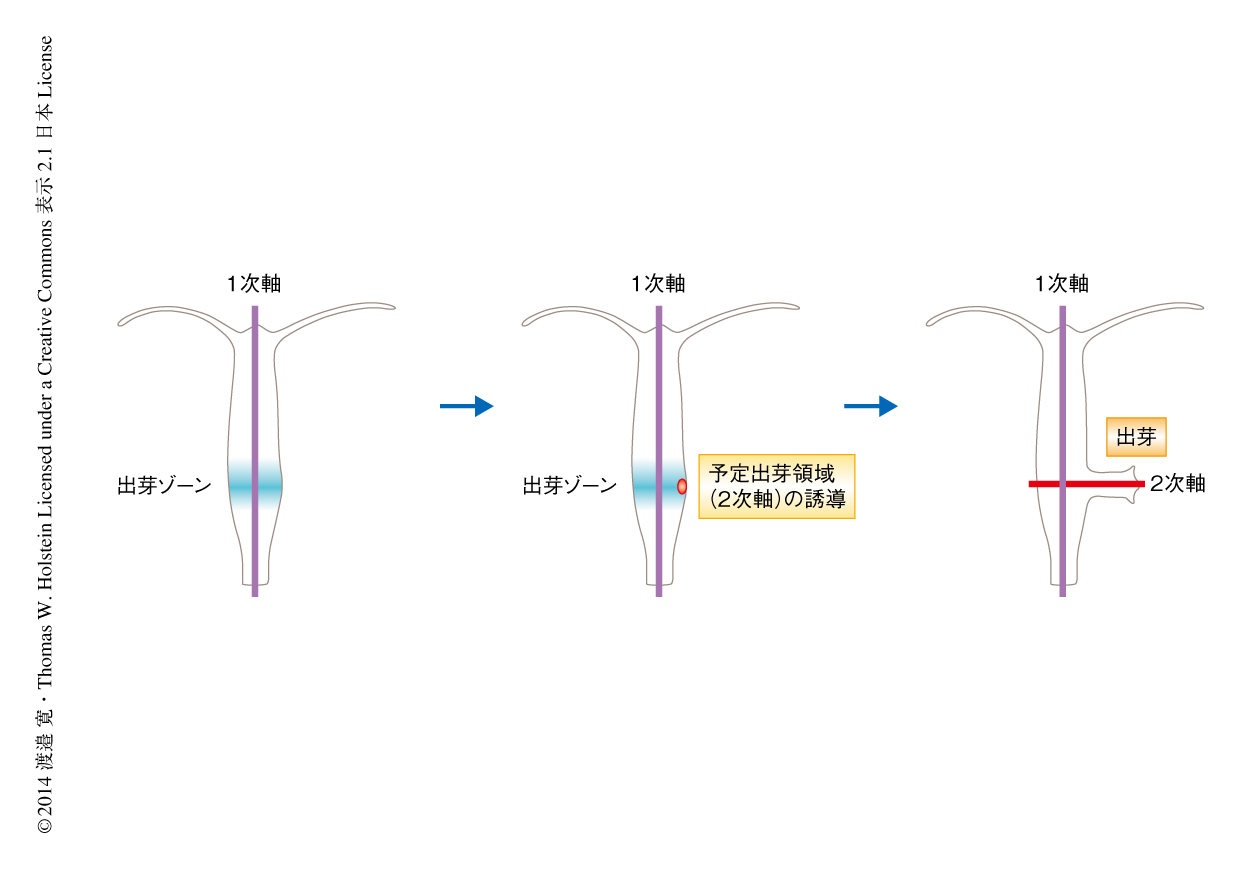
ヒドラでは,体幹部の足側に近い出芽ゾーンから口-反口軸に直交するように新たな出芽が形成される(図1).出芽はつねに1つずつであることから,組織学的に放射相称性である出芽ゾーンにおいて,口-反口軸に直交する2次軸にそって非対称性の形成されることが,予定出芽領域の決定に重要であると考えられる.そこで,予定出芽領域の決定に関与するタンパク質を同定するため,予定出芽領域において特異的に発現する遺伝子を探索することにより,TGFβスーパーファミリーに属する遺伝子を見い出した.分子系統解析によりこの遺伝子はNodal様のリガンドをコードすることが示され,Nodal様(Nodal-related:Ndr)遺伝子として左右相称動物以外でのはじめての発見となった.また,種々の刺胞動物のゲノム情報をくわえた関連遺伝子の系統ゲノム解析により,Ndr遺伝子の下流遺伝子であり転写因子をコードするPitx遺伝子などを同定し,これらNodalシグナルに関連する遺伝子は左右相称動物だけでなく刺胞動物においても広く保存されていることが明らかにされた.ヒドラにおけるホールマウントin situハイブリダイゼーション法による遺伝子の発現解析では,Ndr遺伝子は出芽ゾーンの予定出芽領域において特異的に発現が上昇し,出芽の発達とともにその発現は検出できなくなった.また,Pitx遺伝子も予定出芽領域において発現の上昇することが見い出された.予定出芽領域における局所的な発現は,TGFβスーパーファミリーに属するほかのリガンドをコードするBmp遺伝子やActivin遺伝子などでは観察されなかった.このことから,ヒドラにおいては,Ndr遺伝子の局所的かつ特異的な発現がPitx遺伝子の発現および出芽ゾーンにおける予定出芽領域の誘導(2次軸の形成)において特異的に関与することが示唆された.
ヒドラの出芽におけるNdrの機能を解析するため,精製した組換えNdrタンパク質により処理した出芽ゾーンの組織片を未処理のヒドラに移植しその作用を検証した.その結果,Ndrの処理により出芽の促進されることが明らかにされた.同様の出芽の促進効果は,正常なヒドラにおいてNdr遺伝子発現プラスミドをトランスフェクションした場合にも確認された.興味深いことに,異所的に過剰発現されたNdrは異所的な出芽を誘導できなかった.このことは,ほかのタンパク質が出芽の誘導に必要である可能性,および,Nodalシグナルに対し出芽ゾーンが特異的な感受性を示す可能性を示唆した.つぎに,ヒドラの出芽におけるNdrの要求性について検討した.さきに述べたとおり,Ndrは予定出芽領域において発現が強く誘導され,そののち,出芽の発達にともない発現の抑制される一過的な発現パターンを示す.Nodal受容体キナーゼ阻害剤を用いた実験では,Ndrの発現する出芽の初期から処理することにより出芽の形成は濃度に依存的に阻害されたのに対し,Ndrの発現のみられなくなった出芽の中期から処理した場合は出芽の発達には影響しないことが明らかになった.このことは,出芽の初期における特異的なNodalシグナルの活性化が出芽の誘導に必須の役割をはたすことを示した.さらに,siRNAによりNdrあるいはPitxをノックダウンすることにより出芽が阻害されたことから,ヒドラの出芽の誘導におけるNodalシグナルの重要性が確認された.
Ndrの発現するヒドラの予定出芽領域において,転写因子であるPitxおよびBra1(ヒドラにおける頭部オーガナイザー遺伝子にコードされる)が共発現していることが確認された.Nodal受容体キナーゼ阻害剤により処理したヒドラではPitxやBra1の予定出芽領域における発現が抑制されたことから,これらがNodalシグナルの下流の標的であることが示された.また,Ndrの発現も阻害されたことから,Ndrの発現制御において正のフィードバック機構の存在することも明らかになった(図2).さらに興味深いことに,阻害剤による処理ののち阻害剤のない条件にもどした場合,Ndr,Pitx,Bra1の発現が出芽ゾーンの全体において誘導され,その結果,出芽の領域の拡大がみられた.もっとも顕著な表現型としては,出芽ゾーンの全体において頭部マーカーが発現し2次軸における非対称性の失われたものが出現した.これらの結果は,局所的なNodalシグナルの活性化がヒドラにおける二放射相称性のパターン化に重要であることを明確に示した.さらに,阻害剤を除去したのちNdrの発現する領域が拡大することから,Nodalシグナルに依存的に発現の誘導される内在性の阻害タンパク質の存在している可能性を示唆された.すなわち,通常の出芽の誘導においてはNdrによりこの阻害タンパク質が誘導され,Ndrに依存的なNdrの発現を2次軸において局在化する役目を担っていると考えられた(図2).この負のフィードバックによるNodalシグナルの阻害の機構は,左右相称動物においてはLeftyなどのアンタゴニストにより担われていることが知られている6).しかしながら,刺胞動物のゲノムにはLeftyをコードする遺伝子はなく,また,ヒドラの予定出芽領域においてはCerberus/DANファミリーに属するNodalのアンタゴニストの発現もみられなかった.刺胞動物におけるNdrのフィードバック制御機構の詳細については今後の課題として残されている.
ヒドラの予定出芽領域におけるNdrの発現にNodalシグナルが必要であることは明らかになったが,つづいて,βカテニンシグナルもNdrの発現に深く関与することが見い出された.ヒドラにおいて,口側の先端にて活性化されるWntシグナルは1次軸(口-反口軸)のパターン化において中心的な役割を担うことが明らかになっている7-9).一方で,βカテニンやTCFなどWnt-βカテニンシグナル伝達系に関与する種々の遺伝子の発現が出芽ゾーンにおいて高いことも知られていたが7),その生理的な意義は不明であった.GSK3βに対する阻害剤であるアルステルパウロンによる処理によりβカテニンシグナルを増強すると,NdrおよびPitxの発現は上昇した.一方で,iCRT14によるβカテニンに依存的な転写の阻害は,予定出芽領域におけるNdrおよびPitxの発現を抑制し出芽の形成を阻害した.以上のことから,ヒドラにおいて,出芽ゾーンにおけるβカテニンシグナルの活性がNdrの発現および予定出芽領域の誘導に重要であることが明らかになった(図2).
単純な体制をもつ初期の祖先動物から現生の左右相称動物への進化において,体軸など基本的なボディプランを規定する分子機構が獲得されてきた.しかし,それがいつ,どのように達成されてきたのかに関する知識は現在のところ非常に限られている.カイメンや刺胞動物などの原始的な後生動物における遺伝子発現の解析から,後生動物の進化の初期においてWntシグナルが1次軸の決定因子として獲得されたと考えられている10).今回,筆者らは,刺胞動物ヒドラの出芽におけるNodalシグナルの機能を明らかにすることをとおして,βカテニン-Ndr-Pitxシグナル伝達経路が後生動物において広く保存されていることを示すと同時に,2次軸の初期の進化において重要な役割をはたした“core signalling cassette”(コアとなるシグナル伝達系カセット)であるという仮説を提唱した.左右相称動物においてWntシグナル,Bmpシグナル,Nodalシグナルなどの機能は多岐にわたり,左右相称動物における解析からその祖先的な機能および進化の過程を明らかにすることは容易ではない.後生動物の基本的なボディプランの進化の過程には現在でも未解決の問題が多く,左右相称動物にもっとも近縁な姉妹群である刺胞動物を用いた解析は,今後も多くの重要な知見をもたらすものと期待している.
略歴:2002年 東京工業大学大学院生命理工学研究科 修了,同年 東京都臨床医学総合研究所 研究員を経て,2005年よりドイツHeidelberg大学 博士研究員.
研究テーマ:後生動物の初期の進化の過程.
Thomas W. Holstein
ドイツHeidelberg大学 教授.
研究室URL:http://www.cos.uni-heidelberg.de/index.php/t.holstein?l=_e
© 2014 渡邉 寛・Thomas W. Holstein Licensed under CC 表示 2.1 日本
(ドイツHeidelberg大学Centre for Organismal Studies,Department of Molecular Evolution and Genomics)
email:渡邉 寛
DOI: 10.7875/first.author.2014.119
Nodal signalling determines biradial asymmetry in Hydra.
Hiroshi Watanabe, Heiko A. Schmidt, Anne Kuhn, Stefanie K. Höger, Yigit Kocagöz, Nico Laumann-Lipp, Suat Özbek, Thomas W. Holstein
Nature, 515, 112-115 (2014)
要 約
刺胞動物のポリプの多くは側方出芽により分岐状のコロニーを形成する.側方出芽の際には1次軸に直交する2次軸にそった非対称性の確立により体幹部の一点から出芽が誘導される.側方出芽は刺胞動物において広くみられる形態形成の様式であるが,その分子機構はながらく不明であった.今回の研究において,刺胞動物にてNodal様のリガンドをコードするNdr遺伝子がはじめて同定され,淡水性のヒドラの出芽において2次軸にそった非対称性の確立に必須であることが明らかにされた.ヒドラにおいてNdrは予定出芽領域にて特異的に発現し,転写因子Pitxの局所的な発現の誘導を介して側方出芽を誘導した.また,Ndrの発現の誘導にはβカテニンシグナルが必須であることも明らかにされた.左右相称動物においてβカテニン-Nodal-Pitxシグナル伝達経路は,左右軸など2次軸のパターン化において保存された機能をもつことが知られている.同様のシグナル伝達経路が刺胞動物の側方分岐においても機能することが明らかにされたことは,βカテニン-Nodal-Pitxシグナル伝達経路が後生動物の進化の初期においてすでに獲得されており,2次軸の進化において重要な役割をはたした可能性を強く示唆した.
はじめに
現在,われわれが目にする左右相称動物のほとんどは主要な体軸である前後軸(1次軸)をもつ.また,多くは前後軸に直交する2次軸(背腹軸および左右軸)をもつことにより形態的な左右相称性を示す.これらの基本的な体軸は,それぞれ,Wnt(前後軸),Bmp(背腹軸),Nodal(左右軸)によりパターン化されており,その機構は左右相称動物において広く保存されている.このことから,同様の分子機構は左右相称動物の共通祖先において獲得されたものと考えられている1,2).しかしながら,より単純な体制をもっていたであろう初期の後生動物において2次軸がどのように獲得されたのかについては,まだわかっていない.
今回,筆者らは,左右相称動物のもっとも近縁な姉妹群である刺胞動物を用いて3,4),2次軸の誘導の機構について解析した.刺胞動物は6億年ほどまえに左右相称動物の共通祖先から分かれたと考えられており,クラゲ,イソギンチャク,サンゴなどを含む.刺胞動物は明確な1次軸(口-反口軸)を示す放射相称動物であると一般的には認知されているが,完全な放射相称性はむしろまれであり,とくにポリプの世代において,内胚葉の形態や群体性ポリプの分岐パターンについて二放射相称性を示すことが知られている.淡水性のヒドラは組織学的に完全な放射相称性を示すポリプであり,刺胞動物のモデルとして長い研究の歴史がある.ヒドラは,体幹部からの側方出芽において,群体性ポリプと同様に二放射相称性のパターンを示すことが報告されている5).そこで,筆者らは,ヒドラの側方出芽をモデルとして,刺胞動物における二放射相称性のパターン化を制御する分子機構について解析した.
1.Ndr遺伝子およびPitx遺伝子は予定出芽領域において局所的に発現する
ヒドラでは,体幹部の足側に近い出芽ゾーンから口-反口軸に直交するように新たな出芽が形成される(図1).出芽はつねに1つずつであることから,組織学的に放射相称性である出芽ゾーンにおいて,口-反口軸に直交する2次軸にそって非対称性の形成されることが,予定出芽領域の決定に重要であると考えられる.そこで,予定出芽領域の決定に関与するタンパク質を同定するため,予定出芽領域において特異的に発現する遺伝子を探索することにより,TGFβスーパーファミリーに属する遺伝子を見い出した.分子系統解析によりこの遺伝子はNodal様のリガンドをコードすることが示され,Nodal様(Nodal-related:Ndr)遺伝子として左右相称動物以外でのはじめての発見となった.また,種々の刺胞動物のゲノム情報をくわえた関連遺伝子の系統ゲノム解析により,Ndr遺伝子の下流遺伝子であり転写因子をコードするPitx遺伝子などを同定し,これらNodalシグナルに関連する遺伝子は左右相称動物だけでなく刺胞動物においても広く保存されていることが明らかにされた.ヒドラにおけるホールマウントin situハイブリダイゼーション法による遺伝子の発現解析では,Ndr遺伝子は出芽ゾーンの予定出芽領域において特異的に発現が上昇し,出芽の発達とともにその発現は検出できなくなった.また,Pitx遺伝子も予定出芽領域において発現の上昇することが見い出された.予定出芽領域における局所的な発現は,TGFβスーパーファミリーに属するほかのリガンドをコードするBmp遺伝子やActivin遺伝子などでは観察されなかった.このことから,ヒドラにおいては,Ndr遺伝子の局所的かつ特異的な発現がPitx遺伝子の発現および出芽ゾーンにおける予定出芽領域の誘導(2次軸の形成)において特異的に関与することが示唆された.
2.Nodalシグナルは側方出芽の誘導に必須である
ヒドラの出芽におけるNdrの機能を解析するため,精製した組換えNdrタンパク質により処理した出芽ゾーンの組織片を未処理のヒドラに移植しその作用を検証した.その結果,Ndrの処理により出芽の促進されることが明らかにされた.同様の出芽の促進効果は,正常なヒドラにおいてNdr遺伝子発現プラスミドをトランスフェクションした場合にも確認された.興味深いことに,異所的に過剰発現されたNdrは異所的な出芽を誘導できなかった.このことは,ほかのタンパク質が出芽の誘導に必要である可能性,および,Nodalシグナルに対し出芽ゾーンが特異的な感受性を示す可能性を示唆した.つぎに,ヒドラの出芽におけるNdrの要求性について検討した.さきに述べたとおり,Ndrは予定出芽領域において発現が強く誘導され,そののち,出芽の発達にともない発現の抑制される一過的な発現パターンを示す.Nodal受容体キナーゼ阻害剤を用いた実験では,Ndrの発現する出芽の初期から処理することにより出芽の形成は濃度に依存的に阻害されたのに対し,Ndrの発現のみられなくなった出芽の中期から処理した場合は出芽の発達には影響しないことが明らかになった.このことは,出芽の初期における特異的なNodalシグナルの活性化が出芽の誘導に必須の役割をはたすことを示した.さらに,siRNAによりNdrあるいはPitxをノックダウンすることにより出芽が阻害されたことから,ヒドラの出芽の誘導におけるNodalシグナルの重要性が確認された.
3.局所的なNdrの発現は予定出芽領域の非対称性の確立において重要である
Ndrの発現するヒドラの予定出芽領域において,転写因子であるPitxおよびBra1(ヒドラにおける頭部オーガナイザー遺伝子にコードされる)が共発現していることが確認された.Nodal受容体キナーゼ阻害剤により処理したヒドラではPitxやBra1の予定出芽領域における発現が抑制されたことから,これらがNodalシグナルの下流の標的であることが示された.また,Ndrの発現も阻害されたことから,Ndrの発現制御において正のフィードバック機構の存在することも明らかになった(図2).さらに興味深いことに,阻害剤による処理ののち阻害剤のない条件にもどした場合,Ndr,Pitx,Bra1の発現が出芽ゾーンの全体において誘導され,その結果,出芽の領域の拡大がみられた.もっとも顕著な表現型としては,出芽ゾーンの全体において頭部マーカーが発現し2次軸における非対称性の失われたものが出現した.これらの結果は,局所的なNodalシグナルの活性化がヒドラにおける二放射相称性のパターン化に重要であることを明確に示した.さらに,阻害剤を除去したのちNdrの発現する領域が拡大することから,Nodalシグナルに依存的に発現の誘導される内在性の阻害タンパク質の存在している可能性を示唆された.すなわち,通常の出芽の誘導においてはNdrによりこの阻害タンパク質が誘導され,Ndrに依存的なNdrの発現を2次軸において局在化する役目を担っていると考えられた(図2).この負のフィードバックによるNodalシグナルの阻害の機構は,左右相称動物においてはLeftyなどのアンタゴニストにより担われていることが知られている6).しかしながら,刺胞動物のゲノムにはLeftyをコードする遺伝子はなく,また,ヒドラの予定出芽領域においてはCerberus/DANファミリーに属するNodalのアンタゴニストの発現もみられなかった.刺胞動物におけるNdrのフィードバック制御機構の詳細については今後の課題として残されている.
4.Ndrの発現はβカテニンシグナルを必要とする
ヒドラの予定出芽領域におけるNdrの発現にNodalシグナルが必要であることは明らかになったが,つづいて,βカテニンシグナルもNdrの発現に深く関与することが見い出された.ヒドラにおいて,口側の先端にて活性化されるWntシグナルは1次軸(口-反口軸)のパターン化において中心的な役割を担うことが明らかになっている7-9).一方で,βカテニンやTCFなどWnt-βカテニンシグナル伝達系に関与する種々の遺伝子の発現が出芽ゾーンにおいて高いことも知られていたが7),その生理的な意義は不明であった.GSK3βに対する阻害剤であるアルステルパウロンによる処理によりβカテニンシグナルを増強すると,NdrおよびPitxの発現は上昇した.一方で,iCRT14によるβカテニンに依存的な転写の阻害は,予定出芽領域におけるNdrおよびPitxの発現を抑制し出芽の形成を阻害した.以上のことから,ヒドラにおいて,出芽ゾーンにおけるβカテニンシグナルの活性がNdrの発現および予定出芽領域の誘導に重要であることが明らかになった(図2).
おわりに
単純な体制をもつ初期の祖先動物から現生の左右相称動物への進化において,体軸など基本的なボディプランを規定する分子機構が獲得されてきた.しかし,それがいつ,どのように達成されてきたのかに関する知識は現在のところ非常に限られている.カイメンや刺胞動物などの原始的な後生動物における遺伝子発現の解析から,後生動物の進化の初期においてWntシグナルが1次軸の決定因子として獲得されたと考えられている10).今回,筆者らは,刺胞動物ヒドラの出芽におけるNodalシグナルの機能を明らかにすることをとおして,βカテニン-Ndr-Pitxシグナル伝達経路が後生動物において広く保存されていることを示すと同時に,2次軸の初期の進化において重要な役割をはたした“core signalling cassette”(コアとなるシグナル伝達系カセット)であるという仮説を提唱した.左右相称動物においてWntシグナル,Bmpシグナル,Nodalシグナルなどの機能は多岐にわたり,左右相称動物における解析からその祖先的な機能および進化の過程を明らかにすることは容易ではない.後生動物の基本的なボディプランの進化の過程には現在でも未解決の問題が多く,左右相称動物にもっとも近縁な姉妹群である刺胞動物を用いた解析は,今後も多くの重要な知見をもたらすものと期待している.
文 献
- Niehrs, C.: On growth and form: a Cartesian coordinate system of Wnt and BMP signaling specifies bilaterian body axes. Development, 137, 845-857 (2010)[PubMed]
- Meinhardt, H.: Primary body axes of vertebrates: generation of a near-Cartesian coordinate system and the role of Spemann-type organizer. Dev. Dyn., 235, 2907-2919 (2006)[PubMed]
- Chapman, J. A., Kirkness, E. F., Simakov, O. et al.: The dynamic genome of Hydra. Nature, 464, 592-596 (2010)[PubMed]
- Ryan, J. F., Pang, K., Schnitzler, C. E. et al.: The genome of the ctenophore Mnemiopsis leidyi and its implications for cell type evolution. Science, 342, 1242592 (2013)[PubMed]
- Baird, R. V. & Burnett, A. L.: Observations on the discovery of a dorso-ventral axis in Hydra. J. Embryol. Exp. Morphol., 17, 35-81 (1967)[PubMed]
- Hamada, H., Meno, C., Watanabe, D. et al.: Establishment of vertebrate left-right asymmetry. Nat. Rev. Genet., 3, 103-113 (2002)[PubMed]
- Hobmayer, B., Rentzsch, F., Kuhn, K. et al.: WNT signalling molecules act in axis formation in the diploblastic metazoan Hydra. Nature, 407, 186-189 (2000)[PubMed]
- Lengfeld, T., Watanabe, H., Simakov, O. et al.: Multiple Wnts are involved in Hydra organizer formation and regeneration. Dev. Biol., 330, 186-99 (2009)[PubMed]
- Philipp, I., Aufschnaiter, R., Ozbek, S. et al.: Wnt/β-catenin and noncanonical Wnt signaling interact in tissue evagination in the simple eumetazoan Hydra. Proc. Natl. Acad. Sci. USA, 106, 4290-4295 (2009)[PubMed]
- Holstein, T. W., Watanabe, H., Ozbek, S.: Signaling pathways and axis formation in the lower metazoa. Curr. Top. Dev. Biol., 97, 137-177 (2011)[PubMed]
著者プロフィール
略歴:2002年 東京工業大学大学院生命理工学研究科 修了,同年 東京都臨床医学総合研究所 研究員を経て,2005年よりドイツHeidelberg大学 博士研究員.
研究テーマ:後生動物の初期の進化の過程.
Thomas W. Holstein
ドイツHeidelberg大学 教授.
研究室URL:http://www.cos.uni-heidelberg.de/index.php/t.holstein?l=_e
© 2014 渡邉 寛・Thomas W. Holstein Licensed under CC 表示 2.1 日本