組織特異的にスプライシング反応を制御するRBFOXファミリーRNA結合タンパク質およびSUP-12によるRNAの協働的な認識の機構
桑迫香奈子1・高橋真梨2・黒柳秀人3・武藤 裕1
(1武蔵野大学薬学部 薬学研究所物理化学研究室,2理化学研究所生命分子システム基盤研究領域,3東京医科歯科大学難治疾患研究所 遺伝子発現制御学)
email:武藤 裕
DOI: 10.7875/first.author.2014.117
RBFOX and SUP-12 sandwich a G base to cooperatively regulate tissue-specific splicing.
Kanako Kuwasako, Mari Takahashi, Satoru Unzai, Kengo Tsuda, Seiko Yoshikawa, Fahu He, Naohiro Kobayashi, Peter Güntert, Mikako Shirouzu, Takuhiro Ito, Akiko Tanaka, Shigeyuki Yokoyama, Masatoshi Hagiwara, Hidehito Kuroyanagi, Yutaka Muto
Nature Structural & Molecular Biology, 21, 778-786 (2014)
線虫においてFGF受容体をコードするegl-15遺伝子は,RBFOXファミリーRNA結合タンパク質ASD-1および筋細胞に特異的なRNA結合タンパク質SUP-12の2つのスプライシング制御タンパク質により筋組織に特異的な選択的スプライシングをうける.この研究では,NMR法による構造決定により,この2つのスプライシング制御タンパク質が,結合するRNA配列中のGをはさみこむように協働的に認識する分子機構を明らかにした.さらに,線虫を用いた選択的スプライシングのレポーター系により,このRNA配列におけるGの必要性,および,mRNA前駆体に結合するASD-1とSUP-12の位置関係の重要性を明らかにした.また,この協働的な認識配列の情報を手がかりとして,ASD-1およびSUP-12により制御される新たな遺伝子を発見した.
真核生物のスプライシング反応においては,U1タンパク質-RNA複合体(U1 snRNP),U2タンパク質-RNA複合体(U2 snRNP),U2AFタンパク質複合体の3つのスプライシング基本因子が,それぞれ,5’側スプライシング部位,ブランチ部位,3’側スプライシング部位に結合し,スプライシング反応の起こる位置を決定している.mRNA前駆体の特定のRNA配列に結合したスプライシング制御タンパク質は,これらのスプライシング基本因子と相互作用することによりスプライシング部位の選択に変化をもたらしている.この選択的スプライシングにより,ひとつの遺伝子からでも細胞のおかれた状況に応じて多様なタンパク質がつくりだされるが,この過程は細胞に特異的な遺伝子産物の発現に重要な制御機構のひとつになっている.いままで,多くの生物においてゲノム塩基配列情報が解読されているが,ここから示唆されるスプライシング制御タンパク質の結合部位の情報だけで細胞種に特異的なスプライシングのパターンを推定することは現在でも困難である.このようなスプライシング制御の複雑さを生み出す要因のひとつとして,スプライシング制御タンパク質どうしの相互作用が考えられる.
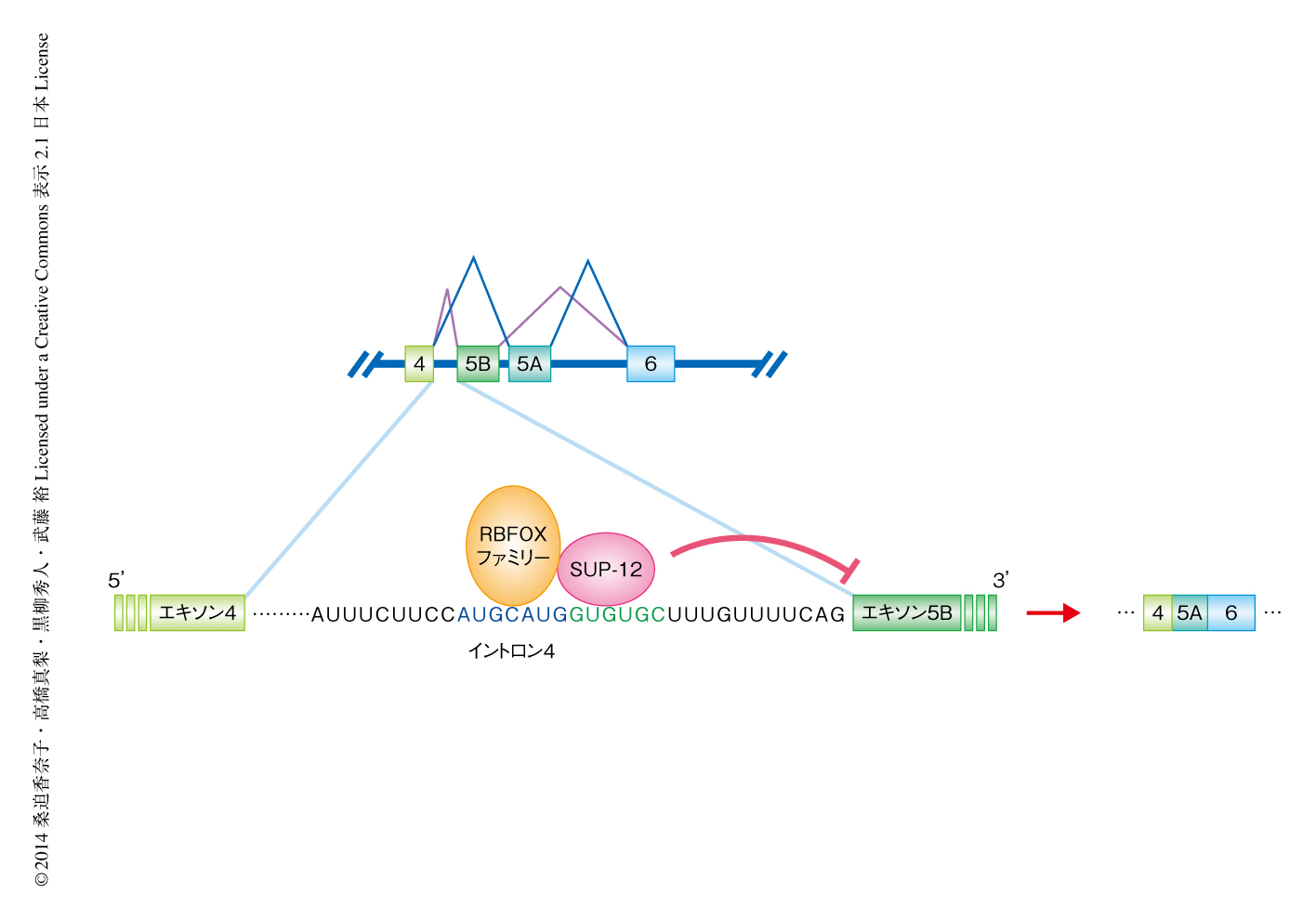
線虫においてegl-15遺伝子は唯一のFGF受容体をコードする遺伝子である.線虫には2種類のFGF,EGL-17およびLET-756が存在するが,egl-15遺伝子のスプライシングでは組織特異的にエキソン5Aとエキソン5Bが相互排他的に使い分けられ(図1),FGF受容体のリガンドへの結合の特異性が変換されている1).egl-15遺伝子におけるエキソン5Aとエキソン5Bの選択を蛍光タンパク質GFPおよびRFPによりモニターできるegl-15遺伝子の選択的スプライシングレポーターをもつ線虫を用いることにより,おのおのの組織の蛍光の色の違いから生体におけるスプライシングのパターンを可視化できる2).このレポーター系を用いた変異体のスクリーニングにより,RBFOXファミリーRNA結合タンパク質であるASD-1あるいはFOX-1,および,筋細胞に特異的なRNA結合タンパク質SUP-12の2つのスプライシング制御タンパク質が,筋組織に特異的な選択的スプライシングに必要であることが明らかにされていた2,3)(図1).この研究では,このASD-1とSUP-12の協働性を立体構造のレベルで明らかにし,遺伝子の1次配列にかくされたスプライシングコードの解明をめざした.
ASD-1およびSUP-12は約90アミノ酸残基からなるRNA認識モチーフをそれぞれ1つもつ4-7).エキソン5Bの上流のイントロンにあるUGCAUGGUGUGCというRNA配列を用いたゲルシフト法の結果,ASD-1のRNA認識モチーフは哺乳類のRBFOXファミリーRNA結合タンパク質と同じく8),UGCAUGGUGUGC配列の最初の6塩基にあたるUGCAUG配列に対し高い特異性を示し1対1の複合体を形成した.これに対し,SUP-12はUGCAUGGUGUGC配列の後半にあたるGUGUGC配列に特異的に結合すると考えられていたが,ASD-1のRNA認識モチーフがない場合にはUGCAUGGUGUGC配列に複数のSUP-12のRNA認識モチーフが結合することがわかった.等温滴定カロリメトリーによる測定から,SUP-12のRNA認識モチーフはUGを含むさまざまなRNA配列に結合すると考えられた.しかし,ASD-1のRNA認識モチーフ存在のもと,ゲルシフト法によりSUP-12のRNA認識モチーフのUGCAUGGUGUGC配列に対する結合をみたところ,SUP-12のRNA認識モチーフが単独でUGCAUGGUGUGC配列と結合する場合よりも低いタンパク質濃度で,ASD-1のRNA認識モチーフ,SUP-12のRNA認識モチーフ,UGCAUGGUGUGC配列が1対1対1で結合した三量体を形成した.これにより,ASD-1のRNA認識モチーフおよびSUP-12のRNA認識モチーフによるRNAの認識には協働性のあることがわかった.
ASD-1のRNA認識モチーフおよびSUP-12のRNA認識モチーフがこのような協働性をどのように発揮しているのかを明らかにするため,SUP-12のRNA認識モチーフとUGCAUGGUGUGC配列の後半の6塩基にあたるGUGUGC配列との二者複合体,および,ASD-1のRNA認識モチーフ,SUP-12のRNA認識モチーフ,UGCAUGGUGUGC配列からなる三者複合体の立体構造をNMR法により解析し比較した.一般に,RNA認識モチーフはβ1-α1-β2-β3-α2-β4というトポロジーをもち,4本のβストランドがつくる逆平行βシート構造を2本のαヘリックスが裏打ちする構造をもつ4-7).通常,β2-β3ストランドの中央に位置する2個の芳香環アミノ酸残基の側鎖にそれぞれ1つずつの塩基がスタッキングして結合する.さらに,この基本になる2つの塩基の5'側につづく塩基が,RNA認識モチーフのほかの部分と相互作用する4-7).
SUP-12のRNA認識モチーフとGUGUGC配列との二者複合体(PDB ID:2RU3)では,β2-β3ストランド上においてUGCAUGGUGUGC配列の10番目のUと11番目のGが認識され,7番目のGがTyr44とArg103にはさまれるように認識されていた(図2a).しかし,8番目のUと9番目のGは,SUP-12のRNA認識モチーフのもつβシート上にしっかりとは固定されてはいなかった.
ASD-1のRNA認識モチーフ,SUP-12のRNA認識モチーフ,UGCAUGGUGUGC配列からなる三者複合体(PDB ID:2MGZ)では,ASD-1のRNA認識モチーフが前半のUGCAUG配列に,SUP-12のRNA認識モチーフが後半のGUGUGC配列に,それぞれ特異的に結合し,7番目のGを2つのRNA認識モチーフがサンドイッチのようにはさみ込むことにより両者の位置が固定されて複合体は安定化していた(図2b).7番目のGの認識様式の変化にともないSUP-12のTyr44の構造が変化するとともに,SUP-12のRNA認識モチーフのβシート構造上のスペースに8番目のU8と9番目のGがはまり込んでいた.同時に,ASD-1のRNA認識モチーフのC末端に存在するArg177が6番目のGと8番目のUのリン酸結合部位と相互作用してRNAとタンパク質との結合を安定化させていた.このように,ASD-1のRNA認識モチーフとSUP-12のRNA認識モチーフによる塩基のはさみこむような認識のためには,UGCAUGGUGUGC配列の7番目の塩基がGである必要が立体構造から示唆された.
ASD-1のRNA認識モチーフ,SUP-12のRNA認識モチーフ,UGCAUGGUGUGC配列からなる三者複合体の構造解析の結果,UGCAUGGUGUGC配列における7番目のGの協働的な認識にともない,ASD-1のGlu130とSUP-12のArg103とのあいだで静電的な相互作用の生じていることがわかった(図2c).そこで,ASD-1のRNA認識モチーフのGlu130をArgに置換した変異体を用いて,ゲルシフト法によりSUP-12のRNA認識モチーフのUGCAUGGUGUGC配列に対する結合能への影響について調べた.このASD-1変異体のUGCAUGGUGUGC配列に対する結合能は野生型のASD-1のものと変化なく,このアミノ酸置換はASD-1のRNA認識モチーフのRNAとの結合には影響を及ぼさなかった.しかし,このASD-1変異体の存在のもとSUP-12のRNA認識モチーフのUGCAUGGUGUGC配列に対する結合能を調べたところ,RNAとの結合能は明らかに低下していた.これらのことから,UGCAUGGUGUGC配列の認識にともない生じるASD-1のRNA認識モチーフとSUP-12のRNA認識モチーフとのタンパク質間相互作用も,このRNA配列を効率よく正確に協働的に認識するために必要であることがわかった.
egl-15遺伝子の選択的スプライシングレポーターをもつ線虫をもちいて,UGCAUGGUGUGC配列を改変した際のin vivoにおけるスプライシング反応への影響を観察したところ,ASD-1のRNA認識モチーフとSUP-12のRNA認識モチーフによる塩基のはさみこむような認識のためには7番目の塩基がGでなければならないこと,UGCAUG配列とGUGUG配列がとなりあっていなければならないことが確認された.ASD-1のRNA認識モチーフ,SUP-12のRNA認識モチーフ,UGCAUGGUGUGC配列からなる三者複合体について,NMR法による15N核の緩和解析を行ったところ,UGCAUG配列とGUGUG配列がとなりあっている場合には,ASD-1のRNA認識モチーフ,SUP-12のRNA認識モチーフ,UGCAUGGUGUGC配列とが水溶液中で一体となり挙動していることがわかった.これに対し,egl-15遺伝子の選択的スプライシングレポーターをもつ線虫をもちいたアッセイにおいて筋組織に特異的なスプライシング反応の起こらなくなった7番目のGに変異をもつRNA配列を用いて三者複合体を形成させると,ASD-1のRNA認識モチーフとSUP-12のRNA認識モチーフとが独立に運動しているような挙動を示した.このように,構造生物学的な情報からも,ASD-1とSUP-12がmRNA前駆体のうえでとなりどうしの適当な位置関係にあるときにかぎり,安定した複合体の形成の起こることがわかった.
egl-15遺伝子の選択的スプライシングレポーターをもつ線虫を用いた解析および構造解析の結果から,ASD-1の属するRBFOXファミリーRNA結合タンパク質とSUP-12とが協働して認識するRNA配列はUGCAUGG(U/C)GUG配列であることが示された.そこで,このRNA配列を手がかりとして,RBFOXファミリーRNA結合タンパク質とSUP-12とによりスプライシング反応が協働的に制御されているほかのmRNA前駆体を探索した.線虫のゲノムにはTGCATGG(T/C)GTG配列が47箇所あり,そのうち14箇所がタンパク質をコードする遺伝子のセンス鎖にあった.そのうちのひとつ,コラーゲンXV型およびコラーゲンXVIII型をコードするcle-1遺伝子のイントロン16にはUGCAUGGUGUG配列が保存されており,RT-PCR法により解析したところ,エキソン16のスプライシングがRBFOXファミリーRNA結合タンパク質およびSUP-12により促進されることが確認された.これは,RBFOXファミリーRNA結合タンパク質とSUP-12とにより協働して制御される選択的スプライシングの標的となるエキソンを,ゲノム塩基配列の情報のみをもとに同定したはじめての例であり,複数のスプライシング制御タンパク質によるRNAの協働的な認識機構を明らかにすることにより選択的スプライシングのパターンをより正確に予測できるようになることを実証するものとなった.
mRNA前駆体のスプライシング反応の制御は,RNA配列を特異的に認識して結合するさまざまなRNA結合タンパク質(スプライシング制御タンパク質)が担っている.ところが,個々のRNA結合ドメインが認識して結合するのは4~6塩基の短いRNA配列であり,特異性が高くない場合も多くある.さらに,この程度の短いRNA配列では多くのmRNA前駆体に頻繁に類似した配列が現われる.このような状況において,どのようにスプライシング反応が厳密に制御されているのかは現在でも未解決の問題である.この研究は,2つのRNA結合タンパク質が協働することにより,個々のスプライシング制御タンパク質が単独ではたらく場合よりも長いRNA配列をより正確に認識するしくみがあること,また,2つのRNA結合タンパク質が結合するそれぞれのRNA配列の位置関係が重要であることをはじめて明らかにすることができた.この研究のように,遺伝学的な解析と構造学的な解析,さらに,生物情報学的な解析とを組み合わせることにより,生体におけるスプライシングコードの体系的な解読につながることが期待される.
略歴:2008年 広島大学大学院理学研究科にて博士号取得,理化学研究所ゲノム科学総合研究センター,2013年 武蔵野大学薬学部 助教を経て,2014年より同 講師.
研究テーマ:mRNA前駆体のスプライシングにおける選択および制御にかかわる複合体構築の構造生物学.
高橋 真梨(Mari Takahashi)
理化学研究所ライフサイエンス技術基盤研究センター リサーチアソシエイト.
黒柳 秀人(Hidehito Kuroyanagi)
東京医科歯科大学難治疾患研究所 准教授.
武藤 裕(Yutaka Muto)
武蔵野大学薬学部 教授.
© 2014 桑迫香奈子・高橋真梨・黒柳秀人・武藤 裕 Licensed under CC 表示 2.1 日本
(1武蔵野大学薬学部 薬学研究所物理化学研究室,2理化学研究所生命分子システム基盤研究領域,3東京医科歯科大学難治疾患研究所 遺伝子発現制御学)
email:武藤 裕
DOI: 10.7875/first.author.2014.117
RBFOX and SUP-12 sandwich a G base to cooperatively regulate tissue-specific splicing.
Kanako Kuwasako, Mari Takahashi, Satoru Unzai, Kengo Tsuda, Seiko Yoshikawa, Fahu He, Naohiro Kobayashi, Peter Güntert, Mikako Shirouzu, Takuhiro Ito, Akiko Tanaka, Shigeyuki Yokoyama, Masatoshi Hagiwara, Hidehito Kuroyanagi, Yutaka Muto
Nature Structural & Molecular Biology, 21, 778-786 (2014)
要 約
線虫においてFGF受容体をコードするegl-15遺伝子は,RBFOXファミリーRNA結合タンパク質ASD-1および筋細胞に特異的なRNA結合タンパク質SUP-12の2つのスプライシング制御タンパク質により筋組織に特異的な選択的スプライシングをうける.この研究では,NMR法による構造決定により,この2つのスプライシング制御タンパク質が,結合するRNA配列中のGをはさみこむように協働的に認識する分子機構を明らかにした.さらに,線虫を用いた選択的スプライシングのレポーター系により,このRNA配列におけるGの必要性,および,mRNA前駆体に結合するASD-1とSUP-12の位置関係の重要性を明らかにした.また,この協働的な認識配列の情報を手がかりとして,ASD-1およびSUP-12により制御される新たな遺伝子を発見した.
はじめに
真核生物のスプライシング反応においては,U1タンパク質-RNA複合体(U1 snRNP),U2タンパク質-RNA複合体(U2 snRNP),U2AFタンパク質複合体の3つのスプライシング基本因子が,それぞれ,5’側スプライシング部位,ブランチ部位,3’側スプライシング部位に結合し,スプライシング反応の起こる位置を決定している.mRNA前駆体の特定のRNA配列に結合したスプライシング制御タンパク質は,これらのスプライシング基本因子と相互作用することによりスプライシング部位の選択に変化をもたらしている.この選択的スプライシングにより,ひとつの遺伝子からでも細胞のおかれた状況に応じて多様なタンパク質がつくりだされるが,この過程は細胞に特異的な遺伝子産物の発現に重要な制御機構のひとつになっている.いままで,多くの生物においてゲノム塩基配列情報が解読されているが,ここから示唆されるスプライシング制御タンパク質の結合部位の情報だけで細胞種に特異的なスプライシングのパターンを推定することは現在でも困難である.このようなスプライシング制御の複雑さを生み出す要因のひとつとして,スプライシング制御タンパク質どうしの相互作用が考えられる.
線虫においてegl-15遺伝子は唯一のFGF受容体をコードする遺伝子である.線虫には2種類のFGF,EGL-17およびLET-756が存在するが,egl-15遺伝子のスプライシングでは組織特異的にエキソン5Aとエキソン5Bが相互排他的に使い分けられ(図1),FGF受容体のリガンドへの結合の特異性が変換されている1).egl-15遺伝子におけるエキソン5Aとエキソン5Bの選択を蛍光タンパク質GFPおよびRFPによりモニターできるegl-15遺伝子の選択的スプライシングレポーターをもつ線虫を用いることにより,おのおのの組織の蛍光の色の違いから生体におけるスプライシングのパターンを可視化できる2).このレポーター系を用いた変異体のスクリーニングにより,RBFOXファミリーRNA結合タンパク質であるASD-1あるいはFOX-1,および,筋細胞に特異的なRNA結合タンパク質SUP-12の2つのスプライシング制御タンパク質が,筋組織に特異的な選択的スプライシングに必要であることが明らかにされていた2,3)(図1).この研究では,このASD-1とSUP-12の協働性を立体構造のレベルで明らかにし,遺伝子の1次配列にかくされたスプライシングコードの解明をめざした.
1.ASD-1によるSUP-12のRNAとの結合様式の変化
ASD-1およびSUP-12は約90アミノ酸残基からなるRNA認識モチーフをそれぞれ1つもつ4-7).エキソン5Bの上流のイントロンにあるUGCAUGGUGUGCというRNA配列を用いたゲルシフト法の結果,ASD-1のRNA認識モチーフは哺乳類のRBFOXファミリーRNA結合タンパク質と同じく8),UGCAUGGUGUGC配列の最初の6塩基にあたるUGCAUG配列に対し高い特異性を示し1対1の複合体を形成した.これに対し,SUP-12はUGCAUGGUGUGC配列の後半にあたるGUGUGC配列に特異的に結合すると考えられていたが,ASD-1のRNA認識モチーフがない場合にはUGCAUGGUGUGC配列に複数のSUP-12のRNA認識モチーフが結合することがわかった.等温滴定カロリメトリーによる測定から,SUP-12のRNA認識モチーフはUGを含むさまざまなRNA配列に結合すると考えられた.しかし,ASD-1のRNA認識モチーフ存在のもと,ゲルシフト法によりSUP-12のRNA認識モチーフのUGCAUGGUGUGC配列に対する結合をみたところ,SUP-12のRNA認識モチーフが単独でUGCAUGGUGUGC配列と結合する場合よりも低いタンパク質濃度で,ASD-1のRNA認識モチーフ,SUP-12のRNA認識モチーフ,UGCAUGGUGUGC配列が1対1対1で結合した三量体を形成した.これにより,ASD-1のRNA認識モチーフおよびSUP-12のRNA認識モチーフによるRNAの認識には協働性のあることがわかった.
2.複合体の構造の比較
ASD-1のRNA認識モチーフおよびSUP-12のRNA認識モチーフがこのような協働性をどのように発揮しているのかを明らかにするため,SUP-12のRNA認識モチーフとUGCAUGGUGUGC配列の後半の6塩基にあたるGUGUGC配列との二者複合体,および,ASD-1のRNA認識モチーフ,SUP-12のRNA認識モチーフ,UGCAUGGUGUGC配列からなる三者複合体の立体構造をNMR法により解析し比較した.一般に,RNA認識モチーフはβ1-α1-β2-β3-α2-β4というトポロジーをもち,4本のβストランドがつくる逆平行βシート構造を2本のαヘリックスが裏打ちする構造をもつ4-7).通常,β2-β3ストランドの中央に位置する2個の芳香環アミノ酸残基の側鎖にそれぞれ1つずつの塩基がスタッキングして結合する.さらに,この基本になる2つの塩基の5'側につづく塩基が,RNA認識モチーフのほかの部分と相互作用する4-7).
SUP-12のRNA認識モチーフとGUGUGC配列との二者複合体(PDB ID:2RU3)では,β2-β3ストランド上においてUGCAUGGUGUGC配列の10番目のUと11番目のGが認識され,7番目のGがTyr44とArg103にはさまれるように認識されていた(図2a).しかし,8番目のUと9番目のGは,SUP-12のRNA認識モチーフのもつβシート上にしっかりとは固定されてはいなかった.
ASD-1のRNA認識モチーフ,SUP-12のRNA認識モチーフ,UGCAUGGUGUGC配列からなる三者複合体(PDB ID:2MGZ)では,ASD-1のRNA認識モチーフが前半のUGCAUG配列に,SUP-12のRNA認識モチーフが後半のGUGUGC配列に,それぞれ特異的に結合し,7番目のGを2つのRNA認識モチーフがサンドイッチのようにはさみ込むことにより両者の位置が固定されて複合体は安定化していた(図2b).7番目のGの認識様式の変化にともないSUP-12のTyr44の構造が変化するとともに,SUP-12のRNA認識モチーフのβシート構造上のスペースに8番目のU8と9番目のGがはまり込んでいた.同時に,ASD-1のRNA認識モチーフのC末端に存在するArg177が6番目のGと8番目のUのリン酸結合部位と相互作用してRNAとタンパク質との結合を安定化させていた.このように,ASD-1のRNA認識モチーフとSUP-12のRNA認識モチーフによる塩基のはさみこむような認識のためには,UGCAUGGUGUGC配列の7番目の塩基がGである必要が立体構造から示唆された.
3.RNAの協同的な認識にともなうASD-1のRNA認識モチーフとSUP-12のRNA認識モチーフとの相互作用
ASD-1のRNA認識モチーフ,SUP-12のRNA認識モチーフ,UGCAUGGUGUGC配列からなる三者複合体の構造解析の結果,UGCAUGGUGUGC配列における7番目のGの協働的な認識にともない,ASD-1のGlu130とSUP-12のArg103とのあいだで静電的な相互作用の生じていることがわかった(図2c).そこで,ASD-1のRNA認識モチーフのGlu130をArgに置換した変異体を用いて,ゲルシフト法によりSUP-12のRNA認識モチーフのUGCAUGGUGUGC配列に対する結合能への影響について調べた.このASD-1変異体のUGCAUGGUGUGC配列に対する結合能は野生型のASD-1のものと変化なく,このアミノ酸置換はASD-1のRNA認識モチーフのRNAとの結合には影響を及ぼさなかった.しかし,このASD-1変異体の存在のもとSUP-12のRNA認識モチーフのUGCAUGGUGUGC配列に対する結合能を調べたところ,RNAとの結合能は明らかに低下していた.これらのことから,UGCAUGGUGUGC配列の認識にともない生じるASD-1のRNA認識モチーフとSUP-12のRNA認識モチーフとのタンパク質間相互作用も,このRNA配列を効率よく正確に協働的に認識するために必要であることがわかった.
4.UGCAUG配列とGUGUG配列との位置関係の重要性
egl-15遺伝子の選択的スプライシングレポーターをもつ線虫をもちいて,UGCAUGGUGUGC配列を改変した際のin vivoにおけるスプライシング反応への影響を観察したところ,ASD-1のRNA認識モチーフとSUP-12のRNA認識モチーフによる塩基のはさみこむような認識のためには7番目の塩基がGでなければならないこと,UGCAUG配列とGUGUG配列がとなりあっていなければならないことが確認された.ASD-1のRNA認識モチーフ,SUP-12のRNA認識モチーフ,UGCAUGGUGUGC配列からなる三者複合体について,NMR法による15N核の緩和解析を行ったところ,UGCAUG配列とGUGUG配列がとなりあっている場合には,ASD-1のRNA認識モチーフ,SUP-12のRNA認識モチーフ,UGCAUGGUGUGC配列とが水溶液中で一体となり挙動していることがわかった.これに対し,egl-15遺伝子の選択的スプライシングレポーターをもつ線虫をもちいたアッセイにおいて筋組織に特異的なスプライシング反応の起こらなくなった7番目のGに変異をもつRNA配列を用いて三者複合体を形成させると,ASD-1のRNA認識モチーフとSUP-12のRNA認識モチーフとが独立に運動しているような挙動を示した.このように,構造生物学的な情報からも,ASD-1とSUP-12がmRNA前駆体のうえでとなりどうしの適当な位置関係にあるときにかぎり,安定した複合体の形成の起こることがわかった.
5.UGCAUG配列とGUGUG配列との位置関係を考慮したスプライシング部位の推定
egl-15遺伝子の選択的スプライシングレポーターをもつ線虫を用いた解析および構造解析の結果から,ASD-1の属するRBFOXファミリーRNA結合タンパク質とSUP-12とが協働して認識するRNA配列はUGCAUGG(U/C)GUG配列であることが示された.そこで,このRNA配列を手がかりとして,RBFOXファミリーRNA結合タンパク質とSUP-12とによりスプライシング反応が協働的に制御されているほかのmRNA前駆体を探索した.線虫のゲノムにはTGCATGG(T/C)GTG配列が47箇所あり,そのうち14箇所がタンパク質をコードする遺伝子のセンス鎖にあった.そのうちのひとつ,コラーゲンXV型およびコラーゲンXVIII型をコードするcle-1遺伝子のイントロン16にはUGCAUGGUGUG配列が保存されており,RT-PCR法により解析したところ,エキソン16のスプライシングがRBFOXファミリーRNA結合タンパク質およびSUP-12により促進されることが確認された.これは,RBFOXファミリーRNA結合タンパク質とSUP-12とにより協働して制御される選択的スプライシングの標的となるエキソンを,ゲノム塩基配列の情報のみをもとに同定したはじめての例であり,複数のスプライシング制御タンパク質によるRNAの協働的な認識機構を明らかにすることにより選択的スプライシングのパターンをより正確に予測できるようになることを実証するものとなった.
おわりに
mRNA前駆体のスプライシング反応の制御は,RNA配列を特異的に認識して結合するさまざまなRNA結合タンパク質(スプライシング制御タンパク質)が担っている.ところが,個々のRNA結合ドメインが認識して結合するのは4~6塩基の短いRNA配列であり,特異性が高くない場合も多くある.さらに,この程度の短いRNA配列では多くのmRNA前駆体に頻繁に類似した配列が現われる.このような状況において,どのようにスプライシング反応が厳密に制御されているのかは現在でも未解決の問題である.この研究は,2つのRNA結合タンパク質が協働することにより,個々のスプライシング制御タンパク質が単独ではたらく場合よりも長いRNA配列をより正確に認識するしくみがあること,また,2つのRNA結合タンパク質が結合するそれぞれのRNA配列の位置関係が重要であることをはじめて明らかにすることができた.この研究のように,遺伝学的な解析と構造学的な解析,さらに,生物情報学的な解析とを組み合わせることにより,生体におけるスプライシングコードの体系的な解読につながることが期待される.
文 献
- Goodman, S. J., Branda, C. S., Robinson, M. K. et al.: Alternative splicing affecting a novel domain in the C. elegans EGL-15 FGF receptor confers functional specificity. Development, 130, 3757-3766 (2003)[PubMed]
- Kuroyanagi, H., Kobayashi, T., Mitani, S. et al.: Transgenic alternative-splicing reporters reveal tissue-specific expression profiles and regulation mechanisms in vivo. Nat. Methods, 3, 909-915 (2006)[PubMed]
- Kuroyanagi, H., Ohno, G., Mitani, S. et al.: The Fox-1 family and SUP-12 coordinately regulate tissue-specific alternative splicing in vivo. Mol. Cell. Biol., 27, 8612-8621 (2007)[PubMed]
- Nagai, K., Oubridge, C., Ito, N. et al.: The RNP domain: a sequence-specific RNA-binding domain involved in processing and transport of RNA. Trends Biochem. Sci., 20, 235-240 (1995)[PubMed]
- Perez-Canadillas, J. M. & Varani, G.: Recent advances in RNA-protein recognition. Curr. Opin. Struct. Biol., 11, 53-58 (2001)[PubMed]
- Auweter, S. D., Oberstrass, F. C., Allain, F. H.: Sequence-specific binding of single-stranded RNA: is there a code for recognition? Nucleic Acids Res., 34, 4943-4959 (2006)[PubMed]
- Muto, Y. & Yokoyama, S.: Structural insight into RNA recognition motifs: versatile molecular Lego building blocks for biological systems. Wiley Interdiscip. Rev. RNA, 3, 229-246 (2012)[PubMed]
- Auweter, S. D., Fasan, R., Reymond, L. et al.: Molecular basis of RNA recognition by the human alternative splicing factor Fox-1. EMBO J., 25, 163-173 (2006)[PubMed]
著者プロフィール
略歴:2008年 広島大学大学院理学研究科にて博士号取得,理化学研究所ゲノム科学総合研究センター,2013年 武蔵野大学薬学部 助教を経て,2014年より同 講師.
研究テーマ:mRNA前駆体のスプライシングにおける選択および制御にかかわる複合体構築の構造生物学.
高橋 真梨(Mari Takahashi)
理化学研究所ライフサイエンス技術基盤研究センター リサーチアソシエイト.
黒柳 秀人(Hidehito Kuroyanagi)
東京医科歯科大学難治疾患研究所 准教授.
武藤 裕(Yutaka Muto)
武蔵野大学薬学部 教授.
© 2014 桑迫香奈子・高橋真梨・黒柳秀人・武藤 裕 Licensed under CC 表示 2.1 日本