Jam1aとJam2aとの相互作用はNotchシグナルを介した造血幹細胞の運命を制御する
小林 功・David Traver
(米国California大学San Diego校Department of Cellular and Molecular Medicine)
email:小林 功
DOI: 10.7875/first.author.2014.113
Jam1a-Jam2a interactions regulate haematopoietic stem cell fate through Notch signalling.
Isao Kobayashi, Jingjing Kobayashi-Sun, Albert D. Kim, Claire Pouget, Naonobu Fujita, Toshio Suda, David Traver
Nature, 512, 319-323 (2014)
脊椎動物の発生の過程においてNotchシグナルは造血幹細胞への運命の決定に重要な役割をはたしている.Notchシグナルは細胞膜において発現するNotchリガンドとNotch受容体とが接触することにより伝達される.これまでに,筆者らの研究グループは,ゼブラフィッシュにおいて体節に発現する2つのNotchリガンド,DlcおよびDldが造血幹細胞の発生において必須であることを報告している.しかしながら,これらのNotchシグナルが,いつ,どこで,どのように造血幹細胞の発生に関与しているのかについては不明であった.この研究においては,造血系および血管系の共通の前駆細胞である血管芽細胞が体節の腹側にそって正中へと移動する際,体節と直接的に接触することによりNotchシグナルが伝達され,さらに,このシグナル伝達にはJamとよばれる2つの細胞接着分子が関与していることを見い出した.これらの結果は,Notchシグナルによる造血幹細胞への運命の決定がこれまで予想されていた時期よりもかなり早い段階で起こっていることを示唆した.
造血幹細胞はすべての種類の血液細胞を生涯にわたり供給しつづけることから,自己複製能および多分化能をもつとされている.生体の外においてiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)から造血幹細胞への分化を誘導することができれば,白血病などさまざまな難治性の血液疾患に対する根治的な治療ができると期待されている.しかしながら,iPS細胞から造血幹細胞への分化の誘導法はいまだ確立されていない.この分化の誘導を実現するためには,生体の外において初期胚から造血幹細胞までの発生の過程を忠実に再現する必要があり,造血幹細胞の発生にかかわる分子機構の解明がもとめられている.
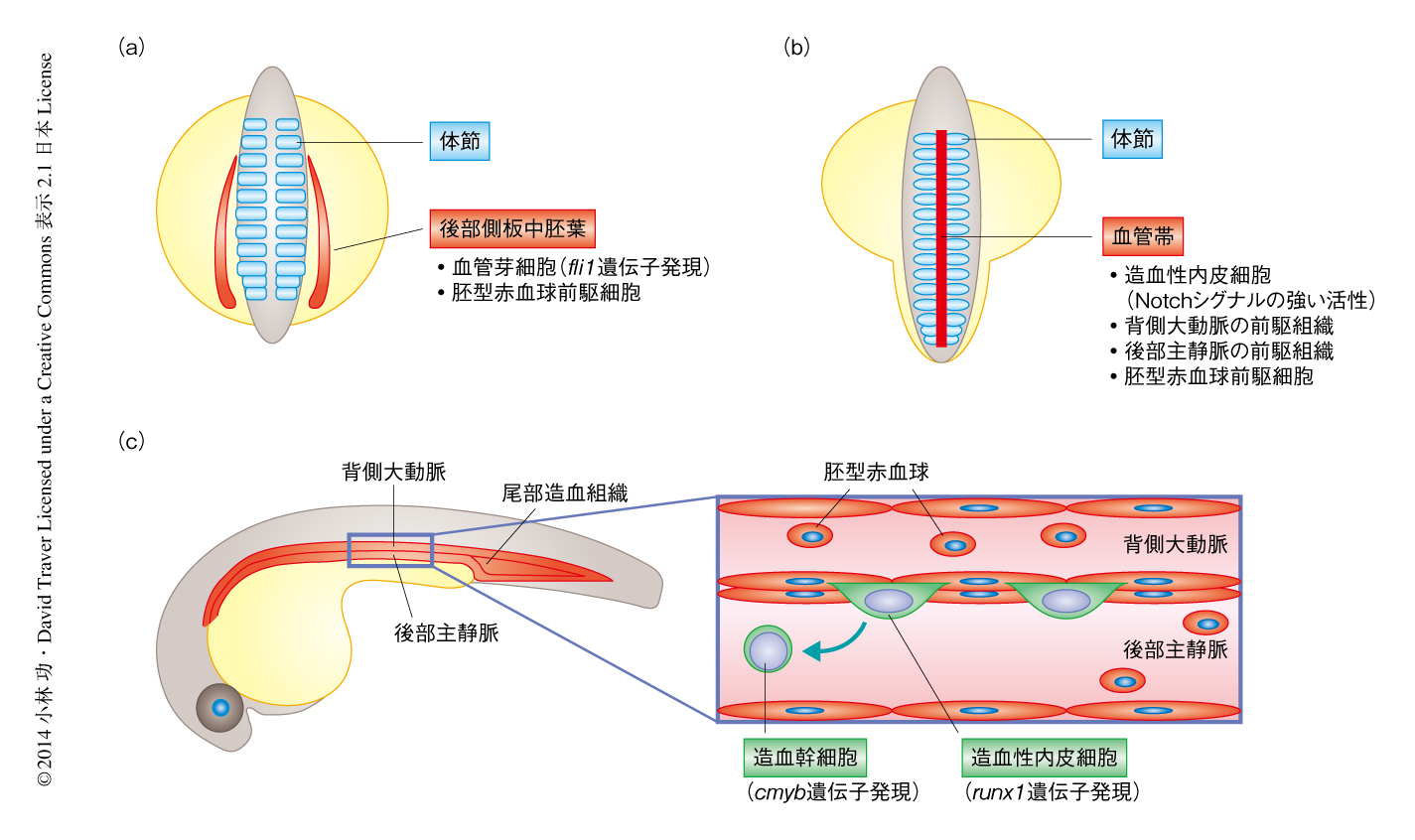
脊椎動物において,造血幹細胞は背側大動脈の腹側壁に存在する血管内皮細胞より出現することが知られている.この血管内皮細胞はとくに造血性内皮細胞とよばれ,内皮-造血転換により造血幹細胞へと分化すると考えられている1-3).この造血性内皮細胞への運命の決定においてはNotchシグナルが中心的な役割をはたしている4).これまでに,筆者らの研究グループは,ゼブラフィッシュにおいて体節に発現する2つのNotchリガンド,DlcおよびDldが造血幹細胞の発生に必須であることを報告している5).Notchシグナルの伝達には,Notchリガンドを発現する細胞とNotch受容体を発現する細胞とが直接的に接触する必要があるため,効率のよいシグナル伝達のためになんらかの細胞接着分子が関与している可能性が考えられる.そこで,この研究においては,造血幹細胞に発現するJam1 6) および体節に発現するJam2 7,8) に着目し,ゼブラフィッシュを用いて造血幹細胞の発生におけるJamタンパク質とNotchシグナルとの関連性およびその役割について解析した.
Jamタンパク質は免疫グロブリンスーパーファミリーに属する細胞接着分子であり,Jam1(Jam-A,F11R),Jam2(Jam-B),Jam3(Jam-C)の3つの大きなグループから構成され,さまざまな組織あるいは細胞において密着結合や細胞移動に関与している.Jam1はマウスの造血幹細胞において発現しているが6),造血幹細胞における機能については報告されていない.Jam1遺伝子のゼブラフィッシュにおけるオルソログであるjam1a遺伝子は,受精後14時間の胚において両側性に分布する後部側板中胚葉に発現していた.この後部側板中胚葉には,造血性内皮細胞と血管内皮細胞の共通の前駆細胞である血管芽細胞が含まれる.jam1a遺伝子の制御領域においてタモキシフェンに誘導性にCreリコンビナーゼを発現するトランスジェニック系統と,Creリコンビナーゼの存在のもと赤色蛍光タンパク質DsRedを発現するレポーター系統とを交配して得られた胚において,jam1a遺伝子を発現する細胞の細胞系譜を長期間にわたり追跡した.後部側板中胚葉が形成される受精後12時間の前後にタモキシフェンを処理したところ,DsRedを発現する多種類の血液細胞が5カ月以上の長期間にわたり成体の造血組織に検出された.これらのことから,jam1a遺伝子は将来,造血幹細胞へと分化する血管芽細胞において発現することが明らかになった.
Jam1aの造血幹細胞の発生における役割を調べるため,モルフォリーノオリゴヌクレオチドを用いて遺伝子の機能を阻害する実験を行った.Runx1は大動脈の造血性内皮細胞において内皮-造血転換に必須な転写因子であり,造血性内皮細胞のマーカーとしても知られている.野生型の胚と比べ,Jam1aを欠損した胚では大動脈の領域におけるrunx1遺伝子の発現がいちじるしく低下していた.背側大動脈より出現した造血幹細胞はcmyb遺伝子を発現する細胞として大動脈の領域および尾部造血組織に検出される2).Jam1aを欠損した胚ではこのcmyb遺伝子を発現する細胞の数が野生型の胚に比べおよそ1/12に低下していた.一方,大動脈のマーカー遺伝子であるefnb2a遺伝子はJam1aを欠損した胚においてもほぼ正常に発現していたことから,Jam1aの欠損は大動脈の形成には影響しないと考えられた.さらに,背側大動脈の周囲に分布する後部主静脈,体節,前腎,脊索などの組織もほぼ正常に発生していたことから,Jam1aを欠損した胚における造血幹細胞の発生の異常は,周囲の組織の発生の異常に起因するものではないと考えられた.
血管芽細胞を含む後部側板中胚葉は,はじめ体節の両側に形成され,そののち正中へ移動し,正中にて血管帯とよばれる帯状の組織を形成して,やがて背側大動脈,後部主静脈,造血幹細胞を形成する(図1).血管芽細胞のマーカー遺伝子であるfli1遺伝子の発現を指標として,Jam1aを欠損した胚における血管芽細胞の形成および細胞移動について調べた.Jam1aを欠損した胚において血管芽細胞の形成に異常は認められなかったが,野生型の胚と比べ,細胞移動に遅れの生じていることがわかった.fli1遺伝子の制御のもとGFPを発現するトランスジェニック系統を用いて,血管芽細胞の細胞移動のようすをタイムラプスイメージング法により観察した.野生型の胚において,血管芽細胞は受精後14時間ごろから細胞移動を開始し,体節の腹側にそって正中に達すると,受精後17.5時間までに血管帯を形成した.一方,Jam1aを欠損した胚では同じ時期に細胞移動を開始したが,その移動速度は遅く,受精後17.5時間においても血管帯の形成は不完全であった.
胚の組織標本を作製し,fli1遺伝子の発現を指標として移動している血管芽細胞の形態を観察した.野生型の胚において移動している血管芽細胞は平らな形態を示し,体節の腹側面にへばりついているようすが観察された.一方,Jam1aを欠損した胚では移動している血管芽細胞は球形で,体節との接着面が有意に小さくなっていた.これらのことから,Jam1aは血管芽細胞において体節との接着に関与している可能性が示唆された.
Jam1aが体節との接着に関与しているのであれば,体節においてJam1aと結合の可能ななんらかの細胞接着分子が発現しているものと考えられたため,体節に発現するjam遺伝子を探索した.ゼブラフィッシュのゲノムにはjam1a遺伝子,jam1b遺伝子,jam2a遺伝子,jam2b遺伝子,jam3a遺伝子,jam3b遺伝子の6つのjam遺伝子が同定されている.これまでの報告によると,これらにコードされるJamタンパク質のうちJam1aと結合の可能なものはJam2a,Jam2b,Jam3aの3つであり,一方,Jam1aはJam1a自体,Jam1b,Jam3bとは結合できず,さらに,6つのjam遺伝子のうち体節に発現しているのはjam2a遺伝子およびjam3b遺伝子のみである7,8).そこで,血管芽細胞が細胞移動の過程においてjam2a遺伝子を発現する体節細胞と接触する機会があるかどうか調べた.血管芽細胞が細胞移動する受精後16時間の胚において,jam2a遺伝子は体節に特異的に発現していた.この受精後16時間の胚の組織標本を作製し,jam2a遺伝子とfli1遺伝子の二重染色を行った.その結果,細胞移動している血管芽細胞がjam2a遺伝子を発現する体節の腹側面と密に接触しているようすが観察された.
Jam1aとJam2aとの結合能を確かめるため,Flagタグを付加したJam1aおよびHAタグを付加したJam2aを用いて抗Flag抗体による免疫沈降を行った.免疫沈降物を抗HA抗体を用いたウェスタンブロット法により解析したところHAタグを付加したJam2aが検出された.さらに,Jam1aあるいはJam2aを発現させたHela細胞を用いて,タンパク質のあいだの結合を蛍光により検出できるproximity ligation assay法により解析した結果,Jam1aを発現させた細胞とJam2aを発現させた細胞との接触面に多数の蛍光シグナルが検出された.以上より,Jam1aとJam2aはトランス型の結合により細胞のあいだの接着に関与していることが明らかになった.
これらのことは,血管芽細胞が細胞移動の過程においてJam1aとJam2aとの結合を介して体節と接着している可能性を示唆した.そこで,Jam2aの機能を阻害した場合にもJam1aを欠損した胚と同様の表現型が得られるかどうか調べるため,モルフォリーノオリゴヌクレオチドを用いてJam2aの機能を阻害する実験を行った.Jam2aを欠損した胚において大動脈の領域におけるrunx1遺伝子の発現はいちじるしく低下していた.さらに,Jam2aを欠損した胚における血管芽細胞の細胞移動は,野生型の胚と比べ遅れが生じていることがわかった.また,同様の結果は,機能的なJam2aを発現できないjam2a変異体からも得られた.これらの表現型はJam1aを欠損した胚の表現型と一致しており,Jam1aとJam2aとの結合が血管芽細胞の細胞移動および造血幹細胞の発生において重要な役割をはたしていることが示唆された.
筆者らのグループは,体節に由来するDlcおよびDldが造血幹細胞の発生に必須であることを報告している5).NotchシグナルはNotchリガンドを発現する細胞とNotch受容体を発現する細胞とが直接的に接触することにより伝達されるため,Jam1aとJam2aを介した細胞接着が体節からのNotchシグナルの伝達を促進している可能性が考えられた.そこで,Jam1aを欠損した胚におけるNotchシグナルの活性化について調べるため,Notchシグナルの活性化にともないGFPを発現するレポーター系統を用いてNotchシグナルの活性化について野生型の胚とJam1aを欠損した胚とで比較した.血管芽細胞が細胞移動を完了する受精後18時間において,野生型の胚では血管芽細胞の一部に強いNotchシグナルの活性化が認められた.一方,Jam1aを欠損した胚では同じ時期において,血管芽細胞におけるNotchシグナルの活性化はいちじるしく低下していた.造血性内皮細胞が大動脈の領域に出現する受精後28時間において,野生型の胚では大動脈の全体に強いNotchシグナルの活性化が認められた.興味深いことに,同じ時期のJam1aを欠損した胚においては,大動脈の腹側壁においてのみNotchシグナルの活性化の顕著な低下が認められ,また,同じ領域に多くのアポトーシス細胞が検出された.
Notchシグナルを活性化させることにより造血系内皮細胞への分化能が回復するかどうかを確かめるため,Jam1aを欠損した胚においてNotchシグナルの活性化因子であるNotch細胞内ドメインを強制発現させた.Notch細胞内ドメインを血管芽細胞において特異的に発現させたところ,Jam1aを欠損した胚の大動脈におけるrunx1遺伝子の発現はほぼ正常なレベルにまで回復した.また,同様の結果はJam2aを欠損した胚においても得られた.以上のことから,Jam1aを欠損した胚ではNotchシグナルの低下にともない血管芽細胞から造血性内皮細胞への分化に異常が生じ,その結果,大動脈の腹側壁においてアポトーシスがひき起こされていると考えられた.
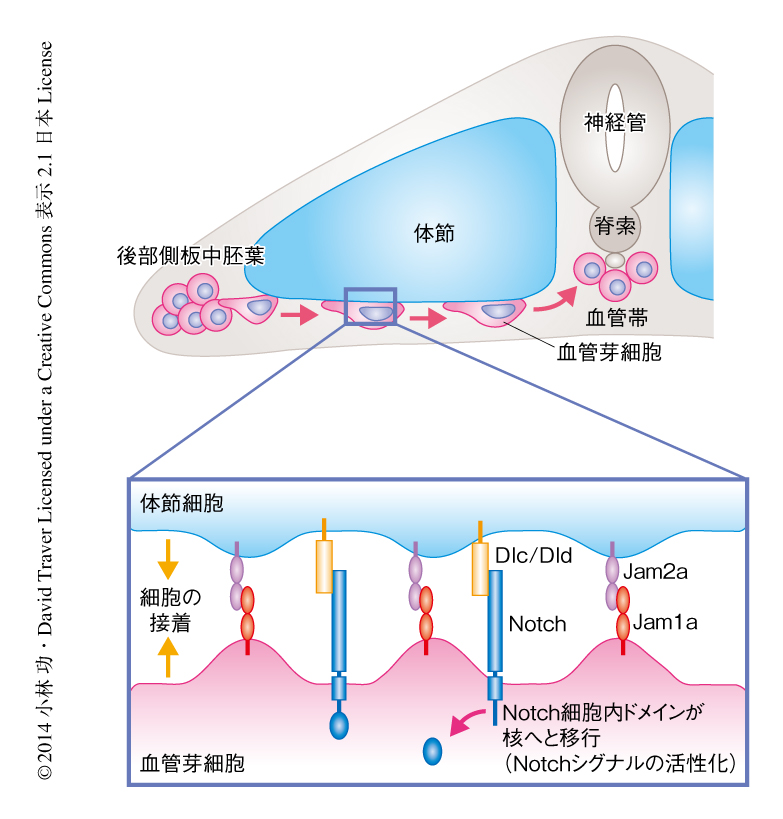
ゼブラフィッシュにおいて体節に発現するdlc遺伝子およびdld遺伝子はWnt16により制御されており,Wnt16を欠損した胚は体節におけるdlc遺伝子およびdld遺伝子の発現が低下する5).このWnt16を欠損した胚においてNotchシグナルの活性化について調べたところ,Jam1aを欠損した胚とほぼ同様に,大動脈の腹側壁においてNotchシグナルの活性化の低下が認められた.このことから,大動脈におけるNotchシグナルの一部は体節に由来するNotchシグナルにより活性化されていると考えられた.そこで,Jam1aを欠損した胚において体節におけるdlc遺伝子およびdld遺伝子の発現,さらに,血管芽細胞におけるNotch受容体をコードするnotch1a遺伝子,notch1b遺伝子,notch3遺伝子の発現について調べた.しかしながら,Jam1aを欠損した胚においてこれらの遺伝子の発現に異常は認められなかった.これらのことから,Jam1aを欠損した胚におけるNotchシグナルの低下は,NotchリガンドあるいはNotch受容体の異常によるものではなく,シグナル伝達の異常によるものと考えられた.さきに述べたように,Jam1aを欠損した胚では細胞移動の過程において血管芽細胞における体節との接触面が小さくなっているため,これにともないNotchシグナル伝達の効率が低下している可能性が考えられた.そこで,Jam1aを欠損した胚の血管芽細胞においてより多くのDlcシグナルあるいはDldシグナルを供給するため,dlc遺伝子あるいはdld遺伝子を全身性に強制発現させた.その結果,Jam1aを欠損した胚において,dld遺伝子の強制発現により大動脈におけるNotchシグナルの活性およびrunx1遺伝子の発現がほぼ正常に回復し,また,dlc遺伝子を強制発現させた場合にも部分的な回復が認められた.以上より,血管芽細胞は細胞移動の過程においてJam1aおよびJam2aを介して体節と接着しており,この接着によりNotchシグナルが効率よく伝達されていることが示された(図2).
Notch-Runx1シグナル伝達経路は造血幹細胞への運命の決定においてもっとも重要なシグナル伝達経路のひとつであり,脊椎動物において高く保存されている9).筆者らの研究によると,runx1遺伝子を発現するのは血管芽細胞のなかでもとくに強いNotchシグナルの活性を示す細胞であった.このことはすなわち,血管芽細胞から造血性内皮細胞への分化には高いレベルのNotchシグナルを必要とすることを示唆した.“Notchシグナルの強さ”はNotchリガンドを発現する細胞とNotch受容体を発現する細胞との“細胞接着の強さ”に比例することが報告されており10),この研究において示された,Jamタンパク質による接着が効率的なNotchシグナル伝達を介するという見解と一致した.くわえて,従来,Notchシグナルによる造血幹細胞への運命の決定は大動脈の形成ののち起こると考えられてきたが,この研究から,血管芽細胞が正中へ移動する時期,つまり,大動脈の形成よりもかなり早い段階で運命の決定がなされていることが示された.これらの知見は,iPS細胞から造血幹細胞へ分化を誘導する際に,どのタイミングでどのシグナルをどのくらい作用させればよいかを決定するための判断基準としても重要である.
略歴:2009年 日本大学大学院獣医学研究科 修了,同年 慶應義塾大学医学部 研究員を経て,2011年より米国California大学San Diego校 研究員.
研究テーマ:造血幹細胞の発生および維持.
関心事:魚類の成体の造血組織である腎臓における造血幹細胞ニッチ.
David Traver
米国California大学San Diego校 教授.
研究室URL:http://labs.biology.ucsd.edu/traver/Traver_Laboratory/Home.html
© 2014 小林 功・David Traver Licensed under CC 表示 2.1 日本
(米国California大学San Diego校Department of Cellular and Molecular Medicine)
email:小林 功
DOI: 10.7875/first.author.2014.113
Jam1a-Jam2a interactions regulate haematopoietic stem cell fate through Notch signalling.
Isao Kobayashi, Jingjing Kobayashi-Sun, Albert D. Kim, Claire Pouget, Naonobu Fujita, Toshio Suda, David Traver
Nature, 512, 319-323 (2014)
要 約
脊椎動物の発生の過程においてNotchシグナルは造血幹細胞への運命の決定に重要な役割をはたしている.Notchシグナルは細胞膜において発現するNotchリガンドとNotch受容体とが接触することにより伝達される.これまでに,筆者らの研究グループは,ゼブラフィッシュにおいて体節に発現する2つのNotchリガンド,DlcおよびDldが造血幹細胞の発生において必須であることを報告している.しかしながら,これらのNotchシグナルが,いつ,どこで,どのように造血幹細胞の発生に関与しているのかについては不明であった.この研究においては,造血系および血管系の共通の前駆細胞である血管芽細胞が体節の腹側にそって正中へと移動する際,体節と直接的に接触することによりNotchシグナルが伝達され,さらに,このシグナル伝達にはJamとよばれる2つの細胞接着分子が関与していることを見い出した.これらの結果は,Notchシグナルによる造血幹細胞への運命の決定がこれまで予想されていた時期よりもかなり早い段階で起こっていることを示唆した.
はじめに
造血幹細胞はすべての種類の血液細胞を生涯にわたり供給しつづけることから,自己複製能および多分化能をもつとされている.生体の外においてiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)から造血幹細胞への分化を誘導することができれば,白血病などさまざまな難治性の血液疾患に対する根治的な治療ができると期待されている.しかしながら,iPS細胞から造血幹細胞への分化の誘導法はいまだ確立されていない.この分化の誘導を実現するためには,生体の外において初期胚から造血幹細胞までの発生の過程を忠実に再現する必要があり,造血幹細胞の発生にかかわる分子機構の解明がもとめられている.
脊椎動物において,造血幹細胞は背側大動脈の腹側壁に存在する血管内皮細胞より出現することが知られている.この血管内皮細胞はとくに造血性内皮細胞とよばれ,内皮-造血転換により造血幹細胞へと分化すると考えられている1-3).この造血性内皮細胞への運命の決定においてはNotchシグナルが中心的な役割をはたしている4).これまでに,筆者らの研究グループは,ゼブラフィッシュにおいて体節に発現する2つのNotchリガンド,DlcおよびDldが造血幹細胞の発生に必須であることを報告している5).Notchシグナルの伝達には,Notchリガンドを発現する細胞とNotch受容体を発現する細胞とが直接的に接触する必要があるため,効率のよいシグナル伝達のためになんらかの細胞接着分子が関与している可能性が考えられる.そこで,この研究においては,造血幹細胞に発現するJam1 6) および体節に発現するJam2 7,8) に着目し,ゼブラフィッシュを用いて造血幹細胞の発生におけるJamタンパク質とNotchシグナルとの関連性およびその役割について解析した.
1.Jam1aは造血幹細胞の発生において不可欠である
Jamタンパク質は免疫グロブリンスーパーファミリーに属する細胞接着分子であり,Jam1(Jam-A,F11R),Jam2(Jam-B),Jam3(Jam-C)の3つの大きなグループから構成され,さまざまな組織あるいは細胞において密着結合や細胞移動に関与している.Jam1はマウスの造血幹細胞において発現しているが6),造血幹細胞における機能については報告されていない.Jam1遺伝子のゼブラフィッシュにおけるオルソログであるjam1a遺伝子は,受精後14時間の胚において両側性に分布する後部側板中胚葉に発現していた.この後部側板中胚葉には,造血性内皮細胞と血管内皮細胞の共通の前駆細胞である血管芽細胞が含まれる.jam1a遺伝子の制御領域においてタモキシフェンに誘導性にCreリコンビナーゼを発現するトランスジェニック系統と,Creリコンビナーゼの存在のもと赤色蛍光タンパク質DsRedを発現するレポーター系統とを交配して得られた胚において,jam1a遺伝子を発現する細胞の細胞系譜を長期間にわたり追跡した.後部側板中胚葉が形成される受精後12時間の前後にタモキシフェンを処理したところ,DsRedを発現する多種類の血液細胞が5カ月以上の長期間にわたり成体の造血組織に検出された.これらのことから,jam1a遺伝子は将来,造血幹細胞へと分化する血管芽細胞において発現することが明らかになった.
Jam1aの造血幹細胞の発生における役割を調べるため,モルフォリーノオリゴヌクレオチドを用いて遺伝子の機能を阻害する実験を行った.Runx1は大動脈の造血性内皮細胞において内皮-造血転換に必須な転写因子であり,造血性内皮細胞のマーカーとしても知られている.野生型の胚と比べ,Jam1aを欠損した胚では大動脈の領域におけるrunx1遺伝子の発現がいちじるしく低下していた.背側大動脈より出現した造血幹細胞はcmyb遺伝子を発現する細胞として大動脈の領域および尾部造血組織に検出される2).Jam1aを欠損した胚ではこのcmyb遺伝子を発現する細胞の数が野生型の胚に比べおよそ1/12に低下していた.一方,大動脈のマーカー遺伝子であるefnb2a遺伝子はJam1aを欠損した胚においてもほぼ正常に発現していたことから,Jam1aの欠損は大動脈の形成には影響しないと考えられた.さらに,背側大動脈の周囲に分布する後部主静脈,体節,前腎,脊索などの組織もほぼ正常に発生していたことから,Jam1aを欠損した胚における造血幹細胞の発生の異常は,周囲の組織の発生の異常に起因するものではないと考えられた.
2.Jam1aは血管芽細胞の細胞移動を制御する
血管芽細胞を含む後部側板中胚葉は,はじめ体節の両側に形成され,そののち正中へ移動し,正中にて血管帯とよばれる帯状の組織を形成して,やがて背側大動脈,後部主静脈,造血幹細胞を形成する(図1).血管芽細胞のマーカー遺伝子であるfli1遺伝子の発現を指標として,Jam1aを欠損した胚における血管芽細胞の形成および細胞移動について調べた.Jam1aを欠損した胚において血管芽細胞の形成に異常は認められなかったが,野生型の胚と比べ,細胞移動に遅れの生じていることがわかった.fli1遺伝子の制御のもとGFPを発現するトランスジェニック系統を用いて,血管芽細胞の細胞移動のようすをタイムラプスイメージング法により観察した.野生型の胚において,血管芽細胞は受精後14時間ごろから細胞移動を開始し,体節の腹側にそって正中に達すると,受精後17.5時間までに血管帯を形成した.一方,Jam1aを欠損した胚では同じ時期に細胞移動を開始したが,その移動速度は遅く,受精後17.5時間においても血管帯の形成は不完全であった.
胚の組織標本を作製し,fli1遺伝子の発現を指標として移動している血管芽細胞の形態を観察した.野生型の胚において移動している血管芽細胞は平らな形態を示し,体節の腹側面にへばりついているようすが観察された.一方,Jam1aを欠損した胚では移動している血管芽細胞は球形で,体節との接着面が有意に小さくなっていた.これらのことから,Jam1aは血管芽細胞において体節との接着に関与している可能性が示唆された.
3.体節に由来するJam2aの欠損はJam1aを欠損した胚と同様の表現型を示す
Jam1aが体節との接着に関与しているのであれば,体節においてJam1aと結合の可能ななんらかの細胞接着分子が発現しているものと考えられたため,体節に発現するjam遺伝子を探索した.ゼブラフィッシュのゲノムにはjam1a遺伝子,jam1b遺伝子,jam2a遺伝子,jam2b遺伝子,jam3a遺伝子,jam3b遺伝子の6つのjam遺伝子が同定されている.これまでの報告によると,これらにコードされるJamタンパク質のうちJam1aと結合の可能なものはJam2a,Jam2b,Jam3aの3つであり,一方,Jam1aはJam1a自体,Jam1b,Jam3bとは結合できず,さらに,6つのjam遺伝子のうち体節に発現しているのはjam2a遺伝子およびjam3b遺伝子のみである7,8).そこで,血管芽細胞が細胞移動の過程においてjam2a遺伝子を発現する体節細胞と接触する機会があるかどうか調べた.血管芽細胞が細胞移動する受精後16時間の胚において,jam2a遺伝子は体節に特異的に発現していた.この受精後16時間の胚の組織標本を作製し,jam2a遺伝子とfli1遺伝子の二重染色を行った.その結果,細胞移動している血管芽細胞がjam2a遺伝子を発現する体節の腹側面と密に接触しているようすが観察された.
Jam1aとJam2aとの結合能を確かめるため,Flagタグを付加したJam1aおよびHAタグを付加したJam2aを用いて抗Flag抗体による免疫沈降を行った.免疫沈降物を抗HA抗体を用いたウェスタンブロット法により解析したところHAタグを付加したJam2aが検出された.さらに,Jam1aあるいはJam2aを発現させたHela細胞を用いて,タンパク質のあいだの結合を蛍光により検出できるproximity ligation assay法により解析した結果,Jam1aを発現させた細胞とJam2aを発現させた細胞との接触面に多数の蛍光シグナルが検出された.以上より,Jam1aとJam2aはトランス型の結合により細胞のあいだの接着に関与していることが明らかになった.
これらのことは,血管芽細胞が細胞移動の過程においてJam1aとJam2aとの結合を介して体節と接着している可能性を示唆した.そこで,Jam2aの機能を阻害した場合にもJam1aを欠損した胚と同様の表現型が得られるかどうか調べるため,モルフォリーノオリゴヌクレオチドを用いてJam2aの機能を阻害する実験を行った.Jam2aを欠損した胚において大動脈の領域におけるrunx1遺伝子の発現はいちじるしく低下していた.さらに,Jam2aを欠損した胚における血管芽細胞の細胞移動は,野生型の胚と比べ遅れが生じていることがわかった.また,同様の結果は,機能的なJam2aを発現できないjam2a変異体からも得られた.これらの表現型はJam1aを欠損した胚の表現型と一致しており,Jam1aとJam2aとの結合が血管芽細胞の細胞移動および造血幹細胞の発生において重要な役割をはたしていることが示唆された.
4.Jam1aとJam2aとの接着はNotchシグナルの伝達を介する
筆者らのグループは,体節に由来するDlcおよびDldが造血幹細胞の発生に必須であることを報告している5).NotchシグナルはNotchリガンドを発現する細胞とNotch受容体を発現する細胞とが直接的に接触することにより伝達されるため,Jam1aとJam2aを介した細胞接着が体節からのNotchシグナルの伝達を促進している可能性が考えられた.そこで,Jam1aを欠損した胚におけるNotchシグナルの活性化について調べるため,Notchシグナルの活性化にともないGFPを発現するレポーター系統を用いてNotchシグナルの活性化について野生型の胚とJam1aを欠損した胚とで比較した.血管芽細胞が細胞移動を完了する受精後18時間において,野生型の胚では血管芽細胞の一部に強いNotchシグナルの活性化が認められた.一方,Jam1aを欠損した胚では同じ時期において,血管芽細胞におけるNotchシグナルの活性化はいちじるしく低下していた.造血性内皮細胞が大動脈の領域に出現する受精後28時間において,野生型の胚では大動脈の全体に強いNotchシグナルの活性化が認められた.興味深いことに,同じ時期のJam1aを欠損した胚においては,大動脈の腹側壁においてのみNotchシグナルの活性化の顕著な低下が認められ,また,同じ領域に多くのアポトーシス細胞が検出された.
Notchシグナルを活性化させることにより造血系内皮細胞への分化能が回復するかどうかを確かめるため,Jam1aを欠損した胚においてNotchシグナルの活性化因子であるNotch細胞内ドメインを強制発現させた.Notch細胞内ドメインを血管芽細胞において特異的に発現させたところ,Jam1aを欠損した胚の大動脈におけるrunx1遺伝子の発現はほぼ正常なレベルにまで回復した.また,同様の結果はJam2aを欠損した胚においても得られた.以上のことから,Jam1aを欠損した胚ではNotchシグナルの低下にともない血管芽細胞から造血性内皮細胞への分化に異常が生じ,その結果,大動脈の腹側壁においてアポトーシスがひき起こされていると考えられた.
ゼブラフィッシュにおいて体節に発現するdlc遺伝子およびdld遺伝子はWnt16により制御されており,Wnt16を欠損した胚は体節におけるdlc遺伝子およびdld遺伝子の発現が低下する5).このWnt16を欠損した胚においてNotchシグナルの活性化について調べたところ,Jam1aを欠損した胚とほぼ同様に,大動脈の腹側壁においてNotchシグナルの活性化の低下が認められた.このことから,大動脈におけるNotchシグナルの一部は体節に由来するNotchシグナルにより活性化されていると考えられた.そこで,Jam1aを欠損した胚において体節におけるdlc遺伝子およびdld遺伝子の発現,さらに,血管芽細胞におけるNotch受容体をコードするnotch1a遺伝子,notch1b遺伝子,notch3遺伝子の発現について調べた.しかしながら,Jam1aを欠損した胚においてこれらの遺伝子の発現に異常は認められなかった.これらのことから,Jam1aを欠損した胚におけるNotchシグナルの低下は,NotchリガンドあるいはNotch受容体の異常によるものではなく,シグナル伝達の異常によるものと考えられた.さきに述べたように,Jam1aを欠損した胚では細胞移動の過程において血管芽細胞における体節との接触面が小さくなっているため,これにともないNotchシグナル伝達の効率が低下している可能性が考えられた.そこで,Jam1aを欠損した胚の血管芽細胞においてより多くのDlcシグナルあるいはDldシグナルを供給するため,dlc遺伝子あるいはdld遺伝子を全身性に強制発現させた.その結果,Jam1aを欠損した胚において,dld遺伝子の強制発現により大動脈におけるNotchシグナルの活性およびrunx1遺伝子の発現がほぼ正常に回復し,また,dlc遺伝子を強制発現させた場合にも部分的な回復が認められた.以上より,血管芽細胞は細胞移動の過程においてJam1aおよびJam2aを介して体節と接着しており,この接着によりNotchシグナルが効率よく伝達されていることが示された(図2).
おわりに
Notch-Runx1シグナル伝達経路は造血幹細胞への運命の決定においてもっとも重要なシグナル伝達経路のひとつであり,脊椎動物において高く保存されている9).筆者らの研究によると,runx1遺伝子を発現するのは血管芽細胞のなかでもとくに強いNotchシグナルの活性を示す細胞であった.このことはすなわち,血管芽細胞から造血性内皮細胞への分化には高いレベルのNotchシグナルを必要とすることを示唆した.“Notchシグナルの強さ”はNotchリガンドを発現する細胞とNotch受容体を発現する細胞との“細胞接着の強さ”に比例することが報告されており10),この研究において示された,Jamタンパク質による接着が効率的なNotchシグナル伝達を介するという見解と一致した.くわえて,従来,Notchシグナルによる造血幹細胞への運命の決定は大動脈の形成ののち起こると考えられてきたが,この研究から,血管芽細胞が正中へ移動する時期,つまり,大動脈の形成よりもかなり早い段階で運命の決定がなされていることが示された.これらの知見は,iPS細胞から造血幹細胞へ分化を誘導する際に,どのタイミングでどのシグナルをどのくらい作用させればよいかを決定するための判断基準としても重要である.
文 献
- Zovein, A. C., Hofmann, J. J., Lynch, M. et al.: Fate tracing reveals the endothelial origin of hematopoietic stem cells. Cell Stem Cell, 3, 625-636 (2008)[PubMed]
- Bertrand, J. Y., Chi, N. C., Santoso, B. et al.: Haematopoietic stem cells derive directly from aortic endothelium during development. Nature, 464, 108-111 (2010)[PubMed]
- Kissa, K. & Herbomel, P.: Blood stem cells emerge from aortic endothelium by a novel type of cell transition. Nature, 464, 112-115 (2010)[PubMed]
- Hadland, B. K., Huppert, S. S., Kanungo, J. et al.: A requirement for Notch1 distinguishes 2 phases of definitive hematopoiesis during development. Blood, 104, 3097-3105 (2004)[PubMed]
- Clements, W. K., Kim, A. D., Ong, K. G. et al.: A somitic Wnt16/Notch pathway specifies haematopoietic stem cells. Nature, 474, 220-224 (2011)[PubMed]
- Sugano, Y., Takeuchi, M., Hirata, A. et al.: Junctional adhesion molecule-A, JAM-A, is a novel cell-surface marker for long-term repopulating hematopoietic stem cells. Blood, 111, 1167-1172 (2008)[PubMed]
- Powell, G. T. & Wright, G. J.: Jamb and Jamc are essential for vertebrate myocyte fusion. PLoS Biol., 9, e1001216 (2011)[PubMed]
- Powell, G. T. & Wright, G. J.: Genomic organisation, embryonic expression and biochemical interactions of the zebrafish junctional adhesion molecule family of receptors. PLoS One, 7, e40810 (2012)[PubMed]
- Clements, W. K. & Traver, D.: Signalling pathways that control vertebrate haematopoietic stem cell specification. Nat. Rev. Immunol., 13, 336-348 (2013)[PubMed]
- Ahimou, F., Mok, L. P., Bardot, B. et al.: The adhesion force of Notch with Delta and the rate of Notch signaling. J. Cell Biol., 167, 1217-1229 (2004)[PubMed]
著者プロフィール
略歴:2009年 日本大学大学院獣医学研究科 修了,同年 慶應義塾大学医学部 研究員を経て,2011年より米国California大学San Diego校 研究員.
研究テーマ:造血幹細胞の発生および維持.
関心事:魚類の成体の造血組織である腎臓における造血幹細胞ニッチ.
David Traver
米国California大学San Diego校 教授.
研究室URL:http://labs.biology.ucsd.edu/traver/Traver_Laboratory/Home.html
© 2014 小林 功・David Traver Licensed under CC 表示 2.1 日本