転写因子NAC45およびNAC86は維管束植物の篩部要素の核の消失をともなう分化を制御する
古田かおり・Ykä Helariutta
(フィンランドHelsinki大学Institute of Biotechnology)
email:古田かおり
DOI: 10.7875/first.author.2014.111
Arabidopsis NAC45/86 direct sieve element morphogenesis culminating in enucleation.
Kaori Miyashima Furuta, Shri Ram Yadav, Satu Lehesranta, Ilya Belevich, Shunsuke Miyashima, Jung-ok Heo, Anne Vatén, Ove Lindgren, Bert De Rybel, Gert Van Isterdael, Panu Somervuo, Raffael Lichtenberger, Raquel Rocha, Siripong Thitamadee, Sari Tähtiharju, Petri Auvinen, Tom Beeckman, Eija Jokitalo, Ykä Helariutta
Science, 345, 933-937 (2014)
維管束植物の篩部は光合成産物の長距離の輸送を担う重要な通導組織であり,篩部要素とよばれる細胞が列状に分化して連結することにより管状の組織が形成され,その内部をとおし物質が輸送される.効率のよい輸送のため,篩部要素は細胞の連結部に篩板を形成し,また,生細胞でありながら核を消失することが古典的に知られていたが,その制御機構についてはまったくわかっていなかった.筆者らは,3次元走査型電子顕微鏡イメージング法およびオルガネラのマーカーを用いた生細胞イメージング法により,シロイヌナズナの根における篩部要素の分化の過程を詳細に可視化した.その結果,核を消失するときに核の内容物が細胞質へと放出されて分解されることを見い出した.また,篩部要素における細胞内での消化はNAC45とNAC86という冗長な2つの転写因子により統合的に制御されていた.NAC45およびNAC86は細胞内での消化のみを特異的に制御し,篩部要素の分化の別の側面である細胞壁の構造の制御には関与していなかった.さらに,核の消失の完了に必要な核酸分解酵素ドメインをもつタンパク質ファミリーをNAC45およびNAC 86の下流タンパク質として同定した.これらの結果から,篩部要素の分化には新規の自己消化の機構とその特異的な制御系が関与することが明らかになった.
高等植物は光合成産物を葉から貯蔵組織へと分配する輸送系として篩部を発達させている1,2).篩部は通導の機能を担う篩部要素と,その生命機能をささえる伴細胞から構成されている.篩部が動物の循環器系と大きく異なる点は,物質が篩部要素という細胞の内部をとおり輸送されることである.そのため,篩部要素の分化には物質の輸送に特化した特異な過程が必要となる.具体的には,篩孔とよばれる穴をもつ細胞壁の構造,すなわち,篩板を細胞の連結面に形成することにより,互いに高度に連絡している.また,篩部要素の内部では核,ゴルジ体,粗面小胞体などのオルガネラが除去され,細胞質基質は希釈されている3,4).このように,篩部要素は維管束植物の生命機能をささえる現象を理解するうえで重要な細胞であるばかりでなく,“near death”様の分化を示す点で真核生物における細胞の機能の分化において非常に興味深い事例であるが,にもかかわらず,篩部要素の分化を担うタンパク質あるいは制御機構に関する分子レベルでの知見は非常に少ない.
真核生物の細胞が分化の過程で核を消失する例としては,哺乳動物の赤血球において細胞体から核が排出されることや5),動物のレンズ線維細胞においてプログラム細胞死に関連するタンパク質が核の消失に必要であること6),単細胞の真核生物においてオートファジー様の核の分解(ヌクレオファジー)が起こること7,8),などが知られている.筆者らは,モデル植物であるシロイヌナズナの篩部要素がこれまでに報告のない新しいタイプの核の消失の過程をへて形成されることを明らかにし,さらに,この過程を制御する2つの階層的な制御タンパク質の解析から,篩部要素における核の消失の分子機構をたどることに成功した.
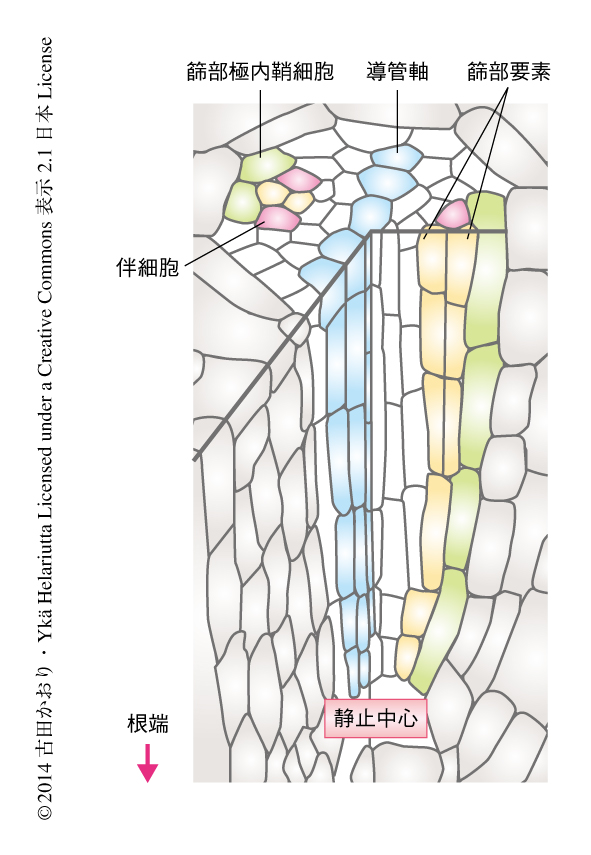
シロイヌナズナの根においては,根端で未分化な細胞が産出され,そののち,基部側の分化領域で表皮,皮層,内皮,内鞘などの細胞層にかこまれるように維管束組織が形成される.この原生維管束組織では中央に導管軸が形成され,導管軸をはさみ導管からもっとも離れた位置に篩部極が形成される(図1).篩部極では2つの篩部極内鞘細胞と伴細胞にはさまれた位置に篩部要素が形成される9,10).これまで,篩部要素および伴細胞の細胞運命を決定するタンパク質は報告されていたものの10),輸送路の本体を構成する篩部要素の分化についてはほとんど解析されておらず,その核の消失の過程もよく知られていなかった.そこで,走査型電子顕微鏡を用いた連続断面観察法(serial block-face scanning electron microscopy:SBEM)を用いて3次元イメージングを行い,シロイヌナズナの根の篩部要素における分化の過程を詳細に可視化した.具体的には,分化の段階にある篩部要素の細胞列について,根端側の予定篩部要素細胞から基部側の成熟した篩部要素までの10~17細胞からなる細胞列に対し,40 nm間隔で連続した横断切片を作製して走査型電子顕微鏡により画像を取得し,得られた数千枚の画像を3次元に構築した.また,これと平行してオルガネラマーカーを用いた共焦点顕微鏡による生細胞イメージングを行った.
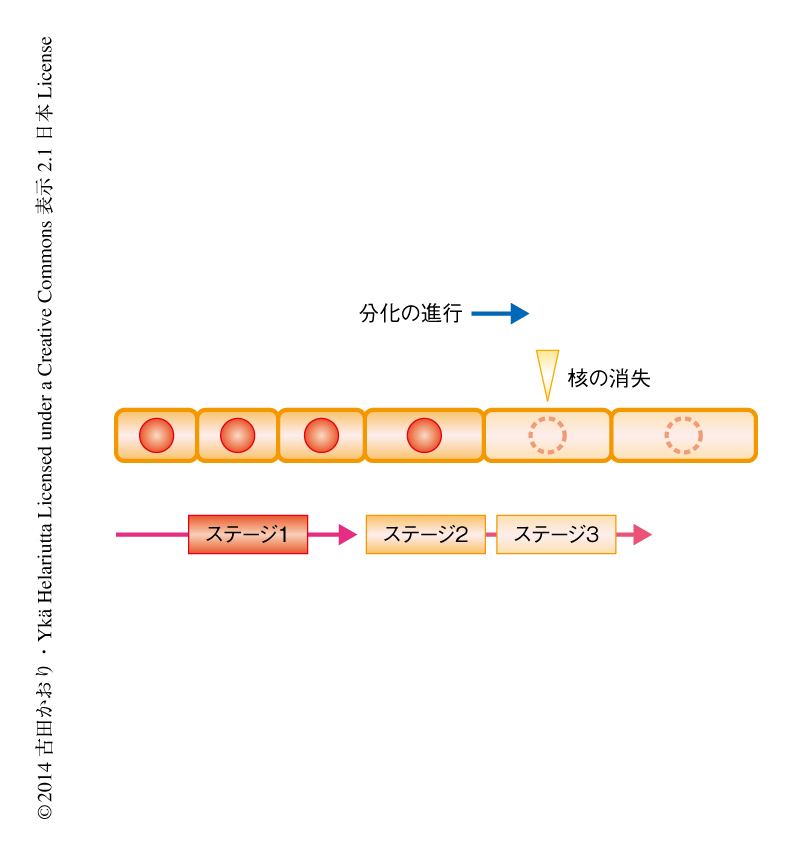
3次元走査型電子顕微鏡イメージング法により篩部要素の細胞内での消化の過程を観察した結果,分化の初期の段階(ステージ1)では,核小体の断片化,小胞体の簡素化,特殊な色素体が確認され(図2),過去の報告が確かめられた2,11).のちの核の消失の直前の段階(ステージ2)では,細胞質に散在するミトコンドリアが核の近傍にクラスター化し,ゴルジ体がみられなくなった.さらに,ステージ2から核の消失の段階(ステージ3)にかけて,核膜が破れ核の内容物の分解と細胞質基質の希釈がほぼ同じタイミングで観察されたが,ステージ3以降も不定形の核膜が残存していた.この核膜の崩壊および残存は,核膜のマーカーであるNUP1-YFP融合タンパク質の蛍光がステージ2において拡散することや,ステージ3以降において縮小した不定形の蛍光として残ることからも支持された.また特筆すべきことに,クロマチンのマーカーであるヒストンH2B-YFP融合タンパク質の蛍光は核膜の崩壊からの約10分間で核から細胞質へと拡散し消失した.このことから,篩部要素における核の消失の過程では,核膜を残したまま核の内容物が細胞質に拡散し分解されることが示唆された.これは,ほかの真核生物の生細胞における核の消失の過程とは異なっており5-8),篩部要素における核の消失はこれまでに報告されていない新規の過程をへることが明らかになった.また,篩部要素は細胞の中央に発達する大きな液胞をもたないため,導管の管状要素においてみられるような液胞の崩壊によるプログラム細胞死12) とは異なるプロセスにより自己消化されると推測された.
これまで,篩部要素および伴細胞の運命決定には転写因子APLが必要であることが明らかにされていたため10),野生型およびapl変異体の篩部をセルソーターにより単離し,マイクロアレイ解析によりAPLに依存して発現量の変化する遺伝子を探索した.その結果,篩部要素および篩部極内鞘細胞において特異的に発現する相同なNAC型の転写因子,NAC45およびNAC86を同定した.NAC45遺伝子およびNAC86遺伝子のプロモーターの活性はともにapl変異体において低下しており,NAC45遺伝子およびNAC86遺伝子の発現はAPLに依存的であることが確認された.
NAC45遺伝子の2つのT-DNA挿入変異体であるnac45-1変異体およびnac45-2変異体,および,NAC86遺伝子のT-DNA挿入変異体であるnac86変異体は,いずれも単独では表現型を示さなかった.一方で,nac45-1 nac86二重変異体およびnac45-2 nac86二重変異体においては根および地上部の成長がいちじるしく阻害され,とくに,nac45-2 nac86二重変異体はapl変異体と同様に芽生え致死であった.この表現型はYFP-NAC86融合遺伝子の導入により回復し,このとき,YFP-NAC86融合タンパク質の蛍光は核に局在した.また,根の分化領域の横断切片をトルイジンブルー染色したところ,nac45-2 nac86二重変異体では分化した篩部要素に特有の非染色細胞がみられなかったことから,この二重変異体では篩部要素が正常に分化していないことが示唆された.これを機能面から確認するため,nac45-2 nac86二重変異体の篩部輸送について解析した.野生型においては伴細胞に特異的に発現させたGFPは篩部要素を介して根端へ輸送されるため根端に蛍光が観察される.これに対し,nac45-2 nac86二重変異体においては伴細胞に発現させたGFPの蛍光は根端では観察されず,篩部輸送に欠損のあることが示唆された.さらに興味深いことに,nac45-2 nac86二重変異体では篩板の形成や細胞壁の肥厚など細胞壁の分化は正常であったが,核の消失や細胞質基質の希釈などの細胞内での消化が起こらなくなっていた.このとき,nac45-2 nac86二重変異体では篩部要素の分化のステージ1においてみられる核小体の断片化などは観察される一方で,ステージ2以降においてみられるはずのミトコンドリアのクラスター化やゴルジ体の消失などはみられなかった.以上のことから,NAC45およびNAC86は核の消失をともなう細胞内での消化の最終ステップを特異的かつ統合的に制御していることが示唆された.
さらに,NAC45過剰発現体では篩部要素に隣接する伴細胞や一部の前形成層細胞において,頻度は低いものの異所的な核の消失や細胞質基質の希釈がひき起こされた.この結果は,NAC45およびNAC86が,少なくとも篩部の周辺の細胞において核の消失をともなう細胞内での消化の誘導に十分であることを示した.
野生型,nac45-2 nac86二重変異体,NAC45過剰発現体のトランスクリプトームを解析することにより転写因子NAC45およびNAC86の下流において機能する遺伝子を探索した.候補となる遺伝子のプロモーターをクローニングしてレポーター解析をしたところ,少なくともいくつかの篩部要素に特異的な遺伝子の発現がNAC45およびNAC86に依存していることが明らかになった.さらに,NAC45およびNAC86の下流で機能する遺伝子として,エキソヌクレアーゼ様ドメインを含むタンパク質ファミリーをコードするNEN1遺伝子,NEN2遺伝子,NEN4遺伝子を同定した.NEN1遺伝子およびNEN2遺伝子はステージ1の篩部要素において発現するのに対し,NEN4遺伝子はステージ1後期からステージ2の篩部要素において限定的に発現していた.レポーター解析の結果,これらの遺伝子の発現量はNAC45およびNAC86に依存することが確認された.また,少なくともNEN2遺伝子については,NAC45遺伝子の過剰発現により異所的な発現が誘導されることが確認された.NENファミリータンパク質の細胞における局在について調べたところ,NEN4-YFP融合タンパク質はステージ1後期からステージ2の1つあるいは少数の細胞において核に局在していた.一方で,NEN1-YFP融合タンパク質およびNEN2-YFP融合タンパク質はステージ1の篩部要素においては細胞質に局在し,ステージ2では細胞質だけではなく核にも局在していた.このような局在の変化はnac45 nac86二重変異体ではみられなかったことから,NEN1遺伝子およびNEN2遺伝子の発現は転写のみならず,転写ののちにおいてもNAC45およびNAC86に依存的であると推測された.
2つの独立したnen4機能欠損変異体においては,根の伸長が抑制され,クロマチンのマーカーであるヒストンH2B-YFP融合タンパク質の断片化した不定形の蛍光がステージ3以降の篩部要素において検出された.3次元走査型電子顕微鏡イメージング法による観察から,これらの変異体では細胞質基質の希釈やミトコンドリアのクラスター化は起こるものの,核膜の崩壊ののちも核の内容物が核膜の残存物に付着して残ることが示された.以上のことから,NEN4はNAC45およびNAC86が統合的に制御する篩部要素の細胞内での消化の過程において,核の内容物の分解を特異的に担っていることが明らかになった.
篩部要素の分化は,大きく分けて篩板の形成など細胞壁の構造の分化と,核の消失を含む細胞内での消化の2つの過程からなる.この研究では,シロイヌナズナを用いてこのうちの細胞内での消化の機構の輪郭を明らかにすることができた.この研究において同定された転写因子NAC45およびNAC86は細胞内での消化の最終ステップの開始を制御すると考えられ,NEN遺伝子を含む篩部要素において発現する遺伝子の発現制御,核の消失,オルガネラのクラスター化,NEN1およびNEN2の細胞における局在の変化,細胞質基質の希釈など,さまざまな過程を統合的に制御していることが示された.NAC45およびNAC86が仲介するさまざまな過程の相互依存の関係(図3)を解明することが今後の課題である.また,筆者らは,篩板など細胞壁の構造の形成,カロースの蓄積,核小体の断片化など,NAC45およびNAC86に依存しない過程も見い出しているが,これらはNAC45およびNAC86の上流の制御タンパク質であるAPLや未知の制御タンパク質に制御されていると考えられる.この研究の成果は,維管束植物において重要な機能を担う篩部の分化制御の機構を明らかにしたのみならず,真核生物の生細胞における自己消化の機構の多様性についても新たな知見をあたえた.
略歴:2011年 大阪大学大学院理学研究科にて博士号取得,同年 フィンランドHelsinki大学 博士研究員を経て,2013年より奈良先端科学技術大学院大学バイオサイエンス研究科 博士研究員.
研究テーマ:篩部輸送をつかさどる細胞の機能の獲得.
関心事:輸送ネットワークの生理機能.
Ykä Helariutta
フィンランドHelsinki大学 教授.
研究室URL:http://www.biocenter.helsinki.fi/bi/Helariutta/index.htm
© 2014 古田かおり・Ykä Helariutta Licensed under CC 表示 2.1 日本
(フィンランドHelsinki大学Institute of Biotechnology)
email:古田かおり
DOI: 10.7875/first.author.2014.111
Arabidopsis NAC45/86 direct sieve element morphogenesis culminating in enucleation.
Kaori Miyashima Furuta, Shri Ram Yadav, Satu Lehesranta, Ilya Belevich, Shunsuke Miyashima, Jung-ok Heo, Anne Vatén, Ove Lindgren, Bert De Rybel, Gert Van Isterdael, Panu Somervuo, Raffael Lichtenberger, Raquel Rocha, Siripong Thitamadee, Sari Tähtiharju, Petri Auvinen, Tom Beeckman, Eija Jokitalo, Ykä Helariutta
Science, 345, 933-937 (2014)
要 約
維管束植物の篩部は光合成産物の長距離の輸送を担う重要な通導組織であり,篩部要素とよばれる細胞が列状に分化して連結することにより管状の組織が形成され,その内部をとおし物質が輸送される.効率のよい輸送のため,篩部要素は細胞の連結部に篩板を形成し,また,生細胞でありながら核を消失することが古典的に知られていたが,その制御機構についてはまったくわかっていなかった.筆者らは,3次元走査型電子顕微鏡イメージング法およびオルガネラのマーカーを用いた生細胞イメージング法により,シロイヌナズナの根における篩部要素の分化の過程を詳細に可視化した.その結果,核を消失するときに核の内容物が細胞質へと放出されて分解されることを見い出した.また,篩部要素における細胞内での消化はNAC45とNAC86という冗長な2つの転写因子により統合的に制御されていた.NAC45およびNAC86は細胞内での消化のみを特異的に制御し,篩部要素の分化の別の側面である細胞壁の構造の制御には関与していなかった.さらに,核の消失の完了に必要な核酸分解酵素ドメインをもつタンパク質ファミリーをNAC45およびNAC 86の下流タンパク質として同定した.これらの結果から,篩部要素の分化には新規の自己消化の機構とその特異的な制御系が関与することが明らかになった.
はじめに
高等植物は光合成産物を葉から貯蔵組織へと分配する輸送系として篩部を発達させている1,2).篩部は通導の機能を担う篩部要素と,その生命機能をささえる伴細胞から構成されている.篩部が動物の循環器系と大きく異なる点は,物質が篩部要素という細胞の内部をとおり輸送されることである.そのため,篩部要素の分化には物質の輸送に特化した特異な過程が必要となる.具体的には,篩孔とよばれる穴をもつ細胞壁の構造,すなわち,篩板を細胞の連結面に形成することにより,互いに高度に連絡している.また,篩部要素の内部では核,ゴルジ体,粗面小胞体などのオルガネラが除去され,細胞質基質は希釈されている3,4).このように,篩部要素は維管束植物の生命機能をささえる現象を理解するうえで重要な細胞であるばかりでなく,“near death”様の分化を示す点で真核生物における細胞の機能の分化において非常に興味深い事例であるが,にもかかわらず,篩部要素の分化を担うタンパク質あるいは制御機構に関する分子レベルでの知見は非常に少ない.
真核生物の細胞が分化の過程で核を消失する例としては,哺乳動物の赤血球において細胞体から核が排出されることや5),動物のレンズ線維細胞においてプログラム細胞死に関連するタンパク質が核の消失に必要であること6),単細胞の真核生物においてオートファジー様の核の分解(ヌクレオファジー)が起こること7,8),などが知られている.筆者らは,モデル植物であるシロイヌナズナの篩部要素がこれまでに報告のない新しいタイプの核の消失の過程をへて形成されることを明らかにし,さらに,この過程を制御する2つの階層的な制御タンパク質の解析から,篩部要素における核の消失の分子機構をたどることに成功した.
1.篩部要素の分化の過程
シロイヌナズナの根においては,根端で未分化な細胞が産出され,そののち,基部側の分化領域で表皮,皮層,内皮,内鞘などの細胞層にかこまれるように維管束組織が形成される.この原生維管束組織では中央に導管軸が形成され,導管軸をはさみ導管からもっとも離れた位置に篩部極が形成される(図1).篩部極では2つの篩部極内鞘細胞と伴細胞にはさまれた位置に篩部要素が形成される9,10).これまで,篩部要素および伴細胞の細胞運命を決定するタンパク質は報告されていたものの10),輸送路の本体を構成する篩部要素の分化についてはほとんど解析されておらず,その核の消失の過程もよく知られていなかった.そこで,走査型電子顕微鏡を用いた連続断面観察法(serial block-face scanning electron microscopy:SBEM)を用いて3次元イメージングを行い,シロイヌナズナの根の篩部要素における分化の過程を詳細に可視化した.具体的には,分化の段階にある篩部要素の細胞列について,根端側の予定篩部要素細胞から基部側の成熟した篩部要素までの10~17細胞からなる細胞列に対し,40 nm間隔で連続した横断切片を作製して走査型電子顕微鏡により画像を取得し,得られた数千枚の画像を3次元に構築した.また,これと平行してオルガネラマーカーを用いた共焦点顕微鏡による生細胞イメージングを行った.
3次元走査型電子顕微鏡イメージング法により篩部要素の細胞内での消化の過程を観察した結果,分化の初期の段階(ステージ1)では,核小体の断片化,小胞体の簡素化,特殊な色素体が確認され(図2),過去の報告が確かめられた2,11).のちの核の消失の直前の段階(ステージ2)では,細胞質に散在するミトコンドリアが核の近傍にクラスター化し,ゴルジ体がみられなくなった.さらに,ステージ2から核の消失の段階(ステージ3)にかけて,核膜が破れ核の内容物の分解と細胞質基質の希釈がほぼ同じタイミングで観察されたが,ステージ3以降も不定形の核膜が残存していた.この核膜の崩壊および残存は,核膜のマーカーであるNUP1-YFP融合タンパク質の蛍光がステージ2において拡散することや,ステージ3以降において縮小した不定形の蛍光として残ることからも支持された.また特筆すべきことに,クロマチンのマーカーであるヒストンH2B-YFP融合タンパク質の蛍光は核膜の崩壊からの約10分間で核から細胞質へと拡散し消失した.このことから,篩部要素における核の消失の過程では,核膜を残したまま核の内容物が細胞質に拡散し分解されることが示唆された.これは,ほかの真核生物の生細胞における核の消失の過程とは異なっており5-8),篩部要素における核の消失はこれまでに報告されていない新規の過程をへることが明らかになった.また,篩部要素は細胞の中央に発達する大きな液胞をもたないため,導管の管状要素においてみられるような液胞の崩壊によるプログラム細胞死12) とは異なるプロセスにより自己消化されると推測された.
2.篩部要素の分化に必要な転写因子NAC45およびNAC86の同定
これまで,篩部要素および伴細胞の運命決定には転写因子APLが必要であることが明らかにされていたため10),野生型およびapl変異体の篩部をセルソーターにより単離し,マイクロアレイ解析によりAPLに依存して発現量の変化する遺伝子を探索した.その結果,篩部要素および篩部極内鞘細胞において特異的に発現する相同なNAC型の転写因子,NAC45およびNAC86を同定した.NAC45遺伝子およびNAC86遺伝子のプロモーターの活性はともにapl変異体において低下しており,NAC45遺伝子およびNAC86遺伝子の発現はAPLに依存的であることが確認された.
NAC45遺伝子の2つのT-DNA挿入変異体であるnac45-1変異体およびnac45-2変異体,および,NAC86遺伝子のT-DNA挿入変異体であるnac86変異体は,いずれも単独では表現型を示さなかった.一方で,nac45-1 nac86二重変異体およびnac45-2 nac86二重変異体においては根および地上部の成長がいちじるしく阻害され,とくに,nac45-2 nac86二重変異体はapl変異体と同様に芽生え致死であった.この表現型はYFP-NAC86融合遺伝子の導入により回復し,このとき,YFP-NAC86融合タンパク質の蛍光は核に局在した.また,根の分化領域の横断切片をトルイジンブルー染色したところ,nac45-2 nac86二重変異体では分化した篩部要素に特有の非染色細胞がみられなかったことから,この二重変異体では篩部要素が正常に分化していないことが示唆された.これを機能面から確認するため,nac45-2 nac86二重変異体の篩部輸送について解析した.野生型においては伴細胞に特異的に発現させたGFPは篩部要素を介して根端へ輸送されるため根端に蛍光が観察される.これに対し,nac45-2 nac86二重変異体においては伴細胞に発現させたGFPの蛍光は根端では観察されず,篩部輸送に欠損のあることが示唆された.さらに興味深いことに,nac45-2 nac86二重変異体では篩板の形成や細胞壁の肥厚など細胞壁の分化は正常であったが,核の消失や細胞質基質の希釈などの細胞内での消化が起こらなくなっていた.このとき,nac45-2 nac86二重変異体では篩部要素の分化のステージ1においてみられる核小体の断片化などは観察される一方で,ステージ2以降においてみられるはずのミトコンドリアのクラスター化やゴルジ体の消失などはみられなかった.以上のことから,NAC45およびNAC86は核の消失をともなう細胞内での消化の最終ステップを特異的かつ統合的に制御していることが示唆された.
さらに,NAC45過剰発現体では篩部要素に隣接する伴細胞や一部の前形成層細胞において,頻度は低いものの異所的な核の消失や細胞質基質の希釈がひき起こされた.この結果は,NAC45およびNAC86が,少なくとも篩部の周辺の細胞において核の消失をともなう細胞内での消化の誘導に十分であることを示した.
3.転写因子NAC45およびNAC86の下流において必要なタンパク質ファミリーの同定
野生型,nac45-2 nac86二重変異体,NAC45過剰発現体のトランスクリプトームを解析することにより転写因子NAC45およびNAC86の下流において機能する遺伝子を探索した.候補となる遺伝子のプロモーターをクローニングしてレポーター解析をしたところ,少なくともいくつかの篩部要素に特異的な遺伝子の発現がNAC45およびNAC86に依存していることが明らかになった.さらに,NAC45およびNAC86の下流で機能する遺伝子として,エキソヌクレアーゼ様ドメインを含むタンパク質ファミリーをコードするNEN1遺伝子,NEN2遺伝子,NEN4遺伝子を同定した.NEN1遺伝子およびNEN2遺伝子はステージ1の篩部要素において発現するのに対し,NEN4遺伝子はステージ1後期からステージ2の篩部要素において限定的に発現していた.レポーター解析の結果,これらの遺伝子の発現量はNAC45およびNAC86に依存することが確認された.また,少なくともNEN2遺伝子については,NAC45遺伝子の過剰発現により異所的な発現が誘導されることが確認された.NENファミリータンパク質の細胞における局在について調べたところ,NEN4-YFP融合タンパク質はステージ1後期からステージ2の1つあるいは少数の細胞において核に局在していた.一方で,NEN1-YFP融合タンパク質およびNEN2-YFP融合タンパク質はステージ1の篩部要素においては細胞質に局在し,ステージ2では細胞質だけではなく核にも局在していた.このような局在の変化はnac45 nac86二重変異体ではみられなかったことから,NEN1遺伝子およびNEN2遺伝子の発現は転写のみならず,転写ののちにおいてもNAC45およびNAC86に依存的であると推測された.
2つの独立したnen4機能欠損変異体においては,根の伸長が抑制され,クロマチンのマーカーであるヒストンH2B-YFP融合タンパク質の断片化した不定形の蛍光がステージ3以降の篩部要素において検出された.3次元走査型電子顕微鏡イメージング法による観察から,これらの変異体では細胞質基質の希釈やミトコンドリアのクラスター化は起こるものの,核膜の崩壊ののちも核の内容物が核膜の残存物に付着して残ることが示された.以上のことから,NEN4はNAC45およびNAC86が統合的に制御する篩部要素の細胞内での消化の過程において,核の内容物の分解を特異的に担っていることが明らかになった.
おわりに
篩部要素の分化は,大きく分けて篩板の形成など細胞壁の構造の分化と,核の消失を含む細胞内での消化の2つの過程からなる.この研究では,シロイヌナズナを用いてこのうちの細胞内での消化の機構の輪郭を明らかにすることができた.この研究において同定された転写因子NAC45およびNAC86は細胞内での消化の最終ステップの開始を制御すると考えられ,NEN遺伝子を含む篩部要素において発現する遺伝子の発現制御,核の消失,オルガネラのクラスター化,NEN1およびNEN2の細胞における局在の変化,細胞質基質の希釈など,さまざまな過程を統合的に制御していることが示された.NAC45およびNAC86が仲介するさまざまな過程の相互依存の関係(図3)を解明することが今後の課題である.また,筆者らは,篩板など細胞壁の構造の形成,カロースの蓄積,核小体の断片化など,NAC45およびNAC86に依存しない過程も見い出しているが,これらはNAC45およびNAC86の上流の制御タンパク質であるAPLや未知の制御タンパク質に制御されていると考えられる.この研究の成果は,維管束植物において重要な機能を担う篩部の分化制御の機構を明らかにしたのみならず,真核生物の生細胞における自己消化の機構の多様性についても新たな知見をあたえた.
文 献
- Lucas, W. J., Groover, A., Lichtenberger, R. et al.: The plant vascular system: evolution, development and functions. J. Integr. Plant Biol., 55, 294-388 (2013)[PubMed]
- Sjolund, R. D.: The phloem sieve element: a river runs through it. Plant Cell, 9, 1137-1146 (1997)[PubMed]
- Esau, K.: Development and structure of the phloem tissue II. Bot. Rev., 16, 67-114 (1950)
- Furuta, K. M., Hellmann, E. & Helariutta, Y.: Molecular control of cell specification and cell differentiation during procambial development. Annu. Rev. Plant Biol., 65, 607-638 (2014)[PubMed]
- Bessis, M. & Bricka, M.: Dynamic aspect of blood cells; study by phase contrast microcinematography. Revue d'hematologie, 7, 407-435 (1952)
- Wride, M. A.: Lens fibre cell differentiation and organelle loss: many paths lead to clarity. Philos. Trans. R. Soc. Lond. B Biol. Sci., 366, 1219-1233 (2011)[PubMed]
- Mijaljica, D. & Devenish, R. J.: Nucleophagy at a glance. J. Cell Sci., 126, 4325-4330 (2013)[PubMed]
- Liu, M. L. & Yao, M. C.: Role of ATG8 and autophagy in programmed nuclear degradation in Tetrahymena thermophila. Eukaryot. Cell, 11, 494-506 (2012)[PubMed]
- Mahonen, A. P., Bonke, M., Kauppinen, L. et al.: A novel two-component hybrid molecule regulates vascular morphogenesis of the Arabidopsis root. Genes Dev., 14, 2938-2943 (2000)[PubMed]
- Bonke, M., Thitamadee, S., Mahonen, A. P. et al.: APL regulates vascular tissue identity in Arabidopsis. Nature, 426, 181-186 (2003)[PubMed]
- Wang, L., Zhou, Z., Song, X. et al.: Evidence of ceased programmed cell death in metaphloem sieve elements in the developing caryopsis of Triticum aestivum L. Protoplasma, 234, 87-96 (2008)[PubMed]
- van Doorn, W. G., Beers, E. P., Dangl, J. L. et al.: Morphological classification of plant cell deaths. Cell Death. Differ., 18, 1241-1246 (2011)[PubMed]
著者プロフィール
略歴:2011年 大阪大学大学院理学研究科にて博士号取得,同年 フィンランドHelsinki大学 博士研究員を経て,2013年より奈良先端科学技術大学院大学バイオサイエンス研究科 博士研究員.
研究テーマ:篩部輸送をつかさどる細胞の機能の獲得.
関心事:輸送ネットワークの生理機能.
Ykä Helariutta
フィンランドHelsinki大学 教授.
研究室URL:http://www.biocenter.helsinki.fi/bi/Helariutta/index.htm
© 2014 古田かおり・Ykä Helariutta Licensed under CC 表示 2.1 日本