内在性の脂質の過酸化によるC型肝炎ウイルスの複製の制御
山根大典・Stanley M. Lemon
(米国North Carolina大学Chapel Hill校Department of Medicine)
email:山根大典
DOI: 10.7875/first.author.2014.109
Regulation of the hepatitis C virus RNA replicase by endogenous lipid peroxidation.
Daisuke Yamane, David R. McGivern, Eliane Wauthier, MinKyung Yi, Victoria J. Madden, Christoph Welsch, Iris Antes, Yahong Wen, Pauline E. Chugh, Charles E. McGee, Douglas G. Widman, Ichiro Misumi, Sibali Bandyopadhyay, Seungtaek Kim, Tetsuro Shimakami, Tsunekazu Oikawa, Jason K. Whitmire, Mark T. Heise, Dirk P. Dittmer, C. Cheng Kao, Stuart M. Pitson, Alfred H. Merrill Jr., Lola M. Reid, Stanley M. Lemon
Nature Medicine, 20, 927-935 (2014)
ウイルスによる感染はしばしば酸化的な組織の傷害をともなうが,それがウイルス複製にあたえる影響についてはこれまであまり理解されていなかった.筆者らは,C型肝炎ウイルスはほかのRNAウイルスとは異なり,脂質の過酸化による小胞体膜の傷害によりウイルス複製がきわめて繊細に抑制されること,また,脂質の過酸化の一部は2型スフィンゴシンキナーゼにより制御されていることを見い出した.細胞における脂質の過酸化を抑制すると,ウイルス複製複合体を構成する非構造タンパク質を標的とする直接作用型の抗ウイルス剤の50%有効濃度が特異的に上昇したことから,脂質の過酸化によりウイルス複製複合体の立体構造が制御されていることが示唆された.さらに,脂質の過酸化への耐性にかかわるアミノ酸変異をプロテアーゼ補因子NS4AおよびRNAポリメラーゼNS5Bの小胞体膜貫通領域あるいは小胞体膜に近接した部位に見い出し,また,耐性の獲得が効率的なウイルス複製に重要であることを明らかにした.細胞培養により効率的に複製することから研究にもっとも用いられているC型肝炎ウイルス株であるJFH1株のウイルス複製複合体も脂質の過酸化に対する耐性を示したことから,それが効率的なウイルス複製に不可欠な要素であることが裏づけられた.複数の異なる遺伝子型のC型肝炎ウイルス株も脂質の過酸化に対する感受性をもつことが確かめられたことから,典型的な野生型のC型肝炎ウイルス株の複製は細胞における脂質の過酸化により負に制御されており,そのことが肝臓における長期的な潜伏感染を促進していると考えられた.
C型肝炎ウイルスは肝硬変や肝臓がんをひき起こす重要な病原体であるが1),ほとんどの野生型のC型肝炎ウイルス株は培養細胞において複製しないためウイルス複製の分子機構の詳細は未解明のままである.劇症肝炎の患者から分離された遺伝子型2aのJFH1株はC型肝炎ウイルス株のなかでも例外であり,肝がんに由来するHuh-7細胞において効率よく複製し,感染性ウイルス粒子の放出や再感染を含む完全なウイルス生活環を培養細胞において再現することができる2).臨床において重要なのは遺伝子型1のC型肝炎ウイルス株であるが,細胞培養では効率よく増殖させることが困難なため,ウイルス複製に関する多くの研究においてJFH1株が用いられている.しかしながら,JFH1株が効率的に複製する分子機構は詳細には理解されていない.
ほかのプラス鎖RNAウイルスと同様に,C型肝炎ウイルスも宿主の細胞の内部に存在する生体膜を利用し,複数のウイルス非構造タンパク質により構成されるウイルス複製複合体によりゲノムを複製する.C型肝炎ウイルスにより誘導される小胞体膜に由来する構造は“membranous web”として知られ3),コレステロールやスフィンゴ脂質などの脂質が多く含まれている.脂質の代謝はウイルス複製の後期(感染性ウイルス粒子の形成)においても重要であるが,脂質による小胞体膜の修飾はウイルスRNAの合成にも深く関与している.スフィンゴ脂質のなかでもスフィンゴミエリンは特定の遺伝子型のC型肝炎ウイルス株のRNAポリメラーゼと結合してその酵素活性や局在に影響をあたえることが知られている4,5).スフィンゴ脂質の代謝とウイルス複製との関係を詳細に評価したところ,JFH1株のウイルス複製複合体と遺伝子型1aのH77S.3株のウイルス複製複合体とでは,さまざまなスフィンゴ脂質代謝酵素を標的とした阻害剤に対する感受性が大きく異なることが見い出された.なかでも,もっともウイルス複製への影響の大きかったスフィンゴシンキナーゼ阻害剤の作用機構を探索した結果,JFH1株を除く典型的なC型肝炎ウイルス株は細胞における脂質の過酸化に対し強い感受性をもつことが見い出され,また,これはほかのRNAウイルスにはみられないユニークな特徴であることがわかった.これらの結果から,C型肝炎ウイルスは感染により誘導される脂質の過酸化を敏感に感知し,RNAの合成を制限することによりウイルス複製の量を低く抑え潜伏感染を促進していると考えられた.
スフィンゴ脂質代謝酵素を標的とした阻害剤がC型肝炎ウイルスの複製にあたえる影響を,異なる遺伝子型1のウイルス株(1a型:H77S.3株6),1b型:N.2株)と,H77S.3株に由来する構造タンパク質と遺伝子型2aのJFH1株に由来する非構造タンパク質からなるキメラウイルス株であるHJ3-5株とで比較した.驚いたことに,すべての阻害剤に対しH77S.3株とHJ3-5株とのあいだで正反対の作用が認められ,なかでも,スフィンゴシンキナーゼ阻害剤に対しもっとも顕著な違いがみられた.1μMのスフィンゴシンキナーゼ阻害剤はH77S.3株およびN.2株の複製を3~6倍も増強した一方,JFH1株に由来するウイルス複製複合体をもつHJ3-5株の複製は有意に抑制された.スフィンゴシンキナーゼには,おもに細胞質に局在する1型スフィンゴシンキナーゼと,小胞体,ミトコンドリア,核に局在する2型スフィンゴシンキナーゼの2つのアイソフォームが存在するが,2型スフィンゴシンキナーゼをsiRNAによりノックダウンすることによりスフィンゴシンキナーゼ阻害剤と同様な効果が得られたことから,スフィンゴシンキナーゼ阻害剤の作用は2型スフィンゴシンキナーゼの抑制によるものと考えられた.in vitroにおける組換えタンパク質を用いた解析においても,1μMのスフィンゴシンキナーゼ阻害剤は2型スフィンゴシンキナーゼのみを抑制することが確認された.スフィンゴシンキナーゼ阻害剤はC型肝炎ウイルスの複製にかかわるとされる細胞に存在するスフィンゴミエリン,コレステロール,脂肪滴の量に影響をあたえなかったことから,宿主のほかの因子に影響をあたえていると考えられた.
以前に,ほかの研究グループにより,多価不飽和脂肪酸が脂質の過酸化を誘導することにより遺伝子型1bのC型肝炎ウイルス株の複製が抑制されることが報告されていたが7),JFH1株に由来するウイルス複製複合体をもつHJ3-5株はH77S.3株と比較して多価不飽和脂肪酸に対し強い耐性をもつことが見い出された.スフィンゴシンキナーゼ阻害剤の存在のもとでは多価不飽和脂肪酸はH77S.3株およびN.2株の複製をまったく抑制しなかったこと,さらに,スフィンゴシンキナーゼ阻害剤は脂質の過酸化物であるマロンジアルデヒドの産生を有意に抑制することから,スフィンゴシンキナーゼ阻害剤は2型スフィンゴシンキナーゼの阻害を介して細胞における脂質の過酸化を低下させることによりC型肝炎ウイルスの複製を促進していると考えられた.
この結果を裏づけるように,脂質の過酸化を抑制する作用のあるビタミンEやコエンザイムQ10などの脂溶性の抗酸化剤も,スフィンゴシンキナーゼ阻害剤と同様にH77S.3株およびN.2株の複製を増強した一方,HJ3-5株の複製には抑制的にはたらくことが確認された.反対に,脂溶性の酸化剤であるクメンヒドロペルオキシドはH77S.3株およびN.2株の複製を強く抑制した一方で,HJ3-5株の複製にはまったく影響しなかった.
細胞培養に用いられるウシ胎仔血清は一般にビタミンEなどの脂溶性の抗酸化物を豊富に含んでいることから,無血清培地においてスフィンゴシンキナーゼ阻害剤およびビタミンEの効果をさらに評価した.H77S.3株の複製は無血清培地においてはほとんど起こらなかったが,スフィンゴシンキナーゼ阻害剤あるいはビタミンEを添加することにより約100倍も増加し,ウシ胎仔血清を含む培地と同等なレベルでウイルス複製が起こったことから,ウシ胎仔血清に含まれる脂溶性の抗酸化物がC型肝炎ウイルスの複製において重要であることが示された.反対に,HJ3-5株の複製は無血清培地においても可能で,脂質の過酸化の抑制によりその効率はやや低下した.このことから,JFH1株のウイルス複製複合体は内在性および薬剤により誘導された脂質の過酸化に対し強い耐性をもつことが示された.
ウイルスの複製量と同様に,スフィンゴシンキナーゼ阻害剤あるいはビタミンEを培地に添加すると,H77S.3株のウイルスの産生は約10倍,N.2株のウイルスの産生は約100倍に増大し,ウイルスに感染していない細胞への新規の感染も増加したが,HJ3-5株においては抑制的な効果のみがみられた.H77S.3株の感染性ウイルス粒子の性状を遠心分離法を用いて観察したところ,感染性ウイルス粒子は脂質の過酸化の有無にかかわらず1.12~1.14g/cm3の比重に分布しており,また,ゲノムのコピー数あたりのウイルスの感染効率もあまり変化はなかった.よって,脂質の過酸化の抑制はおもにC型肝炎ウイルスの複製を活性化し,それにともない感染性ウイルス粒子の産生を増加させると考えられた.
以上の実験は細胞培養に適応した複数のアミノ酸変異をもつC型肝炎ウイルス株を用いたが,アミノ酸変異をもたない野生型のC型肝炎ウイルス株を用いて脂質の過酸化の影響を評価した.肝がんに由来するHuh-7.5細胞にウイルスのRNAをエレクトロポレーション法により導入し,遺伝子型1aあるいは遺伝子型1bの野生型のC型肝炎ウイルス株の複製を測定したところ,複製のレベルはアミノ酸変異をもつC型肝炎ウイルス株と比べいちじるしく低かったものの,スフィンゴシンキナーゼ阻害剤あるいはビタミンEの存在のもとではウイルスの複製量は顕著に増加した.多価不飽和脂肪酸はウイルス複製を抑制したが,スフィンゴシンキナーゼ阻害剤あるいはビタミンEによりその抑制効果が完全に打ち消されたことから,野生型のC型肝炎ウイルス株の複製も脂質の過酸化に感受性をもつことが確認された.
さらに,より自然感染に近い状態を再現するため,初代培養肝細胞を用いて脂質の過酸化の影響について調べた.C型肝炎ウイルスが複製しやすいとされる初代ヒト胎児肝芽細胞に遺伝子型1aのH77S.3株,あるいは,JFH1株に由来するウイルス複製複合体をもつHJ3-5株を感染させてウイルス複製を観察したところ,H77S.3株はスフィンゴシンキナーゼ阻害剤あるいはビタミンEの存在のもとでのみ効率的に複製し感染性ウイルス粒子を産生したが,HJ3-5株においては複製および感染性ウイルス粒子の産生のいずれもが抑制された.初代培養肝細胞においては宿主のインターフェロンシグナル伝達系がC型肝炎ウイルスの複製を強力に抑制していることが知られているが,スフィンゴシンキナーゼ阻害剤およびビタミンEはインターフェロンβの活性化には影響しないことがセンダイウイルスを用いたプロモーターアッセイにより確認された.よって,初代培養肝細胞においても脂質の過酸化はインターフェロンとは異なる経路によりC型肝炎ウイルスの複製を抑制していることが示された.
透過型電子顕微鏡を用いてC型肝炎ウイルスが誘導する小胞体膜に由来する構造(membranous web)を観察したところ,スフィンゴシンキナーゼ阻害剤あるいはビタミンEはH77S.3株の感染した細胞においては小胞体膜に由来する構造の二重膜構造に影響をあたえることなく面積を有意に増大させ,逆に,多価不飽和脂肪酸などによる脂質の過酸化の誘導によりその面積は有意に減少し,ウイルスの複製量との相関がみられた.一方,HJ3-5株に感染した細胞における小胞体膜に由来する構造の二重膜構造および面積は脂質の過酸化による影響をうけないことが示された.
脂質の過酸化への感受性を決定するウイルスタンパク質を探索するため,H77S.3株とJFH1株とのあいだでおのおのの非構造タンパク質を交換した変異体を作製し脂質の過酸化への影響について調べたところ,単独ではなく複数の非構造タンパク質が協同して脂質の過酸化に対する感受性を決定していることが示唆された.この結果と一致して,スフィンゴシンキナーゼ阻害剤あるいはビタミンEにより脂質の過酸化を抑制すると,プロテアーゼ複合体NS3-NS4A,あるいは,RNAポリメラーゼNS5Bを標的とした複数の直接作用型の抗ウイルス剤の50%有効濃度が有意に2~3倍も上昇することが観察された.一方,シクロフィリン,microRNA-122,ホスファチジルイノシトール4-キナーゼなどの宿主のもつ因子を標的とした抗ウイルス剤ではスフィンゴシンキナーゼ阻害剤あるいはビタミンEの存在のもとでの50%有効濃度の上昇がみられなかったことから,抗ウイルス剤の結合するC型肝炎ウイルスタンパク質の立体構造が脂質の過酸化により変化していることが考えられた.JFH1株に由来するウイルス複製複合体をもつHJ3-5株においてはこのような50%有効濃度の上昇がみられなかったことから,この変化は脂質の過酸化に感受性をもつC型肝炎ウイルス株に特異的なものであり,さらに,スフィンゴシンキナーゼ阻害剤およびビタミンEは抗ウイルス剤の取り込みや代謝には影響をあたえないことが示された.
最近,遺伝子型1aのTNcc株が8つのアミノ酸変異を獲得することによりJFH1株と同等の複製効率が得られるという報告があったことから8),それらのアミノ酸変異が脂質の過酸化への感受性に対し影響をあたえるかどうか調べた.8つすべてのアミノ酸変異をH77S.3株に導入したところウイルス複製はまったくみられなかったが,H77S.3株のNS5Aに存在するアミノ酸変異のうち1つをもとにもどすと低いレベルながらウイルス複製がみられることを見い出した.驚いたことに,この変異ウイルス株は脂質の過酸化に対する耐性を示した.しかしながら,ウイルス複製のレベルがいちじるしく低かったことから,この変異ウイルス株を感染した細胞を1カ月にわたり継代維持したところ,新たに3つのアミノ酸変異を獲得することにより約850倍の効率でウイルス複製が起こり,この株をH77D株と命名した.H77D株はHJ3-5株と同等の効率で感染性ウイルス粒子を産生し,ビタミンEによるウイルス複製の増強効果もみられなかった.H77D株に生じた新たな3つのアミノ酸変異はいずれも脂質の過酸化への感受性には影響をあたえなかったことから,TNcc株に由来するアミノ酸変異との互換性に必要なものであると考えられた.TNcc株に由来する8つのアミノ酸変異にくわえ,もっともウイルス複製の増強効果のあったアミノ酸変異1つをNS4Bに導入した変異ウイルス株をベースとして,TNcc株に由来するアミノ酸変異を非構造タンパク質ごとにもとのH77S.3株のものにもどした変異体を作製したところ,NS4Aに存在するアミノ酸変異をもとにもどすと脂質の過酸化への耐性を失い,NS5Bに存在するアミノ酸変異をもとにもどすとウイルス複製はまったく起こらないことが判明したが,NS3あるいはNS4Bに存在するアミノ酸変異をもとにもどしても脂質の過酸化に対する耐性は維持されたままであった.NS4AあるいはNS5Bにおける単独のアミノ酸変異では感受性は変化しなかったことから,複数の非構造タンパク質の変異が共存することが脂質の過酸化に対する耐性の獲得に必要であると考えられた.これらのアミノ酸変異は小胞体膜貫通領域あるいは小胞体膜に近接した部位に位置していたことから,小胞体膜において生じる脂質の過酸化への耐性に直接に関与していると考えられた.
以上の実験において,遺伝子型1aあるいは遺伝子型1bのC型肝炎ウイルス株が脂質の過酸化に耐性であることを示したが,現在,細胞培養の可能なほかのC型肝炎ウイルス株として,遺伝子型2a(JFH-2株),遺伝子型3a(S52株),遺伝子型4a(ED43株)のウイルス株についても調べたところ,これらすべてにおいてスフィンゴシンキナーゼ阻害剤あるいはビタミンEによるウイルス複製の増強および脂溶性の酸化剤によるウイルス複製の抑制が認められた.よって,遺伝子型に関係なくほとんどのC型肝炎ウイルス株が脂質の過酸化に対する感受性をもち,JFH1株のみが例外的に耐性型であることが明らかになった.
ほかのRNAウイルスについても同じ肝がん細胞を用いて調べたところ,近縁のフラビウイルス,アルファウイルス,A型肝炎ウイルス,さらに,持続感染型のリンパ球性脈絡髄膜炎ウイルスのいずれもが脂質の過酸化に耐性であった.このことから,C型肝炎ウイルスの脂質の過酸化に対する感受性はほかのRNAウイルスにはみられないユニークな特徴であることが示された.
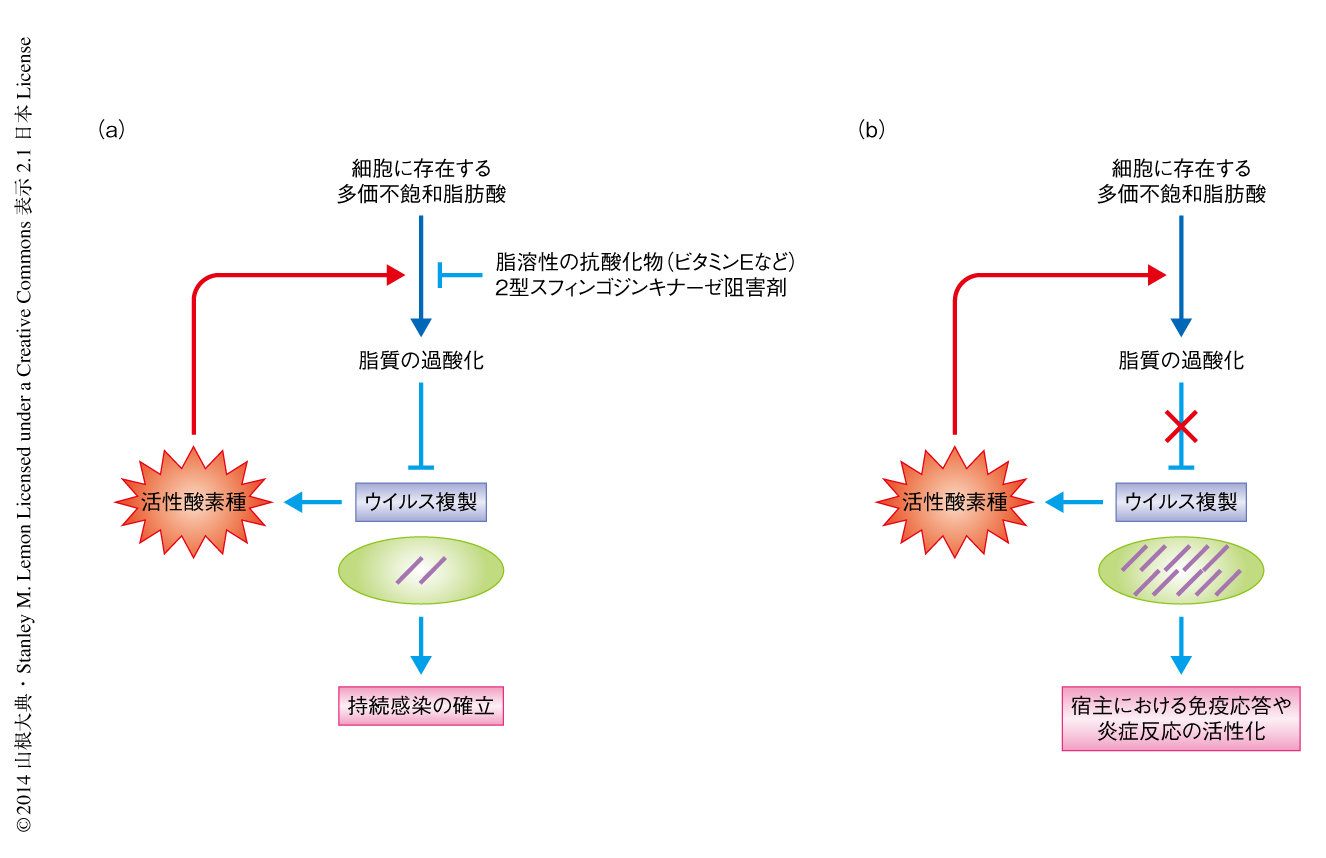
C型肝炎ウイルスはほかのウイルスとは異なり,10年から30年もの長期にわたり持続感染するという特徴をもつ.一般に,慢性期の肝臓の組織においてウイルス抗原を検出するのは困難であり,ウイルス複製は低く保たれていることが知られている9).一部のC型肝炎ウイルスタンパク質は細胞において発現すると酸化ストレスを誘導することから10),それにともない誘導された脂質の過酸化がブレーキとなりウイルス複製を低く維持していると考えられた(図1).C型肝炎ウイルスはアミノ酸変異により脂質の過酸化に対する耐性を獲得できるにもかかわらず,JFH1株を除くほとんどのウイルス株は脂質の過酸化に対する感受性を維持していたことから,この特性が宿主の免疫系からの回避などの点で大きなアドバンテージをもたらしていると推察された.今回の発見は,C型肝炎ウイルスの持続感染の機構の解明に寄与するだけでなく,これまで培養が困難であったJFH1株以外のウイルス株の細胞培養をビタミンEなどの生理的な抗酸化物質を培地に添加するだけというシンプルな方法で大きく改善したという点も重要である.しかしながら,2型スフィンゴシンキナーゼがどのように細胞における脂質の過酸化を促進しているのか,また,脂質の過酸化がウイルス複製複合体の構成タンパク質であるNS4AおよびNS5Bの立体構造を制御する分子機構については未解明のままであり,今後の大きな課題である.
略歴:2009年 東京大学大学院農学生命科学研究科 修了,同年 米国Texas大学Medical Branch Galveston校Postdoctoral Fellow,2010年 米国North Carolina大学Chapel Hill校Postdoctoral Associateを経て,2013年より同Research Associate.
研究テーマ:ウイルス複製に関与する宿主の因子.
Stanley M. Lemon
米国North Carolina大学Chapel Hill校Professor.
© 2014 山根大典・Stanley M. Lemon Licensed under CC 表示 2.1 日本
(米国North Carolina大学Chapel Hill校Department of Medicine)
email:山根大典
DOI: 10.7875/first.author.2014.109
Regulation of the hepatitis C virus RNA replicase by endogenous lipid peroxidation.
Daisuke Yamane, David R. McGivern, Eliane Wauthier, MinKyung Yi, Victoria J. Madden, Christoph Welsch, Iris Antes, Yahong Wen, Pauline E. Chugh, Charles E. McGee, Douglas G. Widman, Ichiro Misumi, Sibali Bandyopadhyay, Seungtaek Kim, Tetsuro Shimakami, Tsunekazu Oikawa, Jason K. Whitmire, Mark T. Heise, Dirk P. Dittmer, C. Cheng Kao, Stuart M. Pitson, Alfred H. Merrill Jr., Lola M. Reid, Stanley M. Lemon
Nature Medicine, 20, 927-935 (2014)
要 約
ウイルスによる感染はしばしば酸化的な組織の傷害をともなうが,それがウイルス複製にあたえる影響についてはこれまであまり理解されていなかった.筆者らは,C型肝炎ウイルスはほかのRNAウイルスとは異なり,脂質の過酸化による小胞体膜の傷害によりウイルス複製がきわめて繊細に抑制されること,また,脂質の過酸化の一部は2型スフィンゴシンキナーゼにより制御されていることを見い出した.細胞における脂質の過酸化を抑制すると,ウイルス複製複合体を構成する非構造タンパク質を標的とする直接作用型の抗ウイルス剤の50%有効濃度が特異的に上昇したことから,脂質の過酸化によりウイルス複製複合体の立体構造が制御されていることが示唆された.さらに,脂質の過酸化への耐性にかかわるアミノ酸変異をプロテアーゼ補因子NS4AおよびRNAポリメラーゼNS5Bの小胞体膜貫通領域あるいは小胞体膜に近接した部位に見い出し,また,耐性の獲得が効率的なウイルス複製に重要であることを明らかにした.細胞培養により効率的に複製することから研究にもっとも用いられているC型肝炎ウイルス株であるJFH1株のウイルス複製複合体も脂質の過酸化に対する耐性を示したことから,それが効率的なウイルス複製に不可欠な要素であることが裏づけられた.複数の異なる遺伝子型のC型肝炎ウイルス株も脂質の過酸化に対する感受性をもつことが確かめられたことから,典型的な野生型のC型肝炎ウイルス株の複製は細胞における脂質の過酸化により負に制御されており,そのことが肝臓における長期的な潜伏感染を促進していると考えられた.
はじめに
C型肝炎ウイルスは肝硬変や肝臓がんをひき起こす重要な病原体であるが1),ほとんどの野生型のC型肝炎ウイルス株は培養細胞において複製しないためウイルス複製の分子機構の詳細は未解明のままである.劇症肝炎の患者から分離された遺伝子型2aのJFH1株はC型肝炎ウイルス株のなかでも例外であり,肝がんに由来するHuh-7細胞において効率よく複製し,感染性ウイルス粒子の放出や再感染を含む完全なウイルス生活環を培養細胞において再現することができる2).臨床において重要なのは遺伝子型1のC型肝炎ウイルス株であるが,細胞培養では効率よく増殖させることが困難なため,ウイルス複製に関する多くの研究においてJFH1株が用いられている.しかしながら,JFH1株が効率的に複製する分子機構は詳細には理解されていない.
ほかのプラス鎖RNAウイルスと同様に,C型肝炎ウイルスも宿主の細胞の内部に存在する生体膜を利用し,複数のウイルス非構造タンパク質により構成されるウイルス複製複合体によりゲノムを複製する.C型肝炎ウイルスにより誘導される小胞体膜に由来する構造は“membranous web”として知られ3),コレステロールやスフィンゴ脂質などの脂質が多く含まれている.脂質の代謝はウイルス複製の後期(感染性ウイルス粒子の形成)においても重要であるが,脂質による小胞体膜の修飾はウイルスRNAの合成にも深く関与している.スフィンゴ脂質のなかでもスフィンゴミエリンは特定の遺伝子型のC型肝炎ウイルス株のRNAポリメラーゼと結合してその酵素活性や局在に影響をあたえることが知られている4,5).スフィンゴ脂質の代謝とウイルス複製との関係を詳細に評価したところ,JFH1株のウイルス複製複合体と遺伝子型1aのH77S.3株のウイルス複製複合体とでは,さまざまなスフィンゴ脂質代謝酵素を標的とした阻害剤に対する感受性が大きく異なることが見い出された.なかでも,もっともウイルス複製への影響の大きかったスフィンゴシンキナーゼ阻害剤の作用機構を探索した結果,JFH1株を除く典型的なC型肝炎ウイルス株は細胞における脂質の過酸化に対し強い感受性をもつことが見い出され,また,これはほかのRNAウイルスにはみられないユニークな特徴であることがわかった.これらの結果から,C型肝炎ウイルスは感染により誘導される脂質の過酸化を敏感に感知し,RNAの合成を制限することによりウイルス複製の量を低く抑え潜伏感染を促進していると考えられた.
1.2型スフィンゴシンキナーゼはC型肝炎ウイルスの複製を制御する
スフィンゴ脂質代謝酵素を標的とした阻害剤がC型肝炎ウイルスの複製にあたえる影響を,異なる遺伝子型1のウイルス株(1a型:H77S.3株6),1b型:N.2株)と,H77S.3株に由来する構造タンパク質と遺伝子型2aのJFH1株に由来する非構造タンパク質からなるキメラウイルス株であるHJ3-5株とで比較した.驚いたことに,すべての阻害剤に対しH77S.3株とHJ3-5株とのあいだで正反対の作用が認められ,なかでも,スフィンゴシンキナーゼ阻害剤に対しもっとも顕著な違いがみられた.1μMのスフィンゴシンキナーゼ阻害剤はH77S.3株およびN.2株の複製を3~6倍も増強した一方,JFH1株に由来するウイルス複製複合体をもつHJ3-5株の複製は有意に抑制された.スフィンゴシンキナーゼには,おもに細胞質に局在する1型スフィンゴシンキナーゼと,小胞体,ミトコンドリア,核に局在する2型スフィンゴシンキナーゼの2つのアイソフォームが存在するが,2型スフィンゴシンキナーゼをsiRNAによりノックダウンすることによりスフィンゴシンキナーゼ阻害剤と同様な効果が得られたことから,スフィンゴシンキナーゼ阻害剤の作用は2型スフィンゴシンキナーゼの抑制によるものと考えられた.in vitroにおける組換えタンパク質を用いた解析においても,1μMのスフィンゴシンキナーゼ阻害剤は2型スフィンゴシンキナーゼのみを抑制することが確認された.スフィンゴシンキナーゼ阻害剤はC型肝炎ウイルスの複製にかかわるとされる細胞に存在するスフィンゴミエリン,コレステロール,脂肪滴の量に影響をあたえなかったことから,宿主のほかの因子に影響をあたえていると考えられた.
2.スフィンゴシンキナーゼ阻害剤は脂質の過酸化を抑制することによりC型肝炎ウイルスの複製を制御する
以前に,ほかの研究グループにより,多価不飽和脂肪酸が脂質の過酸化を誘導することにより遺伝子型1bのC型肝炎ウイルス株の複製が抑制されることが報告されていたが7),JFH1株に由来するウイルス複製複合体をもつHJ3-5株はH77S.3株と比較して多価不飽和脂肪酸に対し強い耐性をもつことが見い出された.スフィンゴシンキナーゼ阻害剤の存在のもとでは多価不飽和脂肪酸はH77S.3株およびN.2株の複製をまったく抑制しなかったこと,さらに,スフィンゴシンキナーゼ阻害剤は脂質の過酸化物であるマロンジアルデヒドの産生を有意に抑制することから,スフィンゴシンキナーゼ阻害剤は2型スフィンゴシンキナーゼの阻害を介して細胞における脂質の過酸化を低下させることによりC型肝炎ウイルスの複製を促進していると考えられた.
この結果を裏づけるように,脂質の過酸化を抑制する作用のあるビタミンEやコエンザイムQ10などの脂溶性の抗酸化剤も,スフィンゴシンキナーゼ阻害剤と同様にH77S.3株およびN.2株の複製を増強した一方,HJ3-5株の複製には抑制的にはたらくことが確認された.反対に,脂溶性の酸化剤であるクメンヒドロペルオキシドはH77S.3株およびN.2株の複製を強く抑制した一方で,HJ3-5株の複製にはまったく影響しなかった.
細胞培養に用いられるウシ胎仔血清は一般にビタミンEなどの脂溶性の抗酸化物を豊富に含んでいることから,無血清培地においてスフィンゴシンキナーゼ阻害剤およびビタミンEの効果をさらに評価した.H77S.3株の複製は無血清培地においてはほとんど起こらなかったが,スフィンゴシンキナーゼ阻害剤あるいはビタミンEを添加することにより約100倍も増加し,ウシ胎仔血清を含む培地と同等なレベルでウイルス複製が起こったことから,ウシ胎仔血清に含まれる脂溶性の抗酸化物がC型肝炎ウイルスの複製において重要であることが示された.反対に,HJ3-5株の複製は無血清培地においても可能で,脂質の過酸化の抑制によりその効率はやや低下した.このことから,JFH1株のウイルス複製複合体は内在性および薬剤により誘導された脂質の過酸化に対し強い耐性をもつことが示された.
3.細胞における脂質の過酸化はC型肝炎ウイルスの感染性ウイルス粒子の産生を抑制する
ウイルスの複製量と同様に,スフィンゴシンキナーゼ阻害剤あるいはビタミンEを培地に添加すると,H77S.3株のウイルスの産生は約10倍,N.2株のウイルスの産生は約100倍に増大し,ウイルスに感染していない細胞への新規の感染も増加したが,HJ3-5株においては抑制的な効果のみがみられた.H77S.3株の感染性ウイルス粒子の性状を遠心分離法を用いて観察したところ,感染性ウイルス粒子は脂質の過酸化の有無にかかわらず1.12~1.14g/cm3の比重に分布しており,また,ゲノムのコピー数あたりのウイルスの感染効率もあまり変化はなかった.よって,脂質の過酸化の抑制はおもにC型肝炎ウイルスの複製を活性化し,それにともない感染性ウイルス粒子の産生を増加させると考えられた.
4.脂質の過酸化は初代培養肝細胞においてもC型肝炎ウイルスの複製を抑制する
以上の実験は細胞培養に適応した複数のアミノ酸変異をもつC型肝炎ウイルス株を用いたが,アミノ酸変異をもたない野生型のC型肝炎ウイルス株を用いて脂質の過酸化の影響を評価した.肝がんに由来するHuh-7.5細胞にウイルスのRNAをエレクトロポレーション法により導入し,遺伝子型1aあるいは遺伝子型1bの野生型のC型肝炎ウイルス株の複製を測定したところ,複製のレベルはアミノ酸変異をもつC型肝炎ウイルス株と比べいちじるしく低かったものの,スフィンゴシンキナーゼ阻害剤あるいはビタミンEの存在のもとではウイルスの複製量は顕著に増加した.多価不飽和脂肪酸はウイルス複製を抑制したが,スフィンゴシンキナーゼ阻害剤あるいはビタミンEによりその抑制効果が完全に打ち消されたことから,野生型のC型肝炎ウイルス株の複製も脂質の過酸化に感受性をもつことが確認された.
さらに,より自然感染に近い状態を再現するため,初代培養肝細胞を用いて脂質の過酸化の影響について調べた.C型肝炎ウイルスが複製しやすいとされる初代ヒト胎児肝芽細胞に遺伝子型1aのH77S.3株,あるいは,JFH1株に由来するウイルス複製複合体をもつHJ3-5株を感染させてウイルス複製を観察したところ,H77S.3株はスフィンゴシンキナーゼ阻害剤あるいはビタミンEの存在のもとでのみ効率的に複製し感染性ウイルス粒子を産生したが,HJ3-5株においては複製および感染性ウイルス粒子の産生のいずれもが抑制された.初代培養肝細胞においては宿主のインターフェロンシグナル伝達系がC型肝炎ウイルスの複製を強力に抑制していることが知られているが,スフィンゴシンキナーゼ阻害剤およびビタミンEはインターフェロンβの活性化には影響しないことがセンダイウイルスを用いたプロモーターアッセイにより確認された.よって,初代培養肝細胞においても脂質の過酸化はインターフェロンとは異なる経路によりC型肝炎ウイルスの複製を抑制していることが示された.
5.脂質の過酸化はウイルス複製複合体の立体構造を制御する
透過型電子顕微鏡を用いてC型肝炎ウイルスが誘導する小胞体膜に由来する構造(membranous web)を観察したところ,スフィンゴシンキナーゼ阻害剤あるいはビタミンEはH77S.3株の感染した細胞においては小胞体膜に由来する構造の二重膜構造に影響をあたえることなく面積を有意に増大させ,逆に,多価不飽和脂肪酸などによる脂質の過酸化の誘導によりその面積は有意に減少し,ウイルスの複製量との相関がみられた.一方,HJ3-5株に感染した細胞における小胞体膜に由来する構造の二重膜構造および面積は脂質の過酸化による影響をうけないことが示された.
脂質の過酸化への感受性を決定するウイルスタンパク質を探索するため,H77S.3株とJFH1株とのあいだでおのおのの非構造タンパク質を交換した変異体を作製し脂質の過酸化への影響について調べたところ,単独ではなく複数の非構造タンパク質が協同して脂質の過酸化に対する感受性を決定していることが示唆された.この結果と一致して,スフィンゴシンキナーゼ阻害剤あるいはビタミンEにより脂質の過酸化を抑制すると,プロテアーゼ複合体NS3-NS4A,あるいは,RNAポリメラーゼNS5Bを標的とした複数の直接作用型の抗ウイルス剤の50%有効濃度が有意に2~3倍も上昇することが観察された.一方,シクロフィリン,microRNA-122,ホスファチジルイノシトール4-キナーゼなどの宿主のもつ因子を標的とした抗ウイルス剤ではスフィンゴシンキナーゼ阻害剤あるいはビタミンEの存在のもとでの50%有効濃度の上昇がみられなかったことから,抗ウイルス剤の結合するC型肝炎ウイルスタンパク質の立体構造が脂質の過酸化により変化していることが考えられた.JFH1株に由来するウイルス複製複合体をもつHJ3-5株においてはこのような50%有効濃度の上昇がみられなかったことから,この変化は脂質の過酸化に感受性をもつC型肝炎ウイルス株に特異的なものであり,さらに,スフィンゴシンキナーゼ阻害剤およびビタミンEは抗ウイルス剤の取り込みや代謝には影響をあたえないことが示された.
6.脂質の過酸化への耐性にはNS4AおよびNS5Bが関与し耐性の獲得は効率的なウイルスの複製に直結する
最近,遺伝子型1aのTNcc株が8つのアミノ酸変異を獲得することによりJFH1株と同等の複製効率が得られるという報告があったことから8),それらのアミノ酸変異が脂質の過酸化への感受性に対し影響をあたえるかどうか調べた.8つすべてのアミノ酸変異をH77S.3株に導入したところウイルス複製はまったくみられなかったが,H77S.3株のNS5Aに存在するアミノ酸変異のうち1つをもとにもどすと低いレベルながらウイルス複製がみられることを見い出した.驚いたことに,この変異ウイルス株は脂質の過酸化に対する耐性を示した.しかしながら,ウイルス複製のレベルがいちじるしく低かったことから,この変異ウイルス株を感染した細胞を1カ月にわたり継代維持したところ,新たに3つのアミノ酸変異を獲得することにより約850倍の効率でウイルス複製が起こり,この株をH77D株と命名した.H77D株はHJ3-5株と同等の効率で感染性ウイルス粒子を産生し,ビタミンEによるウイルス複製の増強効果もみられなかった.H77D株に生じた新たな3つのアミノ酸変異はいずれも脂質の過酸化への感受性には影響をあたえなかったことから,TNcc株に由来するアミノ酸変異との互換性に必要なものであると考えられた.TNcc株に由来する8つのアミノ酸変異にくわえ,もっともウイルス複製の増強効果のあったアミノ酸変異1つをNS4Bに導入した変異ウイルス株をベースとして,TNcc株に由来するアミノ酸変異を非構造タンパク質ごとにもとのH77S.3株のものにもどした変異体を作製したところ,NS4Aに存在するアミノ酸変異をもとにもどすと脂質の過酸化への耐性を失い,NS5Bに存在するアミノ酸変異をもとにもどすとウイルス複製はまったく起こらないことが判明したが,NS3あるいはNS4Bに存在するアミノ酸変異をもとにもどしても脂質の過酸化に対する耐性は維持されたままであった.NS4AあるいはNS5Bにおける単独のアミノ酸変異では感受性は変化しなかったことから,複数の非構造タンパク質の変異が共存することが脂質の過酸化に対する耐性の獲得に必要であると考えられた.これらのアミノ酸変異は小胞体膜貫通領域あるいは小胞体膜に近接した部位に位置していたことから,小胞体膜において生じる脂質の過酸化への耐性に直接に関与していると考えられた.
7.脂質の過酸化に対する感受性はC型肝炎ウイルスに特有である
以上の実験において,遺伝子型1aあるいは遺伝子型1bのC型肝炎ウイルス株が脂質の過酸化に耐性であることを示したが,現在,細胞培養の可能なほかのC型肝炎ウイルス株として,遺伝子型2a(JFH-2株),遺伝子型3a(S52株),遺伝子型4a(ED43株)のウイルス株についても調べたところ,これらすべてにおいてスフィンゴシンキナーゼ阻害剤あるいはビタミンEによるウイルス複製の増強および脂溶性の酸化剤によるウイルス複製の抑制が認められた.よって,遺伝子型に関係なくほとんどのC型肝炎ウイルス株が脂質の過酸化に対する感受性をもち,JFH1株のみが例外的に耐性型であることが明らかになった.
ほかのRNAウイルスについても同じ肝がん細胞を用いて調べたところ,近縁のフラビウイルス,アルファウイルス,A型肝炎ウイルス,さらに,持続感染型のリンパ球性脈絡髄膜炎ウイルスのいずれもが脂質の過酸化に耐性であった.このことから,C型肝炎ウイルスの脂質の過酸化に対する感受性はほかのRNAウイルスにはみられないユニークな特徴であることが示された.
おわりに
C型肝炎ウイルスはほかのウイルスとは異なり,10年から30年もの長期にわたり持続感染するという特徴をもつ.一般に,慢性期の肝臓の組織においてウイルス抗原を検出するのは困難であり,ウイルス複製は低く保たれていることが知られている9).一部のC型肝炎ウイルスタンパク質は細胞において発現すると酸化ストレスを誘導することから10),それにともない誘導された脂質の過酸化がブレーキとなりウイルス複製を低く維持していると考えられた(図1).C型肝炎ウイルスはアミノ酸変異により脂質の過酸化に対する耐性を獲得できるにもかかわらず,JFH1株を除くほとんどのウイルス株は脂質の過酸化に対する感受性を維持していたことから,この特性が宿主の免疫系からの回避などの点で大きなアドバンテージをもたらしていると推察された.今回の発見は,C型肝炎ウイルスの持続感染の機構の解明に寄与するだけでなく,これまで培養が困難であったJFH1株以外のウイルス株の細胞培養をビタミンEなどの生理的な抗酸化物質を培地に添加するだけというシンプルな方法で大きく改善したという点も重要である.しかしながら,2型スフィンゴシンキナーゼがどのように細胞における脂質の過酸化を促進しているのか,また,脂質の過酸化がウイルス複製複合体の構成タンパク質であるNS4AおよびNS5Bの立体構造を制御する分子機構については未解明のままであり,今後の大きな課題である.
文 献
- Thomas, D. L.: Global control of hepatitis C: where challenge meets opportunity. Nat. Med., 19, 850-858 (2013)[PubMed]
- Wakita, T., Pietschmann, T., Kato, T. et al.: Production of infectious hepatitis C virus in tissue culture from a cloned viral genome. Nat. Med., 11, 791-796 (2005)[PubMed]
- Romero-Brey, I., Merz, A., Chiramel, A. et al.: Three-dimensional architecture and biogenesis of membrane structures associated with hepatitis C virus replication. PLoS Pathog., 8, e1003056 (2012)[PubMed]
- Sakamoto, H., Okamoto, K., Aoki, M. et al.: Host sphingolipid biosynthesis as a target for hepatitis C virus therapy. Nat. Chem. Biol., 1, 333-337 (2005)[PubMed]
- Weng, L., Hirata, Y., Arai, M. et al.: Sphingomyelin activates hepatitis C virus RNA polymerase in a genotype-specific manner. J. Virol., 84, 11761-11770 (2010)[PubMed]
- Shimakami, T., Welsch, C., Yamane, D. et al.: Protease inhibitor-resistant hepatitis C virus mutants with reduced fitness from impaired production of infectious virus. Gastroenterology, 140, 667-675 (2011)[PubMed]
- Huang, H., Chen, Y. & Ye, J.: Inhibition of hepatitis C virus replication by peroxidation of arachidonate and restoration by vitamin E. Proc. Natl. Acad. Sci. USA, 104, 18666-18670 (2007)[PubMed]
- Li, Y. P., Ramirez, S., Jensen, S. B. et al.: Highly efficient full-length hepatitis C virus genotype 1 (strain TN) infectious culture system. Proc. Natl. Acad. Sci. USA, 109, 19757-19762 (2012)[PubMed]
- Liang, Y., Shilagard., T., Xiao, S. Y. et al.: Visualizing hepatitis C virus infections in human liver by two-photon microscopy. Gastroenterology, 137, 1448-1458 (2009)[PubMed]
- Okuda, M., Li, K., Beard, M. R. et al.: Mitochondrial injury, oxidative stress, and antioxidant gene expression are induced by hepatitis C virus core protein. Gastroenterology, 122, 366-375 (2002)[PubMed]
著者プロフィール
略歴:2009年 東京大学大学院農学生命科学研究科 修了,同年 米国Texas大学Medical Branch Galveston校Postdoctoral Fellow,2010年 米国North Carolina大学Chapel Hill校Postdoctoral Associateを経て,2013年より同Research Associate.
研究テーマ:ウイルス複製に関与する宿主の因子.
Stanley M. Lemon
米国North Carolina大学Chapel Hill校Professor.
© 2014 山根大典・Stanley M. Lemon Licensed under CC 表示 2.1 日本