卵子および卵母細胞に特異的なタンパク質は移植された体細胞核に階層的にはたらきかけ急速かつゲノムワイドな転写のリプログラミングを誘導する
宮本 圭・Jerome Jullien・Vincent Pasque・John B. Gurdon
(英国Wellcome Trust/Cancer Research UK Gurdon Institute)
email:宮本 圭
DOI: 10.7875/first.author.2014.105
Hierarchical molecular events driven by oocyte-specific factors lead to rapid and extensive reprogramming.
Jerome Jullien, Kei Miyamoto, Vincent Pasque, George E. Allen, Charles R. Bradshaw, Nigel J. Garrett, Richard P. Halley-Stott, Hiroshi Kimura, Keita Ohsumi, John B. Gurdon
Molecular Cell, 55, 524-536 (2014)
分化した体細胞核を卵子の前駆体である卵母細胞に移植することにより,体細胞においては発現の抑制されていた遺伝子が転写を開始することが知られている.しかしながら,この転写のリプログラミングの分子機構はいまだ解明されていない.今回,筆者らは,アフリカツメガエルの卵母細胞に移植されたマウスの体細胞核において転写のリプログラミングが誘導されるまでに起こる一連の過程を分子レベルで明らかにした.移植された体細胞核において48時間以内に活性化した約2000の遺伝子をRNAシークエンシング法により同定し,さらに,体細胞核における転写パターンが卵母細胞における転写パターンに近づくことが明らかにされた.卵母細胞に大量に存在する転写に関連するタンパク質に着目して転写のリプログラミングをうける移植された体細胞核への取り込みについて調べた.その結果,卵子および卵母細胞に特異的なタンパク質が体細胞核につぎつぎと蓄積することわかった.まず,卵子および卵母細胞に特異的なリンカーヒストンであるヒストンB4が体細胞核に移行し,つぎに,卵母細胞に特異的な基本転写因子であるTBP2および卵母細胞に由来するRNAポリメラーゼIIが取り込まれた.最終的に,RNAポリメラーゼIIがリン酸化をうけ体細胞核からの転写を誘導した.以上の結果より,卵母細胞に存在する大量のタンパク質が急速かつ順序だって移植された体細胞核に作用することにより,卵母細胞における転写のリプログラミングが誘導されることが明らかにされた.
体細胞を発生の初期の未分化な状態へともどすリプログラミングは,将来の再生医療のためにも非常に重要な技術である.この技術の臨床への応用を考えた際に,高品質な初期化細胞を患者から効率よく樹立する系は不可欠である.効率的なリプログラミングの達成のためには,初期化細胞に特有の形質が誘導され樹立されるしくみを理解することが必須の課題であり,そのためにも,リプログラミングの際の遺伝子発現の制御機構の理解は重要な意味をもつ.臨床への応用の可能な初期化細胞を樹立する方法として現在のところiPS細胞(induced pluripotent stem cell,人工多能性細胞)が最良の選択とされている一方で,体細胞核を卵子に移植することにより高い効率で高品質な初期化細胞を得られることがわかってきた1,2).そこで,筆者らのグループは,卵子におけるリプログラミングについて理解するため,アフリカツメガエルの卵母細胞(卵子の前駆体)を用いた核移植法を使用した3-6).
卵母細胞の核(卵核胞)にはリプログラミングを誘導する能力のあることが示されており,移植された数百個のマウスの体細胞核において,発現の抑制されていた遺伝子を活性化することができる(転写のリプログラミング).卵母細胞のもつ転写のリプログラミングにかかわるタンパク質はいくつか同定されてきているが3-6),それらのタンパク質が移植された体細胞核にはたらきかける一連の流れは明らかになっていない.今回の研究においては,卵母細胞において転写のリプログラミングが起こる過程を明らかにするとともに,次世代シークエンサーを用いて体細胞核における転写のリプログラミングについて包括的に解析した.
マウスの体細胞核をアフリカツメガエルの卵母細胞へ移植したのち,どのような遺伝子が活性化あるいは抑制されるのか確認するため,RNAシークエンシング法により転写の変化について調べた.まず,核移植ののち48時間のあいだに新規に生合成されたmRNAをBrUTPを用いて標識した.つぎに,これをRNA免疫沈降法により回収し,精製ののちにRNAシークエンシング法により塩基配列を解析した.その結果,移植のまえの体細胞核と比較して917個の遺伝子がその発現を低下させた一方で,1544個の遺伝子は発現を維持していた.さらに興味深いことに,1749個の遺伝子が新たに発現を開始した.この転写のリプログラミングをうけた1749個の遺伝子について遺伝子オントロジー解析により関連する機能カテゴリーを検索した結果,転写や発生といった卵母細胞の機能に関連するものが多くみられた.さらに,ドナーとなったマウスの体細胞,核移植ののちのマウスの体細胞,核移植をしていないアフリカツメガエルの卵母細胞,マウスの2細胞期の胚,マウスのES細胞のそれぞれから得られた転写産物を用いて階層的なクラスタリング解析を行った結果,核移植ののちのマウスの体細胞の転写産物は,核移植をしていないアフリカツメガエルの卵母細胞の転写産物ともっとも類似していることがわかった.以上の結果より,アフリカツメガエルの卵母細胞はマウスの体細胞核の転写プログラムを卵母細胞における転写パターンへと書き換える能力をもつことがわかった.驚くべきことに,この転写のリプログラミングは翻訳を阻害した状況においても誘導されることがわかり,卵母細胞に蓄積したタンパク質だけで転写のリプログラミングの誘導が可能であることが示された.
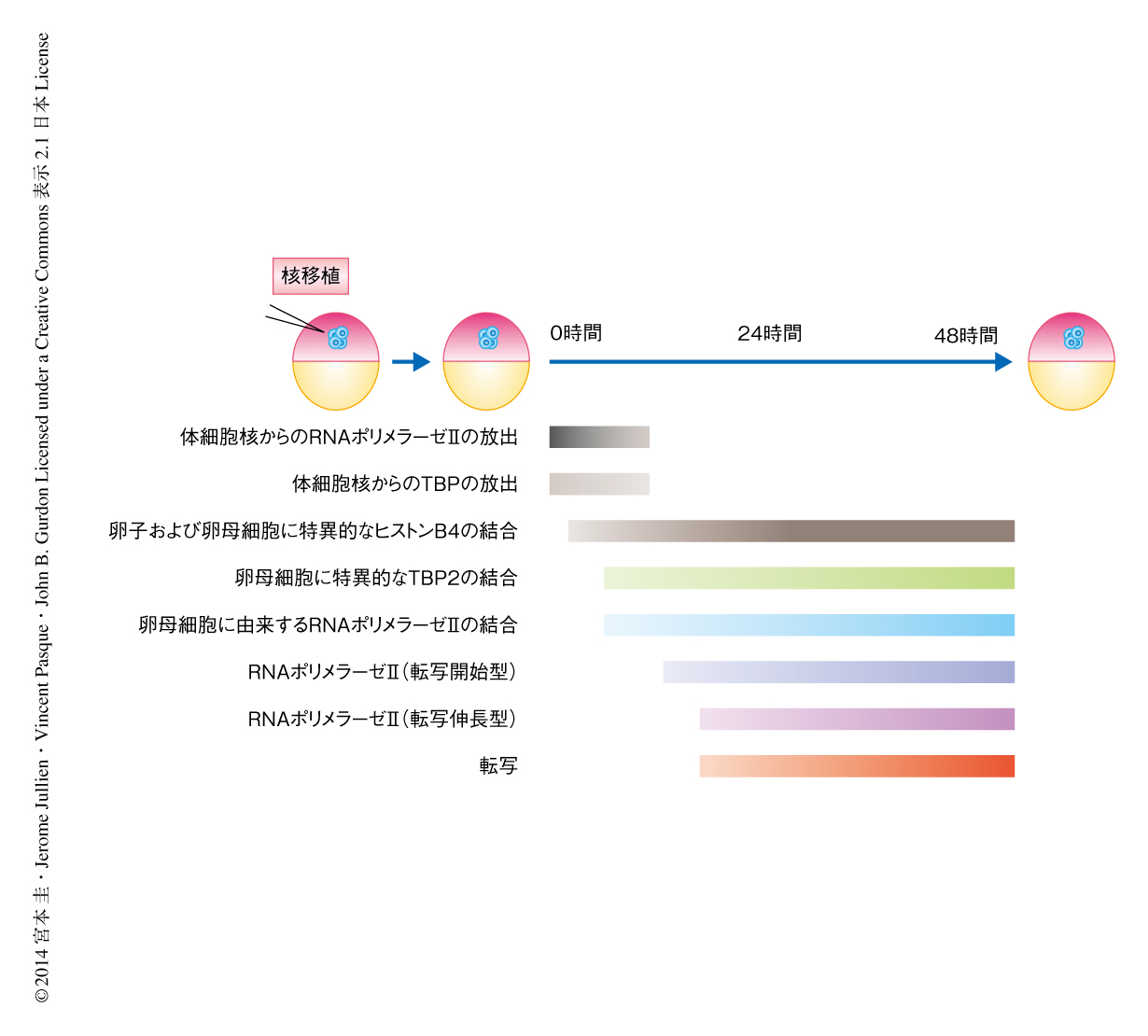
さきの翻訳阻害の実験の結果より,もともと卵母細胞に大量に存在するタンパク質に着目し,その移植された体細胞核への取り込みについて調べた.核移植ののち0~1時間,6時間,24時間,48時間の時点で免疫染色を行い,個々の移植された体細胞核における,卵子および卵母細胞に特異的なリンカーヒストンであるヒストンB4,リン酸化をうけていないRNAポリメラーゼII(転写開始前),Ser5がリン酸化されたRNAポリメラーゼII(転写開始型),Ser2がリン酸化されたRNAポリメラーゼII(転写伸長型)の発現について調べた.ヒストンB4の取り込みはもっとも早期に開始し,核移植ののち6時間の時点ですでに6割以上の体細胞核がヒストンB4を発現していた.リン酸化をうけていないRNAポリメラーゼIIはヒストンB4につづいて体細胞核に蓄積し,核移植ののち48時間の時点ではほぼすべての体細胞核がヒストンB4および非リン酸化型RNAポリメラーゼIIのシグナルを示した.非リン酸化型RNAポリメラーゼIIに陽性の体細胞核のすべてがヒストンB4を取り込んでいる一方で,ヒストンB4に陽性の体細胞核のなかには非リン酸化型RNAポリメラーゼIIのシグナルを示さないものも存在した.これらの結果より,ヒストンB4の取り込みは非リン酸化型RNAポリメラーゼIIの取り込みに先行することがわかった.同様に,RNAポリメラーゼIIについては,非リン酸化型RNAポリメラーゼII,転写開始型RNAポリメラーゼII,転写伸長型RNAポリメラーゼIIの順に体細胞核に蓄積することがわかり,最終的には7割近くの体細胞核が転写伸長型RNAポリメラーゼIIを含むことがわかった.以上の結果より,卵母細胞における転写のリプログラミングは卵子および卵母細胞に特異的なタンパク質の順序だった取り込みによって特徴づけられ(図1),移植された体細胞核に均一に起こることが見い出された.
免疫染色の結果より,移植ののちの体細胞核においてRNAポリメラーゼIIの量が大幅に増加することわかった.そこで,転写のリプログラミングの際に卵母細胞に存在する転写装置が体細胞核のもつ転写装置と交換されるのではないかと仮説をたてこれを検証した.体細胞に由来するRNAポリメラーゼIIと基本転写因子TBPを蛍光タンパク質により標識し,核移植ののちの動向を生細胞イメージング法により観察した.その結果,体細胞に由来するRNAポリメラーゼIIおよびTBPは移植された体細胞核から消失する一方で,卵母細胞に特異的な基本転写因子TBP2が体細胞核に取り込まれることがわかった(図1).RNAポリメラーゼIIに対する免疫染色の結果とあわせて,移植ののちの体細胞核には卵母細胞に由来する転写装置が蓄積したことがわかった.
移植された体細胞核に残された少量の体細胞に由来するRNAポリメラーゼIIが転写のリプログラミングを誘導している可能性についても調べた.RNAポリメラーゼIIを阻害するαアマニチンに対し耐性をもつ変異型のRNAポリメラーゼIIを発現する体細胞核を移植した.この変異型RNAポリメラーゼIIはαアマニチンの存在のもとでも転写を行えるため,核移植ののちの転写のリプログラミングが体細胞に由来するRNAポリメラーゼIIに依存しているのなら,αアマニチンの存在のもとでも転写を誘導できるはずである.しかし,αアマニチンの存在のもとでは転写のリプログラミングは起こらなかった.この結果は,卵母細胞における転写のリプログラミングは体細胞に由来するRNAポリメラーゼIIではなく,卵母細胞に存在するRNAポリメラーゼIIによりひき起こされることを裏づけた.
移植ののちに体細胞核に蓄積したRNAポリメラーゼIIの量を測定したところ,培養された体細胞の核の約8倍もの量の転写伸長型RNAポリメラーゼIIが移植された体細胞核のクロマチンに存在することがわかった.この過多なRNAポリメラーゼIIは卵母細胞が極端に高い転写活性をもつことを反映しており7),卵母細胞における効率的な転写のリプログラミングが卵母細胞に特徴的な高活性型の転写装置により支持されている可能性が示唆された.
卵母細胞において転写のリプログラミングが誘導される一連の流れはわかったが(図1),もっとも早期にはたらくヒストンB4が転写のリプログラミングにおいてどのような役割を担っているのかは明らかではなかった.そこで,移植された体細胞核のクロマチンへのヒストンB4の結合パターンを次世代シークエンサーにより詳細に調べた.核移植ののちの卵母細胞からクロマチンを抽出し,抗ヒストンB4抗体を用いてクロマチン免疫沈降を行った.抗ヒストンB4抗体により回収されたDNAからライブラリーを作製し,次世代シークエンサーを用いて塩基配列を解析した.核移植ののち48時間の時点でヒストンB4はクロマチンのほぼ全域にわたって結合することはわかったが,いくつかの領域においてはその結合が有意に少なくあるいは多くなっていた.まず,転写開始点の周辺においてヒストンB4の結合は顕著に減少していた.この傾向は転写のリプログラミングをうけて発現を開始する遺伝子においてとくに顕著であった.一方で,ヒストンB4はエキソンに優先的に結合する傾向もみられた.以上の結果より,移植された体細胞核のクロマチンへのヒストンB4の結合は転写の状態を反映しており,転写のリプログラミングが完了するためには,ヒストンB4は最終的には移植された体細胞核のクロマチンの転写開始点から放出されることがわかった.
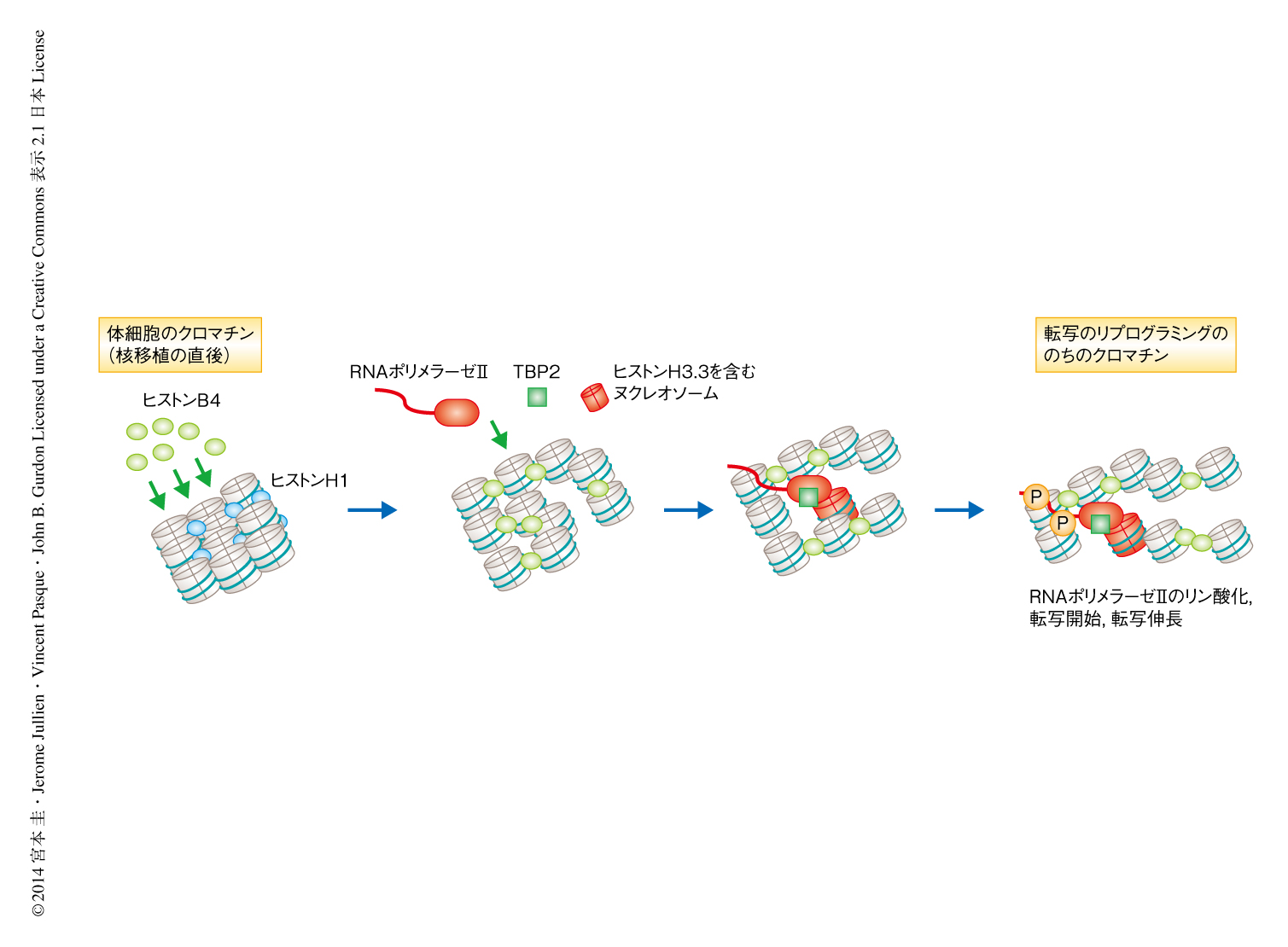
筆者らは,この論文において,アフリカツメガエルの卵母細胞において移植されたマウスの体細胞核に転写のリプログラミングが誘導されるまでの一連の流れを分子レベルで明らかにした(図1).卵子および卵母細胞に特異的なタンパク質は移植された体細胞核に無秩序に取り込まれるのではなく,順序だってつぎつぎに体細胞核のクロマチンへとアクセスした.今回の研究では,とくに,卵子および卵母細胞に特異的なリンカーヒストンであるヒストンB4とRNAポリメラーゼIIに着目してそれらが体細胞核において作用する機構にせまった.興味深いことに,もっとも早期に体細胞核に蓄積するヒストンB4は体細胞核のゲノムの全体に結合していたが,転写のリプログラミングが誘導された遺伝子の転写開始点の付近からは除かれていた.体細胞型のリンカーヒストンであるヒストンH1も同様に,転写が起こっている遺伝子のプロモーターにはほとんど存在しないことが知られている8).ヒストンH1のクロマチンへの結合はヒストンH3.3により阻害される9).また,転写のリプログラミングには卵母細胞に由来するヒストンH3.3が体細胞核のクロマチンに結合することが必須であることも知られている5).これらの報告と今回の結果をあわせて考えると,転写開始点からのヒストンB4の除去はのちに起こるヒストンH3.3の結合により誘導されている可能性がある(図2).それでは,最初にヒストンB4が体細胞核のクロマチンに結合する意味はなんなのだろうか? ヒストンB4の結合によりクロマチンが弛緩した状態になり3),ほかのクロマチンリモデリングタンパク質がアクセスしやすい状態になることがわかっている10).すなわち,ヒストンB4が最初に体細胞核のクロマチンに結合する意味は,のちのヒストンH3.3,TBP2,RNAポリメラーゼIIといったタンパク質がアクセスしやすい状態をつくるためと考えられる(図2).最近,発見された核アクチン4) やWave1 6) などは,リプログラミングにおいて後期のRNAポリメラーゼIIの活性化および転写の伸長にかかわると考えられている.今後は,これまでに発見されてきたリプログラミングタンパク質がどのように共役して最終的なリプログラミングを達成するかを明らかにすることが重要な課題となるだろう.
略歴:2009年 京都大学農学研究科博士後期課程 修了,同年 英国Cambridge大学Gurdon Institute博士研究員,2012年より英国Cambridge大学Wolfson Collegeリサーチフェロー.
研究テーマ:卵におけるリプログラミングの機構.
関心事:胚性ゲノムの活性化,テニス,育児.
Jerome Jullien
英国Cambridge大学Gurdon Institute博士研究員.
Vincent Pasque
米国California大学Los Angeles校 博士研究員.
John B. Gurdon
英国Cambridge大学Gurdon Instituteグループリーダー.
© 2014 宮本 圭・Jerome Jullien・Vincent Pasque・John B. Gurdon Licensed under CC 表示 2.1 日本
(英国Wellcome Trust/Cancer Research UK Gurdon Institute)
email:宮本 圭
DOI: 10.7875/first.author.2014.105
Hierarchical molecular events driven by oocyte-specific factors lead to rapid and extensive reprogramming.
Jerome Jullien, Kei Miyamoto, Vincent Pasque, George E. Allen, Charles R. Bradshaw, Nigel J. Garrett, Richard P. Halley-Stott, Hiroshi Kimura, Keita Ohsumi, John B. Gurdon
Molecular Cell, 55, 524-536 (2014)
要 約
分化した体細胞核を卵子の前駆体である卵母細胞に移植することにより,体細胞においては発現の抑制されていた遺伝子が転写を開始することが知られている.しかしながら,この転写のリプログラミングの分子機構はいまだ解明されていない.今回,筆者らは,アフリカツメガエルの卵母細胞に移植されたマウスの体細胞核において転写のリプログラミングが誘導されるまでに起こる一連の過程を分子レベルで明らかにした.移植された体細胞核において48時間以内に活性化した約2000の遺伝子をRNAシークエンシング法により同定し,さらに,体細胞核における転写パターンが卵母細胞における転写パターンに近づくことが明らかにされた.卵母細胞に大量に存在する転写に関連するタンパク質に着目して転写のリプログラミングをうける移植された体細胞核への取り込みについて調べた.その結果,卵子および卵母細胞に特異的なタンパク質が体細胞核につぎつぎと蓄積することわかった.まず,卵子および卵母細胞に特異的なリンカーヒストンであるヒストンB4が体細胞核に移行し,つぎに,卵母細胞に特異的な基本転写因子であるTBP2および卵母細胞に由来するRNAポリメラーゼIIが取り込まれた.最終的に,RNAポリメラーゼIIがリン酸化をうけ体細胞核からの転写を誘導した.以上の結果より,卵母細胞に存在する大量のタンパク質が急速かつ順序だって移植された体細胞核に作用することにより,卵母細胞における転写のリプログラミングが誘導されることが明らかにされた.
はじめに
体細胞を発生の初期の未分化な状態へともどすリプログラミングは,将来の再生医療のためにも非常に重要な技術である.この技術の臨床への応用を考えた際に,高品質な初期化細胞を患者から効率よく樹立する系は不可欠である.効率的なリプログラミングの達成のためには,初期化細胞に特有の形質が誘導され樹立されるしくみを理解することが必須の課題であり,そのためにも,リプログラミングの際の遺伝子発現の制御機構の理解は重要な意味をもつ.臨床への応用の可能な初期化細胞を樹立する方法として現在のところiPS細胞(induced pluripotent stem cell,人工多能性細胞)が最良の選択とされている一方で,体細胞核を卵子に移植することにより高い効率で高品質な初期化細胞を得られることがわかってきた1,2).そこで,筆者らのグループは,卵子におけるリプログラミングについて理解するため,アフリカツメガエルの卵母細胞(卵子の前駆体)を用いた核移植法を使用した3-6).
卵母細胞の核(卵核胞)にはリプログラミングを誘導する能力のあることが示されており,移植された数百個のマウスの体細胞核において,発現の抑制されていた遺伝子を活性化することができる(転写のリプログラミング).卵母細胞のもつ転写のリプログラミングにかかわるタンパク質はいくつか同定されてきているが3-6),それらのタンパク質が移植された体細胞核にはたらきかける一連の流れは明らかになっていない.今回の研究においては,卵母細胞において転写のリプログラミングが起こる過程を明らかにするとともに,次世代シークエンサーを用いて体細胞核における転写のリプログラミングについて包括的に解析した.
1.アフリカツメガエルの卵母細胞は移植されたマウスの体細胞核に48時間以内にゲノムワイドな転写のリプログラミングを誘導する
マウスの体細胞核をアフリカツメガエルの卵母細胞へ移植したのち,どのような遺伝子が活性化あるいは抑制されるのか確認するため,RNAシークエンシング法により転写の変化について調べた.まず,核移植ののち48時間のあいだに新規に生合成されたmRNAをBrUTPを用いて標識した.つぎに,これをRNA免疫沈降法により回収し,精製ののちにRNAシークエンシング法により塩基配列を解析した.その結果,移植のまえの体細胞核と比較して917個の遺伝子がその発現を低下させた一方で,1544個の遺伝子は発現を維持していた.さらに興味深いことに,1749個の遺伝子が新たに発現を開始した.この転写のリプログラミングをうけた1749個の遺伝子について遺伝子オントロジー解析により関連する機能カテゴリーを検索した結果,転写や発生といった卵母細胞の機能に関連するものが多くみられた.さらに,ドナーとなったマウスの体細胞,核移植ののちのマウスの体細胞,核移植をしていないアフリカツメガエルの卵母細胞,マウスの2細胞期の胚,マウスのES細胞のそれぞれから得られた転写産物を用いて階層的なクラスタリング解析を行った結果,核移植ののちのマウスの体細胞の転写産物は,核移植をしていないアフリカツメガエルの卵母細胞の転写産物ともっとも類似していることがわかった.以上の結果より,アフリカツメガエルの卵母細胞はマウスの体細胞核の転写プログラムを卵母細胞における転写パターンへと書き換える能力をもつことがわかった.驚くべきことに,この転写のリプログラミングは翻訳を阻害した状況においても誘導されることがわかり,卵母細胞に蓄積したタンパク質だけで転写のリプログラミングの誘導が可能であることが示された.
2.転写のリプログラミングの過程において卵子および卵母細胞に特異的なタンパク質が移植された体細胞核に階層的に取り込まれる
さきの翻訳阻害の実験の結果より,もともと卵母細胞に大量に存在するタンパク質に着目し,その移植された体細胞核への取り込みについて調べた.核移植ののち0~1時間,6時間,24時間,48時間の時点で免疫染色を行い,個々の移植された体細胞核における,卵子および卵母細胞に特異的なリンカーヒストンであるヒストンB4,リン酸化をうけていないRNAポリメラーゼII(転写開始前),Ser5がリン酸化されたRNAポリメラーゼII(転写開始型),Ser2がリン酸化されたRNAポリメラーゼII(転写伸長型)の発現について調べた.ヒストンB4の取り込みはもっとも早期に開始し,核移植ののち6時間の時点ですでに6割以上の体細胞核がヒストンB4を発現していた.リン酸化をうけていないRNAポリメラーゼIIはヒストンB4につづいて体細胞核に蓄積し,核移植ののち48時間の時点ではほぼすべての体細胞核がヒストンB4および非リン酸化型RNAポリメラーゼIIのシグナルを示した.非リン酸化型RNAポリメラーゼIIに陽性の体細胞核のすべてがヒストンB4を取り込んでいる一方で,ヒストンB4に陽性の体細胞核のなかには非リン酸化型RNAポリメラーゼIIのシグナルを示さないものも存在した.これらの結果より,ヒストンB4の取り込みは非リン酸化型RNAポリメラーゼIIの取り込みに先行することがわかった.同様に,RNAポリメラーゼIIについては,非リン酸化型RNAポリメラーゼII,転写開始型RNAポリメラーゼII,転写伸長型RNAポリメラーゼIIの順に体細胞核に蓄積することがわかり,最終的には7割近くの体細胞核が転写伸長型RNAポリメラーゼIIを含むことがわかった.以上の結果より,卵母細胞における転写のリプログラミングは卵子および卵母細胞に特異的なタンパク質の順序だった取り込みによって特徴づけられ(図1),移植された体細胞核に均一に起こることが見い出された.
3.移植された体細胞核に卵母細胞に由来する転写装置が結合することにより転写のリプログラミングは誘導される
免疫染色の結果より,移植ののちの体細胞核においてRNAポリメラーゼIIの量が大幅に増加することわかった.そこで,転写のリプログラミングの際に卵母細胞に存在する転写装置が体細胞核のもつ転写装置と交換されるのではないかと仮説をたてこれを検証した.体細胞に由来するRNAポリメラーゼIIと基本転写因子TBPを蛍光タンパク質により標識し,核移植ののちの動向を生細胞イメージング法により観察した.その結果,体細胞に由来するRNAポリメラーゼIIおよびTBPは移植された体細胞核から消失する一方で,卵母細胞に特異的な基本転写因子TBP2が体細胞核に取り込まれることがわかった(図1).RNAポリメラーゼIIに対する免疫染色の結果とあわせて,移植ののちの体細胞核には卵母細胞に由来する転写装置が蓄積したことがわかった.
移植された体細胞核に残された少量の体細胞に由来するRNAポリメラーゼIIが転写のリプログラミングを誘導している可能性についても調べた.RNAポリメラーゼIIを阻害するαアマニチンに対し耐性をもつ変異型のRNAポリメラーゼIIを発現する体細胞核を移植した.この変異型RNAポリメラーゼIIはαアマニチンの存在のもとでも転写を行えるため,核移植ののちの転写のリプログラミングが体細胞に由来するRNAポリメラーゼIIに依存しているのなら,αアマニチンの存在のもとでも転写を誘導できるはずである.しかし,αアマニチンの存在のもとでは転写のリプログラミングは起こらなかった.この結果は,卵母細胞における転写のリプログラミングは体細胞に由来するRNAポリメラーゼIIではなく,卵母細胞に存在するRNAポリメラーゼIIによりひき起こされることを裏づけた.
移植ののちに体細胞核に蓄積したRNAポリメラーゼIIの量を測定したところ,培養された体細胞の核の約8倍もの量の転写伸長型RNAポリメラーゼIIが移植された体細胞核のクロマチンに存在することがわかった.この過多なRNAポリメラーゼIIは卵母細胞が極端に高い転写活性をもつことを反映しており7),卵母細胞における効率的な転写のリプログラミングが卵母細胞に特徴的な高活性型の転写装置により支持されている可能性が示唆された.
4.移植された体細胞核のクロマチンへのヒストンB4の結合は転写のリプログラミングを反映する
卵母細胞において転写のリプログラミングが誘導される一連の流れはわかったが(図1),もっとも早期にはたらくヒストンB4が転写のリプログラミングにおいてどのような役割を担っているのかは明らかではなかった.そこで,移植された体細胞核のクロマチンへのヒストンB4の結合パターンを次世代シークエンサーにより詳細に調べた.核移植ののちの卵母細胞からクロマチンを抽出し,抗ヒストンB4抗体を用いてクロマチン免疫沈降を行った.抗ヒストンB4抗体により回収されたDNAからライブラリーを作製し,次世代シークエンサーを用いて塩基配列を解析した.核移植ののち48時間の時点でヒストンB4はクロマチンのほぼ全域にわたって結合することはわかったが,いくつかの領域においてはその結合が有意に少なくあるいは多くなっていた.まず,転写開始点の周辺においてヒストンB4の結合は顕著に減少していた.この傾向は転写のリプログラミングをうけて発現を開始する遺伝子においてとくに顕著であった.一方で,ヒストンB4はエキソンに優先的に結合する傾向もみられた.以上の結果より,移植された体細胞核のクロマチンへのヒストンB4の結合は転写の状態を反映しており,転写のリプログラミングが完了するためには,ヒストンB4は最終的には移植された体細胞核のクロマチンの転写開始点から放出されることがわかった.
おわりに
筆者らは,この論文において,アフリカツメガエルの卵母細胞において移植されたマウスの体細胞核に転写のリプログラミングが誘導されるまでの一連の流れを分子レベルで明らかにした(図1).卵子および卵母細胞に特異的なタンパク質は移植された体細胞核に無秩序に取り込まれるのではなく,順序だってつぎつぎに体細胞核のクロマチンへとアクセスした.今回の研究では,とくに,卵子および卵母細胞に特異的なリンカーヒストンであるヒストンB4とRNAポリメラーゼIIに着目してそれらが体細胞核において作用する機構にせまった.興味深いことに,もっとも早期に体細胞核に蓄積するヒストンB4は体細胞核のゲノムの全体に結合していたが,転写のリプログラミングが誘導された遺伝子の転写開始点の付近からは除かれていた.体細胞型のリンカーヒストンであるヒストンH1も同様に,転写が起こっている遺伝子のプロモーターにはほとんど存在しないことが知られている8).ヒストンH1のクロマチンへの結合はヒストンH3.3により阻害される9).また,転写のリプログラミングには卵母細胞に由来するヒストンH3.3が体細胞核のクロマチンに結合することが必須であることも知られている5).これらの報告と今回の結果をあわせて考えると,転写開始点からのヒストンB4の除去はのちに起こるヒストンH3.3の結合により誘導されている可能性がある(図2).それでは,最初にヒストンB4が体細胞核のクロマチンに結合する意味はなんなのだろうか? ヒストンB4の結合によりクロマチンが弛緩した状態になり3),ほかのクロマチンリモデリングタンパク質がアクセスしやすい状態になることがわかっている10).すなわち,ヒストンB4が最初に体細胞核のクロマチンに結合する意味は,のちのヒストンH3.3,TBP2,RNAポリメラーゼIIといったタンパク質がアクセスしやすい状態をつくるためと考えられる(図2).最近,発見された核アクチン4) やWave1 6) などは,リプログラミングにおいて後期のRNAポリメラーゼIIの活性化および転写の伸長にかかわると考えられている.今後は,これまでに発見されてきたリプログラミングタンパク質がどのように共役して最終的なリプログラミングを達成するかを明らかにすることが重要な課題となるだろう.
文 献
- Tachibana, M., Amato, P., Sparman, M. et al.: Human embryonic stem cells derived by somatic cell nuclear transfer. Cell, 153, 1228-1238 (2013)[PubMed]
- Ma, H., Morey, R., O’Neil, R. C. et al.: Abnormalities in human pluripotent cells due to reprogramming mechanisms. Nature, 511, 177-183 (2014)[PubMed]
- Jullien, J., Astrand, C., Halley-Stott, R. P. et al.: Characterization of somatic cell nuclear reprogramming by oocytes in which a linker histone is required for pluripotency gene reactivation. Proc. Natl. Acad. Sci. USA, 107, 5483-5488 (2010)[PubMed]
- Miyamoto, K., Pasque, V., Jullien, J. et al.: Nuclear actin polymerization is required for transcriptional reprogramming of Oct4 by oocytes. Genes Dev., 25, 946-958 (2011)[PubMed]
- Jullien, J., Astrand, C., Szenker, E. et al.: HIRA dependent H3.3 deposition is required for transcriptional reprogramming following nuclear transfer to Xenopus oocytes. Epigenetics Chromatin, 5, 17 (2012)[PubMed]
- Miyamoto, K., Teperek, M., Yusa, K. et al.: Nuclear Wave1 is required for reprogramming transcription in oocytes and for normal development. Science, 341, 1002-1005 (2013)[PubMed] [新着論文レビュー]
- Callan, H.: Lampbrush chromosomes. Proc. R. Soc. London B. Biol. Sci., 214, 417-448 (1982)[PubMed]
- Cao, K., Lailler, N., Zhang, Y. et al.: High-resolution mapping of H1 linker histone variants in embryonic stem cells. PLoS Genet., 9, e1003417 (2013)[PubMed]
- Braunschweig, U., Hogan, G. J., Pagie, L. et al.: Histone H1 binding is inhibited by histone variant H3.3. EMBO J., 28, 3635-3645 (2009)[PubMed]
- Saeki, H., Ohsumi, K., Aihara, H. et al.: Linker histone variants control chromatin dynamics during early embryogenesis. Proc. Natl. Acad. Sci. USA, 102, 5697-5702 (2005)[PubMed]
著者プロフィール
略歴:2009年 京都大学農学研究科博士後期課程 修了,同年 英国Cambridge大学Gurdon Institute博士研究員,2012年より英国Cambridge大学Wolfson Collegeリサーチフェロー.
研究テーマ:卵におけるリプログラミングの機構.
関心事:胚性ゲノムの活性化,テニス,育児.
Jerome Jullien
英国Cambridge大学Gurdon Institute博士研究員.
Vincent Pasque
米国California大学Los Angeles校 博士研究員.
John B. Gurdon
英国Cambridge大学Gurdon Instituteグループリーダー.
© 2014 宮本 圭・Jerome Jullien・Vincent Pasque・John B. Gurdon Licensed under CC 表示 2.1 日本