小胞体ストレスおよび肥満にともなう全身性の代謝異常におけるプロオピオメラノコルチン産生ニューロンでのXbp1の役割
福田 真
(米国Baylor College of Medicine,Department of Pediatrics,Children’s Nutrition Research Center)
email:福田 真
DOI: 10.7875/first.author.2014.104
Xbp1s in Pomc neurons connects ER stress with energy balance and glucose homeostasis.
Kevin W. Williams, Tiemin Liu, Xingxing Kong, Makoto Fukuda, Yingfeng Deng, Eric D. Berglund, Zhuo Deng, Yong Gao, Tianya Liu, Jong-Woo Sohn, Lin Jia, Teppei Fujikawa, Daisuke Kohno, Michael M. Scott, Syann Lee, Charlotte E. Lee, Kai Sun, Yongsheng Chang, Philipp E. Scherer, Joel K. Elmquist
Cell Metabolism, 20, 471-482 (2014)
肥満および糖尿病における中枢性のインスリン抵抗性およびレプチン抵抗性の分子機構は不明である.筆者らは,インスリン抵抗性およびレプチン抵抗性にかかわる小胞体ストレス応答に重要なタンパク質Xbp1をプロオピオメラノコルチン産生ニューロンにおいて特異的に発現するマウスを作製した.このマウスは全身のインスリン感受性およびレプチン感受性が亢進しており,高脂肪食による肥満の発症が抑えられていた.また,プロオピオメラノコルチン産生ニューロンにおけるXbp1の発現の亢進は肝臓におけるインスリン感受性を高めるとともに糖の産生を抑制した.意外なことに,プロオピオメラノコルチン産生ニューロンにおけるXbp1の発現は細胞に非自律的な分子機構を介して肝臓におけるXbp1-GalE経路の活性化をもたらした.これらの結果より,プロオピオメラノコルチン産生ニューロンにおける小胞体ストレスとレプチン抵抗性およびインスリン抵抗性,肝臓における代謝系とを結ぶ必須の分子機構が同定された.
個体における恒常性はさまざまなホルモンのはたらきにより維持されている.なかでも,レプチンおよびインスリンは,それぞれ全身のエネルギー代謝制御およびグルコース代謝制御において中枢となるホルモンである.肥満や2型糖尿病においてはレプチンおよびインスリンが正常にはたらかなくなるレプチン抵抗性およびインスリン抵抗性がみられ,これが肥満および糖尿病の病態基盤となっている可能性がある1,2).視床下部のプロオピオメラノコルチン産生ニューロンはレプチンおよびインスリンが直接に作用するニューロンである.レプチンおよびインスリンはプロオピオメラノコルチン産生ニューロンなどからなる神経回路を介して中枢性の代謝制御にかかわっていると考えられている.最近,小胞体ストレスがインスリン抵抗性およびレプチン抵抗性の発症にかかわることが明らかにされつつある3).肥満マウスにおいては,末梢の器官のみならずプロオピオメラノコルチン産生ニューロンにおいても小胞体ストレスが誘導されることから,肥満にともなう代謝異常と小胞体ストレスとのかかわりが示唆されている.とくに,脳における小胞体ストレスの誘導あるいは小胞体ストレス応答に重要なXbp1の欠失は,視床下部におけるレプチン抵抗性を強くひき起こすとともに,高レプチン血症,肥満,過食,代謝量の低下をもたらす4).さらに,小胞体ストレスはSocs3およびPtp1bを介してレプチンシグナルおよびインスリンシグナルを阻害する.しかし,どのようなニューロンが小胞体ストレスを介した全身性の代謝異常にかかわっているのかは不明であった.そこで,プロオピオメラノコルチン産生ニューロンにおいてXbp1を発現させることにより肥満への影響を検討するとともに,プロオピオメラノコルチン産生ニューロンにおける小胞体ストレスによるレプチン抵抗性およびインスリン抵抗性の分子機構について調べた.
テトラサイクリン遺伝子発現誘導系を用いることにより,プロオピオメラノコルチン産生ニューロンに特異的かつ時期特異的に活性型Xbp1を発現するトランスジェニックマウスを作製した.このマウスでは高脂肪食による体重の増加が抑制され,内臓脂肪および皮下脂肪の量も減少していた.また,肝臓における中性脂肪の含有量およびコレステロール値も低いままであった.摂食量に変化はみられなかったが,熱の産生および自発的な活動の亢進が観察されたことから,Xbp1の発現の誘導による体重の増加の抑制はエネルギー消費量の増大により説明しうることがわかった.全身の代謝の亢進を裏づけるように,褐色脂肪細胞においてUCP1遺伝子などの熱の産生に関与する遺伝子の発現が上昇していた.また,レプチンによる摂食の抑制がより強く観察されたことからレプチンに対し高感受性であることがわかった.これらの結果から,プロオピオメラノコルチン産生ニューロンに特異的なXbp1の発現の誘導により,エネルギー代謝が改善するとともに,高脂肪食による肥満が抑制されることが明らかになった.
プロオピオメラノコルチン産生ニューロンに特異的にXbp1を発現したマウスでは血糖値および血中インスリン値が有意に低かった.全身のインスリン感受性を詳細に検討するためグルコースクランプ試験を行ったところ,このマウスではおもに肝臓におけるインスリンによるグルコースの産生の抑制により全身のインスリン感受性が高まっていることがわかった.
最近,Xbp1の下流タンパク質としてGalEが同定された5).肝臓におけるXbp1-GalE経路の活性化が糖代謝およびインスリン感受性などを改善させるとともに,摂食の状態に応じた代謝制御機構に関与することが報告されている.今回,肝臓と同様に,視床下部の弓状核においても絶食から再摂食にかけてXbp1-GalE経路の活性化が見い出された.さらに,プロオピオメラノコルチン産生ニューロンに特異的なXbp1の発現により,プロオピオメラノコルチン産生ニューロンにおいてGalE遺伝子を含むXbp1の標的となる遺伝子の発現が上昇した.興味深いことに,プロオピオメラノコルチン産生ニューロンにおけるXbp1の発現の誘導は肝臓においてXbp1およびその下流タンパク質の発現を上昇させた.これらの結果から,プロオピオメラノコルチン産生ニューロンにおけるXbp1-GalE経路の活性化が,細胞に非自律的に末梢組織である肝臓における代謝制御の変化をもたらし,全身の糖代謝ならびにインスリン感受性などを改善したことが示唆された.
プロオピオメラノコルチン産生ニューロンにおいてXbp1の発現によるエネルギー代謝および糖代謝の改善にいたる分子機構を探る目的で,視床下部の器官培養切片6) を用いた.高脂肪食によりプロオピオメラノコルチン産生ニューロンに小胞体ストレスがもたらされることが知られていたことから,プロオピオメラノコルチン産生ニューロンにおいてレプチンシグナルおよびインスリンシグナルが小胞体ストレスにより阻害されるのではないかと考えた.さらに,Xbp1の発現がレプチンシグナルおよびインスリンシグナルの感受性を高めていると予想した.小胞体ストレスを誘導するため,視床下部の切片を小胞体ストレスの誘導剤により処理した.小胞体ストレスをあたえた視床下部の切片においては翻訳開始因子eIF-2のリン酸化および小胞体シャペロンの発現の誘導など小胞体ストレスマーカーが非常に強くみられた.この小胞体ストレスが誘導された視床下部の切片をさらにレプチンにより刺激することにより,レプチンの下流のシグナル伝達経路の活性について検討した.その結果,小胞体ストレス応答によりレプチンの作用に必須であることが知られているSTAT3シグナル伝達経路,MAKキナーゼシグナル伝達経路,Aktシグナル伝達経路がほぼ完全に阻害されることがわかった.インスリンによるAktのリン酸化も小胞体ストレスにより阻害された.したがって,視床下部において小胞体ストレスがレプチンおよびインスリンの下流のシグナル伝達経路を抑制することが示された.
レプチンはプロオピオメラノコルチン産生ニューロンに直接に作用することにより電気生理学的な活性化をひき起こす.一方,インスリンはプロオピオメラノコルチン産生ニューロンを電気生理学的に不活性化させる.インスリンおよびレプチンによるプロオピオメラノコルチン産生ニューロンへの電気生理学的な作用はPI3Kシグナル伝達経路を介することが知られている.また,プロオピオメラノコルチン産生ニューロンの電気化学的な活性化および不活性化は全身性の代謝制御において必須であると考えられている.さきに述べたように,小胞体ストレスがレプチンシグナルおよびインスリンシグナルを阻害したことから,小胞体ストレスがレプチンあるいはインスリンによるプロオピオメラノコルチン産生ニューロンの電気生理学的な変化に対しても影響を及ぼすのではないかと考えた.
レプチン受容体を発現するプロオピオメラノコルチン産生ニューロンを選択的に標識するため,蛍光タンパク質GFPにより標識したプロオピオメラノコルチン産生ニューロンを発現するマウスと,レプチン受容体を発現する細胞に蛍光タンパク質tdTomatoを発現するマウスとを交配し二重蛍光標識マウスを得た.まず,この二重蛍光標識マウスの急性切片からホールセル記録を行うことによりプロオピオメラノコルチン産生ニューロンにおけるインスリンおよびレプチンの作用を評価した.レプチンはレプチン受容体を発現するプロオピオメラノコルチン産生ニューロンの約75%において活性化をひき起こした.一方,レプチン受容体を発現するプロオピオメラノコルチン産生ニューロンはインスリンには応答しなかった.レプチン受容体を発現していないプロオピオメラノコルチン産生ニューロンのうち40%はインスリンにより過分極し不活性化した.これらの結果から,レプチンおよびインスリンはそれぞれ異なるプロオピオメラノコルチン産生ニューロンに作用することが示唆され,プロオピオメラノコルチン産生ニューロンは機能的に異なるニューロンからなる不均一な集団であるというモデル7) と一致した.この系を用いて,レプチンおよびインスリンによるプロオピオメラノコルチン産生ニューロンの電気化学的な変化に対し小胞体ストレスがあたえる影響について調べた.急性切片および器官培養切片を小胞体ストレスの誘導剤により6時間処理することで,レプチンによるプロオピオメラノコルチン産生ニューロンの活性化はほぼ完全に阻害された.さらに,小胞体ストレスの誘導によりインスリンの刺激によるプロオピオメラノコルチン産生ニューロンの過分極も観察されなくなった.これらのことから,小胞体ストレスによりレプチンあるいはインスリンの刺激に対するプロオピオメラノコルチン産生ニューロンの電気生理学的な応答は消失することがわかった.
レプチン抵抗性にかかわるシグナルタンパク質としてSocs3およびPtp1bはもっともよく研究されている1,3).中枢神経系におけるPtp1bおよびSocs3のはたらきはエネルギー代謝およびレプチンの作用において必須である.たとえば,プロオピオメラノコルチン産生ニューロンにおいて特異的にPtp1bあるいはSocs3を欠損させたマウスは,どちらもレプチンの摂食抑制作用に対し高感受性であるとともに,高脂肪食による体重の増加が抑制されることが知られており,Ptp1bおよびSocs3はレプチン感受性の制御において必須の役割をはたしていると考えられている.今回,小胞体ストレスがPtp1bおよびSocs3のmRNAレベルでの発現を誘導することが見い出された.さらに,プロオピオメラノコルチン産生ニューロンにおけるXbp1の発現の誘導は,弓状核におけるPtp1bおよびSocs3のmRNAレベルでの発現を抑制した.
そこで,Ptp1bとSocs3の両方あるいはどちらかが小胞体ストレスによるレプチン抵抗性およびインスリン抵抗性に必要であるとの仮説をたて,Ptp1bあるいはSocs3をプロオピオメラノコルチン産生ニューロンにおいて特異的に欠損したマウスを作製し,これらのマウスの急性切片を用いて電気生理学的な解析を行うことによりPtp1bおよびSocs3の関与について検討した.対照となるマウスに小胞体ストレスをあたえたところ,予想どおり,レプチンによるプロオピオメラノコルチン産生ニューロンの活性化は抑制された.ところが,Ptp1bあるいはSocs3を欠損したプロオピオメラノコルチン産生ニューロンでは小胞体ストレスによりひき起こされるレプチン抵抗性は観察されなかった.同様に,Ptp1bあるいはSocs3を欠損した急性切片では小胞体ストレスをあたえたときにもインスリンによるプロオピオメラノコルチン産生ニューロンの不活性化が示された.興味深いことに,Socs3を欠損したプロオピオメラノコルチン産生ニューロンは,対照となるプロオピオメラノコルチン産生ニューロンあるいはPtp1bを欠損したプロオピオメラノコルチン産生ニューロンと比較して,インスリンに対しより強く応答したことから,Socs3が小胞体ストレスに依存するレプチン抵抗性およびインスリン抵抗性においてより大きな役割を担っていることが示唆された.さらに,プロオピオメラノコルチン産生ニューロンにXbp1を発現させることにより,小胞体ストレスによるレプチン抵抗性およびインスリン抵抗性はひき起こされないことが示された.
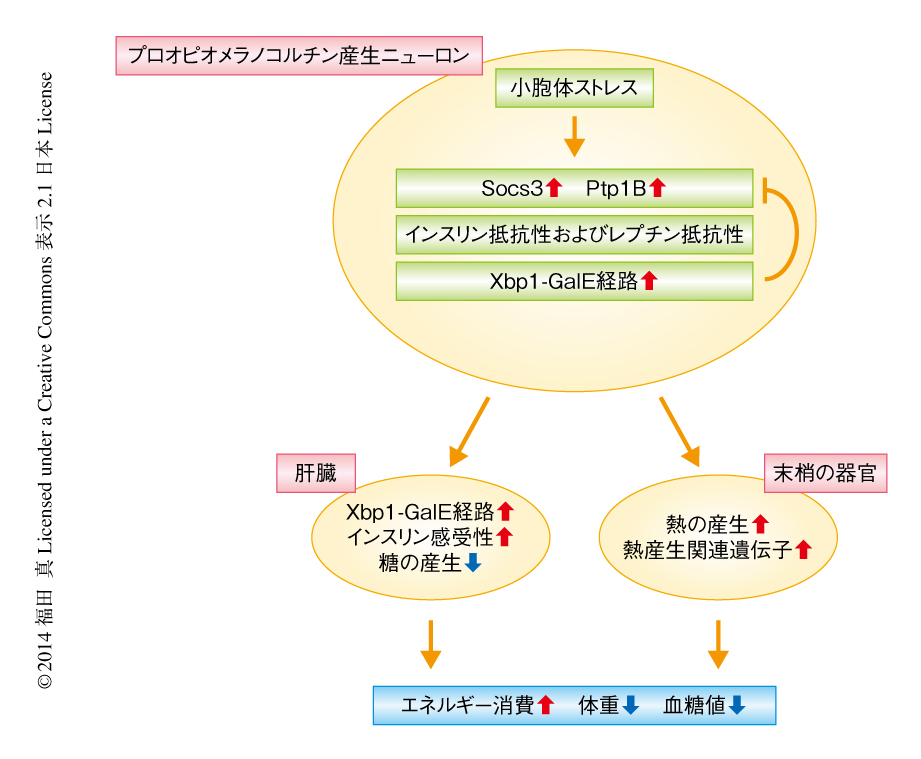
この研究においては,Xbp1がプロオピオメラノコルチン産生ニューロンにおけるインスリン感受性およびレプチン感受性の制御に関与すること,また,Xbp1をプロオピオメラノコルチン産生ニューロンに発現することにより肝臓におけるXbp1の活性化がひき起こされるとともに肝臓における糖代謝が改善されること,が明らかにされた(図1).古くから,中枢神経系により末梢の器官における糖代謝が影響をうけることが示されているが,その分子機構はいまだ不明である.
この研究により,プロオピオメラノコルチン産生ニューロンにおけるXbp1の発現の誘導により肝臓におけるXbp1-GalE経路の活性化が起こることが明らかにされた.最近,線虫を用いた研究から,ニューロンにおけるXbp1の活性化が細胞に非自律的に腸の細胞におけるXbp1-GalE経路の活性化をもたらすことが報告された8).筆者らの研究とあわせると,中枢神経系と肝臓とのあいだのXbp1-GalE経路において細胞に非自律的ななんらかのつながりのあることが予想される.視床下部ニューロンによる膵臓や肝臓など末梢の器官の代謝制御は脳幹や脊髄の自律神経系を介すると考えられているが,その代謝制御機構は不明であり,今後の研究が待たれる分野のひとつである.
また,細胞のレベルでは,急性切片および器官培養切片をモデルとして視床下部およびプロオピオメラノコルチン産生ニューロンにおいて小胞体ストレスがレプチンシグナルおよびインスリンシグナルを阻害することが示された.また,小胞体ストレスによるインスリン抵抗性およびレプチン抵抗性にXbp1,Ptp1b,Socs3が必須であることも明らかにされた.レプチン抵抗性およびインスリン抵抗性の発症は多様なシグナル伝達経路が複雑に影響しあって起こると考えられており,この研究により,代謝シグナルに対する視床下部の抵抗性の基盤となるシグナルネットワークの解明にはずみがつくと思われる.視床下部は全身の代謝機能の制御に必須であることから,視床下部ニューロンによるインスリン抵抗性およびレプチン抵抗性の制御が肥満や糖尿病の病態基盤となっている可能性がある.その分子的な実態の解明が新たな治療アプローチにつながることが期待される.
略歴:1996年 東京大学大学院理学系研究科にて博士号取得,同年 京都大学大学院理学研究科 助手,京都大学大学院生命科学研究科 助手,2004年 米国Harvard大学 博士研究員,米国Texas大学Southwestern Medical Center Instructorを経て,2012年より米国Baylor College of MedicineにてAssistant Professor.
研究テーマ:肥満,糖尿病,老化にかかわる中枢性のシグナル伝達経路.
抱負:脳がどのように肥満あるいは糖尿病をひき起こすのか,分子レベルおよび細胞レベルではっきりさせたい.
© 2014 福田 真 Licensed under CC 表示 2.1 日本
(米国Baylor College of Medicine,Department of Pediatrics,Children’s Nutrition Research Center)
email:福田 真
DOI: 10.7875/first.author.2014.104
Xbp1s in Pomc neurons connects ER stress with energy balance and glucose homeostasis.
Kevin W. Williams, Tiemin Liu, Xingxing Kong, Makoto Fukuda, Yingfeng Deng, Eric D. Berglund, Zhuo Deng, Yong Gao, Tianya Liu, Jong-Woo Sohn, Lin Jia, Teppei Fujikawa, Daisuke Kohno, Michael M. Scott, Syann Lee, Charlotte E. Lee, Kai Sun, Yongsheng Chang, Philipp E. Scherer, Joel K. Elmquist
Cell Metabolism, 20, 471-482 (2014)
要 約
肥満および糖尿病における中枢性のインスリン抵抗性およびレプチン抵抗性の分子機構は不明である.筆者らは,インスリン抵抗性およびレプチン抵抗性にかかわる小胞体ストレス応答に重要なタンパク質Xbp1をプロオピオメラノコルチン産生ニューロンにおいて特異的に発現するマウスを作製した.このマウスは全身のインスリン感受性およびレプチン感受性が亢進しており,高脂肪食による肥満の発症が抑えられていた.また,プロオピオメラノコルチン産生ニューロンにおけるXbp1の発現の亢進は肝臓におけるインスリン感受性を高めるとともに糖の産生を抑制した.意外なことに,プロオピオメラノコルチン産生ニューロンにおけるXbp1の発現は細胞に非自律的な分子機構を介して肝臓におけるXbp1-GalE経路の活性化をもたらした.これらの結果より,プロオピオメラノコルチン産生ニューロンにおける小胞体ストレスとレプチン抵抗性およびインスリン抵抗性,肝臓における代謝系とを結ぶ必須の分子機構が同定された.
はじめに
個体における恒常性はさまざまなホルモンのはたらきにより維持されている.なかでも,レプチンおよびインスリンは,それぞれ全身のエネルギー代謝制御およびグルコース代謝制御において中枢となるホルモンである.肥満や2型糖尿病においてはレプチンおよびインスリンが正常にはたらかなくなるレプチン抵抗性およびインスリン抵抗性がみられ,これが肥満および糖尿病の病態基盤となっている可能性がある1,2).視床下部のプロオピオメラノコルチン産生ニューロンはレプチンおよびインスリンが直接に作用するニューロンである.レプチンおよびインスリンはプロオピオメラノコルチン産生ニューロンなどからなる神経回路を介して中枢性の代謝制御にかかわっていると考えられている.最近,小胞体ストレスがインスリン抵抗性およびレプチン抵抗性の発症にかかわることが明らかにされつつある3).肥満マウスにおいては,末梢の器官のみならずプロオピオメラノコルチン産生ニューロンにおいても小胞体ストレスが誘導されることから,肥満にともなう代謝異常と小胞体ストレスとのかかわりが示唆されている.とくに,脳における小胞体ストレスの誘導あるいは小胞体ストレス応答に重要なXbp1の欠失は,視床下部におけるレプチン抵抗性を強くひき起こすとともに,高レプチン血症,肥満,過食,代謝量の低下をもたらす4).さらに,小胞体ストレスはSocs3およびPtp1bを介してレプチンシグナルおよびインスリンシグナルを阻害する.しかし,どのようなニューロンが小胞体ストレスを介した全身性の代謝異常にかかわっているのかは不明であった.そこで,プロオピオメラノコルチン産生ニューロンにおいてXbp1を発現させることにより肥満への影響を検討するとともに,プロオピオメラノコルチン産生ニューロンにおける小胞体ストレスによるレプチン抵抗性およびインスリン抵抗性の分子機構について調べた.
1.プロオピオメラノコルチン産生ニューロンに特異的なXbp1の発現の誘導は高脂肪食による肥満を抑制する
テトラサイクリン遺伝子発現誘導系を用いることにより,プロオピオメラノコルチン産生ニューロンに特異的かつ時期特異的に活性型Xbp1を発現するトランスジェニックマウスを作製した.このマウスでは高脂肪食による体重の増加が抑制され,内臓脂肪および皮下脂肪の量も減少していた.また,肝臓における中性脂肪の含有量およびコレステロール値も低いままであった.摂食量に変化はみられなかったが,熱の産生および自発的な活動の亢進が観察されたことから,Xbp1の発現の誘導による体重の増加の抑制はエネルギー消費量の増大により説明しうることがわかった.全身の代謝の亢進を裏づけるように,褐色脂肪細胞においてUCP1遺伝子などの熱の産生に関与する遺伝子の発現が上昇していた.また,レプチンによる摂食の抑制がより強く観察されたことからレプチンに対し高感受性であることがわかった.これらの結果から,プロオピオメラノコルチン産生ニューロンに特異的なXbp1の発現の誘導により,エネルギー代謝が改善するとともに,高脂肪食による肥満が抑制されることが明らかになった.
2.プロオピオメラノコルチン産生ニューロンに特異的なXbp1の発現の誘導は全身のインスリン感受性および血糖値を改善する
プロオピオメラノコルチン産生ニューロンに特異的にXbp1を発現したマウスでは血糖値および血中インスリン値が有意に低かった.全身のインスリン感受性を詳細に検討するためグルコースクランプ試験を行ったところ,このマウスではおもに肝臓におけるインスリンによるグルコースの産生の抑制により全身のインスリン感受性が高まっていることがわかった.
3.プロオピオメラノコルチン産生ニューロンにおけるXbp1の発現の誘導は肝臓におけるXbp1-GalE経路を活性化する
最近,Xbp1の下流タンパク質としてGalEが同定された5).肝臓におけるXbp1-GalE経路の活性化が糖代謝およびインスリン感受性などを改善させるとともに,摂食の状態に応じた代謝制御機構に関与することが報告されている.今回,肝臓と同様に,視床下部の弓状核においても絶食から再摂食にかけてXbp1-GalE経路の活性化が見い出された.さらに,プロオピオメラノコルチン産生ニューロンに特異的なXbp1の発現により,プロオピオメラノコルチン産生ニューロンにおいてGalE遺伝子を含むXbp1の標的となる遺伝子の発現が上昇した.興味深いことに,プロオピオメラノコルチン産生ニューロンにおけるXbp1の発現の誘導は肝臓においてXbp1およびその下流タンパク質の発現を上昇させた.これらの結果から,プロオピオメラノコルチン産生ニューロンにおけるXbp1-GalE経路の活性化が,細胞に非自律的に末梢組織である肝臓における代謝制御の変化をもたらし,全身の糖代謝ならびにインスリン感受性などを改善したことが示唆された.
4.小胞体ストレスは弓状核においてレプチンシグナルおよびインスリンシグナルを阻害する
プロオピオメラノコルチン産生ニューロンにおいてXbp1の発現によるエネルギー代謝および糖代謝の改善にいたる分子機構を探る目的で,視床下部の器官培養切片6) を用いた.高脂肪食によりプロオピオメラノコルチン産生ニューロンに小胞体ストレスがもたらされることが知られていたことから,プロオピオメラノコルチン産生ニューロンにおいてレプチンシグナルおよびインスリンシグナルが小胞体ストレスにより阻害されるのではないかと考えた.さらに,Xbp1の発現がレプチンシグナルおよびインスリンシグナルの感受性を高めていると予想した.小胞体ストレスを誘導するため,視床下部の切片を小胞体ストレスの誘導剤により処理した.小胞体ストレスをあたえた視床下部の切片においては翻訳開始因子eIF-2のリン酸化および小胞体シャペロンの発現の誘導など小胞体ストレスマーカーが非常に強くみられた.この小胞体ストレスが誘導された視床下部の切片をさらにレプチンにより刺激することにより,レプチンの下流のシグナル伝達経路の活性について検討した.その結果,小胞体ストレス応答によりレプチンの作用に必須であることが知られているSTAT3シグナル伝達経路,MAKキナーゼシグナル伝達経路,Aktシグナル伝達経路がほぼ完全に阻害されることがわかった.インスリンによるAktのリン酸化も小胞体ストレスにより阻害された.したがって,視床下部において小胞体ストレスがレプチンおよびインスリンの下流のシグナル伝達経路を抑制することが示された.
5.インスリンおよびレプチンによるプロオピオメラノコルチン産生ニューロンの電気生理学的な変化は小胞体ストレスにより阻害される
レプチンはプロオピオメラノコルチン産生ニューロンに直接に作用することにより電気生理学的な活性化をひき起こす.一方,インスリンはプロオピオメラノコルチン産生ニューロンを電気生理学的に不活性化させる.インスリンおよびレプチンによるプロオピオメラノコルチン産生ニューロンへの電気生理学的な作用はPI3Kシグナル伝達経路を介することが知られている.また,プロオピオメラノコルチン産生ニューロンの電気化学的な活性化および不活性化は全身性の代謝制御において必須であると考えられている.さきに述べたように,小胞体ストレスがレプチンシグナルおよびインスリンシグナルを阻害したことから,小胞体ストレスがレプチンあるいはインスリンによるプロオピオメラノコルチン産生ニューロンの電気生理学的な変化に対しても影響を及ぼすのではないかと考えた.
レプチン受容体を発現するプロオピオメラノコルチン産生ニューロンを選択的に標識するため,蛍光タンパク質GFPにより標識したプロオピオメラノコルチン産生ニューロンを発現するマウスと,レプチン受容体を発現する細胞に蛍光タンパク質tdTomatoを発現するマウスとを交配し二重蛍光標識マウスを得た.まず,この二重蛍光標識マウスの急性切片からホールセル記録を行うことによりプロオピオメラノコルチン産生ニューロンにおけるインスリンおよびレプチンの作用を評価した.レプチンはレプチン受容体を発現するプロオピオメラノコルチン産生ニューロンの約75%において活性化をひき起こした.一方,レプチン受容体を発現するプロオピオメラノコルチン産生ニューロンはインスリンには応答しなかった.レプチン受容体を発現していないプロオピオメラノコルチン産生ニューロンのうち40%はインスリンにより過分極し不活性化した.これらの結果から,レプチンおよびインスリンはそれぞれ異なるプロオピオメラノコルチン産生ニューロンに作用することが示唆され,プロオピオメラノコルチン産生ニューロンは機能的に異なるニューロンからなる不均一な集団であるというモデル7) と一致した.この系を用いて,レプチンおよびインスリンによるプロオピオメラノコルチン産生ニューロンの電気化学的な変化に対し小胞体ストレスがあたえる影響について調べた.急性切片および器官培養切片を小胞体ストレスの誘導剤により6時間処理することで,レプチンによるプロオピオメラノコルチン産生ニューロンの活性化はほぼ完全に阻害された.さらに,小胞体ストレスの誘導によりインスリンの刺激によるプロオピオメラノコルチン産生ニューロンの過分極も観察されなくなった.これらのことから,小胞体ストレスによりレプチンあるいはインスリンの刺激に対するプロオピオメラノコルチン産生ニューロンの電気生理学的な応答は消失することがわかった.
6.Ptp1b,Socs3,Xbp1は小胞体ストレスによるインスリン抵抗性およびレプチン抵抗性に関与する
レプチン抵抗性にかかわるシグナルタンパク質としてSocs3およびPtp1bはもっともよく研究されている1,3).中枢神経系におけるPtp1bおよびSocs3のはたらきはエネルギー代謝およびレプチンの作用において必須である.たとえば,プロオピオメラノコルチン産生ニューロンにおいて特異的にPtp1bあるいはSocs3を欠損させたマウスは,どちらもレプチンの摂食抑制作用に対し高感受性であるとともに,高脂肪食による体重の増加が抑制されることが知られており,Ptp1bおよびSocs3はレプチン感受性の制御において必須の役割をはたしていると考えられている.今回,小胞体ストレスがPtp1bおよびSocs3のmRNAレベルでの発現を誘導することが見い出された.さらに,プロオピオメラノコルチン産生ニューロンにおけるXbp1の発現の誘導は,弓状核におけるPtp1bおよびSocs3のmRNAレベルでの発現を抑制した.
そこで,Ptp1bとSocs3の両方あるいはどちらかが小胞体ストレスによるレプチン抵抗性およびインスリン抵抗性に必要であるとの仮説をたて,Ptp1bあるいはSocs3をプロオピオメラノコルチン産生ニューロンにおいて特異的に欠損したマウスを作製し,これらのマウスの急性切片を用いて電気生理学的な解析を行うことによりPtp1bおよびSocs3の関与について検討した.対照となるマウスに小胞体ストレスをあたえたところ,予想どおり,レプチンによるプロオピオメラノコルチン産生ニューロンの活性化は抑制された.ところが,Ptp1bあるいはSocs3を欠損したプロオピオメラノコルチン産生ニューロンでは小胞体ストレスによりひき起こされるレプチン抵抗性は観察されなかった.同様に,Ptp1bあるいはSocs3を欠損した急性切片では小胞体ストレスをあたえたときにもインスリンによるプロオピオメラノコルチン産生ニューロンの不活性化が示された.興味深いことに,Socs3を欠損したプロオピオメラノコルチン産生ニューロンは,対照となるプロオピオメラノコルチン産生ニューロンあるいはPtp1bを欠損したプロオピオメラノコルチン産生ニューロンと比較して,インスリンに対しより強く応答したことから,Socs3が小胞体ストレスに依存するレプチン抵抗性およびインスリン抵抗性においてより大きな役割を担っていることが示唆された.さらに,プロオピオメラノコルチン産生ニューロンにXbp1を発現させることにより,小胞体ストレスによるレプチン抵抗性およびインスリン抵抗性はひき起こされないことが示された.
おわりに
この研究においては,Xbp1がプロオピオメラノコルチン産生ニューロンにおけるインスリン感受性およびレプチン感受性の制御に関与すること,また,Xbp1をプロオピオメラノコルチン産生ニューロンに発現することにより肝臓におけるXbp1の活性化がひき起こされるとともに肝臓における糖代謝が改善されること,が明らかにされた(図1).古くから,中枢神経系により末梢の器官における糖代謝が影響をうけることが示されているが,その分子機構はいまだ不明である.
この研究により,プロオピオメラノコルチン産生ニューロンにおけるXbp1の発現の誘導により肝臓におけるXbp1-GalE経路の活性化が起こることが明らかにされた.最近,線虫を用いた研究から,ニューロンにおけるXbp1の活性化が細胞に非自律的に腸の細胞におけるXbp1-GalE経路の活性化をもたらすことが報告された8).筆者らの研究とあわせると,中枢神経系と肝臓とのあいだのXbp1-GalE経路において細胞に非自律的ななんらかのつながりのあることが予想される.視床下部ニューロンによる膵臓や肝臓など末梢の器官の代謝制御は脳幹や脊髄の自律神経系を介すると考えられているが,その代謝制御機構は不明であり,今後の研究が待たれる分野のひとつである.
また,細胞のレベルでは,急性切片および器官培養切片をモデルとして視床下部およびプロオピオメラノコルチン産生ニューロンにおいて小胞体ストレスがレプチンシグナルおよびインスリンシグナルを阻害することが示された.また,小胞体ストレスによるインスリン抵抗性およびレプチン抵抗性にXbp1,Ptp1b,Socs3が必須であることも明らかにされた.レプチン抵抗性およびインスリン抵抗性の発症は多様なシグナル伝達経路が複雑に影響しあって起こると考えられており,この研究により,代謝シグナルに対する視床下部の抵抗性の基盤となるシグナルネットワークの解明にはずみがつくと思われる.視床下部は全身の代謝機能の制御に必須であることから,視床下部ニューロンによるインスリン抵抗性およびレプチン抵抗性の制御が肥満や糖尿病の病態基盤となっている可能性がある.その分子的な実態の解明が新たな治療アプローチにつながることが期待される.
文 献
- Myers, M. G. Jr., Heymsfield, S. B., Haft, C. et al.: Challenges and opportunities of defining clinical leptin resistance. Cell Metab., 15, 150-156 (2012)[PubMed]
- Taniguchi, C. M., Emanuelli, B. & Kahn, C. R.: Critical nodes in signalling pathways: insights into insulin action. Nat. Rev. Mol. Cell Biol., 7, 85-96 (2006)[PubMed]
- Konner, A. C. & Bruning, J. C.: Selective insulin and leptin resistance in metabolic disorders. Cell Metab., 16, 144-152 (2012)[PubMed]
- Ozcan, L., Ergin, A. S., Lu, A. et al.: Endoplasmic reticulum stress plays a central role in development of leptin resistance. Cell Metab., 9, 35-51 (2009)[PubMed]
- Deng, Y., Wang, Z. V., Tao, C. et al.: The Xbp1s/GalE axis links ER stress to postprandial hepatic metabolism. J. Clin. Invest., 123, 455-468 (2013)[PubMed]
- Fukuda, M., Williams, K. W., Gautron, L. et al.: Induction of leptin resistance by activation of cAMP-Epac signaling. Cell Metab., 13, 331-339 (2011)[PubMed]
- Williams, K. W., Margatho, L. O., Lee, C. E. et al.: Segregation of acute leptin and insulin effects in distinct populations of arcuate proopiomelanocortin neurons. J. Neurosci., 30, 2472-2479 (2010)[PubMed]
- Taylor, R. C. & Dillin, A.: XBP-1 is a cell-nonautonomous regulator of stress resistance and longevity. Cell, 153, 1435-1447 (2013)[PubMed]
著者プロフィール
略歴:1996年 東京大学大学院理学系研究科にて博士号取得,同年 京都大学大学院理学研究科 助手,京都大学大学院生命科学研究科 助手,2004年 米国Harvard大学 博士研究員,米国Texas大学Southwestern Medical Center Instructorを経て,2012年より米国Baylor College of MedicineにてAssistant Professor.
研究テーマ:肥満,糖尿病,老化にかかわる中枢性のシグナル伝達経路.
抱負:脳がどのように肥満あるいは糖尿病をひき起こすのか,分子レベルおよび細胞レベルではっきりさせたい.
© 2014 福田 真 Licensed under CC 表示 2.1 日本