Foxp3陽性T細胞,腸管の免疫グロブリンA,腸内フローラのあいだにみられる相互制御
河本新平・Fagarasan Sidonia
(理化学研究所統合生命医科学研究センター 粘膜免疫研究チーム)
email:河本新平
DOI: 10.7875/first.author.2014.103
Foxp3+ T cells regulate immunoglobulin A selection and facilitate diversification of bacterial species responsible for immune homeostasis.
Shimpei Kawamoto, Mikako Maruya, Lucia M. Kato, Wataru Suda, Koji Atarashi, Yasuko Doi, Yumi Tsutsui, Hongyan Qin, Kenya Honda, Takaharu Okada, Masahira Hattori, Sidonia Fagarasan
Immunity, 41, 152-165 (2014)
制御性T細胞として知られるFoxp3陽性T細胞は宿主免疫系の恒常性を維持するうえで必須のT細胞である.筆者らは,Foxp3陽性T細胞が腸内フローラのなかでもとくにFirmicutes門のClostridium属に属する腸内細菌の多様性を維持するうえで非常に重要な役割をはたしていることを明らかにした.Foxp3陽性T細胞は従来から知られている炎症を抑制する機能だけでなく,パイエル板の胚中心の内部において免疫グロブリンAの産生を制御する機能により腸内フローラを制御していることが明らかになった.Foxp3陽性T細胞の制御により適切な選択をうけた腸管の免疫グロブリンAはバランスのとれた腸内フローラの形成に影響し,反対に,このようにして形成された多様かつバランスのとれた腸内フローラは腸管におけるFoxp3陽性T細胞の分化および免疫グロブリンAの産生を効率的に誘導することがわかった.よって,Foxp3陽性T細胞,腸管の免疫グロブリンA,腸内フローラのあいだには相互制御ループが形成されており,それにより宿主と腸内フローラとの共生関係が維持されていることが示唆された.
ヒトの腸管には500~1000種類,総数で100兆個にも及ぶ腸内細菌が共生している.ヒトの胎児の腸管の内腔はもともと腸内細菌の存在しない無菌状態であるが,生後まもなく母親から腸内細菌をうけつぐことなどにより腸管に腸内細菌を定着させはじめる.そののち,食物,免疫系,生活様式などさまざまな影響をうけながら成長していくなかで,腸内フローラと腸管免疫系とが相互に影響しあい,徐々にバランスのとれた腸内フローラが形成されていくことが知られている.近年の研究により,腸内フローラが宿主の免疫系を適切に活性化することによりわれわれの健康が維持されていることが明らかにされつつある.しかし,バランスのとれた腸内フローラを形成および維持するうえで免疫系がどのように作用しているのか,反対に,バランスのとれた腸内フローラが免疫系にどのような影響を及ぼしているのかについての詳細はこれまでわかっていなかった.
筆者らによるこれまでの研究から,腸管の免疫グロブリンAが腸内フローラのバランスの維持,さらに,宿主免疫系の恒常性の維持において非常に重要な役割をはたしていることがわかってきている.たとえば筆者らは以前に,パイエル板におけるT細胞の機能の不全によりパイエル板の胚中心における免疫グロブリンAの選択に問題が生じると,腸管の免疫グロブリンAに質的な劣化が生じ,その結果,腸内フローラのバランスがみだれ全身の免疫系が過剰に活性化されることを報告した1)(新着論文レビュー でも掲載).一方で,最近の研究により,宿主免疫系の恒常性の維持において必須のT細胞であり制御性T細胞として知られるFoxp3陽性T細胞も,腸内フローラのバランスを維持するうえで重要な役割をはたすことが指摘されている.実際に,Foxp3陽性T細胞のうち腸内細菌に由来する抗原により分化の誘導されるサブセットが腸管において欠失することによりTH2型の炎症が誘発され,腸内フローラの構成に変化の生じることが報告されている2).興味深いことに,筆者らの研究から,Foxp3陽性T細胞はパイエル板において濾胞性ヘルパーT細胞へと分化することにより腸管における免疫グロブリンAの産生に関与していることが示されており3),さらに,抗CD25抗体を投与することにより生体において大部分のFoxp3陽性T細胞を除去すると,腸管における特異的な免疫グロブリンAの応答の消失することが報告されている4).
以上の結果から,Foxp3陽性T細胞および腸管免疫グロブリンAを中心とした制御機構により腸内フローラのバランスが維持されている可能性が考えられた.そこでこの研究では,Foxp3陽性T細胞および腸管免疫グロブリンAに注目し,それらがどのように作用することにより腸内フローラのバランスを制御しているのか,また反対に,腸内フローラがそれらにどのような影響をあたえているのかについてより詳細に明らかにすることを試みた.
バランスのとれた腸内フローラを形成するうえで免疫系がどのような役割をはたしているのかを明らかにするため,獲得免疫系においてはたらく細胞を欠損したさまざまな免疫不全マウスの腸内フローラを解析した.その結果,解析されたすべての免疫不全マウス,すなわち,T細胞欠損マウス(CD3欠損マウス),B細胞欠損マウス(μMTマウス),リンパ球欠損マウス(RAG欠損マウス)においては,正常なマウスに比べ腸内フローラの多様性が有意に低いことが明らかになった.また,これらの免疫不全マウスの腸内フローラの構成は正常なマウスのものとは明らかに異なっていた.よって,宿主免疫系のなかでも獲得免疫系が腸内フローラのバランス,すなわち,その多様性および構成を維持するうえで非常に重要な役割をはたしていることが示唆された.
獲得免疫系がどのような機構により腸内フローラの多様性および構成に影響をあたえているのかについて明らかにするため,T細胞欠損マウスに種々のT細胞を移植する系を用いて,どのT細胞が腸内フローラのバランスを形成するうえで重要な役割をはたしているのかを検討した.T細胞欠損マウスにナイーブT細胞(Foxp3陰性CD25陰性T細胞)を移植したところ腸管において顕著な炎症が確認され,移植するまえのT細胞欠損マウスと比較して腸内フローラの多様性の有意な低下が確認された.一方で,ナイーブT細胞とFoxp3陽性T細胞とを同時に移植したT細胞欠損マウスにおいては腸管の炎症が抑制され,腸内フローラの多様性も移植のまえより上昇し正常なマウスと同等の水準にまで回復した.興味深いことに,T細胞欠損マウスにFoxp3陽性T細胞のみを移植した場合においても腸内フローラの多様性は正常なマウスと同等の水準にまで回復することが明らかになった.以上の結果から,Foxp3陽性T細胞が腸内フローラの多様性の形成において重要な役割をはたしていることが示唆された.
Foxp3陽性T細胞が腸内フローラの多様性だけでなくその構成にどのように影響を及ぼしているのかを明らかにするため,Foxp3陽性T細胞を移植したT細胞欠損マウスの腸内フローラの構成を詳細に解析した.その結果,T細胞欠損マウス,あるいは,ナイーブT細胞を移植したT細胞欠損マウスと比較して,正常なマウスおよびFoxp3陽性T細胞を移植したT細胞欠損マウスにおいては,腸内フローラのなかでもFirmicutes門のClostridium属細菌,とくにClostridumクラスターIVおよびClostridumクラスターXIVaに属する腸内細菌の多様性が有意に上昇していることが明らかになった.これまでの研究により,これらのクラスターに属するClostridium属細菌は腸管におけるFoxp3陽性T細胞の誘導に関与していることが報告されている5,6).今回の結果は,Clostridium属細菌がFoxp3陽性T細胞の誘導に影響をあたえているという報告とは反対に,Foxp3陽性T細胞がClostridium属細菌の多様性の形成および増殖に影響を及ぼしていることを強く示唆した.よって,以上の結果から,Clostridium属細菌とFoxp3陽性T細胞とのあいだには相互作用の存在することが明らかになった.
Foxp3陽性T細胞はおもに2つの方法により腸内フローラを制御している可能性が考えられた.第1に,Foxp3陽性T細胞はFoxp3陰性T細胞の増殖やFoxp3陰性T細胞より産生される炎症性サイトカインの産生を抑制することにより腸管の炎症を抑えて腸内フローラを制御している可能性が考えられた.第2に,Foxp3陽性T細胞はパイエル板の胚中心の内部において免疫グロブリンAの産生に関与することにより腸内フローラを制御している可能性が考えられた.たとえば,筆者らのこれまでの研究から,Foxp3陽性T細胞はパイエル板において特異的に濾胞性ヘルパーT細胞へと分化することにより腸管における免疫グロブリンAの産生に関与していることが明らかになっている3).また近年,一部のFoxp3陽性T細胞は濾胞性制御性T細胞として胚中心の内部に存在することが報告され7-9),腸管における免疫グロブリンAの産生に影響をあたえている可能性が示唆されている.
そこで,Foxp3陽性T細胞が腸管の免疫グロブリンAを介して腸内フローラを制御している可能性について検討するため,AIDを欠損させたT細胞欠損マウスにFoxp3陽性T細胞を移植したのちの腸内フローラの構成を解析した.このマウスは腸管における免疫グロブリンAの産生に必須の酵素であるAIDを欠損しているため,Foxp3陽性T細胞を移植しても腸管において免疫グロブリンAを産生することができない.その結果,Foxp3陽性T細胞をT細胞欠損マウスに移植した場合には移植のまえと比較して腸内フローラの多様性が大きく上昇したのに対し,AIDを欠損させたT細胞欠損マウスに移植した場合には腸内フローラの多様性の上昇はみられなかった.よって,Foxp3陽性T細胞は腸管における免疫グロブリンAの産生を介して腸内フローラの多様性の形成に影響をあたえていることが明らかになった.すなわち,Foxp3陽性T細胞は濾胞性ヘルパーT細胞あるいは濾胞性制御性T細胞に分化してパイエル板の胚中心において機能することにより免疫グロブリンAの産生に関与し腸内フローラを制御している可能性が示唆された.
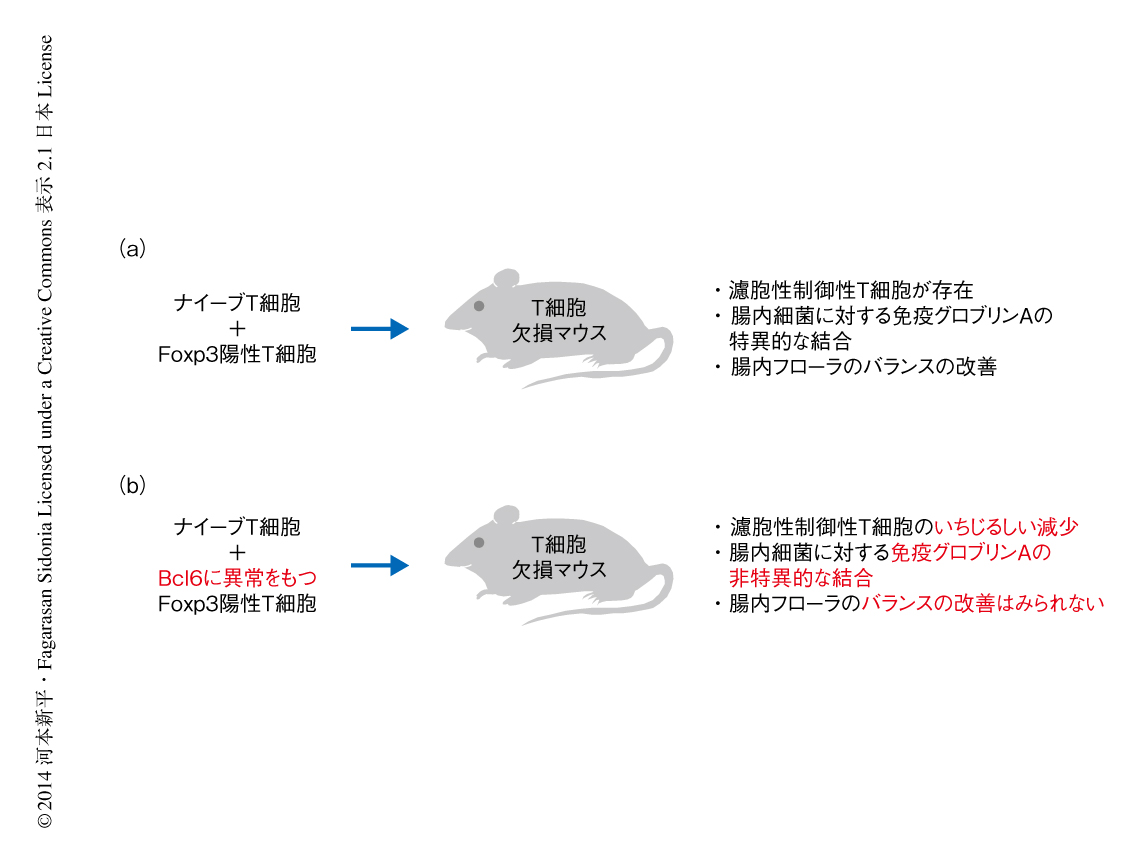
濾胞性ヘルパーT細胞および濾胞性制御性T細胞への分化には転写因子であるBcl6の発現が必須であることが知られている7,8,10).そこで,Foxp3陽性T細胞の胚中心の内部における機能をより詳細に明らかにするため,正常なマウスあるいはBcl6の機能に異常をもつマウスから単離したFoxp3陽性T細胞と,正常なマウスから単離したナイーブT細胞とを1対1の割合で混合し,T細胞欠損マウスに移植した(図1).その結果,Bcl6の機能に異常をもつマウスから単離したFoxp3陽性T細胞は,正常なマウスから単離したFoxp3陽性T細胞と同様に,移植したナイーブT細胞の増殖を抑制し腸管の炎症を抑制する機能をもつことが明らかになった.さらに,どちらのマウスにおいてもパイエル板に存在する濾胞性ヘルパーT細胞の大部分はナイーブT細胞に由来した.一方で,Bcl6の機能に異常をもつマウスから単離したFoxp3陽性T細胞を移植したマウスのパイエル板においては濾胞性制御性T細胞がいちじるしく減少していたことから,濾胞性制御性T細胞はFoxp3陽性T細胞から分化したと考えられた(図1).
興味深いことに,濾胞性制御性T細胞の減少した移植マウスにおいては,パイエル板における腸管の免疫グロブリンAの選択に問題が生じ,腸内細菌に対する結合性に変化の生じていることが明らかになった(図1).実際に,正常なマウスやこれらの移植マウスの糞便より精製した腸管の免疫グロブリンAの腸内細菌に対する結合性を確認したところ,正常なマウスやFoxp3陽性T細胞を移植したマウスのような濾胞性制御性T細胞の存在するマウスにおいて産生された腸管の免疫グロブリンAと比較して,濾胞性制御性T細胞の減少した移植マウスにおいて産生された腸管の免疫グロブリンAは,さまざまな種類の腸内細菌に対し非特異的に強く結合する傾向がみられた(図1).さらに,こうした腸管の免疫グロブリンAの質的な変化により,パイエル板に濾胞性制御性T細胞の存在する移植マウスにおいては移植ののち腸内フローラの多様性が上昇したのに対し,パイエル板に存在する濾胞性制御性T細胞の減少した移植マウスにおいては腸内フローラの多様性に変化はみられず,腸内フローラの構成も正常なマウスなどと比べ明らかに異なっていた(図1).よって,以上の結果から,濾胞性制御性T細胞はパイエル板における免疫グロブリンAの選択を制御することにより腸内フローラのバランスに影響をあたえていることが明らかになった.
腸内フローラの多様性が腸管免疫系にどのような影響をおよぼすのかについて検討した.さきに述べたとおり,ナイーブT細胞を移植したT細胞欠損マウスは多様性の低い腸内フローラを,Foxp3陽性T細胞を移植したT細胞欠損マウスは多様性の高い腸内フローラを保持していた.そこで,これらのマウスより得られた糞便を無菌マウスに投与し,多様性の異なる腸内フローラを定着させることにより腸管免疫系にどのような影響が生じるのかについて検討した.その結果,Foxp3陽性T細胞を移植したマウスから得られた多様性の高い腸内フローラを投与した無菌マウスにおいては,ナイーブT細胞を移植したマウスから得られた多様性の低い腸内フローラを投与した無菌マウスと比較して,腸管における免疫グロブリンAの産生およびFoxp3陽性T細胞の分化の誘導がより効率よく起こることが明らかになった.さらに興味深いことに,これらの腸内フローラを通常の環境において飼育された3週齢のマウスに投与しても,多様性の高い腸内フローラを投与した場合には腸管における効率のよい免疫グロブリンAの産生が確認された.以上の結果から,すでに腸管に腸内フローラが存在している状態においても,外部からの腸内フローラの投与により腸内フローラの構成および免疫系に影響をあたえることのできること,さらに,バランスのとれた多様性の高い腸内フローラがFoxp3陽性T細胞の分化や免疫グロブリンAの産生といった効果的な腸管免疫系の形成に有効であることが明らかになった.
これまでの免疫学の概念では,免疫系は病原細菌などから身を守るため細菌を排除するように発達したものであると考えられてきていた.しかし,この研究をつうじ,従来の概念とはいっけんして反対に,免疫系は腸内フローラを一方的には排除せず,代わりに,腸内フローラのバランスを積極的に維持することによりわれわれの健康を維持していることが明らかになった(図2).
[hs_figure id=12&image=/wp-content/uploads/2014/08/Kawamoto-Immunity-14.7.17-Fig.2.png&caption=fig2-caption-text]
この研究により,免疫系による腸内フローラのバランスの制御,および,腸内フローラのバランスによる免疫系の制御という双方向の制御により健康が保たれているという新しい概念が示され,さらに,外部からの腸内フローラの投与により腸内フローラおよび免疫系を人為的に制御できる可能性が示唆された.この成果は,腸内細菌が影響を及ぼすと考えられるさまざまな疾患,たとえば,自己免疫疾患やアレルギー疾患などの新規の予防法あるいは治療法を考えるうえで役にたつことが期待される.
略歴:2011年 京都大学大学院医学研究科 修了,同年より理化学研究所免疫・アレルギー科学総合研究センター(現 統合生命医科学研究センター) 研究員.
研究テーマ:腸管における免疫グロブリンAによる腸内細菌の制御の機構.
Sidonia Fagarasan
理化学研究所統合生命医科学研究センター チームリーダー.
研究室URL:http://web.rcai.riken.jp/mucosal/
© 2014 河本新平・Fagarasan Sidonia Licensed under CC 表示 2.1 日本
(理化学研究所統合生命医科学研究センター 粘膜免疫研究チーム)
email:河本新平
DOI: 10.7875/first.author.2014.103
Foxp3+ T cells regulate immunoglobulin A selection and facilitate diversification of bacterial species responsible for immune homeostasis.
Shimpei Kawamoto, Mikako Maruya, Lucia M. Kato, Wataru Suda, Koji Atarashi, Yasuko Doi, Yumi Tsutsui, Hongyan Qin, Kenya Honda, Takaharu Okada, Masahira Hattori, Sidonia Fagarasan
Immunity, 41, 152-165 (2014)
要 約
制御性T細胞として知られるFoxp3陽性T細胞は宿主免疫系の恒常性を維持するうえで必須のT細胞である.筆者らは,Foxp3陽性T細胞が腸内フローラのなかでもとくにFirmicutes門のClostridium属に属する腸内細菌の多様性を維持するうえで非常に重要な役割をはたしていることを明らかにした.Foxp3陽性T細胞は従来から知られている炎症を抑制する機能だけでなく,パイエル板の胚中心の内部において免疫グロブリンAの産生を制御する機能により腸内フローラを制御していることが明らかになった.Foxp3陽性T細胞の制御により適切な選択をうけた腸管の免疫グロブリンAはバランスのとれた腸内フローラの形成に影響し,反対に,このようにして形成された多様かつバランスのとれた腸内フローラは腸管におけるFoxp3陽性T細胞の分化および免疫グロブリンAの産生を効率的に誘導することがわかった.よって,Foxp3陽性T細胞,腸管の免疫グロブリンA,腸内フローラのあいだには相互制御ループが形成されており,それにより宿主と腸内フローラとの共生関係が維持されていることが示唆された.
はじめに
ヒトの腸管には500~1000種類,総数で100兆個にも及ぶ腸内細菌が共生している.ヒトの胎児の腸管の内腔はもともと腸内細菌の存在しない無菌状態であるが,生後まもなく母親から腸内細菌をうけつぐことなどにより腸管に腸内細菌を定着させはじめる.そののち,食物,免疫系,生活様式などさまざまな影響をうけながら成長していくなかで,腸内フローラと腸管免疫系とが相互に影響しあい,徐々にバランスのとれた腸内フローラが形成されていくことが知られている.近年の研究により,腸内フローラが宿主の免疫系を適切に活性化することによりわれわれの健康が維持されていることが明らかにされつつある.しかし,バランスのとれた腸内フローラを形成および維持するうえで免疫系がどのように作用しているのか,反対に,バランスのとれた腸内フローラが免疫系にどのような影響を及ぼしているのかについての詳細はこれまでわかっていなかった.
筆者らによるこれまでの研究から,腸管の免疫グロブリンAが腸内フローラのバランスの維持,さらに,宿主免疫系の恒常性の維持において非常に重要な役割をはたしていることがわかってきている.たとえば筆者らは以前に,パイエル板におけるT細胞の機能の不全によりパイエル板の胚中心における免疫グロブリンAの選択に問題が生じると,腸管の免疫グロブリンAに質的な劣化が生じ,その結果,腸内フローラのバランスがみだれ全身の免疫系が過剰に活性化されることを報告した1)(新着論文レビュー でも掲載).一方で,最近の研究により,宿主免疫系の恒常性の維持において必須のT細胞であり制御性T細胞として知られるFoxp3陽性T細胞も,腸内フローラのバランスを維持するうえで重要な役割をはたすことが指摘されている.実際に,Foxp3陽性T細胞のうち腸内細菌に由来する抗原により分化の誘導されるサブセットが腸管において欠失することによりTH2型の炎症が誘発され,腸内フローラの構成に変化の生じることが報告されている2).興味深いことに,筆者らの研究から,Foxp3陽性T細胞はパイエル板において濾胞性ヘルパーT細胞へと分化することにより腸管における免疫グロブリンAの産生に関与していることが示されており3),さらに,抗CD25抗体を投与することにより生体において大部分のFoxp3陽性T細胞を除去すると,腸管における特異的な免疫グロブリンAの応答の消失することが報告されている4).
以上の結果から,Foxp3陽性T細胞および腸管免疫グロブリンAを中心とした制御機構により腸内フローラのバランスが維持されている可能性が考えられた.そこでこの研究では,Foxp3陽性T細胞および腸管免疫グロブリンAに注目し,それらがどのように作用することにより腸内フローラのバランスを制御しているのか,また反対に,腸内フローラがそれらにどのような影響をあたえているのかについてより詳細に明らかにすることを試みた.
1.バランスのとれた腸内フローラを形成するうえで獲得免疫系が重要である
バランスのとれた腸内フローラを形成するうえで免疫系がどのような役割をはたしているのかを明らかにするため,獲得免疫系においてはたらく細胞を欠損したさまざまな免疫不全マウスの腸内フローラを解析した.その結果,解析されたすべての免疫不全マウス,すなわち,T細胞欠損マウス(CD3欠損マウス),B細胞欠損マウス(μMTマウス),リンパ球欠損マウス(RAG欠損マウス)においては,正常なマウスに比べ腸内フローラの多様性が有意に低いことが明らかになった.また,これらの免疫不全マウスの腸内フローラの構成は正常なマウスのものとは明らかに異なっていた.よって,宿主免疫系のなかでも獲得免疫系が腸内フローラのバランス,すなわち,その多様性および構成を維持するうえで非常に重要な役割をはたしていることが示唆された.
2.Foxp3陽性T細胞はClostridium属細菌の多様性の形成に関与する
獲得免疫系がどのような機構により腸内フローラの多様性および構成に影響をあたえているのかについて明らかにするため,T細胞欠損マウスに種々のT細胞を移植する系を用いて,どのT細胞が腸内フローラのバランスを形成するうえで重要な役割をはたしているのかを検討した.T細胞欠損マウスにナイーブT細胞(Foxp3陰性CD25陰性T細胞)を移植したところ腸管において顕著な炎症が確認され,移植するまえのT細胞欠損マウスと比較して腸内フローラの多様性の有意な低下が確認された.一方で,ナイーブT細胞とFoxp3陽性T細胞とを同時に移植したT細胞欠損マウスにおいては腸管の炎症が抑制され,腸内フローラの多様性も移植のまえより上昇し正常なマウスと同等の水準にまで回復した.興味深いことに,T細胞欠損マウスにFoxp3陽性T細胞のみを移植した場合においても腸内フローラの多様性は正常なマウスと同等の水準にまで回復することが明らかになった.以上の結果から,Foxp3陽性T細胞が腸内フローラの多様性の形成において重要な役割をはたしていることが示唆された.
Foxp3陽性T細胞が腸内フローラの多様性だけでなくその構成にどのように影響を及ぼしているのかを明らかにするため,Foxp3陽性T細胞を移植したT細胞欠損マウスの腸内フローラの構成を詳細に解析した.その結果,T細胞欠損マウス,あるいは,ナイーブT細胞を移植したT細胞欠損マウスと比較して,正常なマウスおよびFoxp3陽性T細胞を移植したT細胞欠損マウスにおいては,腸内フローラのなかでもFirmicutes門のClostridium属細菌,とくにClostridumクラスターIVおよびClostridumクラスターXIVaに属する腸内細菌の多様性が有意に上昇していることが明らかになった.これまでの研究により,これらのクラスターに属するClostridium属細菌は腸管におけるFoxp3陽性T細胞の誘導に関与していることが報告されている5,6).今回の結果は,Clostridium属細菌がFoxp3陽性T細胞の誘導に影響をあたえているという報告とは反対に,Foxp3陽性T細胞がClostridium属細菌の多様性の形成および増殖に影響を及ぼしていることを強く示唆した.よって,以上の結果から,Clostridium属細菌とFoxp3陽性T細胞とのあいだには相互作用の存在することが明らかになった.
3.Foxp3陽性T細胞は腸管の免疫グロブリンAを介して腸内フローラを制御する
Foxp3陽性T細胞はおもに2つの方法により腸内フローラを制御している可能性が考えられた.第1に,Foxp3陽性T細胞はFoxp3陰性T細胞の増殖やFoxp3陰性T細胞より産生される炎症性サイトカインの産生を抑制することにより腸管の炎症を抑えて腸内フローラを制御している可能性が考えられた.第2に,Foxp3陽性T細胞はパイエル板の胚中心の内部において免疫グロブリンAの産生に関与することにより腸内フローラを制御している可能性が考えられた.たとえば,筆者らのこれまでの研究から,Foxp3陽性T細胞はパイエル板において特異的に濾胞性ヘルパーT細胞へと分化することにより腸管における免疫グロブリンAの産生に関与していることが明らかになっている3).また近年,一部のFoxp3陽性T細胞は濾胞性制御性T細胞として胚中心の内部に存在することが報告され7-9),腸管における免疫グロブリンAの産生に影響をあたえている可能性が示唆されている.
そこで,Foxp3陽性T細胞が腸管の免疫グロブリンAを介して腸内フローラを制御している可能性について検討するため,AIDを欠損させたT細胞欠損マウスにFoxp3陽性T細胞を移植したのちの腸内フローラの構成を解析した.このマウスは腸管における免疫グロブリンAの産生に必須の酵素であるAIDを欠損しているため,Foxp3陽性T細胞を移植しても腸管において免疫グロブリンAを産生することができない.その結果,Foxp3陽性T細胞をT細胞欠損マウスに移植した場合には移植のまえと比較して腸内フローラの多様性が大きく上昇したのに対し,AIDを欠損させたT細胞欠損マウスに移植した場合には腸内フローラの多様性の上昇はみられなかった.よって,Foxp3陽性T細胞は腸管における免疫グロブリンAの産生を介して腸内フローラの多様性の形成に影響をあたえていることが明らかになった.すなわち,Foxp3陽性T細胞は濾胞性ヘルパーT細胞あるいは濾胞性制御性T細胞に分化してパイエル板の胚中心において機能することにより免疫グロブリンAの産生に関与し腸内フローラを制御している可能性が示唆された.
4.パイエル板の濾胞性制御性T細胞は腸内フローラのバランスを制御するうえで重要な役割をはたす
濾胞性ヘルパーT細胞および濾胞性制御性T細胞への分化には転写因子であるBcl6の発現が必須であることが知られている7,8,10).そこで,Foxp3陽性T細胞の胚中心の内部における機能をより詳細に明らかにするため,正常なマウスあるいはBcl6の機能に異常をもつマウスから単離したFoxp3陽性T細胞と,正常なマウスから単離したナイーブT細胞とを1対1の割合で混合し,T細胞欠損マウスに移植した(図1).その結果,Bcl6の機能に異常をもつマウスから単離したFoxp3陽性T細胞は,正常なマウスから単離したFoxp3陽性T細胞と同様に,移植したナイーブT細胞の増殖を抑制し腸管の炎症を抑制する機能をもつことが明らかになった.さらに,どちらのマウスにおいてもパイエル板に存在する濾胞性ヘルパーT細胞の大部分はナイーブT細胞に由来した.一方で,Bcl6の機能に異常をもつマウスから単離したFoxp3陽性T細胞を移植したマウスのパイエル板においては濾胞性制御性T細胞がいちじるしく減少していたことから,濾胞性制御性T細胞はFoxp3陽性T細胞から分化したと考えられた(図1).
興味深いことに,濾胞性制御性T細胞の減少した移植マウスにおいては,パイエル板における腸管の免疫グロブリンAの選択に問題が生じ,腸内細菌に対する結合性に変化の生じていることが明らかになった(図1).実際に,正常なマウスやこれらの移植マウスの糞便より精製した腸管の免疫グロブリンAの腸内細菌に対する結合性を確認したところ,正常なマウスやFoxp3陽性T細胞を移植したマウスのような濾胞性制御性T細胞の存在するマウスにおいて産生された腸管の免疫グロブリンAと比較して,濾胞性制御性T細胞の減少した移植マウスにおいて産生された腸管の免疫グロブリンAは,さまざまな種類の腸内細菌に対し非特異的に強く結合する傾向がみられた(図1).さらに,こうした腸管の免疫グロブリンAの質的な変化により,パイエル板に濾胞性制御性T細胞の存在する移植マウスにおいては移植ののち腸内フローラの多様性が上昇したのに対し,パイエル板に存在する濾胞性制御性T細胞の減少した移植マウスにおいては腸内フローラの多様性に変化はみられず,腸内フローラの構成も正常なマウスなどと比べ明らかに異なっていた(図1).よって,以上の結果から,濾胞性制御性T細胞はパイエル板における免疫グロブリンAの選択を制御することにより腸内フローラのバランスに影響をあたえていることが明らかになった.
5.バランスのとれた腸内フローラは腸管免疫系の効果的な誘導に重要である
腸内フローラの多様性が腸管免疫系にどのような影響をおよぼすのかについて検討した.さきに述べたとおり,ナイーブT細胞を移植したT細胞欠損マウスは多様性の低い腸内フローラを,Foxp3陽性T細胞を移植したT細胞欠損マウスは多様性の高い腸内フローラを保持していた.そこで,これらのマウスより得られた糞便を無菌マウスに投与し,多様性の異なる腸内フローラを定着させることにより腸管免疫系にどのような影響が生じるのかについて検討した.その結果,Foxp3陽性T細胞を移植したマウスから得られた多様性の高い腸内フローラを投与した無菌マウスにおいては,ナイーブT細胞を移植したマウスから得られた多様性の低い腸内フローラを投与した無菌マウスと比較して,腸管における免疫グロブリンAの産生およびFoxp3陽性T細胞の分化の誘導がより効率よく起こることが明らかになった.さらに興味深いことに,これらの腸内フローラを通常の環境において飼育された3週齢のマウスに投与しても,多様性の高い腸内フローラを投与した場合には腸管における効率のよい免疫グロブリンAの産生が確認された.以上の結果から,すでに腸管に腸内フローラが存在している状態においても,外部からの腸内フローラの投与により腸内フローラの構成および免疫系に影響をあたえることのできること,さらに,バランスのとれた多様性の高い腸内フローラがFoxp3陽性T細胞の分化や免疫グロブリンAの産生といった効果的な腸管免疫系の形成に有効であることが明らかになった.
おわりに
これまでの免疫学の概念では,免疫系は病原細菌などから身を守るため細菌を排除するように発達したものであると考えられてきていた.しかし,この研究をつうじ,従来の概念とはいっけんして反対に,免疫系は腸内フローラを一方的には排除せず,代わりに,腸内フローラのバランスを積極的に維持することによりわれわれの健康を維持していることが明らかになった(図2).
[hs_figure id=12&image=/wp-content/uploads/2014/08/Kawamoto-Immunity-14.7.17-Fig.2.png&caption=fig2-caption-text]
この研究により,免疫系による腸内フローラのバランスの制御,および,腸内フローラのバランスによる免疫系の制御という双方向の制御により健康が保たれているという新しい概念が示され,さらに,外部からの腸内フローラの投与により腸内フローラおよび免疫系を人為的に制御できる可能性が示唆された.この成果は,腸内細菌が影響を及ぼすと考えられるさまざまな疾患,たとえば,自己免疫疾患やアレルギー疾患などの新規の予防法あるいは治療法を考えるうえで役にたつことが期待される.
文 献
- Kawamoto, S., Tran, T. H., Maruya, M. et al.: The inhibitory receptor PD-1 regulates IgA selection and bacterial composition in the gut. Science, 336, 485-489 (2011)[PubMed] [新着論文レビュー]
- Josefowicz, S. Z., Niec, R. E., Kim, H. Y. et al.: Extrathymically generated regulatory T cells control mucosal TH2 inflammation. Nature, 482, 395-399 (2012)[PubMed]
- Tsuji, M., Komatsu, N., Kawamoto, S. et al.: Preferential generation of follicular B helper T cells from Foxp3+ T cells in gut Peyer’s patches. Science, 323, 1488-1492 (2008)[PubMed]
- Cong, Y., Feng, T., Fujihashi, K. et al.: A dominant, coordinated T regulatory cell-IgA response to the intestinal microbiota. Proc. Natl. Acad. Sci. USA, 106, 19256-19261 (2009)[PubMed]
- Atarashi, K., Tanoue, T., Oshima, K. et al.: Treg induction by a rationally selected mixture of Clostridia strains from the human microbiota. Nature, 500, 232-236 (2013)[PubMed]
- Atarashi, K., Tanoue, T., Shima, T. et al.: Induction of colonic regulatory T cells by indigenous Clostridium species. Science, 331, 337-341 (2011)[PubMed]
- Chung, Y., Tanaka, S., Chu, F. et al.: Follicular regulatory T cells expressing Foxp3 and Bcl-6 suppress germinal center reactions. Nat. Med., 17, 983-988 (2011)[PubMed]
- Linterman, M. A., Pierson, W., Lee, S. K. et al.: Foxp3+ follicular regulatory T cells control the germinal center response. Nat. Med., 17, 975-982 (2011)[PubMed]
- Wollenberg, I., Agua-Doce, A., Hernandez, A. et al.: Regulation of the germinal center reaction by Foxp3+ follicular regulatory T cells. J. Immunol., 187, 4553-4560 (2011)[PubMed]
- Crotty, S.: Follicular helper CD4 T cells (TFH). Annu. Rev. Immunol., 29, 621-663 (2011)[PubMed]
著者プロフィール
略歴:2011年 京都大学大学院医学研究科 修了,同年より理化学研究所免疫・アレルギー科学総合研究センター(現 統合生命医科学研究センター) 研究員.
研究テーマ:腸管における免疫グロブリンAによる腸内細菌の制御の機構.
Sidonia Fagarasan
理化学研究所統合生命医科学研究センター チームリーダー.
研究室URL:http://web.rcai.riken.jp/mucosal/
© 2014 河本新平・Fagarasan Sidonia Licensed under CC 表示 2.1 日本