タンパク質の機能を明らかにする小分子化合物
宮崎 功・清水史郎・長田裕之
(理化学研究所基幹研究所 ケミカルバイオロジー研究基盤施設)
email:宮崎 功,長田裕之
DOI: 10.7875/first.author.2010.019
A small-molecule inhibitor shows that pirin regulates migration of melanoma cells.
Isao Miyazaki, Siro Simizu, Hideo Okumura, Satoshi Takagi, Hiroyuki Osada
Nature Chemical Biology, 6, 667-673 (2010)
生命活動の担い手であるタンパク質の機能を解明することは生命現象の謎を解くカギとなるとともに,医薬品や健康食品などの開発につながる.タンパク質に結合してその機能を阻害する小分子化合物を“バイオプローブ”とよぶ.今回,筆者らは,生体に広く存在しながらその役割が知られていなかったタンパク質であるピリンの機能を阻害する,分子量わずか400程度の小分子化合物TPh Aを,化合物アレイという独自に開発した手法を用いはじめて発見した.さらに,このTPh Aをバイオプローブとして用いることでピリンの機能を調べ,悪性メラノーマの運動に関与することを明らかにした.また,TPh Aとピリンとが結合した状態での共結晶化に成功し,X線結晶構造解析により両者の結合のようすを分子レベルで解明することにも成功した.
あるタンパク質に特異的に作用する小分子化合物があれば,そのタンパク質の機能を制御し新たな基礎研究を行うことができる.とくに,タンパク質の機能がわからない場合は,小分子化合物を活用することによってその機能を知ることができる.筆者らの研究チームは,このようなタンパク質の機能を阻害する小分子化合物をバイオプローブとよんで,これまでに,さまざまなタンパク質のバイオプローブを検出することのできる化合物アレイの技術を独自に開発してきた.
この化合物アレイには,目的のタンパク質と物理的に結合する小分子化合物を非常に高い処理能力でスクリーニングすることのできるという特徴がある.この手法では,スライドガラスなどの基盤に化合物を少量ずつスポットしスライドガラスに固定化する.1枚のスライドガラスには数千から数万の化合物を固定化することができ,1回の試験で固定化されたすべての小分子化合物に対する結合の有無を確認することができる.このため,ほかのアッセイ方法に比べて非常にスループットがすぐれている.また,化合物アレイでは物理的な結合を検出するため,機能や役割が不明なタンパク質にも適応できるという特徴をもつ.つまり,原理的にはいかなるタンパク質についても小分子化合物のスクリーニングが可能ということになる.
化合物アレイ法は,1999年,米国Harvard大学のMacBeathとSchreiberらのグループによってはじめて報告された1).当時は,小分子化合物を固定化するためにスライドガラスにあらかじめ反応基を導入しておき,これに小分子化合物の特定の官能基を反応させてスライドガラスにつなぎとめるという手法を用いていた.そのため,結合させる小分子化合物ごとに特定の官能基をもつ必要があった.また,その官能基と標的タンパク質とが結合する場合には,官能基はスライドガラスと小分子化合物とをつなぎとめる役割に使われてしまっているため,小分子化合物とタンパク質との結合を観察することができないという問題点があった.
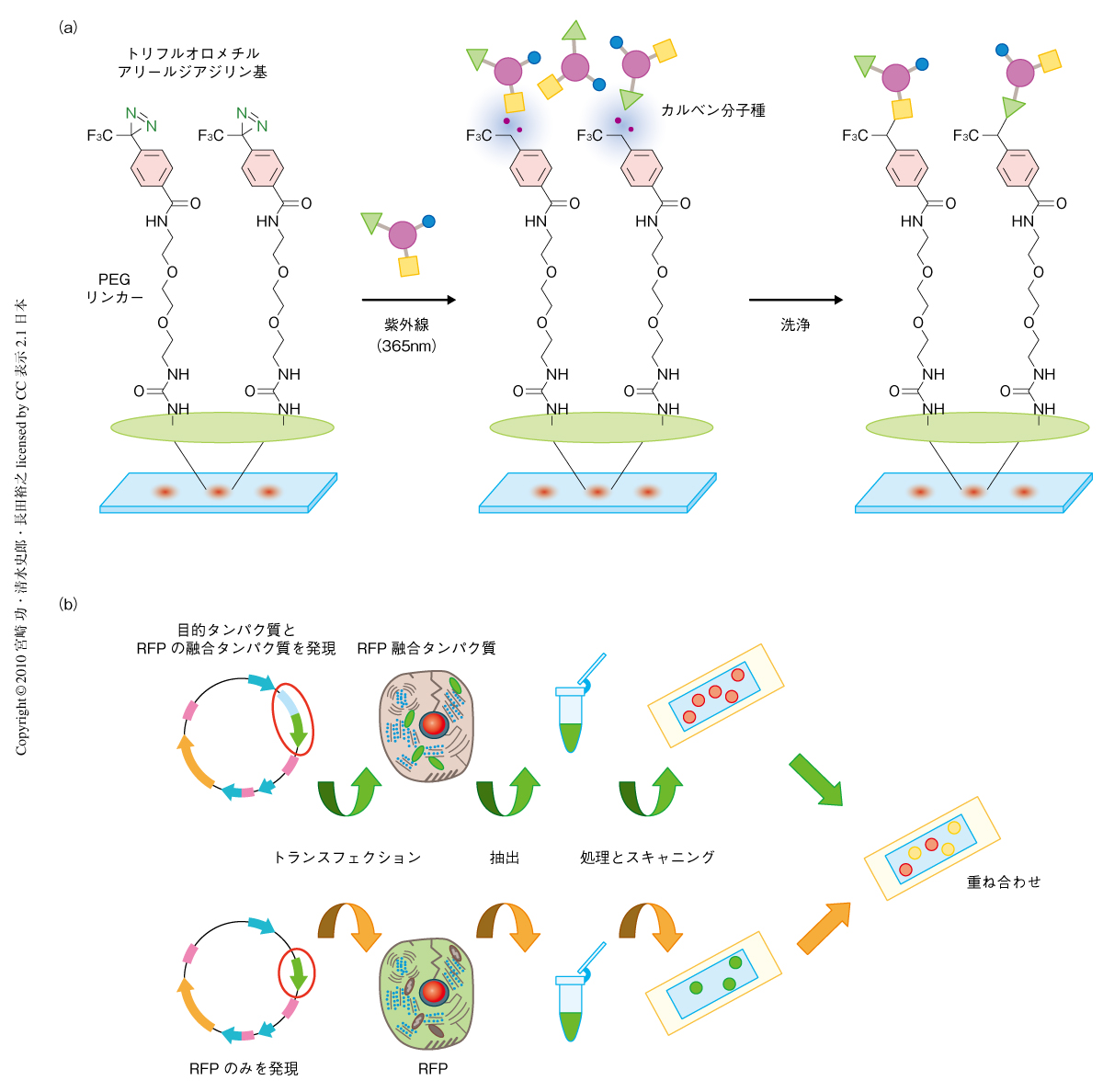
そこで,筆者らの研究室では,2003年,官能基に依存することなくさまざまな小分子化合物をスライドガラスに固定化する方法を開発した2).具体的には,スライドガラスにアリールジアジリン基を導入しておき,波長365 nm付近の紫外線を照射させることで非常に反応性の高いカルベンを発生させる.このカルベンが,官能基の種類を問わず小分子化合物の構造に反応し,スライドガラスに小分子化合物を固定化させる(図1a).
また,2008年には,Bradnerらの報告を参考に3),目的タンパク質と蛍光タンパク質RFPとを融合タンパク質とした状態でHEK293T細胞に発現させ,細胞抽出液のまま化合物アレイに使用する系を構築した4)(図1b).タンパク質精製の手間を省いたことによるスクリーニング系全体のスループット向上にくわえて,動物細胞では翻訳後修飾をうけるため,真核生物に由来するタンパク質が本来の構造や性質を保っている可能性が高いというメリットがくわわった.さらに,化合物アレイでヒット化合物を簡便に認識するため,重ね合わせ提示法と名づけた方法を用いることにした.重ね合わせ提示法とは,RFP融合タンパク質の細胞抽出液を処理した化合物アレイの図と,RFPのみを発現させた細胞抽出液を処理した化合物アレイの図を重ね合わせることにより,ノイズを簡便に除き視覚的にヒット化合物を認識できる方法である(図1b).この方法では,コンピューターにおいて前者の図を赤色,後者の図を緑色に擬似カラーで染色したのち,両者を重ね合わせることによって,RFPに結合する化合物や自家蛍光をもつ化合物などのノイズが色の重なりにより差し引かれて,目的タンパク質に結合した化合物のスポットのみが重ね合わせた図のうえで赤色を示すことになる.
今回,筆者らは,独自に開発したこの化合物アレイの技術を用い,機能が未知であったピリンに結合するバイオプローブのスクリーニングを試みた.
ピリンは,1997年,酵母ツーハイブリット系を使用したスクリーニングにより核内転写因子であるNFI/CTFに結合するタンパク質として発見された5).哺乳類から,植物,真菌,そして,原核生物にいたるまで幅広く保存されており,cupinスーパーファミリーに分類されている6).cupinスーパーファミリーは現在まで見い出されているなかでももっとも機能的に多彩なタンパク質の集まりであり,酵素と非酵素とが多種多様な様相をなしている.これまでピリンの生体内での機能は不明であった.よって,もしピリンに結合する小分子化合物が得られたなら,それをピリンの役割を明らかにするバイオプローブとして使用し,ピリンが関与する生体内での代謝経路についてもより理解を深めることができるだろうと考えた.
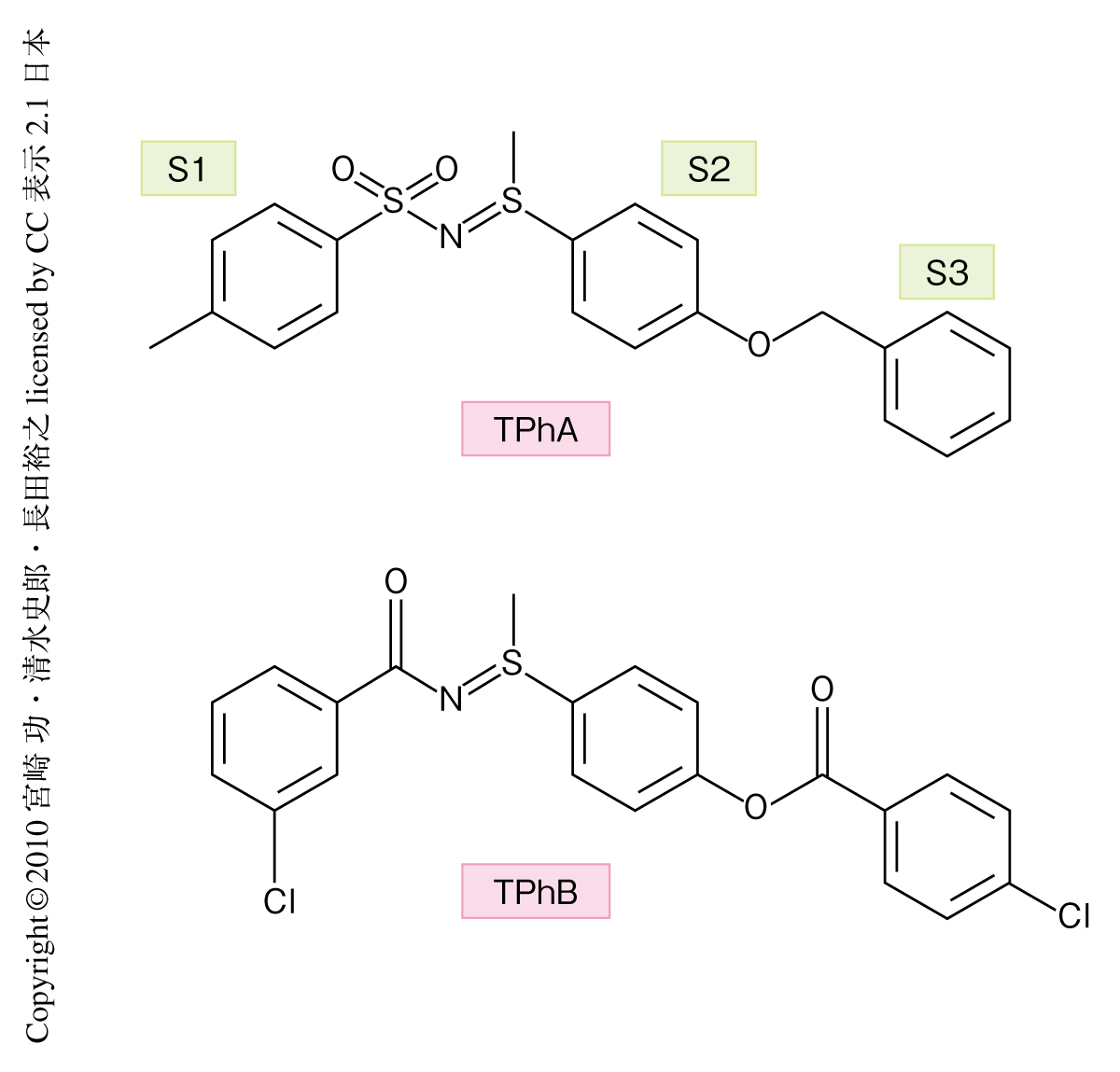
スライドガラス1枚におよそ4000種の化合物を固定化した化合物アレイを作製し,カバーガラスをのせ,スライドガラスとカバーガラスとの隙間にRFPとピリンとの融合タンパク質を過剰発現させたHEK293T細胞抽出液を注入した.4℃で1時間反応させたのち,溶液で数回洗浄し,スキャナーでRFPの蛍光を検出した.RFPのみを過剰発現させた細胞抽出液を同様に処理した化合物アレイの図を対照とし,重ね合わせ提示法を行った.合計約2万種類の小分子化合物についてスクリーニングした結果,ピリンに特異的に結合する小分子化合物を発見し,3つのフェニル基をもつその構造的な特徴からこの小分子化合物をTPh A(Triphenyl compound A)とよぶことにした(図2).つぎに,このTPh Aの結合シグナルの確認と構造活性相関の解析のため,構造類縁体TPh Bととともに化合物アレイに固定化した.この化合物アレイにRFP-ピリン融合タンパク質を過剰発現したHEK293T細胞抽出液を処理したのちRFPの蛍光を検出したところ,TPh Aのスポットされている位置に強い蛍光シグナルがみられた.この蛍光シグナルは遊離のTPh Aにより濃度依存的に阻害されることもわかった.一方,TPh Bのスポットされている位置には有意なシグナルはみられなかった.そこで,TPh Bを陰性対照として使用する化合物とした.また,等温滴定微小カロリメトリーを用いて,TPh Aとピリンとの溶液内での結合定数は0.6μMであることも明らかにした.
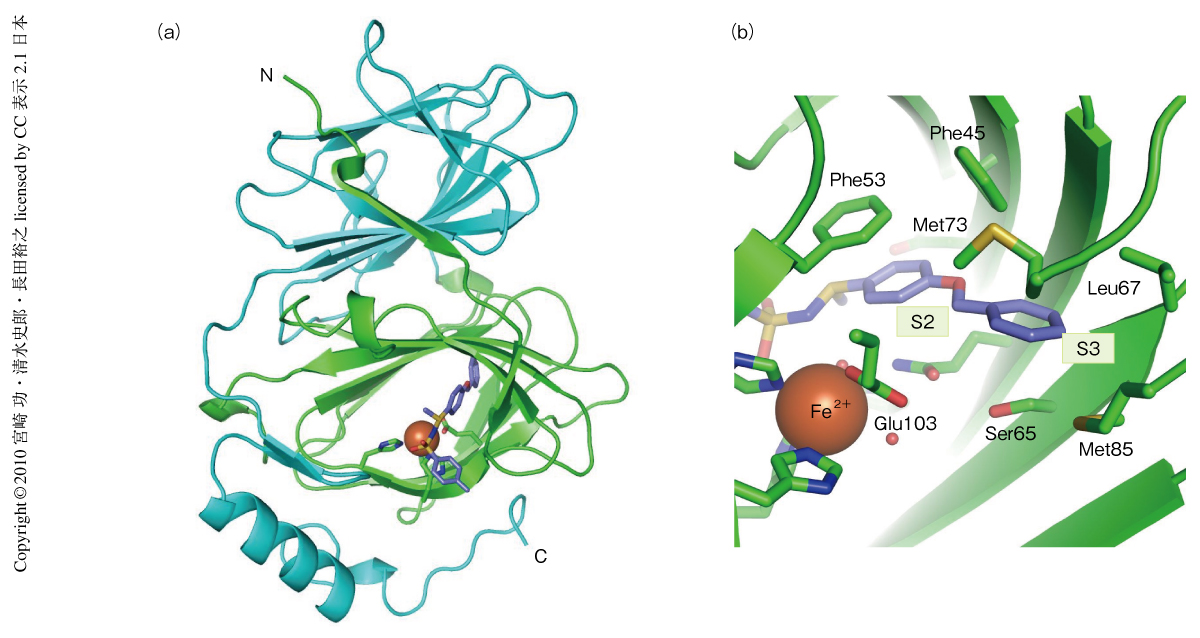
つぎに,ピリンとTPh Aとの結合様式を明らかにするため両者の共結晶化を試みた.その結果,X線結晶構造解析により両者の結合のようすを2.35Åの分解能で明らかにすることができた.ピリン単独の結晶構造は構造的に似たβバレルがむかいあった状態からなり,N末端のくぼみにFe2+を含んでいることがすでに知られていた7).今回の共結晶の構造解析により,TPh AはそのFe2+の存在するポケットにぴったりと入り込んで強く結合していることがわかった(図3a).とくに,TPh Aの末端部位であるS3位置のフェニル基は,Phe45,Ser65,Leu67,Met85,Met73からなるこのポケットの奥深い疎水性領域に挿入されていた(図3b).この領域の奥行きはS3位置のフェニル基によってぴったり充たされているため,TPh BのS3位置のフェニル基に存在する塩素原子の存在はMet85との立体的な衝突を生じさせることとなって,TPh Bは結合することができなくなったものと示唆された.
化合物アレイの技術が開発された当初は,化合物アレイを用いて物理的な相互作用を検出しても,得られるのはタンパク質の機能において重要ではない,たとえば,タンパク質の表面に結合するような機能に影響をあたえない小分子化合物がほとんどではないかという疑念がささやかれていた8).今回の実験結果は,化合物アレイにより見い出されたバイオプローブとタンパク質との結合位置を結晶化により特定したはじめての例である.TPh Aとピリンとの結合様式から,タンパク質構造の機能的に重要なポケットに奥深く入り込む小分子化合物を化合物アレイにより見い出せることがX線構造解析によって証明することができた.
TPh Aの細胞にあたえる影響を確かめるため,いくつかの細胞においてピリンの発現量を比較したところ,ほかの細胞に比べてWM266-4細胞やSK-MEL-28細胞などのメラノーマ細胞で発現量の多いことがわかった.そこで,TPh Aが細胞の遊走に影響をあたえるかどうかを,WM266-4細胞の引っ掻きアッセイ法により調べた.その結果,WM266-4細胞の遊走がTPh Aにより濃度依存的に阻害されることがわかった.一方,陰性対照であるTPh Bでは同様な効果は観察できなかった.また,TPh Aにはこれらの培養細胞を殺す作用はほとんどみられなかった.このことから,ピリンは悪性メラノーマの運動に関与しているのではないかという仮説をたてた.siRNAによりピリンをノックダウンした細胞を用いた実験がTPh Aを処理した細胞と同じ結果となり,この仮説が正しいことを証明することができた.
今回の一連の実験は,化合物アレイを用いて機能未知のタンパク質のバイオプローブを取得し,それらの結合のようすを解明したうえで,タンパク質の機能を明らかにすることに成功したはじめての例となった.
今回,ピリンのはじめてのバイオプローブであるTPh Aを発見し,X線結晶構造解析により両者の結合のようすを解明したことで,ピリンを分子レベルでより詳細に研究することが可能となった.これまで,ピリンの阻害剤は知られていなかったためその詳細な研究は進んでいなかったが,今回,ピリンが悪性メラノーマの運動を制御していることを明らかにしたことから,この成果を足掛かりに,別の細胞種でのはたらき,酵素活性の有無,生体内でのほかの役割,などの研究が進展していくと期待できる.また,化合物アレイを用いた小分子化合物スクリーニングの成功例は,世界的にみても数えるほどしか報告されておらず,とくに,機能が未知のタンパク質のバイオプローブを取得した例はほとんどない.化合物アレイを用いる大きな利点のひとつは,ピリンのように酵素活性や機能が不明であるタンパク質のバイオプローブの取得を可能にすることである.今回のこの実験結果から,機能がわからないため従来のスクリーニング法を断念していたタンパク質でも,化合物アレイ法を用いればバイオプローブの取得が可能であることを証明することができた.この技術を用いて,基礎研究や臨床試験までさまざまな段階でのブレークスルーとなる有用なバイオプローブがひとつでも多くみつかることを期待している.
略歴:2003年 金沢大学大学院薬学研究科 修了,同年 大鵬薬品工業飯能研究所 研究員を経て,2006年より理化学研究所基幹研究所 研究生.
研究テーマ:化合物アレイを用いたケミカルバイオロジー.
長田 裕之(Hiroyuki Osada)
理化学研究所基幹研究所 施設長.
研究室URL:http://cbcore.riken.jp/ja.html
© 2010 宮崎 功・清水史郎・長田裕之 Licensed under CC 表示 2.1 日本
(理化学研究所基幹研究所 ケミカルバイオロジー研究基盤施設)
email:宮崎 功,長田裕之
DOI: 10.7875/first.author.2010.019
A small-molecule inhibitor shows that pirin regulates migration of melanoma cells.
Isao Miyazaki, Siro Simizu, Hideo Okumura, Satoshi Takagi, Hiroyuki Osada
Nature Chemical Biology, 6, 667-673 (2010)
要 約
生命活動の担い手であるタンパク質の機能を解明することは生命現象の謎を解くカギとなるとともに,医薬品や健康食品などの開発につながる.タンパク質に結合してその機能を阻害する小分子化合物を“バイオプローブ”とよぶ.今回,筆者らは,生体に広く存在しながらその役割が知られていなかったタンパク質であるピリンの機能を阻害する,分子量わずか400程度の小分子化合物TPh Aを,化合物アレイという独自に開発した手法を用いはじめて発見した.さらに,このTPh Aをバイオプローブとして用いることでピリンの機能を調べ,悪性メラノーマの運動に関与することを明らかにした.また,TPh Aとピリンとが結合した状態での共結晶化に成功し,X線結晶構造解析により両者の結合のようすを分子レベルで解明することにも成功した.
はじめに
あるタンパク質に特異的に作用する小分子化合物があれば,そのタンパク質の機能を制御し新たな基礎研究を行うことができる.とくに,タンパク質の機能がわからない場合は,小分子化合物を活用することによってその機能を知ることができる.筆者らの研究チームは,このようなタンパク質の機能を阻害する小分子化合物をバイオプローブとよんで,これまでに,さまざまなタンパク質のバイオプローブを検出することのできる化合物アレイの技術を独自に開発してきた.
この化合物アレイには,目的のタンパク質と物理的に結合する小分子化合物を非常に高い処理能力でスクリーニングすることのできるという特徴がある.この手法では,スライドガラスなどの基盤に化合物を少量ずつスポットしスライドガラスに固定化する.1枚のスライドガラスには数千から数万の化合物を固定化することができ,1回の試験で固定化されたすべての小分子化合物に対する結合の有無を確認することができる.このため,ほかのアッセイ方法に比べて非常にスループットがすぐれている.また,化合物アレイでは物理的な結合を検出するため,機能や役割が不明なタンパク質にも適応できるという特徴をもつ.つまり,原理的にはいかなるタンパク質についても小分子化合物のスクリーニングが可能ということになる.
化合物アレイ法は,1999年,米国Harvard大学のMacBeathとSchreiberらのグループによってはじめて報告された1).当時は,小分子化合物を固定化するためにスライドガラスにあらかじめ反応基を導入しておき,これに小分子化合物の特定の官能基を反応させてスライドガラスにつなぎとめるという手法を用いていた.そのため,結合させる小分子化合物ごとに特定の官能基をもつ必要があった.また,その官能基と標的タンパク質とが結合する場合には,官能基はスライドガラスと小分子化合物とをつなぎとめる役割に使われてしまっているため,小分子化合物とタンパク質との結合を観察することができないという問題点があった.
そこで,筆者らの研究室では,2003年,官能基に依存することなくさまざまな小分子化合物をスライドガラスに固定化する方法を開発した2).具体的には,スライドガラスにアリールジアジリン基を導入しておき,波長365 nm付近の紫外線を照射させることで非常に反応性の高いカルベンを発生させる.このカルベンが,官能基の種類を問わず小分子化合物の構造に反応し,スライドガラスに小分子化合物を固定化させる(図1a).
また,2008年には,Bradnerらの報告を参考に3),目的タンパク質と蛍光タンパク質RFPとを融合タンパク質とした状態でHEK293T細胞に発現させ,細胞抽出液のまま化合物アレイに使用する系を構築した4)(図1b).タンパク質精製の手間を省いたことによるスクリーニング系全体のスループット向上にくわえて,動物細胞では翻訳後修飾をうけるため,真核生物に由来するタンパク質が本来の構造や性質を保っている可能性が高いというメリットがくわわった.さらに,化合物アレイでヒット化合物を簡便に認識するため,重ね合わせ提示法と名づけた方法を用いることにした.重ね合わせ提示法とは,RFP融合タンパク質の細胞抽出液を処理した化合物アレイの図と,RFPのみを発現させた細胞抽出液を処理した化合物アレイの図を重ね合わせることにより,ノイズを簡便に除き視覚的にヒット化合物を認識できる方法である(図1b).この方法では,コンピューターにおいて前者の図を赤色,後者の図を緑色に擬似カラーで染色したのち,両者を重ね合わせることによって,RFPに結合する化合物や自家蛍光をもつ化合物などのノイズが色の重なりにより差し引かれて,目的タンパク質に結合した化合物のスポットのみが重ね合わせた図のうえで赤色を示すことになる.
今回,筆者らは,独自に開発したこの化合物アレイの技術を用い,機能が未知であったピリンに結合するバイオプローブのスクリーニングを試みた.
1.ピリンに結合する小分子化合物の発見
ピリンは,1997年,酵母ツーハイブリット系を使用したスクリーニングにより核内転写因子であるNFI/CTFに結合するタンパク質として発見された5).哺乳類から,植物,真菌,そして,原核生物にいたるまで幅広く保存されており,cupinスーパーファミリーに分類されている6).cupinスーパーファミリーは現在まで見い出されているなかでももっとも機能的に多彩なタンパク質の集まりであり,酵素と非酵素とが多種多様な様相をなしている.これまでピリンの生体内での機能は不明であった.よって,もしピリンに結合する小分子化合物が得られたなら,それをピリンの役割を明らかにするバイオプローブとして使用し,ピリンが関与する生体内での代謝経路についてもより理解を深めることができるだろうと考えた.
スライドガラス1枚におよそ4000種の化合物を固定化した化合物アレイを作製し,カバーガラスをのせ,スライドガラスとカバーガラスとの隙間にRFPとピリンとの融合タンパク質を過剰発現させたHEK293T細胞抽出液を注入した.4℃で1時間反応させたのち,溶液で数回洗浄し,スキャナーでRFPの蛍光を検出した.RFPのみを過剰発現させた細胞抽出液を同様に処理した化合物アレイの図を対照とし,重ね合わせ提示法を行った.合計約2万種類の小分子化合物についてスクリーニングした結果,ピリンに特異的に結合する小分子化合物を発見し,3つのフェニル基をもつその構造的な特徴からこの小分子化合物をTPh A(Triphenyl compound A)とよぶことにした(図2).つぎに,このTPh Aの結合シグナルの確認と構造活性相関の解析のため,構造類縁体TPh Bととともに化合物アレイに固定化した.この化合物アレイにRFP-ピリン融合タンパク質を過剰発現したHEK293T細胞抽出液を処理したのちRFPの蛍光を検出したところ,TPh Aのスポットされている位置に強い蛍光シグナルがみられた.この蛍光シグナルは遊離のTPh Aにより濃度依存的に阻害されることもわかった.一方,TPh Bのスポットされている位置には有意なシグナルはみられなかった.そこで,TPh Bを陰性対照として使用する化合物とした.また,等温滴定微小カロリメトリーを用いて,TPh Aとピリンとの溶液内での結合定数は0.6μMであることも明らかにした.
2.ピリンとTPh Aとの共結晶
つぎに,ピリンとTPh Aとの結合様式を明らかにするため両者の共結晶化を試みた.その結果,X線結晶構造解析により両者の結合のようすを2.35Åの分解能で明らかにすることができた.ピリン単独の結晶構造は構造的に似たβバレルがむかいあった状態からなり,N末端のくぼみにFe2+を含んでいることがすでに知られていた7).今回の共結晶の構造解析により,TPh AはそのFe2+の存在するポケットにぴったりと入り込んで強く結合していることがわかった(図3a).とくに,TPh Aの末端部位であるS3位置のフェニル基は,Phe45,Ser65,Leu67,Met85,Met73からなるこのポケットの奥深い疎水性領域に挿入されていた(図3b).この領域の奥行きはS3位置のフェニル基によってぴったり充たされているため,TPh BのS3位置のフェニル基に存在する塩素原子の存在はMet85との立体的な衝突を生じさせることとなって,TPh Bは結合することができなくなったものと示唆された.
化合物アレイの技術が開発された当初は,化合物アレイを用いて物理的な相互作用を検出しても,得られるのはタンパク質の機能において重要ではない,たとえば,タンパク質の表面に結合するような機能に影響をあたえない小分子化合物がほとんどではないかという疑念がささやかれていた8).今回の実験結果は,化合物アレイにより見い出されたバイオプローブとタンパク質との結合位置を結晶化により特定したはじめての例である.TPh Aとピリンとの結合様式から,タンパク質構造の機能的に重要なポケットに奥深く入り込む小分子化合物を化合物アレイにより見い出せることがX線構造解析によって証明することができた.
3.TPh Aはメラノーマ細胞の遊走を阻害する
TPh Aの細胞にあたえる影響を確かめるため,いくつかの細胞においてピリンの発現量を比較したところ,ほかの細胞に比べてWM266-4細胞やSK-MEL-28細胞などのメラノーマ細胞で発現量の多いことがわかった.そこで,TPh Aが細胞の遊走に影響をあたえるかどうかを,WM266-4細胞の引っ掻きアッセイ法により調べた.その結果,WM266-4細胞の遊走がTPh Aにより濃度依存的に阻害されることがわかった.一方,陰性対照であるTPh Bでは同様な効果は観察できなかった.また,TPh Aにはこれらの培養細胞を殺す作用はほとんどみられなかった.このことから,ピリンは悪性メラノーマの運動に関与しているのではないかという仮説をたてた.siRNAによりピリンをノックダウンした細胞を用いた実験がTPh Aを処理した細胞と同じ結果となり,この仮説が正しいことを証明することができた.
今回の一連の実験は,化合物アレイを用いて機能未知のタンパク質のバイオプローブを取得し,それらの結合のようすを解明したうえで,タンパク質の機能を明らかにすることに成功したはじめての例となった.
おわりに
今回,ピリンのはじめてのバイオプローブであるTPh Aを発見し,X線結晶構造解析により両者の結合のようすを解明したことで,ピリンを分子レベルでより詳細に研究することが可能となった.これまで,ピリンの阻害剤は知られていなかったためその詳細な研究は進んでいなかったが,今回,ピリンが悪性メラノーマの運動を制御していることを明らかにしたことから,この成果を足掛かりに,別の細胞種でのはたらき,酵素活性の有無,生体内でのほかの役割,などの研究が進展していくと期待できる.また,化合物アレイを用いた小分子化合物スクリーニングの成功例は,世界的にみても数えるほどしか報告されておらず,とくに,機能が未知のタンパク質のバイオプローブを取得した例はほとんどない.化合物アレイを用いる大きな利点のひとつは,ピリンのように酵素活性や機能が不明であるタンパク質のバイオプローブの取得を可能にすることである.今回のこの実験結果から,機能がわからないため従来のスクリーニング法を断念していたタンパク質でも,化合物アレイ法を用いればバイオプローブの取得が可能であることを証明することができた.この技術を用いて,基礎研究や臨床試験までさまざまな段階でのブレークスルーとなる有用なバイオプローブがひとつでも多くみつかることを期待している.
文 献
- MacBeath, G., Koehler, A. N., Schreiber, S. L.: Printing small molecules as microarrays and detecting protein-ligand interactions en masse. J. Am. Chem. Soc., 121, 7967-7968 (1999)
- Kanoh, N., Kumashiro, S., Simizu, S. et al.: Immobilization of natural products on glass slides by using a photoaffinity reaction and the detection of protein-small-molecule interactions. Angew. Chem. Int. Ed. Engl., 42, 5584-5587 (2003)[PubMed]
- Bradner, J. E., McPherson, O. M, Mazitschek, R. et al.: A robust small-molecule microarray platform for screening cell lysates. Chem. Biol., 13, 493-504 (2006)[PubMed]
- Miyazaki, I., Simizu, S., Ichimiya, H. et al.: Robust and systematic drug screening method using chemical arrays and the protein library: identification of novel inhibitors of carbonic anhydrase II. Biosci. Biotechnol. Biochem., 72, 2739-2749 (2008)[PubMed]
- Wendler, W., Kremmer, E., Forster, R. et al.: Identification of pirin, a novel highly conserved nuclear protein. J. Biol. Chem., 272, 8482-8489 (1997)[PubMed]
- Dunwell, J., Culham, A., Carter, C. et al.: Evolution of functional diversity in the cupin superfamily. Trends Biochem. Sci., 26, 740-746 (2001)[PubMed]
- Pang, H., Bartlam, M., Zeng, Q. et al.: Crystal structure of human pirin: an iron-binding nuclear protein and transcription cofactor. J. Biol. Chem., 279, 1491-1498 (2004)[PubMed]
- He, X., Gerona-Navarro, G., Jaffrey, S.: Ligand discovery using small molecule microarrays. J. Pharmacol. Exp. Ther., 313, 1-7 (2005)[PubMed]
著者プロフィール
略歴:2003年 金沢大学大学院薬学研究科 修了,同年 大鵬薬品工業飯能研究所 研究員を経て,2006年より理化学研究所基幹研究所 研究生.
研究テーマ:化合物アレイを用いたケミカルバイオロジー.
長田 裕之(Hiroyuki Osada)
理化学研究所基幹研究所 施設長.
研究室URL:http://cbcore.riken.jp/ja.html
© 2010 宮崎 功・清水史郎・長田裕之 Licensed under CC 表示 2.1 日本