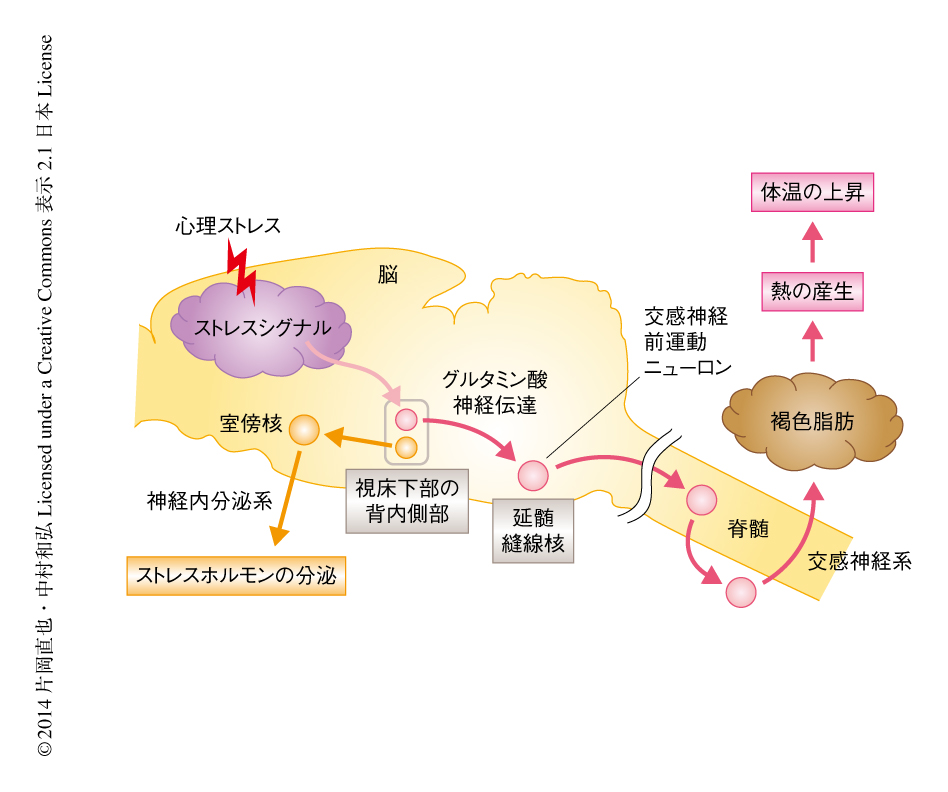
心理ストレスは視床下部の背内側部から延髄縫線核への神経伝達を活性化することにより褐色脂肪における熱の産生および体温の上昇を駆動する
片岡直也・中村和弘
(京都大学生命科学系キャリアパス形成ユニット)
email:中村和弘
DOI: 10.7875/first.author.2014.099
Psychological stress activates a dorsomedial hypothalamus-medullary raphe circuit driving brown adipose tissue thermogenesis and hyperthermia.
Naoya Kataoka, Hiroyuki Hioki, Takeshi Kaneko, Kazuhiro Nakamura
Cell Metabolism, 20, 346-358 (2014)
心理ストレスにより生じる体温の上昇は,多くの哺乳類において生じる基本的な自律性のストレス反応である.今回,筆者らは,視床下部から延髄にストレスシグナルを伝達する神経経路を同定し,これが褐色脂肪における熱の産生を駆動することによりストレス性の体温の上昇を惹起することを明らかにした.ラットの延髄縫線核あるいは視床下部の背内側部におけるニューロンの活動,あるいは,グルタミン酸作動性の神経伝達を阻害すると,心理ストレスにより生じる褐色脂肪における熱の産生および体温の上昇が抑制された.また,視床下部の背内側部においてストレスにより活性化される2種類のニューロンを見い出した.ひとつは延髄縫線核へ伝達することにより褐色脂肪における熱の産生を駆動し,もうひとつは視床下部の室傍核へ伝達することによりストレスホルモンを分泌させるものと推測された.さらに,光遺伝学の技術を用いて視床下部の背内側部から延髄縫線核への直接の神経伝達を特異的に刺激すると,ストレス反応に類似した熱の産生や心血管反応が惹起された.これらのことから,視床下部の背内側部から延髄縫線核への直接のグルタミン酸作動性の神経伝達が,ストレス性の体温の上昇や頻脈などの交感神経の反応を駆動することが示された.これらの知見は,ストレス性の自律生理反応の中枢における神経回路の理解にとどまらず,心因性発熱などストレス疾患の発症の基盤の解明にも寄与するものである.
ヒトを含む多くの哺乳類では,心理的なストレスをうけるとさまざまな自律生理反応が生じる.たとえば,体温,脈拍,血圧などが上昇するのは典型的なストレス性の自律生理反応である.なかでも,ストレス性の体温の上昇は,天敵に狙われるなど動物が生命の危機に瀕するストレス状況において,神経系や筋肉の温度を少し上昇させ身体能力を向上させることにより生存に有利にはたらくという生物学的な意義がある.しかし,現代の人間社会では,過剰な心理ストレスにより高体温が長い期間つづく“心因性発熱”の症状をうったえる患者が多く存在する1).“不明熱”と診断された患者の約半数が心因性発熱であったとの報告もある2).感染性の発熱とは異なり,心因性発熱は解熱剤が効かないため治療が困難となっている1).ストレス性の体温の上昇や心因性発熱には交感神経の出力を介した熱産生の亢進が大きく寄与し,そうしたストレス性の熱産生の反応を駆動するしくみは脳の神経回路にあるが,その実体はわかっていない.今回,筆者らは,人間関係のストレスに近い動物モデルである社会的敗北ストレスをラットにあたえ,それにより生じる交感神経性の熱の産生ならびに体温の上昇を駆動する脳の神経回路を解析した.
オスのWistarラットの体内にあらかじめ温度プローブを埋め込み,肩甲骨のあいだにある褐色脂肪組織の温度および腹腔の深部の体温を同時に計測した.このWistarラットを攻撃的なオスのLong-Evansラットのケージに入れると,Wistarラットは攻撃をうけ服従の姿勢を示すようになる.このような社会的敗北ストレスをうけたWistarラットにおいて褐色脂肪組織の温度は即座に2~3℃上昇し,深部の体温も少し遅れて2℃ほど上昇した.このストレス性の体温の上昇はβアドレナリン受容体の拮抗薬であるプロプラノロールの前投与により強く抑制された.褐色脂肪における熱の産生は褐色脂肪細胞の表面にあるβ3アドレナリン受容体を介した交感神経の刺激により惹起されることから3),社会的敗北ストレスにより褐色脂肪において交感神経性の熱の産生が惹起され,その熱により深部の体温の上昇がひき起こされたことが示された.
筆者らは,これまで,交感神経系を介して褐色脂肪組織へ熱産生の指令をおくる交感神経前運動ニューロンが延髄の縫線核に分布しており4),このニューロンが社会的敗北ストレスにより活性化することを報告していた5).そこで,延髄縫線核におけるニューロンの活性化がストレス性の熱の産生および体温の上昇において機能するかどうかを調べた.Wistarラットの延髄縫線核に神経活動の抑制剤であるムシモールを微量注入し,局所におけるニューロンの活動を抑制した状態で社会的敗北ストレスをあたえた.すると,ストレス性の褐色脂肪における熱の産生および体温の上昇は完全に消失した.また,延髄縫線核への興奮性の神経入力を阻害するため延髄縫線核にグルタミン酸受容体の拮抗薬を微量注入すると,ムシモールの場合と同様に,ストレス反応は大きく減弱した.このグルタミン酸受容体拮抗薬の注入は社会的敗北ストレスにより生じる脈拍の上昇も抑制したが,血圧の上昇は有意には抑制しなかった.これらの実験の結果から,ストレスシグナルがグルタミン酸作動性の興奮性のシグナルとして延髄縫線核に伝達されることにより,交感神経前運動ニューロンが活性化され,褐色脂肪組織や心臓への交感神経の出力が亢進し熱の産生や頻脈が惹起されると考えられた(図1).
興奮性のストレスシグナルを延髄縫線核に入力する上流の脳部位を探索するため,活性化したニューロンのマーカーであるFosの免疫組織染色と神経投射トレース法とを組み合わせた組織化学実験を行った.逆行性の神経投射のトレーサーであるコレラ毒素Bサブユニットを延髄縫線核に注入し,この部位へ軸索を投射するニューロンを標識したうえで,ラットに社会的敗北ストレスをあたえ脳組織を解析した.その結果,ストレスに反応して活性化し軸索を延髄縫線核へ投射するニューロンが視床下部の背内側部に密集して分布することが見い出された.また,視床下部の背内側部から順行性の神経投射をトレースしたところ,視床下部の背内側部に由来する軸索の終末が延髄縫線核の交感神経前運動ニューロンにシナプスを形成していることを示唆する所見が得られた.さらに,この神経終末はグルタミン酸作動性ニューロンのマーカーであるVGLUT2を含有していた.これらの所見は,視床下部の背内側部のニューロンがストレスシグナルをうけて活性化し,そのシグナルを延髄縫線核の交感神経前運動ニューロンに直接に伝達し,グルタミン酸作動性の神経伝達を介して前運動ニューロンを活性化することにより褐色脂肪への熱産生の指令を駆動することを示唆した(図1).
興味深いことに,視床下部の背内側部にはストレスにより活性化される別のニューロンも見い出された.このニューロンは神経内分泌系の出力の中枢である視床下部の室傍核に軸索を投射しており,ストレスシグナルを視床下部の背内側部から室傍核に伝達することによりストレスホルモンの分泌を駆動する機能を担うものと推測された.また,この視床下部の背内側部から室傍核へ投射するニューロンは,視床下部の背内側部でも腹側部に分布し,視床下部の背内側部の背側部に分布して延髄縫線核へ投射するニューロンとは異なるものであった.こうした所見から,視床下部の背内側部はストレス性の自律生理反応の駆動の中枢であり,延髄縫線核への出力を介して熱の産生や心血管反応などの交感神経の反応を駆動する一方,視床下部の室傍核への出力を介して神経内分泌系も駆動しストレスホルモンを分泌させると考えられた(図1).
視床下部の背内側部におけるニューロンの活性化がストレス性の褐色脂肪における熱の産生と体温の上昇において機能しているのかどうか調べるため,Wistarラットの視床下部の背内側部にムシモールを微量注入し,局所におけるニューロンの活動を抑制した状態で社会的敗北ストレスをあたえた.すると,ストレス性の褐色脂肪における熱の産生および体温の上昇が消失した.したがって,ストレス性の褐色脂肪における熱の産生および体温の上昇を駆動するうえで,ストレスシグナルによる視床下部の背内側部におけるニューロンの活性化が必要であることがわかった.
視床下部の背内側部から延髄縫線核への直接の神経伝達は,ストレスにより生じる交感神経の反応を駆動するのであろうか? この疑問に対する答えを見い出すため,視床下部の背内側部から延髄縫線核に軸索を投射するニューロンの神経終末だけを特異的に活性化する実験を行った.アデノ随伴ウイルスを視床下部の背内側部のニューロンに感染させ,光で活性化する陽イオンチャネルであるChIEFを発現させた.ChIEFを発現したニューロンに青色の光を照射すると細胞膜が脱分極し活動電位が生じる6).発現したChIEFは視床下部の背内側部のニューロンの細胞体から軸索をとおり,延髄縫線核の軸索の終末に輸送されることが確認された.そこで,ラットに麻酔をかけ延髄縫線核に光ファイバーを刺入して光を照射することにより,視床下部の背内側部に由来するChIEFを含有する軸索の終末だけを特異的に刺激した.すると,褐色脂肪組織における交感神経の活動および温度が上昇し,さらに,脈拍および血圧も上昇した.この光の照射による褐色脂肪における熱の産生の強度は,社会的敗北ストレスにより生じたものと同じ程度であった.一方,対照実験として,ChIEFの代わりに膜移行型GFPを視床下部の背内側部のニューロンに発現させて同様に光を照射したが,交感神経の反応は惹起されなかった.視床下部の背内側部においてChIEFを発現するニューロンの細胞体に光を照射したところ同様の交感神経の反応が生じたので,延髄縫線核にグルタミン酸受容体の拮抗薬を微量注入したところ,光の照射による褐色脂肪における熱の産生は完全に消失し,脈拍の上昇も抑制された.しかし,血圧の上昇は有意には抑制されなかった.こうした実験の結果から,視床下部の背内側部から延髄縫線核への直接のグルタミン酸作動性の神経伝達が褐色脂肪における熱の産生や頻脈を駆動することが示された(図1).
視床下部の背内側部の外側に位置する視床下部の外側野にはオレキシンニューロンが分布し,これらも延髄縫線核に投射することが知られている7).また,オレキシンニューロンがストレス性の体温の上昇に寄与するという報告もある8).そこで,視床下部の外側野のオレキシンニューロンを含むニューロンにChIEFを発現させ,これらのニューロンに由来する延髄縫線核の軸索の終末に光を照射したところ,褐色脂肪組織における交感神経の活動がわずかに上昇したものの,視床下部の背内側部に由来する軸索の終末に光を照射した場合に比べ非常に弱い反応であった.したがって,視床下部から延髄へむけたストレス性の熱産生シグナルの伝達は,おもに視床下部の背内側部から延髄縫線核へのグルタミン酸作動性の神経伝達が担っており,オレキシンニューロンはその神経伝達を増強するなど修飾的な役割を担っているものと考えられた.
この研究では,前脳のストレスシグナルが視床下部の背内側部から延髄縫線核への直接的なグルタミン酸作動性の神経経路をつうじて後脳に伝達され,それにより末梢への交感神経の出力が駆動されることが明らかになった(図1).この中枢神経の伝達は心理ストレスにより褐色脂肪における熱の産生および体温の上昇を生み出す重要なしくみであり,また,ストレス性の頻脈においても機能することがわかった.強度のストレスを長期にわたりうけたときにはこの神経伝達が過剰に亢進し,慢性的な心因性発熱やストレス性高血圧などのストレス疾患につながる可能性が示唆された.また,視床下部の背内側部は心理ストレスによる交感神経の反応だけでなく,視床下部の室傍核を介したストレスホルモンの分泌も駆動するとみられ,視床下部の背内側部がストレス性の自律生理反応の駆動の中枢として機能することが強く示唆された.今後,視床下部へストレスシグナルを入力する上流の神経回路の機構について解析を進め,“ストレス”とよばれるものの神経科学的な実態にせまりたい.
略歴:2009年 鳥取大学大学院連合農学研究科博士後期課程 修了,中部大学生命健康科学部 研究員を経て,2011年より京都大学生命科学系キャリアパス形成ユニット 特定研究員.
研究テーマ:ストレス性の体温の上昇にかかわる神経回路.
抱負:心理ストレスにかかわる神経回路を明らかにすることにより,ストレスが生命機能に及ぼす影響を解明していきたい.
中村 和弘(Kazuhiro Nakamura)
京都大学生命科学系キャリアパス形成ユニット 准教授.科学技術振興機構 さきがけ研究者 兼任.
研究室URL:http://www.cp.kyoto-u.ac.jp/Nakamura/nakamura-j.html
© 2014 片岡直也・中村和弘 Licensed under CC 表示 2.1 日本
(京都大学生命科学系キャリアパス形成ユニット)
email:中村和弘
DOI: 10.7875/first.author.2014.099
Psychological stress activates a dorsomedial hypothalamus-medullary raphe circuit driving brown adipose tissue thermogenesis and hyperthermia.
Naoya Kataoka, Hiroyuki Hioki, Takeshi Kaneko, Kazuhiro Nakamura
Cell Metabolism, 20, 346-358 (2014)
この論文に出現する遺伝子・タンパク質のUniprot ID
要 約
心理ストレスにより生じる体温の上昇は,多くの哺乳類において生じる基本的な自律性のストレス反応である.今回,筆者らは,視床下部から延髄にストレスシグナルを伝達する神経経路を同定し,これが褐色脂肪における熱の産生を駆動することによりストレス性の体温の上昇を惹起することを明らかにした.ラットの延髄縫線核あるいは視床下部の背内側部におけるニューロンの活動,あるいは,グルタミン酸作動性の神経伝達を阻害すると,心理ストレスにより生じる褐色脂肪における熱の産生および体温の上昇が抑制された.また,視床下部の背内側部においてストレスにより活性化される2種類のニューロンを見い出した.ひとつは延髄縫線核へ伝達することにより褐色脂肪における熱の産生を駆動し,もうひとつは視床下部の室傍核へ伝達することによりストレスホルモンを分泌させるものと推測された.さらに,光遺伝学の技術を用いて視床下部の背内側部から延髄縫線核への直接の神経伝達を特異的に刺激すると,ストレス反応に類似した熱の産生や心血管反応が惹起された.これらのことから,視床下部の背内側部から延髄縫線核への直接のグルタミン酸作動性の神経伝達が,ストレス性の体温の上昇や頻脈などの交感神経の反応を駆動することが示された.これらの知見は,ストレス性の自律生理反応の中枢における神経回路の理解にとどまらず,心因性発熱などストレス疾患の発症の基盤の解明にも寄与するものである.
はじめに
ヒトを含む多くの哺乳類では,心理的なストレスをうけるとさまざまな自律生理反応が生じる.たとえば,体温,脈拍,血圧などが上昇するのは典型的なストレス性の自律生理反応である.なかでも,ストレス性の体温の上昇は,天敵に狙われるなど動物が生命の危機に瀕するストレス状況において,神経系や筋肉の温度を少し上昇させ身体能力を向上させることにより生存に有利にはたらくという生物学的な意義がある.しかし,現代の人間社会では,過剰な心理ストレスにより高体温が長い期間つづく“心因性発熱”の症状をうったえる患者が多く存在する1).“不明熱”と診断された患者の約半数が心因性発熱であったとの報告もある2).感染性の発熱とは異なり,心因性発熱は解熱剤が効かないため治療が困難となっている1).ストレス性の体温の上昇や心因性発熱には交感神経の出力を介した熱産生の亢進が大きく寄与し,そうしたストレス性の熱産生の反応を駆動するしくみは脳の神経回路にあるが,その実体はわかっていない.今回,筆者らは,人間関係のストレスに近い動物モデルである社会的敗北ストレスをラットにあたえ,それにより生じる交感神経性の熱の産生ならびに体温の上昇を駆動する脳の神経回路を解析した.
1.社会的敗北ストレスは交感神経性の熱の産生および体温の上昇を惹起する
オスのWistarラットの体内にあらかじめ温度プローブを埋め込み,肩甲骨のあいだにある褐色脂肪組織の温度および腹腔の深部の体温を同時に計測した.このWistarラットを攻撃的なオスのLong-Evansラットのケージに入れると,Wistarラットは攻撃をうけ服従の姿勢を示すようになる.このような社会的敗北ストレスをうけたWistarラットにおいて褐色脂肪組織の温度は即座に2~3℃上昇し,深部の体温も少し遅れて2℃ほど上昇した.このストレス性の体温の上昇はβアドレナリン受容体の拮抗薬であるプロプラノロールの前投与により強く抑制された.褐色脂肪における熱の産生は褐色脂肪細胞の表面にあるβ3アドレナリン受容体を介した交感神経の刺激により惹起されることから3),社会的敗北ストレスにより褐色脂肪において交感神経性の熱の産生が惹起され,その熱により深部の体温の上昇がひき起こされたことが示された.
2.ストレス性の熱の産生および体温の上昇を駆動するには延髄縫線核へのストレスシグナルの入力が必要である
筆者らは,これまで,交感神経系を介して褐色脂肪組織へ熱産生の指令をおくる交感神経前運動ニューロンが延髄の縫線核に分布しており4),このニューロンが社会的敗北ストレスにより活性化することを報告していた5).そこで,延髄縫線核におけるニューロンの活性化がストレス性の熱の産生および体温の上昇において機能するかどうかを調べた.Wistarラットの延髄縫線核に神経活動の抑制剤であるムシモールを微量注入し,局所におけるニューロンの活動を抑制した状態で社会的敗北ストレスをあたえた.すると,ストレス性の褐色脂肪における熱の産生および体温の上昇は完全に消失した.また,延髄縫線核への興奮性の神経入力を阻害するため延髄縫線核にグルタミン酸受容体の拮抗薬を微量注入すると,ムシモールの場合と同様に,ストレス反応は大きく減弱した.このグルタミン酸受容体拮抗薬の注入は社会的敗北ストレスにより生じる脈拍の上昇も抑制したが,血圧の上昇は有意には抑制しなかった.これらの実験の結果から,ストレスシグナルがグルタミン酸作動性の興奮性のシグナルとして延髄縫線核に伝達されることにより,交感神経前運動ニューロンが活性化され,褐色脂肪組織や心臓への交感神経の出力が亢進し熱の産生や頻脈が惹起されると考えられた(図1).
3.視床下部の背内側部から延髄縫線核への直接の神経伝達がストレスにより活性化される
興奮性のストレスシグナルを延髄縫線核に入力する上流の脳部位を探索するため,活性化したニューロンのマーカーであるFosの免疫組織染色と神経投射トレース法とを組み合わせた組織化学実験を行った.逆行性の神経投射のトレーサーであるコレラ毒素Bサブユニットを延髄縫線核に注入し,この部位へ軸索を投射するニューロンを標識したうえで,ラットに社会的敗北ストレスをあたえ脳組織を解析した.その結果,ストレスに反応して活性化し軸索を延髄縫線核へ投射するニューロンが視床下部の背内側部に密集して分布することが見い出された.また,視床下部の背内側部から順行性の神経投射をトレースしたところ,視床下部の背内側部に由来する軸索の終末が延髄縫線核の交感神経前運動ニューロンにシナプスを形成していることを示唆する所見が得られた.さらに,この神経終末はグルタミン酸作動性ニューロンのマーカーであるVGLUT2を含有していた.これらの所見は,視床下部の背内側部のニューロンがストレスシグナルをうけて活性化し,そのシグナルを延髄縫線核の交感神経前運動ニューロンに直接に伝達し,グルタミン酸作動性の神経伝達を介して前運動ニューロンを活性化することにより褐色脂肪への熱産生の指令を駆動することを示唆した(図1).
興味深いことに,視床下部の背内側部にはストレスにより活性化される別のニューロンも見い出された.このニューロンは神経内分泌系の出力の中枢である視床下部の室傍核に軸索を投射しており,ストレスシグナルを視床下部の背内側部から室傍核に伝達することによりストレスホルモンの分泌を駆動する機能を担うものと推測された.また,この視床下部の背内側部から室傍核へ投射するニューロンは,視床下部の背内側部でも腹側部に分布し,視床下部の背内側部の背側部に分布して延髄縫線核へ投射するニューロンとは異なるものであった.こうした所見から,視床下部の背内側部はストレス性の自律生理反応の駆動の中枢であり,延髄縫線核への出力を介して熱の産生や心血管反応などの交感神経の反応を駆動する一方,視床下部の室傍核への出力を介して神経内分泌系も駆動しストレスホルモンを分泌させると考えられた(図1).
4.ストレス性の熱の産生および体温の上昇を駆動するには視床下部の背内側部におけるニューロンの活性化が必要である
視床下部の背内側部におけるニューロンの活性化がストレス性の褐色脂肪における熱の産生と体温の上昇において機能しているのかどうか調べるため,Wistarラットの視床下部の背内側部にムシモールを微量注入し,局所におけるニューロンの活動を抑制した状態で社会的敗北ストレスをあたえた.すると,ストレス性の褐色脂肪における熱の産生および体温の上昇が消失した.したがって,ストレス性の褐色脂肪における熱の産生および体温の上昇を駆動するうえで,ストレスシグナルによる視床下部の背内側部におけるニューロンの活性化が必要であることがわかった.
5.視床下部の背内側部から延髄縫線核への直接の神経伝達は褐色脂肪における熱の産生を含む交感神経の反応を駆動する
視床下部の背内側部から延髄縫線核への直接の神経伝達は,ストレスにより生じる交感神経の反応を駆動するのであろうか? この疑問に対する答えを見い出すため,視床下部の背内側部から延髄縫線核に軸索を投射するニューロンの神経終末だけを特異的に活性化する実験を行った.アデノ随伴ウイルスを視床下部の背内側部のニューロンに感染させ,光で活性化する陽イオンチャネルであるChIEFを発現させた.ChIEFを発現したニューロンに青色の光を照射すると細胞膜が脱分極し活動電位が生じる6).発現したChIEFは視床下部の背内側部のニューロンの細胞体から軸索をとおり,延髄縫線核の軸索の終末に輸送されることが確認された.そこで,ラットに麻酔をかけ延髄縫線核に光ファイバーを刺入して光を照射することにより,視床下部の背内側部に由来するChIEFを含有する軸索の終末だけを特異的に刺激した.すると,褐色脂肪組織における交感神経の活動および温度が上昇し,さらに,脈拍および血圧も上昇した.この光の照射による褐色脂肪における熱の産生の強度は,社会的敗北ストレスにより生じたものと同じ程度であった.一方,対照実験として,ChIEFの代わりに膜移行型GFPを視床下部の背内側部のニューロンに発現させて同様に光を照射したが,交感神経の反応は惹起されなかった.視床下部の背内側部においてChIEFを発現するニューロンの細胞体に光を照射したところ同様の交感神経の反応が生じたので,延髄縫線核にグルタミン酸受容体の拮抗薬を微量注入したところ,光の照射による褐色脂肪における熱の産生は完全に消失し,脈拍の上昇も抑制された.しかし,血圧の上昇は有意には抑制されなかった.こうした実験の結果から,視床下部の背内側部から延髄縫線核への直接のグルタミン酸作動性の神経伝達が褐色脂肪における熱の産生や頻脈を駆動することが示された(図1).
視床下部の背内側部の外側に位置する視床下部の外側野にはオレキシンニューロンが分布し,これらも延髄縫線核に投射することが知られている7).また,オレキシンニューロンがストレス性の体温の上昇に寄与するという報告もある8).そこで,視床下部の外側野のオレキシンニューロンを含むニューロンにChIEFを発現させ,これらのニューロンに由来する延髄縫線核の軸索の終末に光を照射したところ,褐色脂肪組織における交感神経の活動がわずかに上昇したものの,視床下部の背内側部に由来する軸索の終末に光を照射した場合に比べ非常に弱い反応であった.したがって,視床下部から延髄へむけたストレス性の熱産生シグナルの伝達は,おもに視床下部の背内側部から延髄縫線核へのグルタミン酸作動性の神経伝達が担っており,オレキシンニューロンはその神経伝達を増強するなど修飾的な役割を担っているものと考えられた.
おわりに
この研究では,前脳のストレスシグナルが視床下部の背内側部から延髄縫線核への直接的なグルタミン酸作動性の神経経路をつうじて後脳に伝達され,それにより末梢への交感神経の出力が駆動されることが明らかになった(図1).この中枢神経の伝達は心理ストレスにより褐色脂肪における熱の産生および体温の上昇を生み出す重要なしくみであり,また,ストレス性の頻脈においても機能することがわかった.強度のストレスを長期にわたりうけたときにはこの神経伝達が過剰に亢進し,慢性的な心因性発熱やストレス性高血圧などのストレス疾患につながる可能性が示唆された.また,視床下部の背内側部は心理ストレスによる交感神経の反応だけでなく,視床下部の室傍核を介したストレスホルモンの分泌も駆動するとみられ,視床下部の背内側部がストレス性の自律生理反応の駆動の中枢として機能することが強く示唆された.今後,視床下部へストレスシグナルを入力する上流の神経回路の機構について解析を進め,“ストレス”とよばれるものの神経科学的な実態にせまりたい.
文 献
- Oka, T. & Oka, K.: Mechanisms of psychogenic fever. Adv. Neuroimmune Biol., 3, 3-17 (2012)
- Nozu, T. & Uehara, A.: The diagnoses and outcomes of patients complaining of fever without any abnormal findings on diagnostic tests. Intern. Med., 44, 901-902 (2005)[PubMed]
- Cannon, B. & Nedergaard, J.: Brown adipose tissue: function and physiological significance. Physiol. Rev., 84, 277-359 (2004)[PubMed]
- Nakamura, K., Matsumura, K., Hubschle, T. et al.: Identification of sympathetic premotor neurons in medullary raphe regions mediating fever and other thermoregulatory functions. J. Neurosci., 24, 5370-5380 (2004)[PubMed]
- Lkhagvasuren, B., Nakamura, Y., Oka, T. et al.: Social defeat stress induces hyperthermia through activation of thermoregulatory sympathetic premotor neurons in the medullary raphe region. Eur. J. Neurosci., 34, 1442-1452 (2011)[PubMed]
- Lin, J. Y., Lin, M. Z., Steinbach, P. et al.: Characterization of engineered channelrhodopsin variants with improved propertiesand kinetics. Biophys. J., 96, 1803-1814 (2009)[PubMed]
- Berthoud, H. R., Patterson, L. M., Sutton, G. M. et al.: Orexin inputs to caudal raphe neurons involved in thermal, cardiovascular, and gastrointestinal regulation. Histochem. Cell Biol., 123, 147-156 (2005)[PubMed]
- Zhang, W., Sunanaga, J., Takahashi, Y. et al.: Orexin neurons are indispensable for stress-induced thermogenesis in mice. J. Physiol., 588, 4117-4129 (2010)[PubMed]
著者プロフィール
略歴:2009年 鳥取大学大学院連合農学研究科博士後期課程 修了,中部大学生命健康科学部 研究員を経て,2011年より京都大学生命科学系キャリアパス形成ユニット 特定研究員.
研究テーマ:ストレス性の体温の上昇にかかわる神経回路.
抱負:心理ストレスにかかわる神経回路を明らかにすることにより,ストレスが生命機能に及ぼす影響を解明していきたい.
中村 和弘(Kazuhiro Nakamura)
京都大学生命科学系キャリアパス形成ユニット 准教授.科学技術振興機構 さきがけ研究者 兼任.
研究室URL:http://www.cp.kyoto-u.ac.jp/Nakamura/nakamura-j.html
© 2014 片岡直也・中村和弘 Licensed under CC 表示 2.1 日本