キネトコアの形成を促進する分子スイッチ
堀 哲也・商 維昊・深川竜郎
(国立遺伝学研究所 分子遺伝研究部門)
email:堀 哲也,商 維昊,深川竜郎
DOI: 10.7875/first.author.2014.096
Histone H4 Lys 20 monomethylation of the CENP-A nucleosome is essential for kinetochore assembly.
Tetsuya Hori, Wei-Hao Shang, Atsushi Toyoda, Sadahiko Misu, Norikazu Monma, Kazuho Ikeo, Oscar Molina, Giulia Vargiu, Asao Fujiyama, Hiroshi Kimura, William C. Earnshaw, Tatsuo Fukagawa
Developmental Cell, 29, 740-749 (2014)
染色体が娘細胞に正確に分配されるためには,複数のタンパク質がセントロメアとよばれるゲノムDNAの領域に集合し,キネトコアという構造を形成しなければならない.たいていの真核生物では,1本の染色体に1カ所のセントロメアが規定されるが,このセントロメア領域の規定はDNAの配列情報によらないエピジェネティックな分子機構によることが知られている.このセントロメア領域の規定において重要なはたらきを担うのが,セントロメアに特異的に存在するヒストンH3のバリアントであるCENP-Aである.CENP-Aが重要であることは明白であるが,CENP-Aがセントロメアに取り込まれたのち,どのような制御によりキネトコアが形成されるのかについては未知な点が多かった.この研究では,CENP-Aを含むヌクレオソームにおいてヒストンH4のLys20がモノメチル化されることを見い出した.さらに,ゲノム工学を駆使してヒストンH4のLys20のモノメチル化の意義について解析した結果,セントロメア領域におけるこのメチル化修飾がキネトコアの形成を促進する分子スイッチとして機能していることが明らかにされた.
生物のすべてのゲノムの情報は染色体に担われており,染色体は細胞周期の過程において正確に複製されて分配される必要がある.染色体の複製や分配の異常は染色体の不正確な伝達をひき起こす(染色体の不安定性).その結果,正常でない染色体をもつ細胞には細胞死やがん化が起こる.したがって,正常な染色体の分配を保障する分子機構を解明することは,基礎生物学および医科学の両面から重要である.
染色体は細胞周期のS期において複製され,M期において両方の極から延びた紡錘体にとらえられて娘細胞へと分配される.この染色体の分配において,紡錘体は染色体にある特殊な構造と強固に結合する必要がある.この構造はキネトコア(動原体)とよばれ,染色体のセントロメア領域に形成される.興味深いことに,キネトコアが形成されるセントロメア領域のDNA配列に特異性はなく,セントロメア領域はエピジェネティックな分子機構により規定されると考えられている1).すなわち,どのようなDNA配列もセントロメア領域としての機能を獲得しうるが,いったん,その領域がセントロメアになると次世代の細胞にもその情報は安定に受け継がれてゆく.これまでの多くの研究から,セントロメア領域の規定に関与するエピジェネティックなマーカーとして,ヒストンH3のバリアントであるCENP-Aが有力な候補であると考えられている1,2).セントロメアがどのようなDNA配列から構成されていても,すべてのセントロメアには必ずCENP-Aが存在するので,CENP-Aがセントロメア領域の規定に重要なはたらきを担うことはまちがいない.その一方で,一部の生物を除き3),CENP-Aのみで機能的なキネトコアの構造を形成することはかなり困難である4).したがって,CENP-Aが取り込まれたのちにキネトコアの形成を促進する制御機構の存在することが予想される.
この研究では,CENP-Aが取り込まれたのちに起こるクロマチンの修飾に注目した.その結果,セントロメア領域にはヒストンH4のLys20のモノメチル化が存在すること,このメチル化修飾はCENP-Aを含むヌクレオソームにおいて起こること,このメチル化修飾を欠失させるとキネトコアの集合に異常が生じることを見い出した.これらの結果より,CENP-Aを含むヌクレオソームにおいて起こるヒストンH4のLys20のモノメチル化がキネトコアの形成を促進する分子スイッチになるというモデルを提出した.
一般に,セントロメアを構成するゲノムの領域はくり返し配列から構成されている.この性質がセントロメア領域の詳細なゲノム解析を遅らせている原因である.たとえばヒトのセントロメア領域には,171 bpのαサテライトとよばれる配列を1ユニットとしてこの配列が何回もくり返して存在しており,最終的にメガ塩基対ほどの長さになっている.現在のゲノム解析の技術では,このような高度なくり返し配列を正確につなぎあわせて全体の配列を明らかにすることはきわめて困難である.このような事情から,たとえ全ゲノム塩基配列が決定されたといわれている生物種であっても,データベースに収載されたゲノム配列情報からは高度なくり返し構造をもつセントロメア領域の情報は除かれている.これまでの知見から,実際にキネトコアの形成される領域はこの長大なくり返し配列のごく一部であることがわかっている.しかし,実際にくり返し配列のどこにキネトコアが形成されているのかを特定することは,DNA配列が同じであることから容易ではない.
近年,あるタンパク質と結合するDNA配列を同定する方法として,対象となるタンパク質に対する抗体を用いて免疫沈降を行い,共沈降してくるDNAの配列を次世代シークエンサーにより解析してゲノム配列にマッピングする,クロマチン免疫沈降-シークエンシング法(ChIP-seq法)がよく活用されている.セントロメアタンパク質に対する抗体を用いて免疫沈降を行うと,セントロメア領域を構成するくり返し配列のDNAが回収される.しかし,このくり返し配列のDNA配列を解読してゲノム配列にマッピングしようとしても,さきの理由により正確にはマッピングできない.
一般に,クロマチンの修飾としてはヒストンの修飾がよく知られており,各種のヒストン修飾がさまざまな生命現象を制御していることが知られている5).セントロメア領域の機能の制御がある種のヒストン修飾により行われている可能性の高いことは予想されたものの,各種のヒストン修飾に対する抗体を用いてChIP-seq法を行ってもヒストン修飾の位置をくり返し配列を含むセントロメア領域に正確にマッピングすることは困難であり,セントロメア領域においてどのようなヒストン修飾が起こっているのかを知ることは不可能であった.
これまで,筆者らの研究室では,ニワトリの細胞を対象にセントロメア領域の詳細なゲノム解析を行い,ニワトリには,くり返し配列から構成されるセントロメアをもつ染色体と,くり返し配列をもたないセントロメアから構成される染色体とが存在することを見い出していた6).驚くべきことに,くり返し配列をもたないセントロメアを含むニワトリのZ染色体,第5染色体,第27染色体を解析したところ,セントロメアの大きさは3本の染色体に共通して40 kb程度であった6).さらに,このくり返し配列をもたないセントロメアを対象として,ニワトリDT40細胞においてセントロメアを取り除くことにも成功していた.たいていの細胞はセントロメアを取り除くと染色体の分配に遅延をひき起こして死滅してしまうが,そのなかから生存してくる細胞を選別して解析した.その結果,生存した細胞ではセントロメアを取り除いた染色体の別の場所に新しいセントロメア(ネオセントロメア)が形成されていることが明らかになった7).これらのネオセントロメアを詳細に解析したところ,くり返し配列のない40 kb程度の領域に新たにセントロメアが形成されていた.このくり返し配列をもたないセントロメアは,セントロメアに特異的なヒストン修飾を見い出すためにすぐれた材料であると考えられた.この研究では,これらくり返し配列をもたないセントロメアを対象として,セントロメアに特異的なヒストン修飾を探索した.
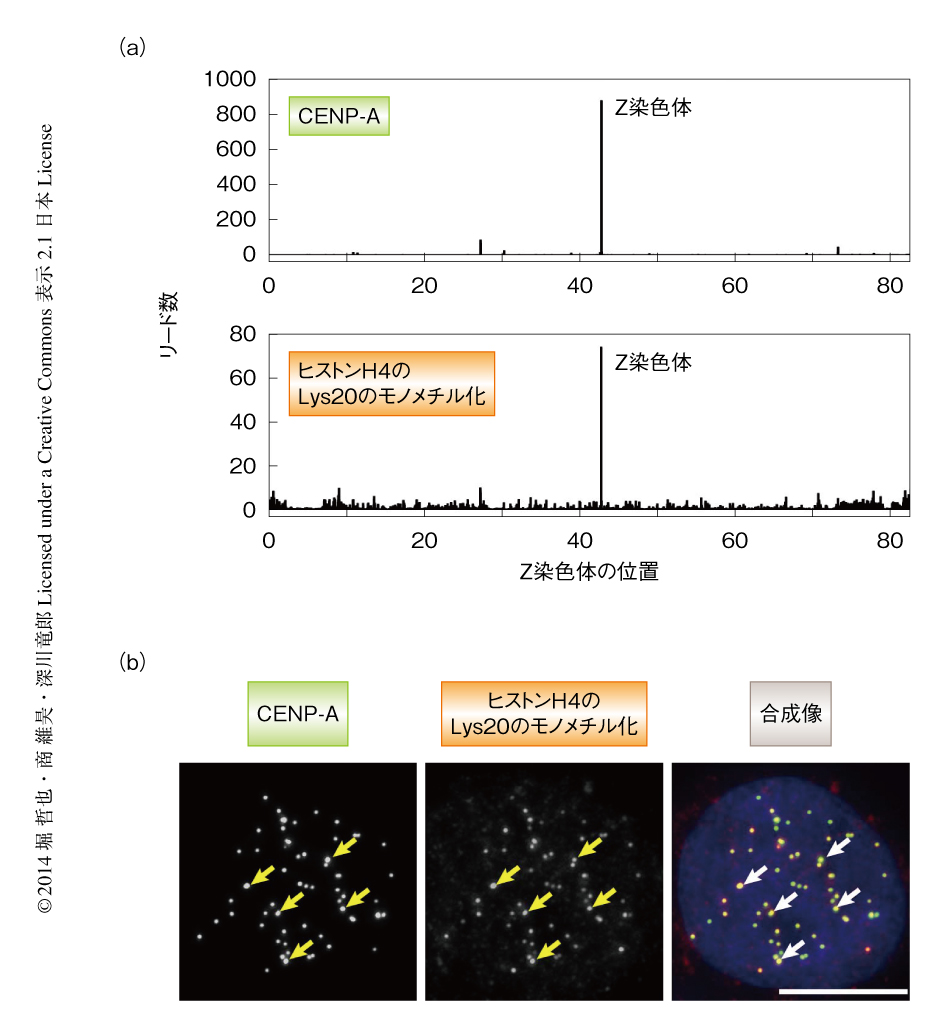
各種のヒストン修飾を認識する約20種類の抗体を用いてChIP-seq法を行ない,セントロメアに特異的なヒストン修飾を探索した.その結果,ヒストンH4のLys20のモノメチル化を特異的に認識する抗体によるChIP-seqプロファイルと,セントロメアタンパク質であるCENP-Aに対する抗体によるChIP-seqプロファイルがきわめて類似していることが判明した(図1a).また,これらの抗体を用いて免疫染色を行うと,ニワトリの細胞だけなくヒトの細胞においても,くり返し配列を含むすべてのセントロメアにおいてヒストンH4のLys20のモノメチル化の存在を示すシグナルが検出された(図1b).これらChIP-seq法および抗体染色法の結果から,セントロメア領域にはLys20がモノメチル化されたヒストンH4が濃縮されていることが明らかになった.
これまで,ヒストンH4のLys20のモノメチル化は転写の制御にかかわることが知られており,実際に,筆者らの研究においても,セントロメア領域以外のさまざま遺伝子の領域においてこのメチル化修飾は濃縮されていた.しかしながら,これらの遺伝子の領域にはCENP-Aは濃縮されていなかった.さらに,ヒストンH4のLys20にモノメチル化を導入する酵素であるprSET7を非セントロメア領域に局在させたところ,その領域にこのメチル化修飾の濃縮は見い出せたもののCENP-Aの集積は確認できなかった.つまり,セントロメア領域にはまずCENP-Aが集積し,そのうえでヒストンH4のLys20のモノメチル化の起こることが示唆された.
CENP-AはヒストンH3のバリアントのひとつであり,ヒストンH2A,ヒストンH2B,ヒストンH4と複合体を形成してDNAとともにヌクレオソームを形成すると考えられている.CENP-Aを含むヌクレオソームが,通常のヒストンH3を含むヌクレオソームと同様にヒストン八量体の構造をとるのか,それとも,別の構造をとるのかという点については多くの議論があるが1,2),CENP-Aがほかのヒストンとともにヌクレオソームを形成することはまちがいない.一方で,セントロメア領域にはCENP-Aを含むヌクレオソームにくわえ,ヒストンH3を含むヌクレオソームも多く存在している8).そこで,セントロメア領域において検出されたヒストンH4のLys20のモノメチル化が,CENP-Aを含むヌクレオソームにおいて起こっているのか,それとも,ヒストンH3を含むヌクレオソームにおいて起こっているのかを解析することはきわめて重要である.生化学的な手法によりCENP-Aを含むヌクレオソームとヒストンH3を含むヌクレオソームとを分画して解析した結果,ヒストンH4のLys20のモノメチル化はおもにCENP-Aを含むヌクレオソームにおいて起こっていることが明らかになった.
ヒストンH4のLys20のモノメチル化がキネトコアの形成にどのようにかかわっているかについて細胞レベルで解析した.この解析のため,ゲノム工学を用いた新しい実験系を構築した.ヒストンH4のLys20のモノメチル化はセントロメア領域だけでなくゲノムのほかの領域でも起こり,これまで,さまざまな生命現象への関与が指摘されていたことから,単純にゲノムの全体でこのメチル化修飾のレベルを低下させると細胞が死滅してしまい,セントロメア領域への直接的な影響を解析できない可能性があると考えられた.そこで,ヒストンH4のLys20のモノメチル化に対する脱メチル化酵素であるPHF8をセントロメアタンパク質CENP-Uと融合させ,CENP-Uの性質によりこの融合タンパク質をセントロメア領域に強制的に局在させた.その結果,セントロメア領域のヒストンH4のLys20のモノメチル化のレベルを人為的に低下させることに成功した.セントロメア領域においてヒストンH4のLys20のモノメチル化のレベルを低下させた細胞では,CENP-Aは存在していたが,CENP-HやCENP-Tといったキネトコアの形成に必須なタンパク質8) の局在が大きく減少していた.さらに,これらの細胞では染色体の整列の異常や細胞分裂の異常が高頻度に観察された.これらの実験により,ヒストンH4のLys20のモノメチル化は機能的なキネトコアの形成に必須であると結論された.
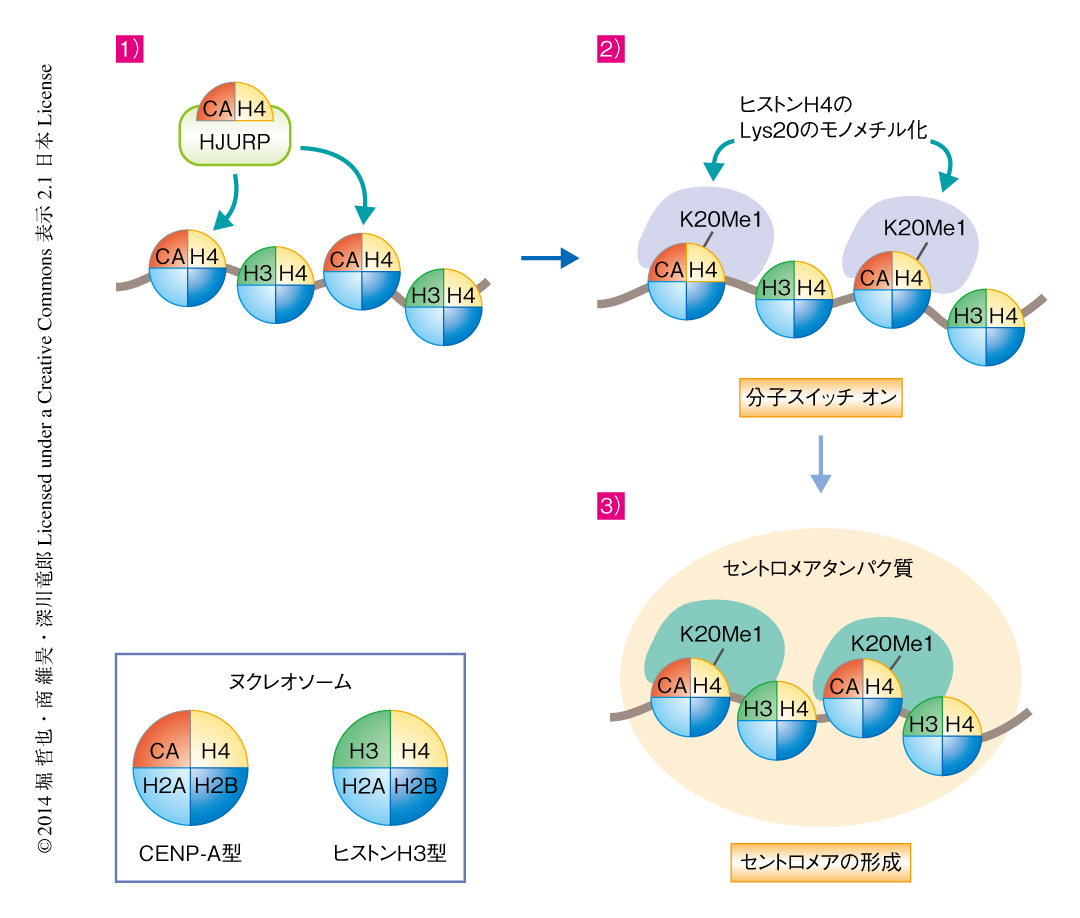
ここまでのゲノム解析,生化学的な実験,ゲノム工学を活用した細胞生物学的な手法の結果から,セントロメア領域にCENP-Aが取り込まれたのち,CENP-Aを含むヌクレオソームにおいてヒストンH4のLys20がモノメチル化され,このメチル化修飾はCENP-TやCENP-Hの集合を促進するための分子スイッチとしてはたらき,その結果,機能的なキネトコアが形成される,というモデルが提出された(図2).
最近の研究から,セントロメアあるいはキネトコアの形成においてCENP-Aが重要であることは明白である.したがって,セントロメアの研究分野においては,CENP-Aがどのようにセントロメアに取り込まれるかという分子機構を明らかにしようとする研究が主流である9,10).これらの研究からは,セントロメア領域のクロマチンはG1期のまえにMis18複合体というタンパク質複合体によりライセンス化され,CENP-AはHJURPという特異的なヒストンシャペロンによりセントロメア領域に取り込まれることが明らかになっている9,10).しかしながら,CENP-Aが取り込まれるだけではキネトコアの形成は十分には起こらない.今回の研究から,CENP-Aを含むヌクレオソームにおいてヒストンH4のLys20がモノメチル化するという仕上げの分子スイッチがオンになることにより,キネトコアの形成が促進されることが明らかになった.今後は,ヒストンH4のLys20のモノメチル化がどのようにキネトコアの形成を促進させるのかという分子機構の理解をめざしたい.
略歴:2000年 東北大学大学院農学研究科 修了,国立遺伝学研究所 特任研究員を経て,2009年より同 助教.
研究テーマ:セントロメアの形成の分子機構.
関心事:セントロメアの機能と“核酸”との未知の関係.
商 維昊(Wei-Hao Shang)
国立遺伝学研究所 特任研究員.
深川 竜郎(Tatsuo Fukagawa)
国立遺伝学研究所 教授.
研究室URL:http://www.nig.ac.jp/labs/MolGene/index_j.html
© 2014 堀 哲也・商 維昊・深川竜郎 Licensed under CC 表示 2.1 日本
(国立遺伝学研究所 分子遺伝研究部門)
email:堀 哲也,商 維昊,深川竜郎
DOI: 10.7875/first.author.2014.096
Histone H4 Lys 20 monomethylation of the CENP-A nucleosome is essential for kinetochore assembly.
Tetsuya Hori, Wei-Hao Shang, Atsushi Toyoda, Sadahiko Misu, Norikazu Monma, Kazuho Ikeo, Oscar Molina, Giulia Vargiu, Asao Fujiyama, Hiroshi Kimura, William C. Earnshaw, Tatsuo Fukagawa
Developmental Cell, 29, 740-749 (2014)
要 約
染色体が娘細胞に正確に分配されるためには,複数のタンパク質がセントロメアとよばれるゲノムDNAの領域に集合し,キネトコアという構造を形成しなければならない.たいていの真核生物では,1本の染色体に1カ所のセントロメアが規定されるが,このセントロメア領域の規定はDNAの配列情報によらないエピジェネティックな分子機構によることが知られている.このセントロメア領域の規定において重要なはたらきを担うのが,セントロメアに特異的に存在するヒストンH3のバリアントであるCENP-Aである.CENP-Aが重要であることは明白であるが,CENP-Aがセントロメアに取り込まれたのち,どのような制御によりキネトコアが形成されるのかについては未知な点が多かった.この研究では,CENP-Aを含むヌクレオソームにおいてヒストンH4のLys20がモノメチル化されることを見い出した.さらに,ゲノム工学を駆使してヒストンH4のLys20のモノメチル化の意義について解析した結果,セントロメア領域におけるこのメチル化修飾がキネトコアの形成を促進する分子スイッチとして機能していることが明らかにされた.
はじめに
生物のすべてのゲノムの情報は染色体に担われており,染色体は細胞周期の過程において正確に複製されて分配される必要がある.染色体の複製や分配の異常は染色体の不正確な伝達をひき起こす(染色体の不安定性).その結果,正常でない染色体をもつ細胞には細胞死やがん化が起こる.したがって,正常な染色体の分配を保障する分子機構を解明することは,基礎生物学および医科学の両面から重要である.
染色体は細胞周期のS期において複製され,M期において両方の極から延びた紡錘体にとらえられて娘細胞へと分配される.この染色体の分配において,紡錘体は染色体にある特殊な構造と強固に結合する必要がある.この構造はキネトコア(動原体)とよばれ,染色体のセントロメア領域に形成される.興味深いことに,キネトコアが形成されるセントロメア領域のDNA配列に特異性はなく,セントロメア領域はエピジェネティックな分子機構により規定されると考えられている1).すなわち,どのようなDNA配列もセントロメア領域としての機能を獲得しうるが,いったん,その領域がセントロメアになると次世代の細胞にもその情報は安定に受け継がれてゆく.これまでの多くの研究から,セントロメア領域の規定に関与するエピジェネティックなマーカーとして,ヒストンH3のバリアントであるCENP-Aが有力な候補であると考えられている1,2).セントロメアがどのようなDNA配列から構成されていても,すべてのセントロメアには必ずCENP-Aが存在するので,CENP-Aがセントロメア領域の規定に重要なはたらきを担うことはまちがいない.その一方で,一部の生物を除き3),CENP-Aのみで機能的なキネトコアの構造を形成することはかなり困難である4).したがって,CENP-Aが取り込まれたのちにキネトコアの形成を促進する制御機構の存在することが予想される.
この研究では,CENP-Aが取り込まれたのちに起こるクロマチンの修飾に注目した.その結果,セントロメア領域にはヒストンH4のLys20のモノメチル化が存在すること,このメチル化修飾はCENP-Aを含むヌクレオソームにおいて起こること,このメチル化修飾を欠失させるとキネトコアの集合に異常が生じることを見い出した.これらの結果より,CENP-Aを含むヌクレオソームにおいて起こるヒストンH4のLys20のモノメチル化がキネトコアの形成を促進する分子スイッチになるというモデルを提出した.
1.通常のセントロメアに対するゲノム解析は困難である
一般に,セントロメアを構成するゲノムの領域はくり返し配列から構成されている.この性質がセントロメア領域の詳細なゲノム解析を遅らせている原因である.たとえばヒトのセントロメア領域には,171 bpのαサテライトとよばれる配列を1ユニットとしてこの配列が何回もくり返して存在しており,最終的にメガ塩基対ほどの長さになっている.現在のゲノム解析の技術では,このような高度なくり返し配列を正確につなぎあわせて全体の配列を明らかにすることはきわめて困難である.このような事情から,たとえ全ゲノム塩基配列が決定されたといわれている生物種であっても,データベースに収載されたゲノム配列情報からは高度なくり返し構造をもつセントロメア領域の情報は除かれている.これまでの知見から,実際にキネトコアの形成される領域はこの長大なくり返し配列のごく一部であることがわかっている.しかし,実際にくり返し配列のどこにキネトコアが形成されているのかを特定することは,DNA配列が同じであることから容易ではない.
近年,あるタンパク質と結合するDNA配列を同定する方法として,対象となるタンパク質に対する抗体を用いて免疫沈降を行い,共沈降してくるDNAの配列を次世代シークエンサーにより解析してゲノム配列にマッピングする,クロマチン免疫沈降-シークエンシング法(ChIP-seq法)がよく活用されている.セントロメアタンパク質に対する抗体を用いて免疫沈降を行うと,セントロメア領域を構成するくり返し配列のDNAが回収される.しかし,このくり返し配列のDNA配列を解読してゲノム配列にマッピングしようとしても,さきの理由により正確にはマッピングできない.
一般に,クロマチンの修飾としてはヒストンの修飾がよく知られており,各種のヒストン修飾がさまざまな生命現象を制御していることが知られている5).セントロメア領域の機能の制御がある種のヒストン修飾により行われている可能性の高いことは予想されたものの,各種のヒストン修飾に対する抗体を用いてChIP-seq法を行ってもヒストン修飾の位置をくり返し配列を含むセントロメア領域に正確にマッピングすることは困難であり,セントロメア領域においてどのようなヒストン修飾が起こっているのかを知ることは不可能であった.
2.ニワトリにはくり返し配列をもたないセントロメアがある
これまで,筆者らの研究室では,ニワトリの細胞を対象にセントロメア領域の詳細なゲノム解析を行い,ニワトリには,くり返し配列から構成されるセントロメアをもつ染色体と,くり返し配列をもたないセントロメアから構成される染色体とが存在することを見い出していた6).驚くべきことに,くり返し配列をもたないセントロメアを含むニワトリのZ染色体,第5染色体,第27染色体を解析したところ,セントロメアの大きさは3本の染色体に共通して40 kb程度であった6).さらに,このくり返し配列をもたないセントロメアを対象として,ニワトリDT40細胞においてセントロメアを取り除くことにも成功していた.たいていの細胞はセントロメアを取り除くと染色体の分配に遅延をひき起こして死滅してしまうが,そのなかから生存してくる細胞を選別して解析した.その結果,生存した細胞ではセントロメアを取り除いた染色体の別の場所に新しいセントロメア(ネオセントロメア)が形成されていることが明らかになった7).これらのネオセントロメアを詳細に解析したところ,くり返し配列のない40 kb程度の領域に新たにセントロメアが形成されていた.このくり返し配列をもたないセントロメアは,セントロメアに特異的なヒストン修飾を見い出すためにすぐれた材料であると考えられた.この研究では,これらくり返し配列をもたないセントロメアを対象として,セントロメアに特異的なヒストン修飾を探索した.
3.セントロメアにはヒストンH4のLys20のモノメチル化が存在する
各種のヒストン修飾を認識する約20種類の抗体を用いてChIP-seq法を行ない,セントロメアに特異的なヒストン修飾を探索した.その結果,ヒストンH4のLys20のモノメチル化を特異的に認識する抗体によるChIP-seqプロファイルと,セントロメアタンパク質であるCENP-Aに対する抗体によるChIP-seqプロファイルがきわめて類似していることが判明した(図1a).また,これらの抗体を用いて免疫染色を行うと,ニワトリの細胞だけなくヒトの細胞においても,くり返し配列を含むすべてのセントロメアにおいてヒストンH4のLys20のモノメチル化の存在を示すシグナルが検出された(図1b).これらChIP-seq法および抗体染色法の結果から,セントロメア領域にはLys20がモノメチル化されたヒストンH4が濃縮されていることが明らかになった.
これまで,ヒストンH4のLys20のモノメチル化は転写の制御にかかわることが知られており,実際に,筆者らの研究においても,セントロメア領域以外のさまざま遺伝子の領域においてこのメチル化修飾は濃縮されていた.しかしながら,これらの遺伝子の領域にはCENP-Aは濃縮されていなかった.さらに,ヒストンH4のLys20にモノメチル化を導入する酵素であるprSET7を非セントロメア領域に局在させたところ,その領域にこのメチル化修飾の濃縮は見い出せたもののCENP-Aの集積は確認できなかった.つまり,セントロメア領域にはまずCENP-Aが集積し,そのうえでヒストンH4のLys20のモノメチル化の起こることが示唆された.
4.ヒストンH4のLys20のモノメチル化はCENP-Aヌクレオソームにおいて起こる
CENP-AはヒストンH3のバリアントのひとつであり,ヒストンH2A,ヒストンH2B,ヒストンH4と複合体を形成してDNAとともにヌクレオソームを形成すると考えられている.CENP-Aを含むヌクレオソームが,通常のヒストンH3を含むヌクレオソームと同様にヒストン八量体の構造をとるのか,それとも,別の構造をとるのかという点については多くの議論があるが1,2),CENP-Aがほかのヒストンとともにヌクレオソームを形成することはまちがいない.一方で,セントロメア領域にはCENP-Aを含むヌクレオソームにくわえ,ヒストンH3を含むヌクレオソームも多く存在している8).そこで,セントロメア領域において検出されたヒストンH4のLys20のモノメチル化が,CENP-Aを含むヌクレオソームにおいて起こっているのか,それとも,ヒストンH3を含むヌクレオソームにおいて起こっているのかを解析することはきわめて重要である.生化学的な手法によりCENP-Aを含むヌクレオソームとヒストンH3を含むヌクレオソームとを分画して解析した結果,ヒストンH4のLys20のモノメチル化はおもにCENP-Aを含むヌクレオソームにおいて起こっていることが明らかになった.
5.ヒストンH4のLys20のモノメチル化はキネトコアの形成に必須である
ヒストンH4のLys20のモノメチル化がキネトコアの形成にどのようにかかわっているかについて細胞レベルで解析した.この解析のため,ゲノム工学を用いた新しい実験系を構築した.ヒストンH4のLys20のモノメチル化はセントロメア領域だけでなくゲノムのほかの領域でも起こり,これまで,さまざまな生命現象への関与が指摘されていたことから,単純にゲノムの全体でこのメチル化修飾のレベルを低下させると細胞が死滅してしまい,セントロメア領域への直接的な影響を解析できない可能性があると考えられた.そこで,ヒストンH4のLys20のモノメチル化に対する脱メチル化酵素であるPHF8をセントロメアタンパク質CENP-Uと融合させ,CENP-Uの性質によりこの融合タンパク質をセントロメア領域に強制的に局在させた.その結果,セントロメア領域のヒストンH4のLys20のモノメチル化のレベルを人為的に低下させることに成功した.セントロメア領域においてヒストンH4のLys20のモノメチル化のレベルを低下させた細胞では,CENP-Aは存在していたが,CENP-HやCENP-Tといったキネトコアの形成に必須なタンパク質8) の局在が大きく減少していた.さらに,これらの細胞では染色体の整列の異常や細胞分裂の異常が高頻度に観察された.これらの実験により,ヒストンH4のLys20のモノメチル化は機能的なキネトコアの形成に必須であると結論された.
おわりに
ここまでのゲノム解析,生化学的な実験,ゲノム工学を活用した細胞生物学的な手法の結果から,セントロメア領域にCENP-Aが取り込まれたのち,CENP-Aを含むヌクレオソームにおいてヒストンH4のLys20がモノメチル化され,このメチル化修飾はCENP-TやCENP-Hの集合を促進するための分子スイッチとしてはたらき,その結果,機能的なキネトコアが形成される,というモデルが提出された(図2).
最近の研究から,セントロメアあるいはキネトコアの形成においてCENP-Aが重要であることは明白である.したがって,セントロメアの研究分野においては,CENP-Aがどのようにセントロメアに取り込まれるかという分子機構を明らかにしようとする研究が主流である9,10).これらの研究からは,セントロメア領域のクロマチンはG1期のまえにMis18複合体というタンパク質複合体によりライセンス化され,CENP-AはHJURPという特異的なヒストンシャペロンによりセントロメア領域に取り込まれることが明らかになっている9,10).しかしながら,CENP-Aが取り込まれるだけではキネトコアの形成は十分には起こらない.今回の研究から,CENP-Aを含むヌクレオソームにおいてヒストンH4のLys20がモノメチル化するという仕上げの分子スイッチがオンになることにより,キネトコアの形成が促進されることが明らかになった.今後は,ヒストンH4のLys20のモノメチル化がどのようにキネトコアの形成を促進させるのかという分子機構の理解をめざしたい.
文 献
- Black, B. E. & Cleveland, D. W.: Epigenetic centromere propagation and the nature of CENP-A nucleosomes. Cell, 144, 471-479 (2011)[PubMed]
- Perpelescu, M. & Fukagawa, T.: The ABCs of CENPs. Chromosoma, 120, 425-446 (2011)[PubMed]
- Mendiburo, M. J., Padeken, J., Fulop, S. et al.: Drosophila CENH3 is sufficient for centromere formation. Science, 334, 686-690 (2011)[PubMed]
- Gascoigne, K. E., Takeuchi, K., Suzuki, A. et al.: Induced ectopic kinetochore assembly bypasses the requirement for CENP-A nucleosomes. Cell, 145, 410-422 (2011)[PubMed]
- Ruthenburg, A. J., Li, H., Patel, D. J. et al.: Multivalent engagement of chromatin modifications by linked binding modules. Nat. Rev. Mol. Cell Biol., 8, 983-994 (2007)[PubMed]
- Shang, W. H., Hori, T., Toyoda, A. et al.: Chickens possess centromeres with both extended tandem repeats and short non-tandem-repetitive sequences. Genome Res., 20, 1219-1228 (2010)[PubMed]
- Shang, W. H., Hori, T., Martins, N. M. et al.: Chromosome engineering allows the efficient isolation of vertebrate neocentromeres. Dev. Cell, 24, 635-648 (2013)[PubMed]
- Hori, T., Amano, M., Suzuki, A. et al.: CCAN makes multiple contacts with centromeric DNA to provide distinct pathways to the outer kinetochore. Cell, 135, 1039-1052 (2008)[PubMed]
- Foltz, D. R., Jansen, L. E., Bailey, A. O. et al.: Centromere-specific assembly of CENP-A nucleosomes is mediated by HJURP. Cell, 137, 472-484 (2009)[PubMed]
- Dunleavy, E. M., Roche, D., Tagami, H. et al.: HJURP is a cell-cycle-dependent maintenance and deposition factor of CENP-A at centromeres. Cell, 137, 485-497 (2009)[PubMed]
著者プロフィール
略歴:2000年 東北大学大学院農学研究科 修了,国立遺伝学研究所 特任研究員を経て,2009年より同 助教.
研究テーマ:セントロメアの形成の分子機構.
関心事:セントロメアの機能と“核酸”との未知の関係.
商 維昊(Wei-Hao Shang)
国立遺伝学研究所 特任研究員.
深川 竜郎(Tatsuo Fukagawa)
国立遺伝学研究所 教授.
研究室URL:http://www.nig.ac.jp/labs/MolGene/index_j.html
© 2014 堀 哲也・商 維昊・深川竜郎 Licensed under CC 表示 2.1 日本