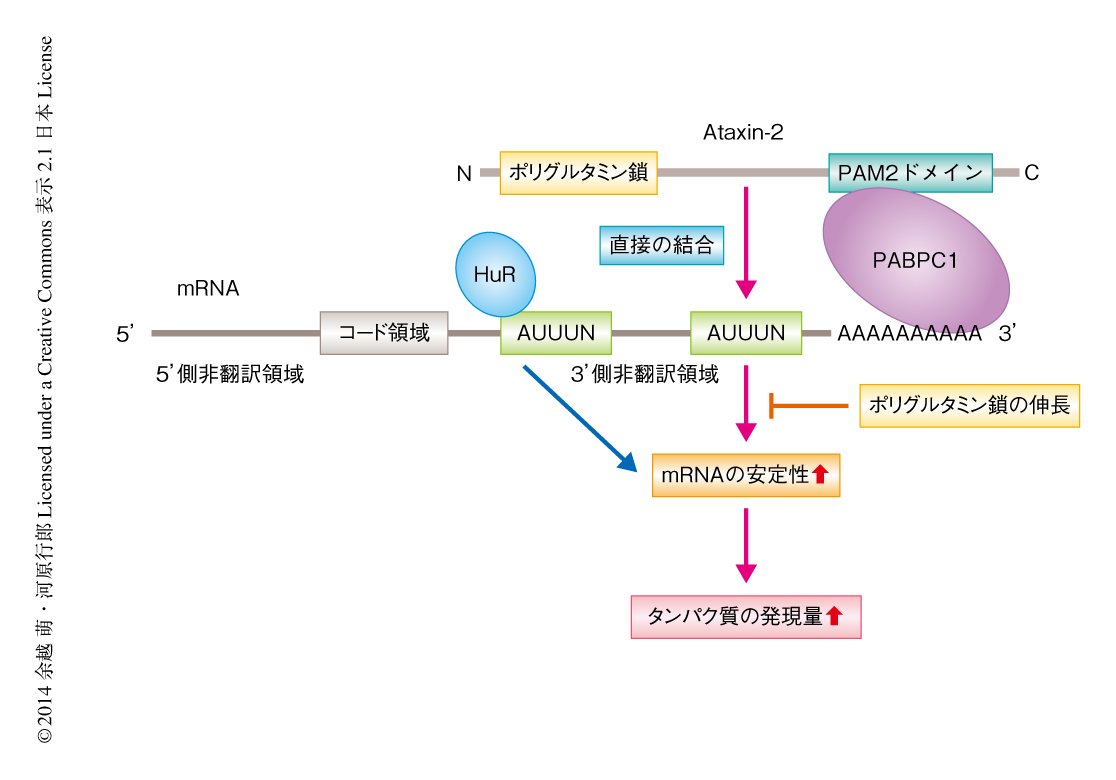
神経変性疾患に関連するタンパク質Ataxin-2は3'側非翻訳領域に直接に結合することによりmRNAの安定性を促進する
余越 萌・河原行郎
(大阪大学大学院医学系研究科 神経遺伝子学)
email:余越 萌,河原行郎
DOI: 10.7875/first.author.2014.098
Direct binding of Ataxin-2 to distinct elements in 3' UTRs promotes mRNA stability and protein expression.
Moe Yokoshi, Quan Li, Munetaka Yamamoto, Hitomi Okada, Yutaka Suzuki, Yukio Kawahara
Molecular Cell, 55, 186-198 (2014)
Ataxin-2はRNAプロセシングに関与するLSmタンパク質ファミリーに属し,ポリA鎖結合タンパク質PABPC1と直接に結合する.そのため,なんらかのRNA代謝にかかわると予想されてきたが生理的な機能は不明であった.今回,筆者らは,PAR-CLIP法とよばれるタンパク質に結合するRNAを高純度に回収する手法をAtaxin-2に対し適用したところ,なんらかのRNAがPABPC1を介さず直接にAtaxin-2と結合していることを見い出した.Ataxin-2と結合するRNAを網羅的に解析した結果,Ataxin-2はmRNAの3'側非翻訳領域に存在するウリジンに富んだ配列をおもに認識していることを発見した.これらの配列にはmRNAの安定性を規定することが知られているAUリッチ配列も含まれていた.Ataxin-2の発現を抑制あるいは過剰にしたときのすべての遺伝子の発現量の変動を解析した結果,Ataxin-2は標的となるmRNAの安定化を促進し,その結果,タンパク質の発現量を増加させていることがわかった.この機能を発揮するにはAtaxin-2が標的となるmRNAに直接に結合することが必要不可欠であった.また,神経変性疾患と関連するAtaxin-2のもつポリグルタミン鎖の異常な伸長は,mRNAを安定化する機能を低下させることがわかり,標的となる遺伝子の発現制御能の低下が神経変性疾患の一因となっている可能性が考えられた.
遺伝子の発現は転写から翻訳にいたるまで,スプライシング,RNA編集,mRNAの安定化など,多様な時空間的な制御をうけている.なかでも,mRNAの安定性の制御はタンパク質の発現量を規定する重要な制御機構であり,おもにマイクロRNAおよびRNA結合タンパク質により協調的に制御されている.マイクロRNAの場合には,mRNAの3'側非翻訳領域に存在する標的配列に結合することによりその発現を負に制御する.一方,RNA結合タンパク質の認識するシス配列としては,3'側非翻訳領域に存在するAUリッチ配列がよく知られている.RNA結合タンパク質のうち,HuRはおもにAUリッチ配列に結合してmRNAの安定性を上昇させる一方で,TTPやKSRPなどはAUリッチ配列への結合を介してmRNAの分解を促進する.こういったmRNAの安定性を制御するRNA結合タンパク質はほかにも存在すると予想されてきた.
近年,CLIP(crosslinking and immunoprecipitation,架橋および免疫沈降)法あるいはその改変法と次世代シークエンサーとを組み合わせることにより,RNA結合タンパク質と結合するRNAを高純度かつ網羅的に決定できるようになった.とくに,PAR(photoactivatable-ribonucleoside-enhanced,光活性化リボヌクレオシド強化)-CLIP法では,培地に4-チオウリジンを添加しこれをウリジンの代わりにRNAに取り込ませる.RNA結合タンパク質と4-チオウリジンは紫外線の照射により強く架橋するので,非特異的なRNAの混入を抑えることができる.また,cDNAへの逆転写の際,架橋した4-チオウリジンはシトシンと認識されるため,ゲノムへのアノテーションの際にチミンからシトシンへの置換を確認できる.このため,RNA結合タンパク質との結合部位を1塩基のレベルで決定できるという特徴をもつ.これまでに,Ago,FMRP,HuRなどのRNA結合タンパク質に適用され,標的となるRNAや結合モチーフが同定されている1-4).
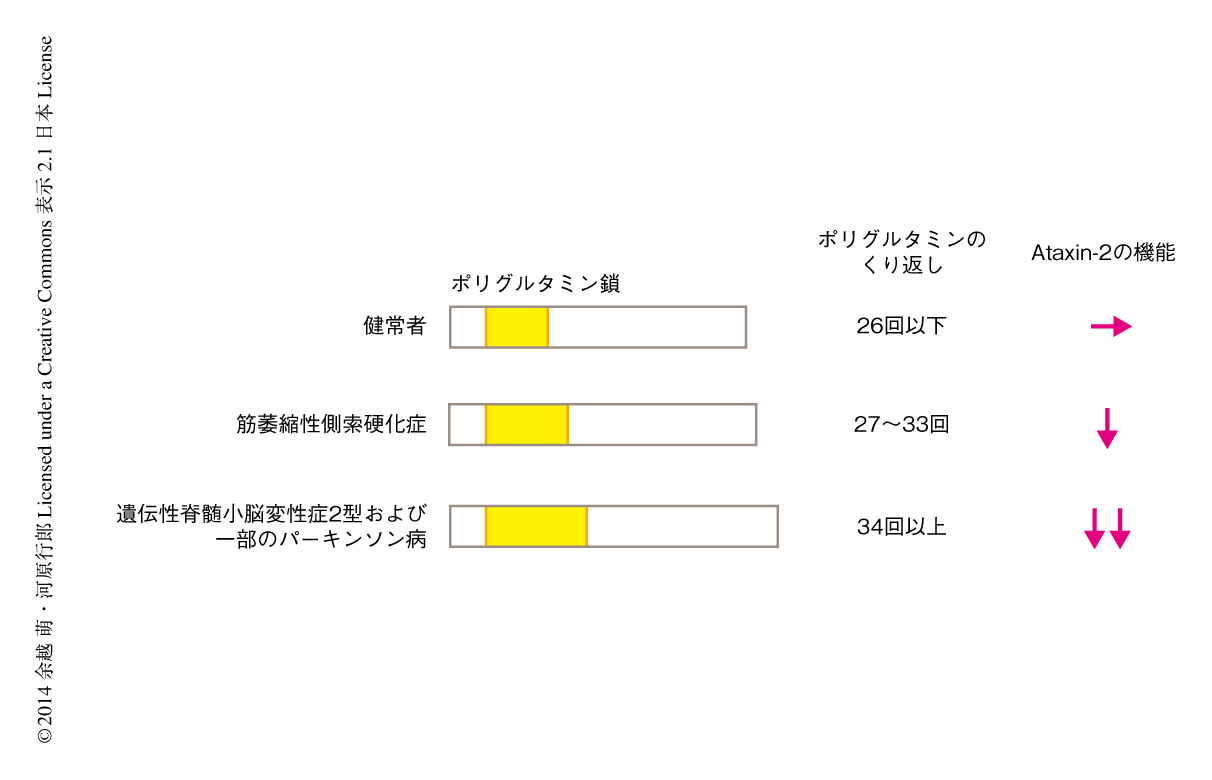
Ataxin-2は約140 kDaの細胞質タンパク質で,酵母から哺乳動物まで保存されており,多くの細胞に発現している.ポリA鎖結合タンパク質であるPABPC1とPAM2ドメインを介して直接に結合することから,なんらかのRNA代謝に関与していると考えられてきたが(図1),PABPC1を介してすべてのmRNAを制御しているのか,あるいは,特定の標的があるのかは不明であった.一方,Ataxin-2は,遺伝性脊髄小脳変性症2型の原因遺伝子の産物としても知られており,正常ではN末端側のポリグルタミンのくり返しは26個以下なのに対し,遺伝性脊髄小脳変性症2型の患者では34個以上に伸長していることが知られている5,6)(図2).さらに最近になり,ポリグルタミン鎖の中等度の伸長(くり返しが27~33回)が別の神経変性疾患である筋萎縮性側索硬化症の発症を有意に高めることが明らかになった7).しかしながら,ポリグルタミン鎖の伸長が病態においてどのような意義をもつのかは不明であった.このため,この研究では,Ataxin-2の機能を同定したうえで,ポリグルタミン鎖の伸長が生理的な機能に及ぼす影響について解析することを目的とした.
Ataxin-2の生理的な機能を同定するため,そのLSmドメインに着目した.一般に,Ataxin-2を含めたLSmファミリータンパク質はLSmドメインを介してRNAと結合する.そのため,Ataxin-2がRNAと直接に結合している可能性についてPAR-CLIP法を用いて解析したところ,Ataxin-2と結合するRNAが確認された.また,PABPC1との結合ドメインであるPAM2ドメインを欠損させたAtaxin-2変異体を用いて同様の実験を行っても,Ataxin-2と結合するRNAの存在が確認されたことから,なんらかのRNAがPABPC1を介さず直接にAtaxin-2と結合していることが明らかになった.Ataxin-2と結合するRNAを抽出して網羅的に塩基配列を解析したところ,約4千の遺伝子の1万5千箇所にAtaxin-2との結合部位が同定され,その主たる標的はmRNAの3'側非翻訳領域にあることが判明した.
Ataxin-2が特定のモチーフを認識して結合しているのかどうか解析した.PAR-CLIP法ではRNA結合タンパク質の結合部位にチミンからシトシンへの置換が挿入されるため,この情報をもとに解析した.その結果,Ataxin-2はウリジンに富んだ配列を認識していることがわかった(図1).そのなかには,AUUUAを基本骨格としmRNAの安定性を制御するAUリッチ配列も含まれていた.in vitroにおいて結合アッセイを行ったところ,Ataxin-2はAUリッチ配列を含むmRNAを特異的に認識すること,その結合にはLSmドメインが必要であることが確認された.
Ataxin-2はAUリッチ配列に結合したことから,mRNAの安定性を制御している可能性が示唆された.そのため,Ataxin-2をノックダウンあるいは過剰に発現したときのすべての遺伝子の発現の変化をマイクロアレイ法により解析した.その結果,Ataxin-2をノックダウンすると標的となるmRNAの発現量は減少し,過剰に発現すると発現量は増加した.Ataxin-2との結合部位が多いものほど,Ataxin-2の発現量の変化の影響を強くうけた.また,Ataxin-2をノックダウンすると標的となるmRNAの半減期が短縮し,これにともないタンパク質の発現量も減少することが確認された.これらの結果から,Ataxin-2は標的となるmRNAの安定性を促進する機能をもつことが明らかになった(図1).
近年,報告された,RNA結合タンパク質HuRに対するPAR-CLIP法の結果によると,HuRはAtaxin-2と同じようなウリジンに富んだ配列を認識していた3,4).そのため,Ataxin-2およびHuRのPAR-CLIP法によるデータを比較し,標的となるmRNAの認識に違いがあるかどうか調べた.その結果,標的遺伝子については71%が重複していたが,結合部位や結合しているAUリッチ配列のレベルで比較すると,重複は限定していることがわかった.HuRは3'側非翻訳領域の全体に結合範囲が広がっていたのに対して,Ataxin-2はポリA鎖の側に圧倒的にかたよって結合していた.これは,Ataxin-2がポリA鎖に結合するPABPC1と直接に結合していることと関連していると考えられた.以上の結果から,Ataxin-2およびHuRはそれぞれが3'側非翻訳領域において異なるウリジンに富んだ配列に結合し,協調して同じ遺伝子の安定性を促進しているものと考えられた(図1).
Ataxin-2によるmRNA安定性の促進に必要なドメインについて解析した.解析は,Ataxin-2のN末端側にλNペプチドを付加したものと,これと高効率かつ選択的に結合するボックスB配列を3'側非翻訳領域に挿入したレポーター遺伝子を用いたテザリングアッセイ系により行った.その結果,Ataxin-2によるmRNAの安定性の促進には,Ataxin-2が3'側非翻訳領域に直接に結合することが必要不可欠であることが確認された.また,各種の欠損変異体において同様に解析した結果,PAM2ドメインおよびポリグルタミン鎖を欠損させるとmRNAの安定化を促進する機能が30%ほど低下することがわかった.この結果は,非神経系の培養細胞であるHEK293細胞でも神経系の培養細胞であるSH-SY5Y細胞でも同じであった.
Ataxin-2がmRNAの安定性だけでなく,翻訳を促進する機能ももつかどうか解析した.スクロース密度勾配遠心法によりポリソーム分画を行い,Ataxin-2およびレポーター遺伝子の局在を解析した.その結果,Ataxin-2はポリソーム画分にはほとんど存在しておらず,レポーター遺伝子の積極的な翻訳は確認されなかった.このことから,Ataxin-2の主要な機能はmRNAの安定性の促進にあると結論づけた.
神経変性疾患において認められるポリグルタミン鎖の異常な伸長がAtaxin-2によるmRNAの安定性の促進に及ぼす影響について解析した.ポリグルタミンのくり返しが31回の筋萎縮性側索硬化症タイプ,および,くり返しが35回あるいは39回の遺伝性脊髄小脳変性症2型タイプのポリグルタミン鎖をもつ3種類のAtaxin-2発現ベクターを作製した.くり返しが31回のものと39回のものに対してPAR-CLIP法を行い,標的となるRNAが変化するかどうか解析した.その結果,80%以上の標的RNAは野生型のAtaxin-2と同じであった.一方,mRNAを安定化させる能力については,ポリグルタミン鎖が伸長するほど低下した(図2).これは,HEK293細胞でもSH-SY5Y細胞でも同様の結果であった.以上の結果から,ポリグルタミン鎖の異常な伸長は,標的となるRNAの認識にはあまり影響しないが,mRNAの安定性を促進する機能を低下させることがわかった.
この研究により,Ataxin-2がmRNAの3'側非翻訳領域にあるウリジンに富んだ配列を認識し,標的となるmRNAの安定性を促進するRNA結合タンパク質であることが明らかにされた.認識配列にはAUリッチ配列も含まれていたことから,Ataxin-2はHuRなどと同じAUリッチ配列結合タンパク質のメンバーであることもわかった.Ataxin-2の標的遺伝子には,RNAスプライシングやmRNAのポリアデニル化などの転写後制御に関する遺伝子が多く含まれており,これらの遺伝子の発現制御を介してRNA代謝を統合的に制御していると考えられた.現状では,Ataxin-2がRNAの安定性を促進する詳細な分子機構は不明である.出芽酵母のホモログであるPbp1の場合,PABPC1との結合を介してポリA鎖分解酵素PANのポリA鎖への接近を阻止していることが報告されている8).しかし,PAM2ドメインを欠損しても機能は30%程度しか低下しなかったことから,ほかの要因もあると予想される.たとえば,エクソソームなどをリクルートしてmRNAの分解を促進するTTPやKSRPなどと,Ataxin-2は同じ結合部位をめぐり競合している可能性が考えられる.マイクロRNAとも競合している可能性がある.今後,これらの具体的な分子機構を明らかにする必要がある.
遺伝性脊髄小脳変性症2型の患者の剖検脳では,変性したニューロンに封入体を認めることはまれである.また,異常に伸長したポリグルタミン鎖をもつヒトのAtaxin-2を過剰発現させたトランスジェニックマウスは運動症状を呈するが9),封入体はほとんど認められず,異常なAtaxin-2は細胞質に野生型と同じ程度に発現していることが確認されている.このため,遺伝性脊髄小脳変性症2型では,一般的な神経変性疾患において提唱されている封入体の形成による毒性の獲得よりも,Ataxin-2のなんらかの機能障害がその病態の根底にあると考えられてきた.今回,Ataxin-2におけるポリグルタミン鎖の伸長は,mRNAの安定性を促進する機能を低下させることがわかった.Ataxin-2の標的遺伝子の産物には神経変性疾患と深く関連するTDP-43なども含まれていたことから,Ataxin-2の機能の低下が神経変性を誘導する一因になっていると考察された.今後は,モデル動物などの脳組織を使ってAtaxin-2を中心としたタンパク質-RNAネットワークの全容を明らかにすることが神経変性疾患の病態の解明に必要と考えられた.
略歴:大阪大学大学院医学系研究科博士課程 在学中.
研究テーマ:RNA代謝の異常における神経変性の誘導機構.
抱負:基礎医学の研究に貢献したい.
河原 行郎(Yukio Kawahara)
大阪大学大学院医学系研究科 教授.
© 2014 余越 萌・河原行郎 Licensed under CC 表示 2.1 日本
(大阪大学大学院医学系研究科 神経遺伝子学)
email:余越 萌,河原行郎
DOI: 10.7875/first.author.2014.098
Direct binding of Ataxin-2 to distinct elements in 3' UTRs promotes mRNA stability and protein expression.
Moe Yokoshi, Quan Li, Munetaka Yamamoto, Hitomi Okada, Yutaka Suzuki, Yukio Kawahara
Molecular Cell, 55, 186-198 (2014)
要 約
Ataxin-2はRNAプロセシングに関与するLSmタンパク質ファミリーに属し,ポリA鎖結合タンパク質PABPC1と直接に結合する.そのため,なんらかのRNA代謝にかかわると予想されてきたが生理的な機能は不明であった.今回,筆者らは,PAR-CLIP法とよばれるタンパク質に結合するRNAを高純度に回収する手法をAtaxin-2に対し適用したところ,なんらかのRNAがPABPC1を介さず直接にAtaxin-2と結合していることを見い出した.Ataxin-2と結合するRNAを網羅的に解析した結果,Ataxin-2はmRNAの3'側非翻訳領域に存在するウリジンに富んだ配列をおもに認識していることを発見した.これらの配列にはmRNAの安定性を規定することが知られているAUリッチ配列も含まれていた.Ataxin-2の発現を抑制あるいは過剰にしたときのすべての遺伝子の発現量の変動を解析した結果,Ataxin-2は標的となるmRNAの安定化を促進し,その結果,タンパク質の発現量を増加させていることがわかった.この機能を発揮するにはAtaxin-2が標的となるmRNAに直接に結合することが必要不可欠であった.また,神経変性疾患と関連するAtaxin-2のもつポリグルタミン鎖の異常な伸長は,mRNAを安定化する機能を低下させることがわかり,標的となる遺伝子の発現制御能の低下が神経変性疾患の一因となっている可能性が考えられた.
はじめに
遺伝子の発現は転写から翻訳にいたるまで,スプライシング,RNA編集,mRNAの安定化など,多様な時空間的な制御をうけている.なかでも,mRNAの安定性の制御はタンパク質の発現量を規定する重要な制御機構であり,おもにマイクロRNAおよびRNA結合タンパク質により協調的に制御されている.マイクロRNAの場合には,mRNAの3'側非翻訳領域に存在する標的配列に結合することによりその発現を負に制御する.一方,RNA結合タンパク質の認識するシス配列としては,3'側非翻訳領域に存在するAUリッチ配列がよく知られている.RNA結合タンパク質のうち,HuRはおもにAUリッチ配列に結合してmRNAの安定性を上昇させる一方で,TTPやKSRPなどはAUリッチ配列への結合を介してmRNAの分解を促進する.こういったmRNAの安定性を制御するRNA結合タンパク質はほかにも存在すると予想されてきた.
近年,CLIP(crosslinking and immunoprecipitation,架橋および免疫沈降)法あるいはその改変法と次世代シークエンサーとを組み合わせることにより,RNA結合タンパク質と結合するRNAを高純度かつ網羅的に決定できるようになった.とくに,PAR(photoactivatable-ribonucleoside-enhanced,光活性化リボヌクレオシド強化)-CLIP法では,培地に4-チオウリジンを添加しこれをウリジンの代わりにRNAに取り込ませる.RNA結合タンパク質と4-チオウリジンは紫外線の照射により強く架橋するので,非特異的なRNAの混入を抑えることができる.また,cDNAへの逆転写の際,架橋した4-チオウリジンはシトシンと認識されるため,ゲノムへのアノテーションの際にチミンからシトシンへの置換を確認できる.このため,RNA結合タンパク質との結合部位を1塩基のレベルで決定できるという特徴をもつ.これまでに,Ago,FMRP,HuRなどのRNA結合タンパク質に適用され,標的となるRNAや結合モチーフが同定されている1-4).
Ataxin-2は約140 kDaの細胞質タンパク質で,酵母から哺乳動物まで保存されており,多くの細胞に発現している.ポリA鎖結合タンパク質であるPABPC1とPAM2ドメインを介して直接に結合することから,なんらかのRNA代謝に関与していると考えられてきたが(図1),PABPC1を介してすべてのmRNAを制御しているのか,あるいは,特定の標的があるのかは不明であった.一方,Ataxin-2は,遺伝性脊髄小脳変性症2型の原因遺伝子の産物としても知られており,正常ではN末端側のポリグルタミンのくり返しは26個以下なのに対し,遺伝性脊髄小脳変性症2型の患者では34個以上に伸長していることが知られている5,6)(図2).さらに最近になり,ポリグルタミン鎖の中等度の伸長(くり返しが27~33回)が別の神経変性疾患である筋萎縮性側索硬化症の発症を有意に高めることが明らかになった7).しかしながら,ポリグルタミン鎖の伸長が病態においてどのような意義をもつのかは不明であった.このため,この研究では,Ataxin-2の機能を同定したうえで,ポリグルタミン鎖の伸長が生理的な機能に及ぼす影響について解析することを目的とした.
1.Ataxin-2はmRNAの3'側非翻訳領域と直接に結合する
Ataxin-2の生理的な機能を同定するため,そのLSmドメインに着目した.一般に,Ataxin-2を含めたLSmファミリータンパク質はLSmドメインを介してRNAと結合する.そのため,Ataxin-2がRNAと直接に結合している可能性についてPAR-CLIP法を用いて解析したところ,Ataxin-2と結合するRNAが確認された.また,PABPC1との結合ドメインであるPAM2ドメインを欠損させたAtaxin-2変異体を用いて同様の実験を行っても,Ataxin-2と結合するRNAの存在が確認されたことから,なんらかのRNAがPABPC1を介さず直接にAtaxin-2と結合していることが明らかになった.Ataxin-2と結合するRNAを抽出して網羅的に塩基配列を解析したところ,約4千の遺伝子の1万5千箇所にAtaxin-2との結合部位が同定され,その主たる標的はmRNAの3'側非翻訳領域にあることが判明した.
2.Ataxin-2はウリジンに富んだ配列を認識して結合する
Ataxin-2が特定のモチーフを認識して結合しているのかどうか解析した.PAR-CLIP法ではRNA結合タンパク質の結合部位にチミンからシトシンへの置換が挿入されるため,この情報をもとに解析した.その結果,Ataxin-2はウリジンに富んだ配列を認識していることがわかった(図1).そのなかには,AUUUAを基本骨格としmRNAの安定性を制御するAUリッチ配列も含まれていた.in vitroにおいて結合アッセイを行ったところ,Ataxin-2はAUリッチ配列を含むmRNAを特異的に認識すること,その結合にはLSmドメインが必要であることが確認された.
3.Ataxin-2は標的となるmRNAの安定性を促進する
Ataxin-2はAUリッチ配列に結合したことから,mRNAの安定性を制御している可能性が示唆された.そのため,Ataxin-2をノックダウンあるいは過剰に発現したときのすべての遺伝子の発現の変化をマイクロアレイ法により解析した.その結果,Ataxin-2をノックダウンすると標的となるmRNAの発現量は減少し,過剰に発現すると発現量は増加した.Ataxin-2との結合部位が多いものほど,Ataxin-2の発現量の変化の影響を強くうけた.また,Ataxin-2をノックダウンすると標的となるmRNAの半減期が短縮し,これにともないタンパク質の発現量も減少することが確認された.これらの結果から,Ataxin-2は標的となるmRNAの安定性を促進する機能をもつことが明らかになった(図1).
4.Ataxin-2とHuRは同じ遺伝子の異なる部位に結合する
近年,報告された,RNA結合タンパク質HuRに対するPAR-CLIP法の結果によると,HuRはAtaxin-2と同じようなウリジンに富んだ配列を認識していた3,4).そのため,Ataxin-2およびHuRのPAR-CLIP法によるデータを比較し,標的となるmRNAの認識に違いがあるかどうか調べた.その結果,標的遺伝子については71%が重複していたが,結合部位や結合しているAUリッチ配列のレベルで比較すると,重複は限定していることがわかった.HuRは3'側非翻訳領域の全体に結合範囲が広がっていたのに対して,Ataxin-2はポリA鎖の側に圧倒的にかたよって結合していた.これは,Ataxin-2がポリA鎖に結合するPABPC1と直接に結合していることと関連していると考えられた.以上の結果から,Ataxin-2およびHuRはそれぞれが3'側非翻訳領域において異なるウリジンに富んだ配列に結合し,協調して同じ遺伝子の安定性を促進しているものと考えられた(図1).
5.PAM2ドメインおよびポリグルタミン鎖はAtaxin-2の機能の保持に必要である
Ataxin-2によるmRNA安定性の促進に必要なドメインについて解析した.解析は,Ataxin-2のN末端側にλNペプチドを付加したものと,これと高効率かつ選択的に結合するボックスB配列を3'側非翻訳領域に挿入したレポーター遺伝子を用いたテザリングアッセイ系により行った.その結果,Ataxin-2によるmRNAの安定性の促進には,Ataxin-2が3'側非翻訳領域に直接に結合することが必要不可欠であることが確認された.また,各種の欠損変異体において同様に解析した結果,PAM2ドメインおよびポリグルタミン鎖を欠損させるとmRNAの安定化を促進する機能が30%ほど低下することがわかった.この結果は,非神経系の培養細胞であるHEK293細胞でも神経系の培養細胞であるSH-SY5Y細胞でも同じであった.
Ataxin-2がmRNAの安定性だけでなく,翻訳を促進する機能ももつかどうか解析した.スクロース密度勾配遠心法によりポリソーム分画を行い,Ataxin-2およびレポーター遺伝子の局在を解析した.その結果,Ataxin-2はポリソーム画分にはほとんど存在しておらず,レポーター遺伝子の積極的な翻訳は確認されなかった.このことから,Ataxin-2の主要な機能はmRNAの安定性の促進にあると結論づけた.
6.Ataxin-2の機能はポリグルタミン鎖の長さに依存して低下する
神経変性疾患において認められるポリグルタミン鎖の異常な伸長がAtaxin-2によるmRNAの安定性の促進に及ぼす影響について解析した.ポリグルタミンのくり返しが31回の筋萎縮性側索硬化症タイプ,および,くり返しが35回あるいは39回の遺伝性脊髄小脳変性症2型タイプのポリグルタミン鎖をもつ3種類のAtaxin-2発現ベクターを作製した.くり返しが31回のものと39回のものに対してPAR-CLIP法を行い,標的となるRNAが変化するかどうか解析した.その結果,80%以上の標的RNAは野生型のAtaxin-2と同じであった.一方,mRNAを安定化させる能力については,ポリグルタミン鎖が伸長するほど低下した(図2).これは,HEK293細胞でもSH-SY5Y細胞でも同様の結果であった.以上の結果から,ポリグルタミン鎖の異常な伸長は,標的となるRNAの認識にはあまり影響しないが,mRNAの安定性を促進する機能を低下させることがわかった.
おわりに
この研究により,Ataxin-2がmRNAの3'側非翻訳領域にあるウリジンに富んだ配列を認識し,標的となるmRNAの安定性を促進するRNA結合タンパク質であることが明らかにされた.認識配列にはAUリッチ配列も含まれていたことから,Ataxin-2はHuRなどと同じAUリッチ配列結合タンパク質のメンバーであることもわかった.Ataxin-2の標的遺伝子には,RNAスプライシングやmRNAのポリアデニル化などの転写後制御に関する遺伝子が多く含まれており,これらの遺伝子の発現制御を介してRNA代謝を統合的に制御していると考えられた.現状では,Ataxin-2がRNAの安定性を促進する詳細な分子機構は不明である.出芽酵母のホモログであるPbp1の場合,PABPC1との結合を介してポリA鎖分解酵素PANのポリA鎖への接近を阻止していることが報告されている8).しかし,PAM2ドメインを欠損しても機能は30%程度しか低下しなかったことから,ほかの要因もあると予想される.たとえば,エクソソームなどをリクルートしてmRNAの分解を促進するTTPやKSRPなどと,Ataxin-2は同じ結合部位をめぐり競合している可能性が考えられる.マイクロRNAとも競合している可能性がある.今後,これらの具体的な分子機構を明らかにする必要がある.
遺伝性脊髄小脳変性症2型の患者の剖検脳では,変性したニューロンに封入体を認めることはまれである.また,異常に伸長したポリグルタミン鎖をもつヒトのAtaxin-2を過剰発現させたトランスジェニックマウスは運動症状を呈するが9),封入体はほとんど認められず,異常なAtaxin-2は細胞質に野生型と同じ程度に発現していることが確認されている.このため,遺伝性脊髄小脳変性症2型では,一般的な神経変性疾患において提唱されている封入体の形成による毒性の獲得よりも,Ataxin-2のなんらかの機能障害がその病態の根底にあると考えられてきた.今回,Ataxin-2におけるポリグルタミン鎖の伸長は,mRNAの安定性を促進する機能を低下させることがわかった.Ataxin-2の標的遺伝子の産物には神経変性疾患と深く関連するTDP-43なども含まれていたことから,Ataxin-2の機能の低下が神経変性を誘導する一因になっていると考察された.今後は,モデル動物などの脳組織を使ってAtaxin-2を中心としたタンパク質-RNAネットワークの全容を明らかにすることが神経変性疾患の病態の解明に必要と考えられた.
文 献
- Hafner, M., Landthaler, M., Burger, L. et al.: Transcriptome-wide identification of RNA-binding protein and microRNA target sites by PAR-CLIP. Cell, 141, 129-141 (2010)[PubMed]
- Ascano, M. Jr., Mukherjee, N., Bandaru, P. et al.: FMRP targets distinct mRNA sequence elements to regulate protein expression. Nature, 492, 382-386 (2012)[PubMed]
- Lebedeva, S., Jens, M., Theil, K. et al.: Transcriptome-wide analysis of regulatory interactions of the RNA-binding protein HuR. Mol. Cell, 43, 340-352 (2011)[PubMed]
- Mukherjee, N., Corcoran, D. L., Nusbaum, J. D. et al.: Integrative regulatory mapping indicates that the RNA-binding protein HuR couples pre-mRNA processing and mRNA stability. Mol. Cell, 43, 327-339 (2011)[PubMed]
- Sanpei, K., Takano, H., Igarashi, S. et al.: Identification of the spinocerebellarataxia type 2 gene using a direct identification of repeat expansion and cloning technique, DIRECT. Nat. Genet., 14, 277-284 (1996)[PubMed]
- Pulst, S. M., Nechiporuk, A., Nechiporuk, T. et al.: Moderate expansion of a normally biallelic trinucleotide repeat in spinocerebellar ataxia type 2. Nat. Genet., 14, 269-276 (1996)[PubMed]
- Elden, A. C., Kim, H. J., Hart, M. P. et al.: Ataxin-2 intermediate-length polyglutamine expansions are associated with increased risk for ALS. Nature, 466, 1069-1075 (2010)[PubMed]
- Mangus, D. A., Smith, M. M., McSweeney, J. M. et al.: Identification of factors regulating poly(A) tail synthesis and maturation. ol. Cell. Biol., 24, 4196-4206 (2004)[PubMed]
- Huynh, D. P., Figueroa, K., Hoang, N. et al.: Nuclear localization or inclusion body formation of ataxin-2 are not necessary for SCA2 pathogenesis in mouse or human. Nat. Genet., 26, 44-50 (2000)[PubMed]
著者プロフィール
略歴:大阪大学大学院医学系研究科博士課程 在学中.
研究テーマ:RNA代謝の異常における神経変性の誘導機構.
抱負:基礎医学の研究に貢献したい.
河原 行郎(Yukio Kawahara)
大阪大学大学院医学系研究科 教授.
© 2014 余越 萌・河原行郎 Licensed under CC 表示 2.1 日本