老化細胞は分裂期の回避により生じた4倍体のG1期細胞である
城村由和・中西 真
(名古屋市立大学大学院医学研究科 細胞生化学分野)
email:中西 真
DOI: 10.7875/first.author.2014.097
Necessary and sufficient role for a mitosis skip in senescence induction.
Yoshikazu Johmura, Midori Shimada, Toshinori Misaki, Aya Naiki-Ito, Hiroyuki Miyoshi, Noboru Motoyama, Naoko Ohtani, Eiji Hara, Motoki Nakamura, Akimichi Morita, Satoru Takahashi, Makoto Nakanishi
Molecular Cell, 55, 73-84 (2014)
細胞老化は不可逆的な細胞増殖の停止機構であり,重要な抗腫瘍化機構のひとつであると考えられている.以前より,細胞老化の誘導にはがん抑制遺伝子の産物であるp53およびpRbファミリーが必要不可欠であることは明らかになっていたが,これらのがん抑制遺伝子産物がどのような分子機構を介して細胞老化を特異的に誘導しているかについてはよくわかっていなかった.筆者らは,FUCCI系を用いて細胞老化の誘導の過程における細胞周期の変化を1細胞レベルで解析した.その結果,老化を誘導する刺激をうけた正常なヒトの2倍体細胞は,G2期における一時的な細胞周期の停止ののち,細胞分裂をすることなくG1期に進行する,いわゆる,分裂期の回避を生じて4倍体のG1期細胞となり,不可逆的な細胞増殖の停止をひき起こすことを見い出した.さらに,分裂期の回避はG2期におけるp53の活性化に依存したAPC/Ccdh1によるタンパク質分解,および,pRb遺伝子ファミリーによる転写抑制を介した分裂制御タンパク質の発現の顕著な低下により誘導され,細胞老化の誘導に必要かつ十分であることも明らかになった.
Hayflickらにより,ヒトの正常な体細胞は培養皿で継代をくり返すと最終的に不可逆的な細胞増殖の停止をひき起こすことがはじめて示された1).のちの解析により,幹細胞を除く多くのヒトの正常な細胞にはテロメアの短小化に起因する細胞分裂の回数の限界(分裂寿命)のあることがわかり,分裂寿命により生じた細胞老化はとくに“複製老化”と定義づけられた.一方,細胞老化に関する研究が進むにつれ,Ras遺伝子などのがん遺伝子の活性化,酸化ストレス,DNA損傷などによっても細胞老化が誘導されることも明らかになり,これらは“ストレス性の細胞老化”などとよばれている2).細胞老化のもっとも重要かつ共通の特徴のひとつは不可逆的な細胞増殖の停止であり,その特徴から,細胞死を誘導するアポトーシスとならんで,もっとも重要な抗腫瘍化機構のひとつであると考えられている.また,近年の研究により,細胞老化は加齢にともなう病態にも深く関与することが明らかになりつつある3,4).
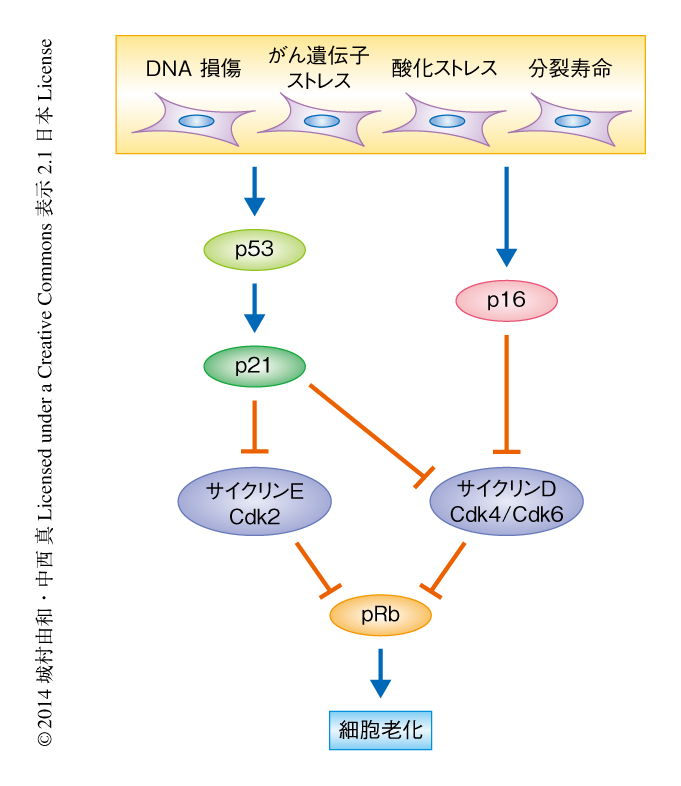
細胞老化の誘導機構については古くから活発に研究がなされており,がん抑制遺伝子の産物であるp53およびpRbファミリーが重要な役割をはたすことが明らかにされ,細胞老化の誘導機構がいくつか提唱されている5,6).とくに有力であると考えられているモデルでは,細胞老化を誘導するシグナルがDNA損傷応答を介して恒常的にp53を活性化し,活性化したp53が細胞周期のエンジンであるCDKファミリーの阻害タンパク質であるp21の発現上昇を介してpRbファミリーを活性化することにより,不可逆的に細胞周期をG1期に停止させていると考えられていた(図1).しかしながら,ごく最近になり,複製ストレスを起こした細胞の多くはG2期において細胞増殖を停止していることが報告された7).さらに以前より,DNA損傷により発現の上昇したp21がG2期からM期への移行に重要な役割をはたすCDK1およびCDK2の活性抑制を介してAPC/Ccdh1を活性化することにより,G2期における不可逆的な細胞周期の停止を誘導できることも報告されていた8).このように,細胞老化の誘導による不可逆的な細胞増殖の停止が細胞周期のどのステージで起こっているのか,その詳細な分子機構はどのようなものなのかについては,不明な点が多く残されていた.さらに重要な点として,細胞老化の誘導に重要であるp53およびpRbファミリーは,細胞老化の誘導だけでなく細胞周期の一時的な停止やアポトーシスを誘導することも知られており,細胞老化を特異的に誘導する分子機構について十分に理解できているとはいいがたかった.つまり,細胞老化を誘導する機構の詳細を明らかにすることは,新規のがんの治療法の開発や老化に関連する疾患の病態の理解につながるだけでなく,DNA損傷応答における細胞運命の決定という重要な命題を解き明かす鍵になることが期待される.
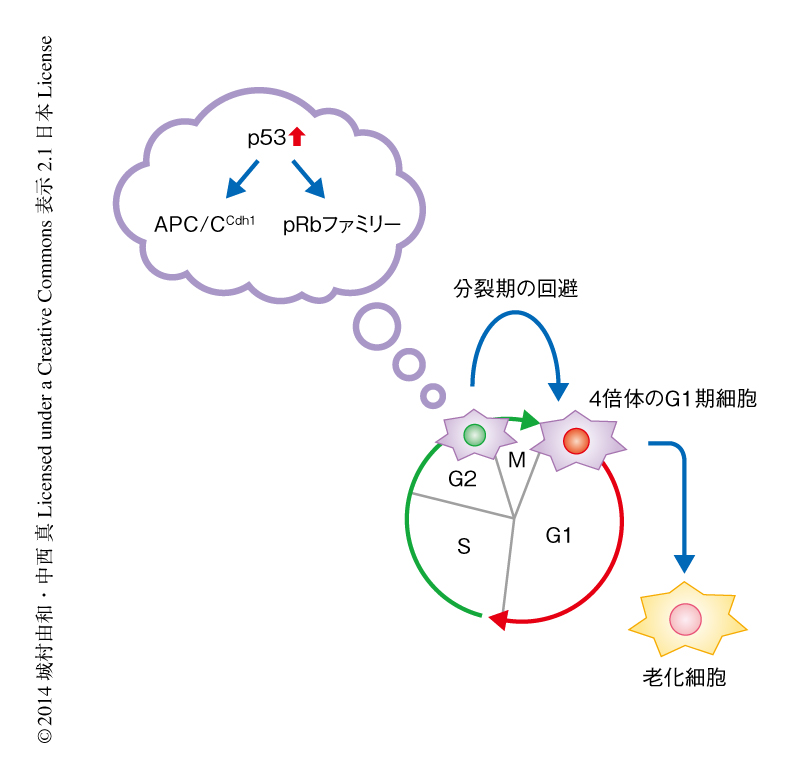
老化細胞が細胞周期のどのステージにおいて不可逆的に細胞増殖を停止するかを検討するため,FUCCI(fluorescent ubiquitination-based cell cycle indicator)系とよばれる細胞周期の動的な変化を生細胞イメージングにより観察する方法9) を応用することにより,細胞老化の過程における細胞周期の変化を1細胞レベルで解析した.その結果,がん遺伝子のストレスを含めたすべての細胞老化の過程において,多くの細胞がG2期における一時的な細胞周期の停止ののち,通常は起こるべき細胞分裂をすることなくG1期に進行する,いわゆる,分裂期の回避を生じて4倍体のG1期細胞となり,不可逆的に細胞周期を停止することを見い出した.また,老化の過程における分裂制御タンパク質の発現の変化を解析したところ,解析したすべてのタンパク質の発現が分裂期の回避のタイミングにあわせていちじるしく低下していることがわかった.この結果は,分裂制御タンパク質の発現の顕著な低下が分裂期の回避の引き金になっていることを示唆した.さらに,DNA損傷により細胞老化を誘導した細胞を蛍光セルソーターにより2倍体細胞と4倍体細胞とに分画したのち,細胞老化のマーカーであるCDK4およびCDK6の阻害タンパク質であるp16の発現の変化の解析,および,SA-β-gal(senescence-associated β-galactosidase)染色を行った.その結果,4倍体細胞はp16の発現の顕著な上昇を示すこと,そのほとんどがSA-β-gal陽性細胞であることがわかった.これらの結果から,老化細胞は分裂期の回避により生じた四倍体のG1期細胞であると考えられた.
分裂期の回避が誘導される分子機構および細胞老化の誘導における役割について調べた.がん抑制遺伝子の産物であるp53は細胞老化の誘導の鍵となるタンパク質であることが知られていることから,RNAi法を用いて,p53遺伝子の発現の抑制をテトラサイクリンにより誘導できる細胞株を樹立し,FUCCI系により生細胞イメージング解析を行った.その結果,対照となる細胞と比較して,p53の発現を抑制した細胞の多くにおいては老化を誘導する種々の刺激に対し分裂期の回避は起こらないことがわかった.また,このとき,SA-β-gal陽性細胞の顕著な減少も認められた.以上より,p53は分裂期の回避および細胞老化の誘導に必須であることが示された.
以前の報告より,p53の単純な活性化だけでは細胞老化を誘導できないと考えられていた.そこで,細胞周期に特異的かつ一過的にp53の発現を制御できる系を構築するため,レンチウイルスベクターを用いて,p53遺伝子の発現をテトラサイクリンにより誘導できる細胞株を樹立した.この細胞をCDK1の阻害剤によりG2期に同調させたのち,ドキシサイクリンで48時間処理することによりp53を一過的に発現させたところ,多くの細胞において分裂期の回避および不可逆的な細胞増殖の停止が認められた.一方,血清飢餓やDNA複製阻害剤などによりG0期やG1期/S期に同調した細胞に一過的にp53を発現させても細胞老化の誘導は認められなかった.また,p53の分解においてはたらくユビキチンリガーゼとして知られるMdm2の阻害剤を用いてp53の発現を一過的に上昇させた場合にも同様の結果が得られた.以上の結果より,G2期におけるp53の活性化が分裂期の回避および細胞老化の誘導に必要かつ十分であることが明らかになった.
p53による分裂期の回避の制御機構について明らかにするため,p53により転写の制御される主要な遺伝子の産物であるp21に着目して,発現抑制系および過剰発現系において解析した.その結果,p21は部分的ではあるものの分裂期の回避および細胞老化の誘導に関与することが明らかになった.
p21の発現の上昇はユビキチン系を介したタンパク質分解を制御するタンパク質複合体APC/Ccdh1の活性化を介して長期的に細胞周期をG2期に停止させることが報告されている8).そこで,Cdh1遺伝子の発現の抑制をテトラサイクリンにより誘導できる細胞株を用いて,細胞老化を誘導する種々の刺激に対する影響を解析した.その結果,対照となる細胞と比較して遅延は認められたものの,Cdh1の発現を抑制した細胞の多くには分裂期の回避が誘導されること,さらには,老化細胞になることがわかった.また,老化を誘導した細胞にプロテアソームの阻害剤を添加して分裂期の回避に対する影響を解析したところ,タンパク質分解以外の機構も重要な役割をはたすことが示された.以上より,分裂期の回避および細胞老化の誘導にはp53-p21シグナル伝達経路によるAPC/Ccdh1の活性化を介したタンパク質分解だけでは十分ではないことが示唆された.
細胞老化の過程におけるM期制御タンパク質の遺伝子レベルでの発現の変化を定量PCR法により解析した結果,これらの発現はp53に依存して抑制されることが明らかになった.p53はpRbファミリーを間接的に活性化することにより細胞周期に関連する遺伝子の発現抑制に関与することが知られている.実際,pRbファミリーであるpRb,p107,p130の三重発現抑制細胞株を用いて解析したところ,細胞老化を誘導する刺激に対してM期制御タンパク質の発現の抑制は認められず,pRbファミリーがp53の下流において分裂期の回避の制御に関与することが明らかになった.
これらの検討により,p53はAPC/Ccdh1およびpRbファミリーを協調的に活性化することにより分裂期の回避および細胞老化を誘導する可能性が考えられた.この可能性を検討するため,Cdh1およびpRbの構成的な活性化変異体それぞれ単独の発現,あるいは,その両方の発現をテトラサイクリンにより誘導できる細胞株を樹立して解析した.その結果,p53を過剰に発現する細胞と同様に,Cdh1およびpRbの発現をG2期において一過的に誘導した場合のみ,分裂期の回避および細胞老化の誘導が認められた.
CDK4およびCDK6の阻害タンパク質であるp16は細胞老化のマーカーであり,老化形質の獲得に深く関与することが知られている.p16遺伝子の発現の抑制をテトラサイクリンにより誘導できる細胞株を用いて,FUCCI系による生細胞イメージング解析を行ったところ,p16は分裂期の回避には関与しないことがわかった.しかしながら,分裂期の回避により生じた4倍体のG1期細胞においてp16の発現を抑制したところ,4倍体のG1期細胞がふたたびDNA複製を開始して8倍体細胞の生じることが見い出された.この結果から,p16が分裂期の回避により生じた老化細胞の不可逆的な細胞増殖を停止する重要な制御タンパク質であることが示された.
分裂期の回避がヒトの生体においても細胞老化の誘導において重要な役割をはたしているかどうかを検討した.ヒトの母斑細胞(ほくろ)はRas遺伝子の下流ではたらくリン酸化酵素BRAFの変異により生じる老化細胞であることが報告されている10).そこで,母斑の組織切片における細胞のDNA含量を測定するためDAPI染色を行った.その結果,正常な上皮細胞あるいは血管内皮細胞と比較して,母斑細胞では約2倍のDNA含量を示すことがわかった.さらに,G2期/M期のマーカーであるサイクリンB1や細胞増殖のマーカーであるKi67による組織免疫染色を行ったところ,母斑細胞においてはどちらの発現も認められなかった.これらの結果から,生体に存在する老化細胞も4倍体のG1期細胞であることが示唆された.
今回の筆者らの研究により,細胞老化の過程におけるG2期に特異的なp53の活性化に依存したAPC/Ccdh1によるタンパク質分解,および,pRbファミリーによる転写抑制を介して分裂期の回避が生じること,その結果として,老化細胞は4倍体のG1期細胞となり不可逆的な細胞増殖の停止をひき起こすことが明らかになった(図2).つまり,p53が細胞周期のどのステージにおいて活性化するかにより,p53による細胞運命の決定が大きく変化すると考えられた.
略歴:2008年 名古屋市立大学大学院薬学研究科博士課程 修了,同 研究員,米国NIHポスドクを経て,2011年より名古屋市立大学大学院医学研究科 助教.
中西 真(Makoto Nakanishi)
名古屋市立大学大学院医学研究科 教授.
© 2014 城村由和・中西 真 Licensed under CC 表示 2.1 日本
(名古屋市立大学大学院医学研究科 細胞生化学分野)
email:中西 真
DOI: 10.7875/first.author.2014.097
Necessary and sufficient role for a mitosis skip in senescence induction.
Yoshikazu Johmura, Midori Shimada, Toshinori Misaki, Aya Naiki-Ito, Hiroyuki Miyoshi, Noboru Motoyama, Naoko Ohtani, Eiji Hara, Motoki Nakamura, Akimichi Morita, Satoru Takahashi, Makoto Nakanishi
Molecular Cell, 55, 73-84 (2014)
この論文に出現する遺伝子・タンパク質のUniprot ID
がん抑制遺伝子, p53(P04637), pRbファミリー, APC/C, cdh1(Q9UM11), pRb遺伝子ファミリー, Ras遺伝子, CDK, p21(P38936), CDK1(P06493), CDK2(P24941), CDK4(P11802), CDK6(Q00534), p16(P42771), Cdh1(Q9UM11), pRb(P06400), p107(P28749), p130(Q08999), BRAF(P15056), サイクリンB1(P14635), Ki67(P46013), サイクリン, Cdk
要 約
細胞老化は不可逆的な細胞増殖の停止機構であり,重要な抗腫瘍化機構のひとつであると考えられている.以前より,細胞老化の誘導にはがん抑制遺伝子の産物であるp53およびpRbファミリーが必要不可欠であることは明らかになっていたが,これらのがん抑制遺伝子産物がどのような分子機構を介して細胞老化を特異的に誘導しているかについてはよくわかっていなかった.筆者らは,FUCCI系を用いて細胞老化の誘導の過程における細胞周期の変化を1細胞レベルで解析した.その結果,老化を誘導する刺激をうけた正常なヒトの2倍体細胞は,G2期における一時的な細胞周期の停止ののち,細胞分裂をすることなくG1期に進行する,いわゆる,分裂期の回避を生じて4倍体のG1期細胞となり,不可逆的な細胞増殖の停止をひき起こすことを見い出した.さらに,分裂期の回避はG2期におけるp53の活性化に依存したAPC/Ccdh1によるタンパク質分解,および,pRb遺伝子ファミリーによる転写抑制を介した分裂制御タンパク質の発現の顕著な低下により誘導され,細胞老化の誘導に必要かつ十分であることも明らかになった.
はじめに
Hayflickらにより,ヒトの正常な体細胞は培養皿で継代をくり返すと最終的に不可逆的な細胞増殖の停止をひき起こすことがはじめて示された1).のちの解析により,幹細胞を除く多くのヒトの正常な細胞にはテロメアの短小化に起因する細胞分裂の回数の限界(分裂寿命)のあることがわかり,分裂寿命により生じた細胞老化はとくに“複製老化”と定義づけられた.一方,細胞老化に関する研究が進むにつれ,Ras遺伝子などのがん遺伝子の活性化,酸化ストレス,DNA損傷などによっても細胞老化が誘導されることも明らかになり,これらは“ストレス性の細胞老化”などとよばれている2).細胞老化のもっとも重要かつ共通の特徴のひとつは不可逆的な細胞増殖の停止であり,その特徴から,細胞死を誘導するアポトーシスとならんで,もっとも重要な抗腫瘍化機構のひとつであると考えられている.また,近年の研究により,細胞老化は加齢にともなう病態にも深く関与することが明らかになりつつある3,4).
細胞老化の誘導機構については古くから活発に研究がなされており,がん抑制遺伝子の産物であるp53およびpRbファミリーが重要な役割をはたすことが明らかにされ,細胞老化の誘導機構がいくつか提唱されている5,6).とくに有力であると考えられているモデルでは,細胞老化を誘導するシグナルがDNA損傷応答を介して恒常的にp53を活性化し,活性化したp53が細胞周期のエンジンであるCDKファミリーの阻害タンパク質であるp21の発現上昇を介してpRbファミリーを活性化することにより,不可逆的に細胞周期をG1期に停止させていると考えられていた(図1).しかしながら,ごく最近になり,複製ストレスを起こした細胞の多くはG2期において細胞増殖を停止していることが報告された7).さらに以前より,DNA損傷により発現の上昇したp21がG2期からM期への移行に重要な役割をはたすCDK1およびCDK2の活性抑制を介してAPC/Ccdh1を活性化することにより,G2期における不可逆的な細胞周期の停止を誘導できることも報告されていた8).このように,細胞老化の誘導による不可逆的な細胞増殖の停止が細胞周期のどのステージで起こっているのか,その詳細な分子機構はどのようなものなのかについては,不明な点が多く残されていた.さらに重要な点として,細胞老化の誘導に重要であるp53およびpRbファミリーは,細胞老化の誘導だけでなく細胞周期の一時的な停止やアポトーシスを誘導することも知られており,細胞老化を特異的に誘導する分子機構について十分に理解できているとはいいがたかった.つまり,細胞老化を誘導する機構の詳細を明らかにすることは,新規のがんの治療法の開発や老化に関連する疾患の病態の理解につながるだけでなく,DNA損傷応答における細胞運命の決定という重要な命題を解き明かす鍵になることが期待される.
1.正常なヒトの2倍体細胞は老化の過程において分裂期の回避を生じ4倍体のG1期細胞になる
老化細胞が細胞周期のどのステージにおいて不可逆的に細胞増殖を停止するかを検討するため,FUCCI(fluorescent ubiquitination-based cell cycle indicator)系とよばれる細胞周期の動的な変化を生細胞イメージングにより観察する方法9) を応用することにより,細胞老化の過程における細胞周期の変化を1細胞レベルで解析した.その結果,がん遺伝子のストレスを含めたすべての細胞老化の過程において,多くの細胞がG2期における一時的な細胞周期の停止ののち,通常は起こるべき細胞分裂をすることなくG1期に進行する,いわゆる,分裂期の回避を生じて4倍体のG1期細胞となり,不可逆的に細胞周期を停止することを見い出した.また,老化の過程における分裂制御タンパク質の発現の変化を解析したところ,解析したすべてのタンパク質の発現が分裂期の回避のタイミングにあわせていちじるしく低下していることがわかった.この結果は,分裂制御タンパク質の発現の顕著な低下が分裂期の回避の引き金になっていることを示唆した.さらに,DNA損傷により細胞老化を誘導した細胞を蛍光セルソーターにより2倍体細胞と4倍体細胞とに分画したのち,細胞老化のマーカーであるCDK4およびCDK6の阻害タンパク質であるp16の発現の変化の解析,および,SA-β-gal(senescence-associated β-galactosidase)染色を行った.その結果,4倍体細胞はp16の発現の顕著な上昇を示すこと,そのほとんどがSA-β-gal陽性細胞であることがわかった.これらの結果から,老化細胞は分裂期の回避により生じた四倍体のG1期細胞であると考えられた.
2.G2期におけるp53の活性化は分裂期の回避および細胞老化の誘導に必要かつ十分である
分裂期の回避が誘導される分子機構および細胞老化の誘導における役割について調べた.がん抑制遺伝子の産物であるp53は細胞老化の誘導の鍵となるタンパク質であることが知られていることから,RNAi法を用いて,p53遺伝子の発現の抑制をテトラサイクリンにより誘導できる細胞株を樹立し,FUCCI系により生細胞イメージング解析を行った.その結果,対照となる細胞と比較して,p53の発現を抑制した細胞の多くにおいては老化を誘導する種々の刺激に対し分裂期の回避は起こらないことがわかった.また,このとき,SA-β-gal陽性細胞の顕著な減少も認められた.以上より,p53は分裂期の回避および細胞老化の誘導に必須であることが示された.
以前の報告より,p53の単純な活性化だけでは細胞老化を誘導できないと考えられていた.そこで,細胞周期に特異的かつ一過的にp53の発現を制御できる系を構築するため,レンチウイルスベクターを用いて,p53遺伝子の発現をテトラサイクリンにより誘導できる細胞株を樹立した.この細胞をCDK1の阻害剤によりG2期に同調させたのち,ドキシサイクリンで48時間処理することによりp53を一過的に発現させたところ,多くの細胞において分裂期の回避および不可逆的な細胞増殖の停止が認められた.一方,血清飢餓やDNA複製阻害剤などによりG0期やG1期/S期に同調した細胞に一過的にp53を発現させても細胞老化の誘導は認められなかった.また,p53の分解においてはたらくユビキチンリガーゼとして知られるMdm2の阻害剤を用いてp53の発現を一過的に上昇させた場合にも同様の結果が得られた.以上の結果より,G2期におけるp53の活性化が分裂期の回避および細胞老化の誘導に必要かつ十分であることが明らかになった.
3.p53はAPC/Ccdh1によるタンパク質分解とpRbファミリーによる転写抑制を介して分裂期の回避を誘導する
p53による分裂期の回避の制御機構について明らかにするため,p53により転写の制御される主要な遺伝子の産物であるp21に着目して,発現抑制系および過剰発現系において解析した.その結果,p21は部分的ではあるものの分裂期の回避および細胞老化の誘導に関与することが明らかになった.
p21の発現の上昇はユビキチン系を介したタンパク質分解を制御するタンパク質複合体APC/Ccdh1の活性化を介して長期的に細胞周期をG2期に停止させることが報告されている8).そこで,Cdh1遺伝子の発現の抑制をテトラサイクリンにより誘導できる細胞株を用いて,細胞老化を誘導する種々の刺激に対する影響を解析した.その結果,対照となる細胞と比較して遅延は認められたものの,Cdh1の発現を抑制した細胞の多くには分裂期の回避が誘導されること,さらには,老化細胞になることがわかった.また,老化を誘導した細胞にプロテアソームの阻害剤を添加して分裂期の回避に対する影響を解析したところ,タンパク質分解以外の機構も重要な役割をはたすことが示された.以上より,分裂期の回避および細胞老化の誘導にはp53-p21シグナル伝達経路によるAPC/Ccdh1の活性化を介したタンパク質分解だけでは十分ではないことが示唆された.
細胞老化の過程におけるM期制御タンパク質の遺伝子レベルでの発現の変化を定量PCR法により解析した結果,これらの発現はp53に依存して抑制されることが明らかになった.p53はpRbファミリーを間接的に活性化することにより細胞周期に関連する遺伝子の発現抑制に関与することが知られている.実際,pRbファミリーであるpRb,p107,p130の三重発現抑制細胞株を用いて解析したところ,細胞老化を誘導する刺激に対してM期制御タンパク質の発現の抑制は認められず,pRbファミリーがp53の下流において分裂期の回避の制御に関与することが明らかになった.
これらの検討により,p53はAPC/Ccdh1およびpRbファミリーを協調的に活性化することにより分裂期の回避および細胞老化を誘導する可能性が考えられた.この可能性を検討するため,Cdh1およびpRbの構成的な活性化変異体それぞれ単独の発現,あるいは,その両方の発現をテトラサイクリンにより誘導できる細胞株を樹立して解析した.その結果,p53を過剰に発現する細胞と同様に,Cdh1およびpRbの発現をG2期において一過的に誘導した場合のみ,分裂期の回避および細胞老化の誘導が認められた.
4.p16は老化細胞の不可逆的な細胞増殖の停止に必要である
CDK4およびCDK6の阻害タンパク質であるp16は細胞老化のマーカーであり,老化形質の獲得に深く関与することが知られている.p16遺伝子の発現の抑制をテトラサイクリンにより誘導できる細胞株を用いて,FUCCI系による生細胞イメージング解析を行ったところ,p16は分裂期の回避には関与しないことがわかった.しかしながら,分裂期の回避により生じた4倍体のG1期細胞においてp16の発現を抑制したところ,4倍体のG1期細胞がふたたびDNA複製を開始して8倍体細胞の生じることが見い出された.この結果から,p16が分裂期の回避により生じた老化細胞の不可逆的な細胞増殖を停止する重要な制御タンパク質であることが示された.
5.生体に存在する老化細胞も4倍体のG1期細胞である
分裂期の回避がヒトの生体においても細胞老化の誘導において重要な役割をはたしているかどうかを検討した.ヒトの母斑細胞(ほくろ)はRas遺伝子の下流ではたらくリン酸化酵素BRAFの変異により生じる老化細胞であることが報告されている10).そこで,母斑の組織切片における細胞のDNA含量を測定するためDAPI染色を行った.その結果,正常な上皮細胞あるいは血管内皮細胞と比較して,母斑細胞では約2倍のDNA含量を示すことがわかった.さらに,G2期/M期のマーカーであるサイクリンB1や細胞増殖のマーカーであるKi67による組織免疫染色を行ったところ,母斑細胞においてはどちらの発現も認められなかった.これらの結果から,生体に存在する老化細胞も4倍体のG1期細胞であることが示唆された.
おわりに
今回の筆者らの研究により,細胞老化の過程におけるG2期に特異的なp53の活性化に依存したAPC/Ccdh1によるタンパク質分解,および,pRbファミリーによる転写抑制を介して分裂期の回避が生じること,その結果として,老化細胞は4倍体のG1期細胞となり不可逆的な細胞増殖の停止をひき起こすことが明らかになった(図2).つまり,p53が細胞周期のどのステージにおいて活性化するかにより,p53による細胞運命の決定が大きく変化すると考えられた.
文 献
- Hayflick, L. & Moorhead, P. S.: The serial cultivation of human diploid cell strains. Exp. Cell Res., 25, 585-621 (1961)[PubMed]
- Kuilman, T., Michaloglou, C., Mooi, W. J. et al.: The essence of senescence. Genes Dev, 24, 2463-2479 (2010)[PubMed]
- Campisi, J. & d'Adda di Fagagna, F.: Cellular senescence: when bad things happen to good cells. Nat. Rev. Mol. Cell Biol., 8, 729-740 (2007)[PubMed]
- Halazonetis, T. D., Gorgoulis, V. G. & Bartek, J.: An oncogene-induced DNA damage model for cancer development. Science, 319, 1352-1355 (2008)[PubMed]
- Adams, P. D.: Healing and hurting: molecular mechanisms, functions, and pathologies of cellular senescence. Mol. Cell, 36, 2-14 (2009)[PubMed]
- Courtois-Cox, S., Jones, S. L. & Cichowski, K.: Many roads lead to oncogene-induced senescence. Oncogene, 27, 2801-2809 (2008)[PubMed]
- Mao, Z., Ke, Z., Gorbunova, V. et al.: Replicatively senescent cells are arrested in G1 and G2 phases. Aging, 4, 431-435 (2012)[PubMed]
- Wiebusch, L. & Hagemeier, C.: p53- and p21-dependent premature APC/C-Cdh1 activation in G2 is part of the long-term response to genotoxic stress. Oncogene, 29, 3477-3489 (2010)[PubMed]
- Sakaue-Sawano, A., Kurokawa, H., Morimura, T. et al.: Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell, 132, 487-498 (2008)[PubMed]
- Michaloglou, C., Vredeveld, L. C., Soengas, M. S. et al.: BRAFE600-associated senescence-like cell cycle arrest of human naevi. Nature, 436, 720-704 (2005)[PubMed]
著者プロフィール
略歴:2008年 名古屋市立大学大学院薬学研究科博士課程 修了,同 研究員,米国NIHポスドクを経て,2011年より名古屋市立大学大学院医学研究科 助教.
中西 真(Makoto Nakanishi)
名古屋市立大学大学院医学研究科 教授.
© 2014 城村由和・中西 真 Licensed under CC 表示 2.1 日本