線維芽細胞からiPS細胞を経由せず直接的に心筋細胞を作製することに成功
家田 真樹
(慶應義塾大学医学部 臨床分子循環器病学講座)
email:家田真樹
DOI: 10.7875/first.author.2010.020
Direct reprogramming of fibroblasts into functional cardiomyocytes bydefined factors.
Masaki Ieda, Ji-Dong Fu, Paul Delgado-Olguin, Vasanth Vedantham, Yohei Hayashi, Benoit G. Bruneau, Deepak Srivastava
Cell, 142, 375-386 (2010)
心筋細胞は終末分化細胞であり再生できないため,心臓はいちど障害をうけると線維芽細胞の増殖により瘢痕化する.幹細胞は心臓再生医療の細胞源として期待されているが,その使用には,分化誘導の効率,腫瘍形成の可能性,細胞生着など,さまざまな問題がある.もし,心臓にある線維芽細胞を直接的に心筋細胞に分化転換できたなら,これらの問題を一気に解決できるかもしれない.4因子の導入による線維芽細胞からのiPS細胞の樹立は,体細胞を多能性細胞にもどさず直接的にほかの細胞系列に転換することが可能であることを示唆している.心臓には多数の線維芽細胞が存在するが,これまで,直接,体細胞を心筋細胞に転換できるような心筋細胞マスター遺伝子は発見されていなかった.そこで筆者らは,単数ではなく複数の心筋細胞誘導タンパク質を同時に導入することで,直接,線維芽細胞を心筋細胞に分化転換できるのではないかという仮説をたてた.心筋細胞誘導タンパク質の探索として,マウス胎仔の心筋細胞で特異的に発現する遺伝子をマイクロアレイ法で確認し,そのなかから14の候補遺伝子を選択してスクリーニングを開始した.その結果,心臓発生に重要な3つの転写因子,Gata4,Mef2c,Tbx5の同時導入により線維芽細胞から心筋様細胞への分化転換を確認できた.誘導された心筋様細胞では,心筋細胞に特異的なマーカーの発現,心筋細胞に類似したグローバルな遺伝子発現パターン,自律的な細胞の拍動が認められた.3因子を導入した線維芽細胞をマウス心臓に移植したところ,心筋様細胞への分化転換も観察された.これらの結果から,体細胞を直接的に心筋細胞へ転換することは可能であるものと考えられた.心臓に多く存在する線維芽細胞を直接的に心筋細胞へと転換できるこの技術は,心臓再生医療の実現にむけ大きなブレークスルーとなることが期待される.
心臓はさまざまな種類の細胞により構成されている臓器で,心筋細胞のみならず,血管,線維芽細胞などによりその機能は綿密に制御されている.心臓を構成する細胞のうち,細胞数でみると心筋細胞は全体の約30%程度であり,残り50%以上は心臓線維芽細胞でしめられている1).心筋細胞は終末分化細胞であり自己複製能がないため,心筋梗塞,心不全では心筋細胞は減少し,そのかわり線維芽細胞が増殖して障害部位を線維瘢痕化させる.
2006年,4因子の導入による線維芽細胞からiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)の樹立が報告されたが2),心臓再生としてiPS細胞をはじめとした幹細胞を心筋細胞に分化させ,それを心臓に移植して心機能を回復させる方法は非常に期待されており,現在も世界中で活発に研究が行われている3).しかし,幹細胞の使用には,目的細胞への分化誘導効率,未分化細胞の混入による腫瘍形成の可能性,移植細胞の生着性など,さまざまな問題が指摘されている.そこで筆者らは,これまでとは異なるアプローチとして,心臓に多く存在する線維芽細胞を,幹細胞を経由することなく,直接,心筋細胞へと分化転換することはできないかと考えた.これには体細胞から心筋細胞を直接的に誘導できる心筋細胞マスター遺伝子が必要であるが,1987年に骨格筋のマスター遺伝子MyoDが発見されて以来,心筋細胞マスター遺伝子探しが行われきたものの,これまで成功はしていない4).しかし,近年の複数の転写因子の導入によるiPS細胞の樹立は体細胞の可塑性を示しており,また,単数ではなく複数のタンパク質を同時に導入することで,直接,線維芽細胞を心筋細胞に分化転換できる可能性があるのではないかと考えた.
まず,線維芽細胞からの心筋細胞の誘導を定量的に観察しスクリーニングできる方法を確立した.そのために,成熟分化した心筋細胞でのみ特異的にGFPを発現するトランスジェニックマウス,α型ミオシン重鎖-GFPマウスを作製した.このトランスジェニックマウスでは心筋細胞のみがGFPを発現し,線維芽細胞の状態ではGFPを発現しないため,培養皿上で線維芽細胞から心筋細胞への分化転換が成功するとGFPを発現するようになり,それをフローサイトメーターで定量的に解析することができた.
つぎに,心筋細胞誘導タンパク質をコードする候補遺伝子として,マウス胎仔期の心筋細胞に特異的に発現し,かつ,心臓形成に重要な遺伝子を選定した.そのためにまず,2009年に開発した,心筋細胞と心臓線維芽細胞とをフローサイトメーターで高純度に分別する方法により,マウス胎仔の心筋細胞に特異的に発現する遺伝子を同定した2).この遺伝子発現情報と,その遺伝子をノックアウトしたときのマウス表現型(胎生致死かつ心臓奇形をもつ)の情報を組み合わせ,14の遺伝子を心筋細胞誘導タンパク質の候補遺伝子としてスクリーニングを開始した.
まず,14種類の候補遺伝子すべてをレトロウイルスベクターにより心臓線維芽細胞に遺伝子導入した.その結果,ウイルス導入後1週間で約1.7%の線維芽細胞がGFPを発現し,心筋細胞へと分化している可能性が示唆された.一方,陰性対照群ではGFPを発現する細胞はまったく観察されなかった.そこで,さらに14の遺伝子から1遺伝子ずつを除いた組合せで遺伝子導入を行ない,GFPの発現を検討した.その結果,14のうち3つの遺伝子(Gata4,Mef2c,Tbx5をコード)の組合せで約17%の線維芽細胞がGFPを発現するようになり,この3つの遺伝子からさらに遺伝子を除くとGFPやほかの心筋細胞マーカーが発現しなくなることにより,Gata4,Mef2c,Tbx5の3つの因子の同時導入が心筋細胞の誘導に必須であることが示唆された.そこで,この線維芽細胞より誘導された心筋様細胞をiCM細胞(induced cardiomyocytes)と名づけた.
得られたiCM細胞と心筋細胞とを比較した.GFPを発現するiCM細胞を免疫染色で観察したところ,たしかにαアクニチン,心筋トロポニンT,心房性ナトリウム利尿ペプチド(ANF)など心筋細胞に特異的なタンパク質を発現しており,また,心筋に特徴的とされる横紋筋構造も観察された.すべての遺伝子の発現パターンをマイクロアレイ法により検討したところ,iCM細胞は心筋細胞に非常に類似した遺伝子発現パターンを示し,逆に,線維芽細胞とはまったく異なっていた.
つぎに,細胞のエピジェネティックな状態を確認するため,心筋細胞に特異的な遺伝子のプロモーター領域におけるヒストンメチル化とDNAメチル化を,線維芽細胞,iCM細胞,心筋細胞とで比較検討した.クロマチン免疫沈降(chromatin immunoprecipitation:ChIP)法の結果より,線維芽細胞と比較してiCM細胞ではヒストンメチル化の抑制マーカーであるヒストンH3の27番目のリジン残基のトリメチル化は心筋細胞と同程度まで低下しており,逆に,活性化マーカーであるヒストンH3の4番目のリジン残基のトリメチル化は上昇していた.バイサルファイトシークエンス法の結果より,線維芽細胞と比較してiCM細胞では心筋細胞に特異的な遺伝子のプロモーター領域のDNAの脱メチル化が進行しており,心筋細胞と同じくらいの程度まで低メチル化状態となっていた.
iCM細胞が心筋細胞に特徴的な生理機能をもつかどうかを検討するため,Ca2+イメージング,および,パッチクランプ法を行った.Rhod-3を用いたCa2+イメージングでは,iCM細胞にはたしかに細胞内Ca2+の自律的な変化があり,その変化様式は新生仔マウスの心筋細胞に類似していた.また,パッチクランプ法ではiCM細胞はマウス心室筋細胞と同様な心筋細胞に特徴的な活動電位を示し,重要なことに,iCM細胞の自律的な収縮も観察された5).
以上の結果より,iCM細胞は,遺伝子発現パターン,エピジェネティックレベル,また,生理的にも,心筋細胞に類似した細胞であることが確認された.
線維芽細胞からiCM細胞の誘導が直接の分化転換なのか,それとも,いちど心臓前駆細胞にもどってから心筋細胞に分化しているのか,その分化転換経路を検討した.そのため,心臓前駆細胞でYFPを特異的に発現するコンディショナルトランスジェニックマウスを作製することで,心臓前駆細胞から派生する細胞すべてをYFPの蛍光で識別できるようにした6,7).もし,心臓前駆細胞を経由するならばiCM細胞はYFPを発現するのに対し,心臓前駆細胞を経由せず直接に心筋細胞となるならばiCM細胞はYFPを発現しない.結果は,ほぼすべてのiCM細胞がYFPを発現せず,線維芽細胞は3因子の導入により前駆細胞を介さず直接に心筋様細胞に分化転換することが示唆された.
心筋細胞への直接の分化転換が生体内で可能かどうかを検討した.Gata4,Mef2c,Tbx5の3因子を導入した線維芽細胞を,導入後1日目,まだiCM細胞に分化転換するまえにマウスの心臓に移植した.細胞移植後2週間で心臓を免疫染色したところ,3因子を導入した線維芽細胞は心臓でGFPを発現するiCM細胞に転換しており,αアクニチンなど心筋細胞に特異的なタンパク質の発現,および,横紋筋構造も観察された.以上の結果より,心筋細胞への直接の分化転換は生体内でも可能だと考えられた.
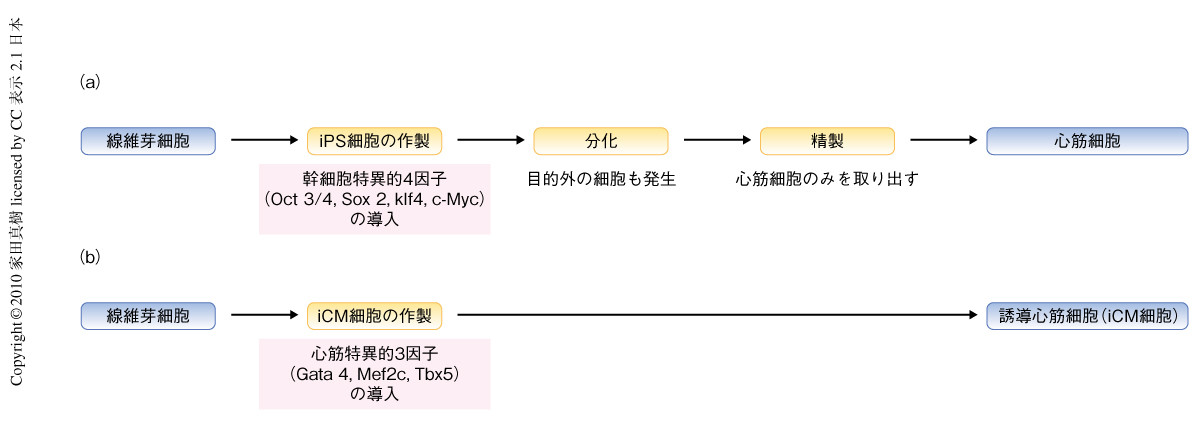
心臓発生に重要な3つの転写因子Gata4,Mef2c,Tbx5の同時導入により,線維芽細胞から心筋様細胞への直接の分化転換に成功した8).分化した体細胞から心筋細胞を直接に作製できたという報告はこれがはじめてである.この新しい技術は,従来のiPS細胞を用いた心筋細胞の再生方法に比べて,1)ステップが単純なため簡便で時間も短縮できる,2)未分化細胞を経由しないため腫瘍発現のリスクが少ない,3)心臓に存在する線維芽細胞を直接的に心筋細胞に転換すれば線維化した心臓病変をその場で心筋細胞に転換でき細胞移植の必要がなくなる,などの利点をもつ(図1).心筋細胞への誘導効率のさらなる改善や分化転換過程の分子基盤の解明の研究がさらに進展し,将来の心臓再生医療を真に実現できるよう願っている.
略歴:内科医として勤務ののち,1999年 慶應義塾大学医学部 助手.多くの患者さんを診るうちに心臓病に関する疑問がわき,2000年ごろより基礎研究を開始する.2005年 同大学 医学博士,2007年 米国California大学San Francisco校Gladstone Institute留学を経て,2010年より慶應義塾大学医学部 講師.
研究テーマ:心臓の再生・発生,心臓病の分子基盤の解明.
抱負:多くのすぐれた臨床医科学者を育てたい.基礎研究を臨床につなげたい.
© 2010 家田 真樹 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 臨床分子循環器病学講座)
email:家田真樹
DOI: 10.7875/first.author.2010.020
Direct reprogramming of fibroblasts into functional cardiomyocytes bydefined factors.
Masaki Ieda, Ji-Dong Fu, Paul Delgado-Olguin, Vasanth Vedantham, Yohei Hayashi, Benoit G. Bruneau, Deepak Srivastava
Cell, 142, 375-386 (2010)
要 約
心筋細胞は終末分化細胞であり再生できないため,心臓はいちど障害をうけると線維芽細胞の増殖により瘢痕化する.幹細胞は心臓再生医療の細胞源として期待されているが,その使用には,分化誘導の効率,腫瘍形成の可能性,細胞生着など,さまざまな問題がある.もし,心臓にある線維芽細胞を直接的に心筋細胞に分化転換できたなら,これらの問題を一気に解決できるかもしれない.4因子の導入による線維芽細胞からのiPS細胞の樹立は,体細胞を多能性細胞にもどさず直接的にほかの細胞系列に転換することが可能であることを示唆している.心臓には多数の線維芽細胞が存在するが,これまで,直接,体細胞を心筋細胞に転換できるような心筋細胞マスター遺伝子は発見されていなかった.そこで筆者らは,単数ではなく複数の心筋細胞誘導タンパク質を同時に導入することで,直接,線維芽細胞を心筋細胞に分化転換できるのではないかという仮説をたてた.心筋細胞誘導タンパク質の探索として,マウス胎仔の心筋細胞で特異的に発現する遺伝子をマイクロアレイ法で確認し,そのなかから14の候補遺伝子を選択してスクリーニングを開始した.その結果,心臓発生に重要な3つの転写因子,Gata4,Mef2c,Tbx5の同時導入により線維芽細胞から心筋様細胞への分化転換を確認できた.誘導された心筋様細胞では,心筋細胞に特異的なマーカーの発現,心筋細胞に類似したグローバルな遺伝子発現パターン,自律的な細胞の拍動が認められた.3因子を導入した線維芽細胞をマウス心臓に移植したところ,心筋様細胞への分化転換も観察された.これらの結果から,体細胞を直接的に心筋細胞へ転換することは可能であるものと考えられた.心臓に多く存在する線維芽細胞を直接的に心筋細胞へと転換できるこの技術は,心臓再生医療の実現にむけ大きなブレークスルーとなることが期待される.
はじめに
心臓はさまざまな種類の細胞により構成されている臓器で,心筋細胞のみならず,血管,線維芽細胞などによりその機能は綿密に制御されている.心臓を構成する細胞のうち,細胞数でみると心筋細胞は全体の約30%程度であり,残り50%以上は心臓線維芽細胞でしめられている1).心筋細胞は終末分化細胞であり自己複製能がないため,心筋梗塞,心不全では心筋細胞は減少し,そのかわり線維芽細胞が増殖して障害部位を線維瘢痕化させる.
2006年,4因子の導入による線維芽細胞からiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)の樹立が報告されたが2),心臓再生としてiPS細胞をはじめとした幹細胞を心筋細胞に分化させ,それを心臓に移植して心機能を回復させる方法は非常に期待されており,現在も世界中で活発に研究が行われている3).しかし,幹細胞の使用には,目的細胞への分化誘導効率,未分化細胞の混入による腫瘍形成の可能性,移植細胞の生着性など,さまざまな問題が指摘されている.そこで筆者らは,これまでとは異なるアプローチとして,心臓に多く存在する線維芽細胞を,幹細胞を経由することなく,直接,心筋細胞へと分化転換することはできないかと考えた.これには体細胞から心筋細胞を直接的に誘導できる心筋細胞マスター遺伝子が必要であるが,1987年に骨格筋のマスター遺伝子MyoDが発見されて以来,心筋細胞マスター遺伝子探しが行われきたものの,これまで成功はしていない4).しかし,近年の複数の転写因子の導入によるiPS細胞の樹立は体細胞の可塑性を示しており,また,単数ではなく複数のタンパク質を同時に導入することで,直接,線維芽細胞を心筋細胞に分化転換できる可能性があるのではないかと考えた.
1.心筋細胞誘導タンパク質のスクリーニング
まず,線維芽細胞からの心筋細胞の誘導を定量的に観察しスクリーニングできる方法を確立した.そのために,成熟分化した心筋細胞でのみ特異的にGFPを発現するトランスジェニックマウス,α型ミオシン重鎖-GFPマウスを作製した.このトランスジェニックマウスでは心筋細胞のみがGFPを発現し,線維芽細胞の状態ではGFPを発現しないため,培養皿上で線維芽細胞から心筋細胞への分化転換が成功するとGFPを発現するようになり,それをフローサイトメーターで定量的に解析することができた.
つぎに,心筋細胞誘導タンパク質をコードする候補遺伝子として,マウス胎仔期の心筋細胞に特異的に発現し,かつ,心臓形成に重要な遺伝子を選定した.そのためにまず,2009年に開発した,心筋細胞と心臓線維芽細胞とをフローサイトメーターで高純度に分別する方法により,マウス胎仔の心筋細胞に特異的に発現する遺伝子を同定した2).この遺伝子発現情報と,その遺伝子をノックアウトしたときのマウス表現型(胎生致死かつ心臓奇形をもつ)の情報を組み合わせ,14の遺伝子を心筋細胞誘導タンパク質の候補遺伝子としてスクリーニングを開始した.
まず,14種類の候補遺伝子すべてをレトロウイルスベクターにより心臓線維芽細胞に遺伝子導入した.その結果,ウイルス導入後1週間で約1.7%の線維芽細胞がGFPを発現し,心筋細胞へと分化している可能性が示唆された.一方,陰性対照群ではGFPを発現する細胞はまったく観察されなかった.そこで,さらに14の遺伝子から1遺伝子ずつを除いた組合せで遺伝子導入を行ない,GFPの発現を検討した.その結果,14のうち3つの遺伝子(Gata4,Mef2c,Tbx5をコード)の組合せで約17%の線維芽細胞がGFPを発現するようになり,この3つの遺伝子からさらに遺伝子を除くとGFPやほかの心筋細胞マーカーが発現しなくなることにより,Gata4,Mef2c,Tbx5の3つの因子の同時導入が心筋細胞の誘導に必須であることが示唆された.そこで,この線維芽細胞より誘導された心筋様細胞をiCM細胞(induced cardiomyocytes)と名づけた.
2.iCM細胞は心筋細胞に類似した細胞である
得られたiCM細胞と心筋細胞とを比較した.GFPを発現するiCM細胞を免疫染色で観察したところ,たしかにαアクニチン,心筋トロポニンT,心房性ナトリウム利尿ペプチド(ANF)など心筋細胞に特異的なタンパク質を発現しており,また,心筋に特徴的とされる横紋筋構造も観察された.すべての遺伝子の発現パターンをマイクロアレイ法により検討したところ,iCM細胞は心筋細胞に非常に類似した遺伝子発現パターンを示し,逆に,線維芽細胞とはまったく異なっていた.
つぎに,細胞のエピジェネティックな状態を確認するため,心筋細胞に特異的な遺伝子のプロモーター領域におけるヒストンメチル化とDNAメチル化を,線維芽細胞,iCM細胞,心筋細胞とで比較検討した.クロマチン免疫沈降(chromatin immunoprecipitation:ChIP)法の結果より,線維芽細胞と比較してiCM細胞ではヒストンメチル化の抑制マーカーであるヒストンH3の27番目のリジン残基のトリメチル化は心筋細胞と同程度まで低下しており,逆に,活性化マーカーであるヒストンH3の4番目のリジン残基のトリメチル化は上昇していた.バイサルファイトシークエンス法の結果より,線維芽細胞と比較してiCM細胞では心筋細胞に特異的な遺伝子のプロモーター領域のDNAの脱メチル化が進行しており,心筋細胞と同じくらいの程度まで低メチル化状態となっていた.
iCM細胞が心筋細胞に特徴的な生理機能をもつかどうかを検討するため,Ca2+イメージング,および,パッチクランプ法を行った.Rhod-3を用いたCa2+イメージングでは,iCM細胞にはたしかに細胞内Ca2+の自律的な変化があり,その変化様式は新生仔マウスの心筋細胞に類似していた.また,パッチクランプ法ではiCM細胞はマウス心室筋細胞と同様な心筋細胞に特徴的な活動電位を示し,重要なことに,iCM細胞の自律的な収縮も観察された5).
以上の結果より,iCM細胞は,遺伝子発現パターン,エピジェネティックレベル,また,生理的にも,心筋細胞に類似した細胞であることが確認された.
3.線維芽細胞は3因子の導入により前駆細胞にもどらず心筋細胞に転換する
線維芽細胞からiCM細胞の誘導が直接の分化転換なのか,それとも,いちど心臓前駆細胞にもどってから心筋細胞に分化しているのか,その分化転換経路を検討した.そのため,心臓前駆細胞でYFPを特異的に発現するコンディショナルトランスジェニックマウスを作製することで,心臓前駆細胞から派生する細胞すべてをYFPの蛍光で識別できるようにした6,7).もし,心臓前駆細胞を経由するならばiCM細胞はYFPを発現するのに対し,心臓前駆細胞を経由せず直接に心筋細胞となるならばiCM細胞はYFPを発現しない.結果は,ほぼすべてのiCM細胞がYFPを発現せず,線維芽細胞は3因子の導入により前駆細胞を介さず直接に心筋様細胞に分化転換することが示唆された.
4.3因子を導入した線維芽細胞は心臓でiCM細胞に転換する
心筋細胞への直接の分化転換が生体内で可能かどうかを検討した.Gata4,Mef2c,Tbx5の3因子を導入した線維芽細胞を,導入後1日目,まだiCM細胞に分化転換するまえにマウスの心臓に移植した.細胞移植後2週間で心臓を免疫染色したところ,3因子を導入した線維芽細胞は心臓でGFPを発現するiCM細胞に転換しており,αアクニチンなど心筋細胞に特異的なタンパク質の発現,および,横紋筋構造も観察された.以上の結果より,心筋細胞への直接の分化転換は生体内でも可能だと考えられた.
おわりに
心臓発生に重要な3つの転写因子Gata4,Mef2c,Tbx5の同時導入により,線維芽細胞から心筋様細胞への直接の分化転換に成功した8).分化した体細胞から心筋細胞を直接に作製できたという報告はこれがはじめてである.この新しい技術は,従来のiPS細胞を用いた心筋細胞の再生方法に比べて,1)ステップが単純なため簡便で時間も短縮できる,2)未分化細胞を経由しないため腫瘍発現のリスクが少ない,3)心臓に存在する線維芽細胞を直接的に心筋細胞に転換すれば線維化した心臓病変をその場で心筋細胞に転換でき細胞移植の必要がなくなる,などの利点をもつ(図1).心筋細胞への誘導効率のさらなる改善や分化転換過程の分子基盤の解明の研究がさらに進展し,将来の心臓再生医療を真に実現できるよう願っている.
文 献
- Ieda, M., Tsuchihashi, T., Ivey, K. N. et al.: Cardiac fibroblasts regulate myocardial proliferation through beta1 integrin signaling. Dev. Cell, 16, 233-244 (2009)[PubMed]
- Takahashi, K. & Yamanaka, S.: Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126, 663-676 (2006)[PubMed]
- Zhang, J., Wilson, G. F., Soerens, A. G. et al.: Functional cardiomyocytes derived from human induced pluripotent stem cells. Circ. Res., 104, e30-41 (2009)[PubMed]
- Davis, R. L., Weintraub, H., Lassar, A. B.: Expression of a single transfected cDNA converts fibroblasts to myoblasts. Cell, 51, 987-1000 (1987)[PubMed]
- Ieda, M., Kanazawa, H., Kimura, K. et al.: Sema3a maintains normal heart rhythm through sympathetic innervation patterning. Nat. Med., 13, 604-612 (2007)[PubMed]
- David, R., Brenner, C., Stieber, J. et al.: MesP1 drives vertebrate cardiovascular differentiation through Dkk-1-mediated blockade of Wnt-signalling. Nat. Cell Biol., 10, 338-345 (2008)[PubMed]
- Laugwitz, K. L., Moretti, A., Lam, J. et al.: Postnatal isl1+ cardioblasts enter fully differentiated cardiomyocyte lineages. Nature, 433, 647-653 (2005)[PubMed]
- Srivastava, D.: Making or breaking the heart: from lineage determination to morphogenesis. Cell, 126, 1037-1048 (2006)[PubMed]
著者プロフィール
略歴:内科医として勤務ののち,1999年 慶應義塾大学医学部 助手.多くの患者さんを診るうちに心臓病に関する疑問がわき,2000年ごろより基礎研究を開始する.2005年 同大学 医学博士,2007年 米国California大学San Francisco校Gladstone Institute留学を経て,2010年より慶應義塾大学医学部 講師.
研究テーマ:心臓の再生・発生,心臓病の分子基盤の解明.
抱負:多くのすぐれた臨床医科学者を育てたい.基礎研究を臨床につなげたい.
© 2010 家田 真樹 Licensed under CC 表示 2.1 日本