FHOD1はnesprin-2Gとの相互作用によりアクチンに依存した核の移動を仲介する
安徳 晋・Gregg G. Gundersen
(米国Columbia大学Department of Pathology and Cell Biology)
email:安徳 晋
DOI: 10.7875/first.author.2014.094
FHOD1 interaction with nesprin-2G mediates TAN line formation and nuclear movement.
Stefan Kutscheidt, Ruijun Zhu, Susumu Antoku, Gant W. Luxton, Igor Stagljar, Oliver T. Fackler, Gregg G. Gundersen
Nature Cell Biology, 16, 708-715 (2014)
後生動物は,細胞分裂,細胞分化,細胞運動を制御するため,細胞における核の位置を制御している.繊維芽細胞においては,アクチンの求心性の流動が核を細胞の進行とは逆の方向,つまり,後方へと移動させることにより細胞が極性化し細胞運動がはじまる.このアクチンの求心性の流動による核の移動は,TANラインとよばれる複合体の構成タンパク質であるnesprin-2Gがアクチンと核とをつなぐことにより可能になっている.今回の研究において,筆者らは,Diaphanous関連ForminファミリーのメンバーであるFHOD1がnesprin-2Gと相互作用していることを発見した.ノックダウン実験およびドミナントネガティブ阻害実験により,FHOD1,あるいは,FHOD1とnesprin-2Gとの相互作用は,極性化する繊維芽細胞における核の移動において不可欠であることが示された.FHOD1は細胞の背側におけるアクチン繊維束の形成やその流動ではなく,TANラインの形成において必要であった.FHOD1をノックダウンした細胞にさまざまなFHOD1の変異体および領域を発現させるレスキュー実験により,FHOD1が核の移動のために必須であるアクチン繊維束への付加的な結合をnesprin-2Gにもたらす機構が明らかにされた.これらの結果から,オルガネラをアクチン繊維につなぎその移動をサポートするというFHOD1というこのForminファミリータンパク質のもつ独特の役割が明らかにされた.
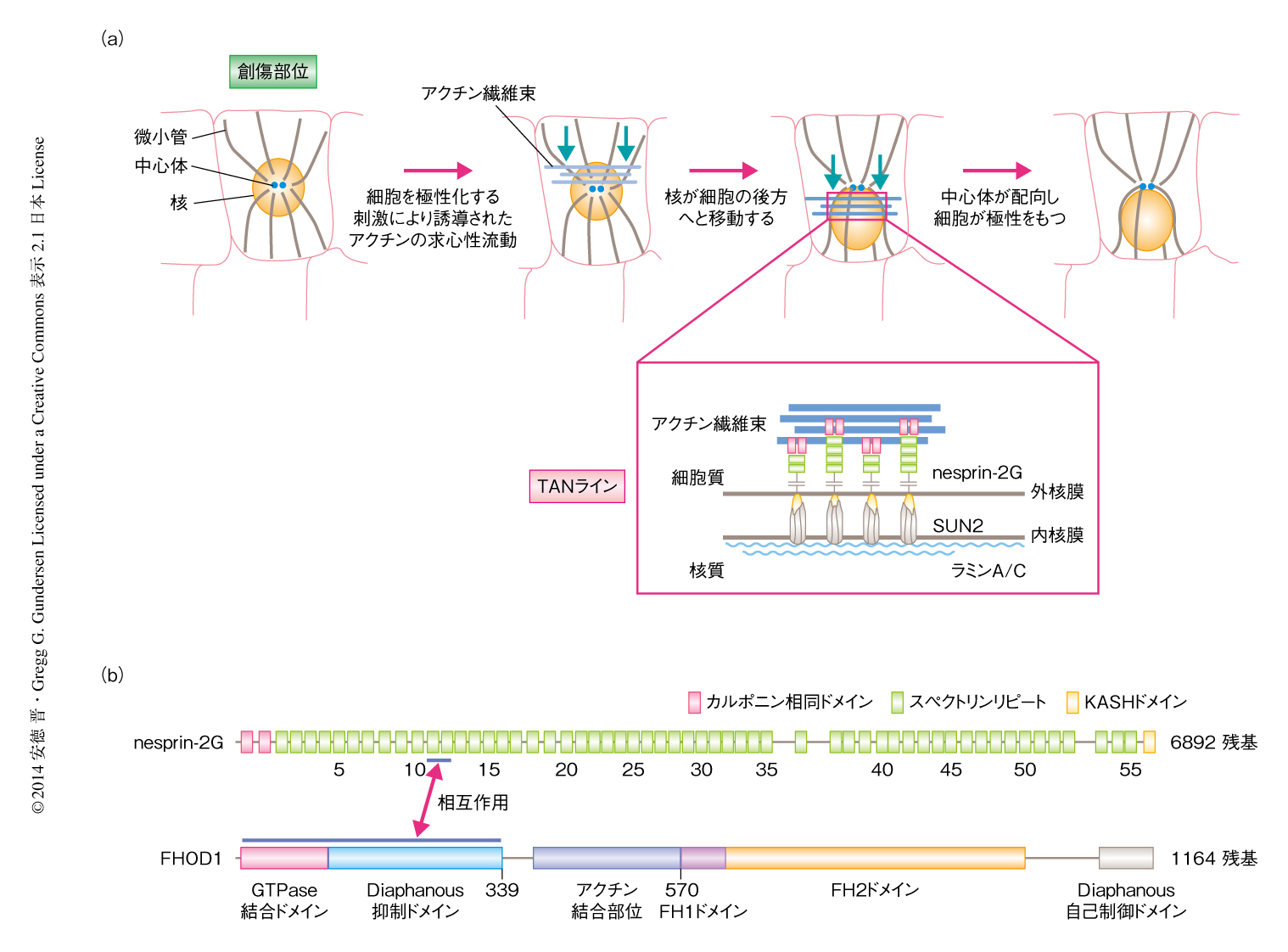
後生動物においては組織の発達および維持のため,核はそのときどきに応じて細胞の特定の場所に局在している.核の位置の制御がうまくいかないと,細胞の極性化や細胞運動に支障をきたし,大脳皮質の形成,内耳の感覚上皮における有毛細胞の協調的な発達,神経筋接合部の形成などに異常をひき起こすことがわかっている1).LINC複合体は細胞骨格と核質とをつなぐタンパク質複合体であり,細胞における核の位置の制御に重要である1)(図1a).LINC複合体は外核膜タンパク質であるnespirinと内核膜タンパク質であるSUNから構成される.nespirinとSUNは特定の細胞骨格の構成タンパク質と核ラミナとのあいだを結合することにより細胞骨格と核質をつないでいる.単層培養し血清飢餓処理を施した繊維芽細胞をひっかいて傷を形成した実験系では,核および中心体は細胞の中心付近に位置している.血清の成分であるリゾホスファチジン酸による極性化の刺激を細胞にあたえると,アクチンの求心性の流動が細胞の創傷部位の側から起こる.アクチンの求心性流動がLINC複合体をつうじて核に伝達し,核を細胞の後方へと移動させる2,3)(図1a).これが核を中心体の後ろ側に局在させる結果となり,中心体を細胞の進行方向の先導部にむけて細胞の極性を決める.
Diaphanous関連Forminファミリータンパク質はGTPaseであるRhoにより制御され,Formin相同ドメインであるFH1ドメインとFH2ドメインをもち,アクチンおよび微小管の両方の細胞骨格の制御にかかわっている4)(図1b).ほとんどのDiaphanous関連ForminファミリーはFH1ドメインとFH2ドメインを介してアクチン重合核の形成および直線状のアクチン繊維の伸長(もしくは,どちらか)を促進し,フィロポディア(糸状仮足),ラメリポディア(葉状仮足),収縮環などに必要なアクチン構造をつくりあげる.FHOD1は,ほかのDiaphanous関連Forminファミリーのメンバーとは異なり,アクチン重合核の形成もアクチン繊維の伸長も行わない代わりに,繊維状アクチンを束化する5).この束化の活性は,N末端側にあるFHOD1に特有のアクチン結合領域と,FH2ドメインのもつ二量体形成能によるものである.FHOD1の細胞の過程へのかかわりを示唆するいくつかの報告がなされているが,その細胞における機能的な役割はいまだよくわかっていない6-8).
ほかのDiaphanous関連Forminファミリーのメンバーとは異なり,FHOD1は繊維状アクチンの重合を促進することはできないが,N末端側1~569残基(ヒトのFHOD1)の領域のみで繊維状アクチンを修飾する5).以前に,FHOD1のN末端側1~339残基の領域の構造はほかのDiaphanous関連Forminファミリーのメンバーとは違っていることが示されていたので9),このN末端側の領域と相互作用するタンパク質を酵母ツーハイブリッド法で探索することにより,この領域の役割をみつけようとした.そして,FHOD1のN末端側1~339残基はnesprin-2Gと相互作用することを発見した.さらに,FHOD1のN末端側1~339残基に対しnesprin-2Gの全長を断片化してスクリーニングした結果,nesprin-2Gのもつスペクトリンリピート8~13と相互作用することがわかった.FHOD1のN末端側1~339残基をトランスフェクションしたHEK293T細胞の抽出液を用いてGSTプルダウンアッセイを行ったところ,nesprin-2Gのスペクトリンリピート11~12がFHOD1のN末端側1~339残基との相互作用に十分であった.
繊維芽細胞における核の移動の際のnesprin-2Gの重要性に注目し,NIH3T3細胞においてFHOD1をノックダウンし,FHOD1が核の移動に必要かどうかを調べた.nesprin-2Gノックダウン細胞の表現型と同様に,FHOD1をノックダウンした細胞はリゾホスファチジン酸により刺激をしても核は移動しなかった.重要なことに,FHOD1ノックダウン細胞におけるレスキュー実験により,FHOD1のもつnesprin-2Gとの相互作用領域が核の移動に必要なことが示された.さらには,FHOD1のN末端側1~339残基,あるいは,nesprin-2Gのスペクトリンリピート11~12を含む断片をNIH3T3細胞に発現させると核の移動が阻害された.これらの結果をまとめると,FHOD1のN末端側1~339残基とnesprin-2Gのスペクトリンリピート11~12を介した相互作用は,核の移動のために機能的に不可欠であった.
ほかのDiaphanous関連Forminファミリーのメンバーとは異なり,FHOD1はアクチンの重合を促進しないが繊維状アクチンを束化する5).繊維芽細胞の極性化の際に,繊維状アクチンは束化し,細胞の背側の核をおおう流動的なアクチン繊維束を形成する.これらのアクチン繊維束がTANライン(TAN:transmembrane actin-associated,膜貫通アクチン関連)を介して核とつながり,その求心性の流動が核を細胞の後方へと移動させる2,3).これらを考慮にいれ,FHOD1ノックダウン細胞において,核をおおうアクチン繊維束の形成,繊維状アクチンの求心性流動の速度,TANラインの形成について注意深く調べた.野生型のNIH3T3細胞と比較すると,FHOD1ノックダウン細胞はアクチン繊維束の形成およびアクチンの求心性流動の速度に違いはみられなかったが,TANラインの形成がいちじるしく低下していた.
FHOD1がTANラインの形成をサポートしていたことから,FHOD1がnesprin-2Gのアクチン繊維束への結合を強めていると推測した.以前から,FHOD1がN末端側1~569残基およびFH2ドメインという2つの別々の領域を介して繊維状アクチンと結合しうることがin vitroにおいて示されていた5).そこで,FHOD1ノックダウン細胞に繊維状アクチンおよびnesprin-2Gと結合することのできるFHOD1のN末端側1~569残基を発現させるレスキュー実験を行い,核の移動について調べた.その結果,FHOD1のN末端側1~569残基はFHOD1ノックダウン細胞における核の移動の異常をレスキューした.さらに,アクチン結合ドメインとしてよく知られたαアクチニンのカルポニン相同ドメインをFHOD1のN末端側1~339残基に付加し,FHOD1ノックダウン細胞において核の移動の異常をレスキューできるかどうか調べた.その結果,カルポニン相同ドメインのみではレスキューできなかったが,FHOD1のN末端側の領域とカルポニン相同ドメインとのキメラタンパク質は核の移動の異常をレスキューした.これらの結果は,FHOD1が 繊維状アクチンとのさらなる結合を付加し,TANラインの形成を強めることによりnesprin-2Gとアクチン繊維束との結合をサポートしていることを示唆した.これにより繊維状アクチンは核としっかり結合し,核がアクチンの求心性の流動とともに移動することができるようになると思われた.
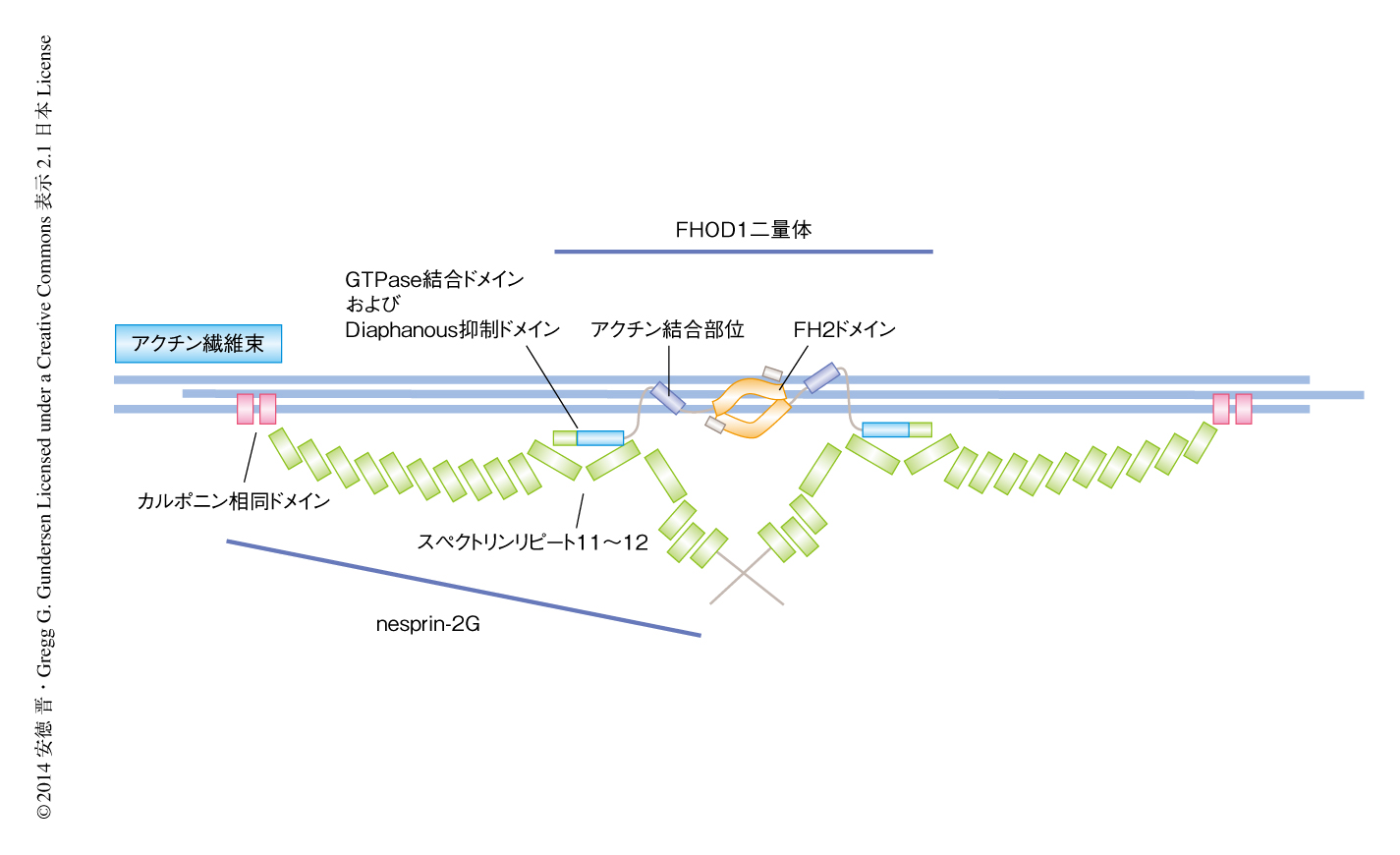
以前より,筆者らは,nesprin-2Gがカルポニン相同ドメインのみを介して核の上部をおおうアクチン繊維束に結合するというTANラインのモデルを提唱してきた3).今回の発見は,細胞質タンパク質であるFHOD1がnesprin-2Gとアクチン繊維束とのあいだに重要な結合を付加することにより,核とそれをおおうアクチン繊維束との結合を強めていることを明らかにした(図2).この役割にくわえ,FHOD1とnesprin-2Gとの相互作用にはほかの機能もあるかもしれない.FHOD1はそのN末端側の領域とC末端のもっとも端の部位との分子内相互作用を介して自己抑制していることが知られている10).nesprin-2GはFHOD1のN末端側の領域と相互作用するので,FHOD1の自己抑制を解放し活性化する可能性がある.その一方で,活性化されたFHOD1がnesprin-2Gのスペクトリンリピート11~12と相互作用することによりスペクトリンリピートの構成を変化させるのかもしれない.こういったさらなる可能性の研究はたいへん興味深く,これらのタンパク質が細胞においてどのようにしてはたらいているかという,より機構的な知見をあたえてくれるであろう.
略歴:2009年 米国Connecticut大学大学院にてPh.D.取得,同年 米国Fred Hutchinson Cancer Research Center研究員を経て,2011年より米国Columbia大学 研究員.
研究テーマ:アクチンと微小管による細胞運動の制御.
Gregg G. Gundersen
米国Columbia大学 教授.
研究室URL:http://www.columbia.edu/~wc2383/index.html
© 2014 安徳 晋・Gregg G. Gundersen Licensed under CC 表示 2.1 日本
(米国Columbia大学Department of Pathology and Cell Biology)
email:安徳 晋
DOI: 10.7875/first.author.2014.094
FHOD1 interaction with nesprin-2G mediates TAN line formation and nuclear movement.
Stefan Kutscheidt, Ruijun Zhu, Susumu Antoku, Gant W. Luxton, Igor Stagljar, Oliver T. Fackler, Gregg G. Gundersen
Nature Cell Biology, 16, 708-715 (2014)
要 約
後生動物は,細胞分裂,細胞分化,細胞運動を制御するため,細胞における核の位置を制御している.繊維芽細胞においては,アクチンの求心性の流動が核を細胞の進行とは逆の方向,つまり,後方へと移動させることにより細胞が極性化し細胞運動がはじまる.このアクチンの求心性の流動による核の移動は,TANラインとよばれる複合体の構成タンパク質であるnesprin-2Gがアクチンと核とをつなぐことにより可能になっている.今回の研究において,筆者らは,Diaphanous関連ForminファミリーのメンバーであるFHOD1がnesprin-2Gと相互作用していることを発見した.ノックダウン実験およびドミナントネガティブ阻害実験により,FHOD1,あるいは,FHOD1とnesprin-2Gとの相互作用は,極性化する繊維芽細胞における核の移動において不可欠であることが示された.FHOD1は細胞の背側におけるアクチン繊維束の形成やその流動ではなく,TANラインの形成において必要であった.FHOD1をノックダウンした細胞にさまざまなFHOD1の変異体および領域を発現させるレスキュー実験により,FHOD1が核の移動のために必須であるアクチン繊維束への付加的な結合をnesprin-2Gにもたらす機構が明らかにされた.これらの結果から,オルガネラをアクチン繊維につなぎその移動をサポートするというFHOD1というこのForminファミリータンパク質のもつ独特の役割が明らかにされた.
はじめに
後生動物においては組織の発達および維持のため,核はそのときどきに応じて細胞の特定の場所に局在している.核の位置の制御がうまくいかないと,細胞の極性化や細胞運動に支障をきたし,大脳皮質の形成,内耳の感覚上皮における有毛細胞の協調的な発達,神経筋接合部の形成などに異常をひき起こすことがわかっている1).LINC複合体は細胞骨格と核質とをつなぐタンパク質複合体であり,細胞における核の位置の制御に重要である1)(図1a).LINC複合体は外核膜タンパク質であるnespirinと内核膜タンパク質であるSUNから構成される.nespirinとSUNは特定の細胞骨格の構成タンパク質と核ラミナとのあいだを結合することにより細胞骨格と核質をつないでいる.単層培養し血清飢餓処理を施した繊維芽細胞をひっかいて傷を形成した実験系では,核および中心体は細胞の中心付近に位置している.血清の成分であるリゾホスファチジン酸による極性化の刺激を細胞にあたえると,アクチンの求心性の流動が細胞の創傷部位の側から起こる.アクチンの求心性流動がLINC複合体をつうじて核に伝達し,核を細胞の後方へと移動させる2,3)(図1a).これが核を中心体の後ろ側に局在させる結果となり,中心体を細胞の進行方向の先導部にむけて細胞の極性を決める.
Diaphanous関連Forminファミリータンパク質はGTPaseであるRhoにより制御され,Formin相同ドメインであるFH1ドメインとFH2ドメインをもち,アクチンおよび微小管の両方の細胞骨格の制御にかかわっている4)(図1b).ほとんどのDiaphanous関連ForminファミリーはFH1ドメインとFH2ドメインを介してアクチン重合核の形成および直線状のアクチン繊維の伸長(もしくは,どちらか)を促進し,フィロポディア(糸状仮足),ラメリポディア(葉状仮足),収縮環などに必要なアクチン構造をつくりあげる.FHOD1は,ほかのDiaphanous関連Forminファミリーのメンバーとは異なり,アクチン重合核の形成もアクチン繊維の伸長も行わない代わりに,繊維状アクチンを束化する5).この束化の活性は,N末端側にあるFHOD1に特有のアクチン結合領域と,FH2ドメインのもつ二量体形成能によるものである.FHOD1の細胞の過程へのかかわりを示唆するいくつかの報告がなされているが,その細胞における機能的な役割はいまだよくわかっていない6-8).
1.FHOD1はnesprin-2Gと相互作用し細胞が極性化するときの核の移動に必要である
ほかのDiaphanous関連Forminファミリーのメンバーとは異なり,FHOD1は繊維状アクチンの重合を促進することはできないが,N末端側1~569残基(ヒトのFHOD1)の領域のみで繊維状アクチンを修飾する5).以前に,FHOD1のN末端側1~339残基の領域の構造はほかのDiaphanous関連Forminファミリーのメンバーとは違っていることが示されていたので9),このN末端側の領域と相互作用するタンパク質を酵母ツーハイブリッド法で探索することにより,この領域の役割をみつけようとした.そして,FHOD1のN末端側1~339残基はnesprin-2Gと相互作用することを発見した.さらに,FHOD1のN末端側1~339残基に対しnesprin-2Gの全長を断片化してスクリーニングした結果,nesprin-2Gのもつスペクトリンリピート8~13と相互作用することがわかった.FHOD1のN末端側1~339残基をトランスフェクションしたHEK293T細胞の抽出液を用いてGSTプルダウンアッセイを行ったところ,nesprin-2Gのスペクトリンリピート11~12がFHOD1のN末端側1~339残基との相互作用に十分であった.
繊維芽細胞における核の移動の際のnesprin-2Gの重要性に注目し,NIH3T3細胞においてFHOD1をノックダウンし,FHOD1が核の移動に必要かどうかを調べた.nesprin-2Gノックダウン細胞の表現型と同様に,FHOD1をノックダウンした細胞はリゾホスファチジン酸により刺激をしても核は移動しなかった.重要なことに,FHOD1ノックダウン細胞におけるレスキュー実験により,FHOD1のもつnesprin-2Gとの相互作用領域が核の移動に必要なことが示された.さらには,FHOD1のN末端側1~339残基,あるいは,nesprin-2Gのスペクトリンリピート11~12を含む断片をNIH3T3細胞に発現させると核の移動が阻害された.これらの結果をまとめると,FHOD1のN末端側1~339残基とnesprin-2Gのスペクトリンリピート11~12を介した相互作用は,核の移動のために機能的に不可欠であった.
2.FHOD1はnesprin-2Gにアクチンとの付加的な結合をもたらすことによりTANラインの形成および核の移動をサポートしている
ほかのDiaphanous関連Forminファミリーのメンバーとは異なり,FHOD1はアクチンの重合を促進しないが繊維状アクチンを束化する5).繊維芽細胞の極性化の際に,繊維状アクチンは束化し,細胞の背側の核をおおう流動的なアクチン繊維束を形成する.これらのアクチン繊維束がTANライン(TAN:transmembrane actin-associated,膜貫通アクチン関連)を介して核とつながり,その求心性の流動が核を細胞の後方へと移動させる2,3).これらを考慮にいれ,FHOD1ノックダウン細胞において,核をおおうアクチン繊維束の形成,繊維状アクチンの求心性流動の速度,TANラインの形成について注意深く調べた.野生型のNIH3T3細胞と比較すると,FHOD1ノックダウン細胞はアクチン繊維束の形成およびアクチンの求心性流動の速度に違いはみられなかったが,TANラインの形成がいちじるしく低下していた.
FHOD1がTANラインの形成をサポートしていたことから,FHOD1がnesprin-2Gのアクチン繊維束への結合を強めていると推測した.以前から,FHOD1がN末端側1~569残基およびFH2ドメインという2つの別々の領域を介して繊維状アクチンと結合しうることがin vitroにおいて示されていた5).そこで,FHOD1ノックダウン細胞に繊維状アクチンおよびnesprin-2Gと結合することのできるFHOD1のN末端側1~569残基を発現させるレスキュー実験を行い,核の移動について調べた.その結果,FHOD1のN末端側1~569残基はFHOD1ノックダウン細胞における核の移動の異常をレスキューした.さらに,アクチン結合ドメインとしてよく知られたαアクチニンのカルポニン相同ドメインをFHOD1のN末端側1~339残基に付加し,FHOD1ノックダウン細胞において核の移動の異常をレスキューできるかどうか調べた.その結果,カルポニン相同ドメインのみではレスキューできなかったが,FHOD1のN末端側の領域とカルポニン相同ドメインとのキメラタンパク質は核の移動の異常をレスキューした.これらの結果は,FHOD1が 繊維状アクチンとのさらなる結合を付加し,TANラインの形成を強めることによりnesprin-2Gとアクチン繊維束との結合をサポートしていることを示唆した.これにより繊維状アクチンは核としっかり結合し,核がアクチンの求心性の流動とともに移動することができるようになると思われた.
おわりに
以前より,筆者らは,nesprin-2Gがカルポニン相同ドメインのみを介して核の上部をおおうアクチン繊維束に結合するというTANラインのモデルを提唱してきた3).今回の発見は,細胞質タンパク質であるFHOD1がnesprin-2Gとアクチン繊維束とのあいだに重要な結合を付加することにより,核とそれをおおうアクチン繊維束との結合を強めていることを明らかにした(図2).この役割にくわえ,FHOD1とnesprin-2Gとの相互作用にはほかの機能もあるかもしれない.FHOD1はそのN末端側の領域とC末端のもっとも端の部位との分子内相互作用を介して自己抑制していることが知られている10).nesprin-2GはFHOD1のN末端側の領域と相互作用するので,FHOD1の自己抑制を解放し活性化する可能性がある.その一方で,活性化されたFHOD1がnesprin-2Gのスペクトリンリピート11~12と相互作用することによりスペクトリンリピートの構成を変化させるのかもしれない.こういったさらなる可能性の研究はたいへん興味深く,これらのタンパク質が細胞においてどのようにしてはたらいているかという,より機構的な知見をあたえてくれるであろう.
文 献
- Gundersen, G. G. & Worman, H. J.: Nuclear positioning. Cell, 152, 1376-1389 (2013)[PubMed]
- Gomes, E. R., Jani, S. & Gundersen, G. G.: Nuclear movement regulated by Cdc42, MRCK, myosin, and actin flow establishes MTOC polarization in migrating cells. Cell, 121, 451-463 (2005)[PubMed]
- Luxton, G. W., Gomes, E. R., Folker, E. S. et al.: Linear arrays of nuclear envelope proteins harness retrograde actin flow for nuclear movement. Science, 329, 956-959 (2010)[PubMed]
- Chesarone, M. A., DuPage, A. G. & Goode, B. L.: Unleashing formins to remodel the actin and microtubule cytoskeletons. Nat. Rev. Mol. Cell Biol., 11, 62-74 (2010)[PubMed]
- Schonichen, A., Mannherz, H. G., Behrmann, E. et al.: FHOD1 is a combined actin filament capping and bundling factor that selectively associates with actin arcs and stress fibers. J. Cell Sci., 126, 1891-1901 (2013)[PubMed]
- Alvarez, D. E. & Agaisse, H.: The formin FHOD1 and the small GTPase Rac1 promote vaccinia virus actin-based motility. J. Cell Biol., 202, 1075-1090 (2013)[PubMed]
- Iskratsch, T., Yu, C. H., Mathur, A. et al.: FHOD1 is needed for directed forces and adhesion maturation during cell spreading and migration. Dev. Cell, 27, 545-559 (2013)[PubMed]
- Truong, D., Brabant, D., Bashkurov, M. et al.: Formin-mediated actin polymerization promotes Salmonella invasion. Cell. Microbiol., 15, 2051-2063 (2013)[PubMed]
- Schulte, A., Stolp, B., Schonichen, A. et al.: The human formin FHOD1 contains a bipartite structure of FH3 and GTPase-binding domains required for activation. Structure, 16, 1313-1323 (2008)[PubMed]
- Takeya, R., Taniguchi, K., Narumiya, S. et al.: The mammalian formin FHOD1 is activated through phosphorylation by ROCK and mediates thrombin-induced stress fibre formation in endothelial cells. EMBO J., 27, 618-628 (2008)[PubMed]
著者プロフィール
略歴:2009年 米国Connecticut大学大学院にてPh.D.取得,同年 米国Fred Hutchinson Cancer Research Center研究員を経て,2011年より米国Columbia大学 研究員.
研究テーマ:アクチンと微小管による細胞運動の制御.
Gregg G. Gundersen
米国Columbia大学 教授.
研究室URL:http://www.columbia.edu/~wc2383/index.html
© 2014 安徳 晋・Gregg G. Gundersen Licensed under CC 表示 2.1 日本