マウスの受精卵においてヌクレオソームの新規の形成は核膜孔複合体の形成に必要である
井上 梓
(米国Harvard Medical School,Department of Genetics)
email:井上 梓
DOI: 10.7875/first.author.2014.093
Nucleosome assembly is required for nuclear pore complex assembly in mouse zygotes.
Azusa Inoue, Yi Zhang
Nature Structural & Molecular Biology, 21, 609-616 (2014)
DNAとヒストンからなるヌクレオソームは真核生物において広く保存されており,DNAを収納するのみならず,転写や複製の制御など幅広い役割をはたす.ヌクレオソームのもつ細胞生物学的な新機能の発見のためには生きた細胞においてヒストンを欠損させる戦略が考えられるが,ヒストンの欠損は即座に細胞の致死をひき起こすためこれまで成功していない.今回,筆者らは,精子のゲノムが受精ののちヌクレオソームを新規に形成する,雄性前核の形成に着目した.この過程においてヒストンのバリアントであるヒストンH3.3の取り込みを阻害することにより,マウスの受精卵においてヌクレオソームを欠損した核を作製することに成功した.このヌクレオソーム欠損核では核膜は形成されたものの,核膜孔複合体が欠損していた.ヌクレオソーム欠損核では核膜孔複合体の形成に必須なヌクレオポリンであるELYSの核膜の近傍への局在が阻害されており,ELYSを核膜内膜に強制的に局在させることによりヌクレオソーム欠損核に核膜孔複合体の形成が誘導されることを見い出した.さらに,in vitroにおける結合実験により,ELYSはヌクレオソームと結合することが示された.以上の結果から,ヌクレオソームはELYSの局在の制御を介して,核膜における核膜孔複合体の形成に必須の機能をもつことが示唆された.
ヌクレオソームは,ヒストンH2A,ヒストンH2B,ヒストンH3,ヒストンH4のコアヒストン2分子ずつが集合したヒストン八量体の周囲を,147 bpのDNAが巻きついたクロマチンの基本構造である.ヌクレオソームはほとんどすべての真核生物に保存されており,DNAを規則正しく収納する役割をもつほか,転写,複製,DNA修復の制御や,ヒストンの化学修飾を介したエピジェネティックな制御など,細胞において幅広い機能をもつ1).このように,ヌクレオソームはDNAと密接に関連した多くの機能をもつことが知られている一方で,ヌクレオソームそれ自体がもつ細胞生物学的な機能はよくわかっていなかった.というのも,真核生物においてヌクレオソームを欠損させると即座に致死になることから,その解析が困難であったためである2).
そこで,筆者らは,哺乳類の生活環において唯一,ヌクレオソームが新たに形成される受精の過程に着目して,生きた細胞においてヌクレオソームを欠損した核を作製することを試みた.精子はヒストンをもたず,代わりにプロタミンという塩基性に非常に富んだタンパク質によりDNAをコンパクトに収納している.受精をきっかけに精子のプロタミンは放出され,卵に蓄えられたヒストンが取り込まれることで雄性ゲノムにヌクレオソームが新規に形成される.この過程では,ヒストンH3のバリアントのうちヒストンH3.3が選択的に取り込まれる3).これは,複製をともなわない雄性クロマチンの形成の過程では,複製に依存してクロマチンに取り込まれるヒストンH3.1およびヒストンH3.2は利用できず,複製に依存しないで取り込まれることのできるヒストンH3.3が選択的に利用されるためだと考えられている.このことから,ヒストンH3.3の取り込みを阻害すると雄性ゲノムにおけるヌクレオソームの新規の形成が阻害され,その結果,ヌクレオソームを欠損した核が作製できるのではないかと考えた.
クロマチンへのヒストンの取り込みには,それぞれのヒストンバリアントに特異的なヒストンシャペロンが必要である.たとえば,ヒストンH3.3ではHIRAやDAXX,ヒストンH3.1およびヒストンH3.2ではCAF-1が,それぞれおもなヒストンシャペロンとして機能している4).ショウジョウバエにおいて雄性前核へのヒストンH3.3の取り込みはHIRAに依存すること5),また,マウスの受精卵においてHIRAは雄性前核に局在することから6),マウスにおいてもHIRAがヒストンH3.3の取り込みに必要であると予想した.そこで,マウスの受精卵においてHIRAの発現を抑制することにより,雄性ゲノムへのヒストンH3.3の取り込みを阻害することを試みた.
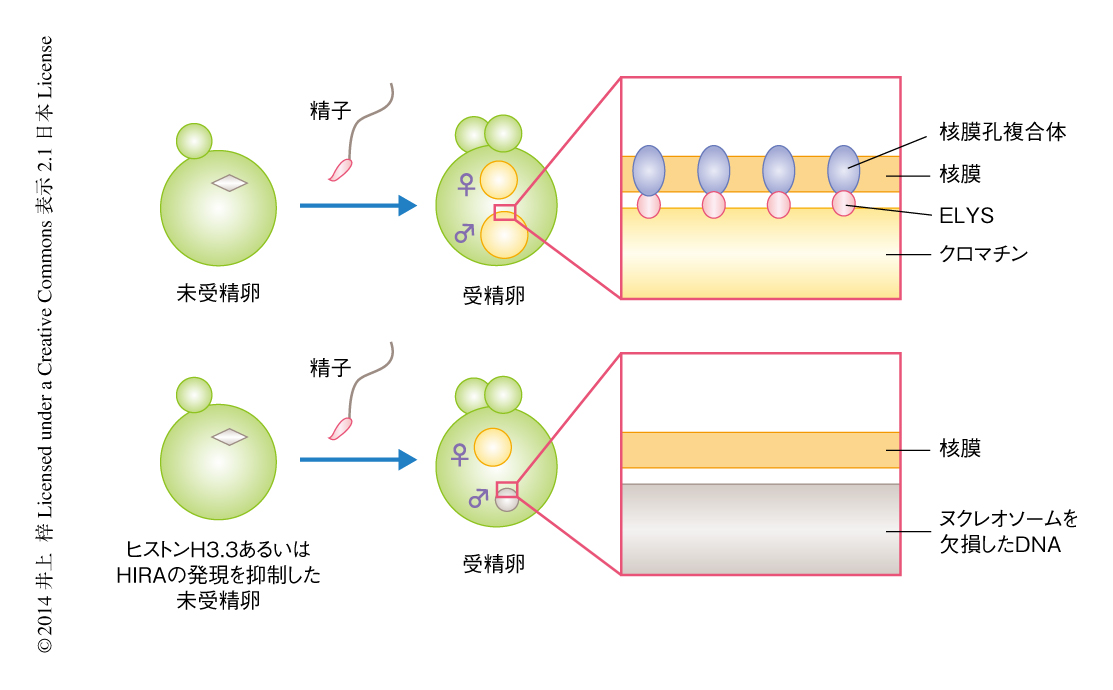
HIRAが雄性ゲノムへのヒストンH3.3の取り込みに必要かどうかを検証するため,成長期の卵にHIRAに対するsiRNAを注入し,体外成長培養系を用いて7),HIRAをノックダウンした.その結果,HIRAをノックダウンした卵では雄性ゲノムへのヒストンH3.3の取り込みが阻害されたことから,マウスにおいてもショウジョウバエと同様にHIRAがヒストンH3.3の取り込みに必須であることがわかった.HIRAをノックダウンすると雄性前核は野生型のそれに比べ非常に小さくなり,同一の受精卵に存在する雌性前核と比べても約30%にとどまっていた(図1).その雄性前核ではヒストンH3.3だけでなく,あらゆるコアヒストンの取り込みが阻害されていた.このことは,in vitroにおけるヌクレオソームの形成の過程において,ヒストンH3-ヒストンH4がヒストンH2A-ヒストンH2Bよりもさきに取り込まれるという事実と一致した8).またこの結果は,雄性前核の形成の過程において,ヒストンH3.1あるいはヒストンH3.2はヒストンH3.3の機能を代替できないことを示した.
HIRAのノックダウンによる核の大きさの減少などの表現型が,HIRAのもつ未知の機能の阻害を介したものではなく,ヒストンH3.3の取り込みの阻害を介したものであることを確認するため,ヒストンH3.3をコードする2つの遺伝子それぞれに対するsiRNAを同時に注入することによりヒストンH3.3をノックダウンした.その結果,ヒストンH3.3をノックダウンした受精卵はHIRAのノックダウンと同じように雄性前核へのあらゆるコアヒストンの取り込みが阻害され,核の大きさが約30%に減少した(図1).このヌクレオソームを欠損した核においてもプロタミンの放出および精子DNAの脱凝集は正常に完了していたことから,プロタミンの放出および精子DNAの脱凝集はヒストンの取り込みと独立した機構により起こることが示唆された.HIRAあるいはヒストンH3.3をノックダウンした卵では雄性前核にヌクレオソームが形成されない一方で,雌性前核には卵のクロマチンに由来するヒストンが保持されており,同一の細胞においてヌクレオソームをもつ雌性前核ともたない雄性前核が存在する受精卵になった(図1).
ヌクレオソームを欠損した核を利用することにより,ヌクレオソームのもつ未知の細胞生物学的な機能を明らかにできるのではないかと考えた.そこで,ヌクレオソーム欠損核の大きさが雌性前核に比べ顕著に小さい点に着目した.一般に,細胞分裂ののちの核は核の内外に形成されたRan-GTPの濃度勾配を利用してタンパク質を核へと輸送することにより拡張する9).そこで,蛍光免疫染色法を用いてRanや核ラミナなどの核タンパク質の局在を調べたところ,ヌクレオソーム欠損核にはそれらが検出されなかった.さらに,核移行シグナルを付加した蛍光タンパク質GFPの動態を調べた結果,ヌクレオソーム欠損核は核へのタンパク質の輸送能をもたないことがわかった.
核へのタンパク質の輸送には機能的な核膜孔複合体をもつ正常な核膜が必須である.そこで,ヌクレオソーム欠損核における核膜の有無を検証するため,電子顕微鏡による観察,および,核膜内膜タンパク質であるEmerinやLBRの局在を調べたところ,ヌクレオソーム欠損核においても二重膜構造をもつ核膜が正常に形成されていた.その一方で,核膜孔複合体の存在をFGヌクレオポリンに対する抗体を用いた免疫染色法により調べたところ,ヌクレオソーム欠損核には正常な核膜孔複合体が欠損していることが明らかになった(図1).
核膜孔複合体は細胞分裂ののちの核膜の形成にともない以下のように構築されると考えられている10).1)核膜孔複合体の構成タンパク質(ヌクレオポリン)のひとつであるELYSがクロマチンに結合する,2)ELYSがNup107-160複合体をリクルートする(プレポアの形成),3)核膜がクロマチンをおおう,4)POM121などの核膜に局在するヌクレオポリンがプレポアに結合する,5)FGヌクレオポリンを含むさまざまなタンパク質が集合して機能的な核膜孔複合体が構築される.ヌクレオソーム欠損核において核膜孔複合体の形成のどのステップが阻害されているのかを調べるため,ELYS,Nup107-160複合体,POM121の局在を調べたところ,いずれのタンパク質もヌクレオソーム欠損核の核膜には集積していなかった(図1).この結果から,核膜孔複合体の形成の最初のステップにはたらくELYSの局在の異常がヌクレオソーム欠損核において核膜孔複合体の形成不全をひき起こしているのではないかと考えた.
ELYSの局在の異常がヌクレオソームを欠損した核における核膜孔複合体の形成不全の原因であるという仮説を検証するため,ELYSを強制的にヌクレオソーム欠損核の核膜内膜に局在させてレスキュー実験を試みた.具体的には,核膜内膜に局在するタンパク質であるEmerinをELYSのC末端側に融合させたELYS-Emerin融合タンパク質をコードするコンストラクトを作製し,ヒストンH3.3をノックダウンした受精卵に発現させた.その結果,期待どおり,ELYS-Emerin融合タンパク質はヌクレオソーム欠損核の核膜に局在した.そして,ELYS-Emerin融合タンパク質の発現はヌクレオソーム欠損核において核膜孔複合体の形成を回復させ,さらに,核ラミナ,Ran,核移行シグナルを付加したGFPの核への局在,そして,核の大きさまでを回復させた.一方で,この雄性前核においてもコアヒストンの取り込みはわずかしか認められなかった.すなわちこの結果は,ELYSさえ核膜内膜に局在させることができれば,ヌクレオソームがほとんど存在しなくてもいっけん正常な核へのタンパク質の輸送能をもつ核が形成されることを示唆した.以上のことから,核膜孔複合体の形成にはELYSが核膜内膜の近傍に集積することが必須であり,ヌクレオソーム欠損核における核膜孔複合体の形成不全はELYSの局在の異常がおもな原因であることが示唆された.
ELYSの核膜内膜の近傍への局在においてヌクレオソームはどのように関与しているのだろうか? 過去のアフリカツメガエルの卵抽出液を用いた研究から,RanがELYSのクロマチンへの局在を制御していることが知られていた11).そこで,マウスの受精卵においてRan優性変異体を過剰に発現させてその機能を阻害することにより,ELYSの局在におけるRanの関与について検証した.しかしながら,Ranの機能を阻害してもELYSは正常に核膜に集積したことから,マウスの受精卵においてRanはELYSの核膜への局在に重要ではないことが示唆された.つづいて,培養細胞系を用いてELYSとヌクレオソームとが直接に結合する可能性について検証した.抗ELYS抗体を用いて293T細胞からELYSを精製し,HeLa細胞の核からモノヌクレオソームを調製した.これらをin vitroにおいて混合させたところ,ELYSとヌクレオソームとが直接に結合することがわかった.さらに,293T細胞の抽出液においてもELYSはヌクレオソームと結合していることが見い出された.これらの結果と受精卵における発見とをあわせて,ヌクレオソームにはELYSを核膜内膜の近傍に集積させるための足場としての役割があるのではないかと考えた.
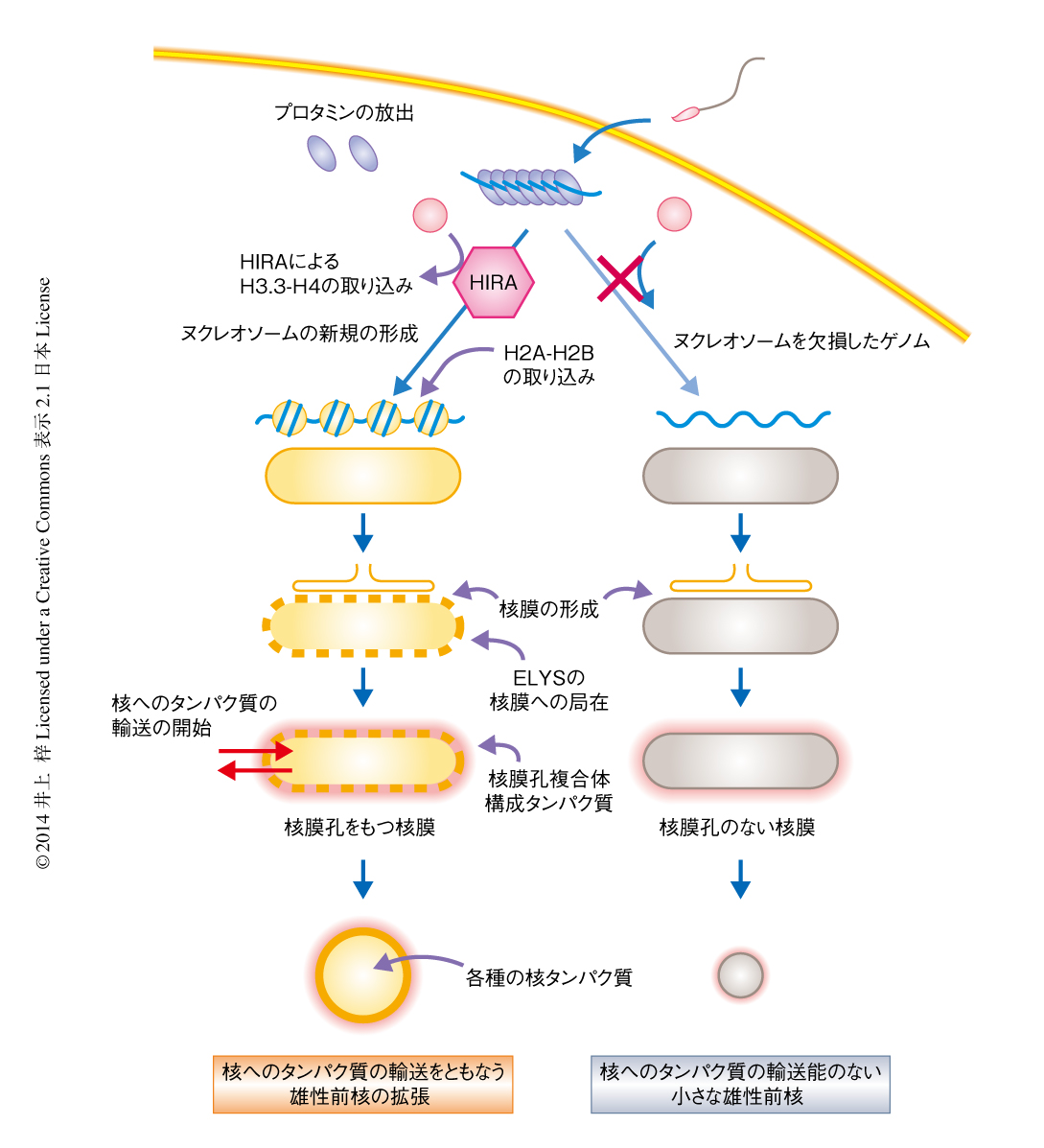
過去の知見をあわせ,この研究の結果から,マウスの受精卵における雄性前核の形成に関して以下のような段階的モデルがみえてきた(図2).まず,卵に侵入した精子からは未知の因子によりプロタミンが放出され,それと同時に,NPM2によりDNAが脱凝集する12).つづいて,ヒストンシャペロンであるHIRAによりヒストンH3.3-ヒストンH4が取り込まれたのち,未知のヒストンシャペロンによりヒストンH2A-ヒストンH2Bが取り込まれヌクレオソームが新規に形成される.そののち,雄性クロマチンに核膜が形成され,このタイミングでELYSが核膜の近傍に集積する.このステップにヌクレオソームが必須であるようだが,具体的にどのような機構でヌクレオソームがELYSの局在を制御しているかは明らかではない.そののち,ELYSを中心にNup107-160複合体やPOM121をはじめとしたヌクレオポリンが集合することにより機能的な核膜孔複合体が構築され,Ranを介した核へのタンパク質の輸送が行われるようになる.このようなステップが受精ののちわずか4時間のあいだになしとげられることにより,雄性ゲノムは受精卵において機能的な核を獲得する.一方で,雄性ゲノムへのヒストンH3.3の取り込みが阻害されるとほかのコアヒストンまで取り込まれなくなり,ヌクレオソームを欠損したDNAが生じる.このDNAの周囲に核膜は正常に形成されたことから,核膜の形成それ自体にヌクレオソームは必要ないことが示唆された.しかし,ヌクレオソームが存在しないとELYSが核膜の近傍に集積できないため核膜孔複合体が構築されない.その結果,核へのタンパク質の輸送は起こらず,雄性前核は拡張することなく小さいままとどまる(図2).
歴史的に,核膜の形成の機構はおもにアフリカツメガエルの卵抽出液を用いて解明されてきた.しかしながら,卵抽出液には多量のヒストンが存在しており,外来のDNAに対し即座にヒストンが取り込まれてヌクレオソームを形成してしまう13).そのため,これまでの卵抽出液を用いた研究ではヌクレオソームの機能とDNAの機能とを明確に区別することができなかった.今回,筆者らは,HIRAあるいはヒストンH3.3をノックダウンしたマウスの受精卵を用いることによりこれを可能にし,ヌクレオソームの細胞生物学的な役割,すなわち,ELYSの局在の制御を介した核膜孔複合体の形成への関与を示唆することに成功した.なお,同時に掲載された論文では,アフリカツメガエルの卵抽出液から免疫除去によりヒストンを取り除くことによりin vitroにおいてヌクレオソームを形成しないDNAを作製し,この研究と同様の結論にいたっている14).
ヌクレオソームの形成が核膜孔複合体をもつ機能的な核膜の形成の上流にあるという今回の発見は,原核生物がヌクレオソームも核膜ももたない事実を考えると,進化の側面からとても興味深い.すなわち,原核生物から真核生物への進化の過程で,ヌクレオソームが核膜よりさきに獲得されたのではないかと想像(妄想)できるのである.また,コアヒストンをもたないDNAが受精卵において自らの電荷で反発して拡散することなくコンパクトにとどまっていることは特筆すべきことであり,ヌクレオソームを欠損した核においてコアヒストンやプロタミンの代わりにどのようなタンパク質がDNAに結合しているのかも興味深いところである.
略歴:2011年 東京大学大学院新領域創成科学研究科 修了,同年 米国North Carolina大学Chapel Hill校 研究員を経て,2012年より米国Harvard Medical School研究員.
研究テーマ:マウスの受精卵における発生プログラムの全貌を分子レベルで明らかにする.
抱負:卵の研究と離れた分野の研究とを融合させてみたい.
© 2014 井上 梓 Licensed under CC 表示 2.1 日本
(米国Harvard Medical School,Department of Genetics)
email:井上 梓
DOI: 10.7875/first.author.2014.093
Nucleosome assembly is required for nuclear pore complex assembly in mouse zygotes.
Azusa Inoue, Yi Zhang
Nature Structural & Molecular Biology, 21, 609-616 (2014)
要 約
DNAとヒストンからなるヌクレオソームは真核生物において広く保存されており,DNAを収納するのみならず,転写や複製の制御など幅広い役割をはたす.ヌクレオソームのもつ細胞生物学的な新機能の発見のためには生きた細胞においてヒストンを欠損させる戦略が考えられるが,ヒストンの欠損は即座に細胞の致死をひき起こすためこれまで成功していない.今回,筆者らは,精子のゲノムが受精ののちヌクレオソームを新規に形成する,雄性前核の形成に着目した.この過程においてヒストンのバリアントであるヒストンH3.3の取り込みを阻害することにより,マウスの受精卵においてヌクレオソームを欠損した核を作製することに成功した.このヌクレオソーム欠損核では核膜は形成されたものの,核膜孔複合体が欠損していた.ヌクレオソーム欠損核では核膜孔複合体の形成に必須なヌクレオポリンであるELYSの核膜の近傍への局在が阻害されており,ELYSを核膜内膜に強制的に局在させることによりヌクレオソーム欠損核に核膜孔複合体の形成が誘導されることを見い出した.さらに,in vitroにおける結合実験により,ELYSはヌクレオソームと結合することが示された.以上の結果から,ヌクレオソームはELYSの局在の制御を介して,核膜における核膜孔複合体の形成に必須の機能をもつことが示唆された.
はじめに
ヌクレオソームは,ヒストンH2A,ヒストンH2B,ヒストンH3,ヒストンH4のコアヒストン2分子ずつが集合したヒストン八量体の周囲を,147 bpのDNAが巻きついたクロマチンの基本構造である.ヌクレオソームはほとんどすべての真核生物に保存されており,DNAを規則正しく収納する役割をもつほか,転写,複製,DNA修復の制御や,ヒストンの化学修飾を介したエピジェネティックな制御など,細胞において幅広い機能をもつ1).このように,ヌクレオソームはDNAと密接に関連した多くの機能をもつことが知られている一方で,ヌクレオソームそれ自体がもつ細胞生物学的な機能はよくわかっていなかった.というのも,真核生物においてヌクレオソームを欠損させると即座に致死になることから,その解析が困難であったためである2).
そこで,筆者らは,哺乳類の生活環において唯一,ヌクレオソームが新たに形成される受精の過程に着目して,生きた細胞においてヌクレオソームを欠損した核を作製することを試みた.精子はヒストンをもたず,代わりにプロタミンという塩基性に非常に富んだタンパク質によりDNAをコンパクトに収納している.受精をきっかけに精子のプロタミンは放出され,卵に蓄えられたヒストンが取り込まれることで雄性ゲノムにヌクレオソームが新規に形成される.この過程では,ヒストンH3のバリアントのうちヒストンH3.3が選択的に取り込まれる3).これは,複製をともなわない雄性クロマチンの形成の過程では,複製に依存してクロマチンに取り込まれるヒストンH3.1およびヒストンH3.2は利用できず,複製に依存しないで取り込まれることのできるヒストンH3.3が選択的に利用されるためだと考えられている.このことから,ヒストンH3.3の取り込みを阻害すると雄性ゲノムにおけるヌクレオソームの新規の形成が阻害され,その結果,ヌクレオソームを欠損した核が作製できるのではないかと考えた.
クロマチンへのヒストンの取り込みには,それぞれのヒストンバリアントに特異的なヒストンシャペロンが必要である.たとえば,ヒストンH3.3ではHIRAやDAXX,ヒストンH3.1およびヒストンH3.2ではCAF-1が,それぞれおもなヒストンシャペロンとして機能している4).ショウジョウバエにおいて雄性前核へのヒストンH3.3の取り込みはHIRAに依存すること5),また,マウスの受精卵においてHIRAは雄性前核に局在することから6),マウスにおいてもHIRAがヒストンH3.3の取り込みに必要であると予想した.そこで,マウスの受精卵においてHIRAの発現を抑制することにより,雄性ゲノムへのヒストンH3.3の取り込みを阻害することを試みた.
1.ヒストンH3.3の取り込みの阻害によりマウスの受精卵にヌクレオソームを欠損した核が形成される
HIRAが雄性ゲノムへのヒストンH3.3の取り込みに必要かどうかを検証するため,成長期の卵にHIRAに対するsiRNAを注入し,体外成長培養系を用いて7),HIRAをノックダウンした.その結果,HIRAをノックダウンした卵では雄性ゲノムへのヒストンH3.3の取り込みが阻害されたことから,マウスにおいてもショウジョウバエと同様にHIRAがヒストンH3.3の取り込みに必須であることがわかった.HIRAをノックダウンすると雄性前核は野生型のそれに比べ非常に小さくなり,同一の受精卵に存在する雌性前核と比べても約30%にとどまっていた(図1).その雄性前核ではヒストンH3.3だけでなく,あらゆるコアヒストンの取り込みが阻害されていた.このことは,in vitroにおけるヌクレオソームの形成の過程において,ヒストンH3-ヒストンH4がヒストンH2A-ヒストンH2Bよりもさきに取り込まれるという事実と一致した8).またこの結果は,雄性前核の形成の過程において,ヒストンH3.1あるいはヒストンH3.2はヒストンH3.3の機能を代替できないことを示した.
HIRAのノックダウンによる核の大きさの減少などの表現型が,HIRAのもつ未知の機能の阻害を介したものではなく,ヒストンH3.3の取り込みの阻害を介したものであることを確認するため,ヒストンH3.3をコードする2つの遺伝子それぞれに対するsiRNAを同時に注入することによりヒストンH3.3をノックダウンした.その結果,ヒストンH3.3をノックダウンした受精卵はHIRAのノックダウンと同じように雄性前核へのあらゆるコアヒストンの取り込みが阻害され,核の大きさが約30%に減少した(図1).このヌクレオソームを欠損した核においてもプロタミンの放出および精子DNAの脱凝集は正常に完了していたことから,プロタミンの放出および精子DNAの脱凝集はヒストンの取り込みと独立した機構により起こることが示唆された.HIRAあるいはヒストンH3.3をノックダウンした卵では雄性前核にヌクレオソームが形成されない一方で,雌性前核には卵のクロマチンに由来するヒストンが保持されており,同一の細胞においてヌクレオソームをもつ雌性前核ともたない雄性前核が存在する受精卵になった(図1).
2.ヌクレオソームを欠損した核の核膜には核膜孔複合体が形成されない
ヌクレオソームを欠損した核を利用することにより,ヌクレオソームのもつ未知の細胞生物学的な機能を明らかにできるのではないかと考えた.そこで,ヌクレオソーム欠損核の大きさが雌性前核に比べ顕著に小さい点に着目した.一般に,細胞分裂ののちの核は核の内外に形成されたRan-GTPの濃度勾配を利用してタンパク質を核へと輸送することにより拡張する9).そこで,蛍光免疫染色法を用いてRanや核ラミナなどの核タンパク質の局在を調べたところ,ヌクレオソーム欠損核にはそれらが検出されなかった.さらに,核移行シグナルを付加した蛍光タンパク質GFPの動態を調べた結果,ヌクレオソーム欠損核は核へのタンパク質の輸送能をもたないことがわかった.
核へのタンパク質の輸送には機能的な核膜孔複合体をもつ正常な核膜が必須である.そこで,ヌクレオソーム欠損核における核膜の有無を検証するため,電子顕微鏡による観察,および,核膜内膜タンパク質であるEmerinやLBRの局在を調べたところ,ヌクレオソーム欠損核においても二重膜構造をもつ核膜が正常に形成されていた.その一方で,核膜孔複合体の存在をFGヌクレオポリンに対する抗体を用いた免疫染色法により調べたところ,ヌクレオソーム欠損核には正常な核膜孔複合体が欠損していることが明らかになった(図1).
核膜孔複合体は細胞分裂ののちの核膜の形成にともない以下のように構築されると考えられている10).1)核膜孔複合体の構成タンパク質(ヌクレオポリン)のひとつであるELYSがクロマチンに結合する,2)ELYSがNup107-160複合体をリクルートする(プレポアの形成),3)核膜がクロマチンをおおう,4)POM121などの核膜に局在するヌクレオポリンがプレポアに結合する,5)FGヌクレオポリンを含むさまざまなタンパク質が集合して機能的な核膜孔複合体が構築される.ヌクレオソーム欠損核において核膜孔複合体の形成のどのステップが阻害されているのかを調べるため,ELYS,Nup107-160複合体,POM121の局在を調べたところ,いずれのタンパク質もヌクレオソーム欠損核の核膜には集積していなかった(図1).この結果から,核膜孔複合体の形成の最初のステップにはたらくELYSの局在の異常がヌクレオソーム欠損核において核膜孔複合体の形成不全をひき起こしているのではないかと考えた.
3.核膜へのELYSの強制的な局在によりヌクレオソームを欠損した核に核膜孔複合体が形成される
ELYSの局在の異常がヌクレオソームを欠損した核における核膜孔複合体の形成不全の原因であるという仮説を検証するため,ELYSを強制的にヌクレオソーム欠損核の核膜内膜に局在させてレスキュー実験を試みた.具体的には,核膜内膜に局在するタンパク質であるEmerinをELYSのC末端側に融合させたELYS-Emerin融合タンパク質をコードするコンストラクトを作製し,ヒストンH3.3をノックダウンした受精卵に発現させた.その結果,期待どおり,ELYS-Emerin融合タンパク質はヌクレオソーム欠損核の核膜に局在した.そして,ELYS-Emerin融合タンパク質の発現はヌクレオソーム欠損核において核膜孔複合体の形成を回復させ,さらに,核ラミナ,Ran,核移行シグナルを付加したGFPの核への局在,そして,核の大きさまでを回復させた.一方で,この雄性前核においてもコアヒストンの取り込みはわずかしか認められなかった.すなわちこの結果は,ELYSさえ核膜内膜に局在させることができれば,ヌクレオソームがほとんど存在しなくてもいっけん正常な核へのタンパク質の輸送能をもつ核が形成されることを示唆した.以上のことから,核膜孔複合体の形成にはELYSが核膜内膜の近傍に集積することが必須であり,ヌクレオソーム欠損核における核膜孔複合体の形成不全はELYSの局在の異常がおもな原因であることが示唆された.
4.ELYSはヌクレオソームと結合する
ELYSの核膜内膜の近傍への局在においてヌクレオソームはどのように関与しているのだろうか? 過去のアフリカツメガエルの卵抽出液を用いた研究から,RanがELYSのクロマチンへの局在を制御していることが知られていた11).そこで,マウスの受精卵においてRan優性変異体を過剰に発現させてその機能を阻害することにより,ELYSの局在におけるRanの関与について検証した.しかしながら,Ranの機能を阻害してもELYSは正常に核膜に集積したことから,マウスの受精卵においてRanはELYSの核膜への局在に重要ではないことが示唆された.つづいて,培養細胞系を用いてELYSとヌクレオソームとが直接に結合する可能性について検証した.抗ELYS抗体を用いて293T細胞からELYSを精製し,HeLa細胞の核からモノヌクレオソームを調製した.これらをin vitroにおいて混合させたところ,ELYSとヌクレオソームとが直接に結合することがわかった.さらに,293T細胞の抽出液においてもELYSはヌクレオソームと結合していることが見い出された.これらの結果と受精卵における発見とをあわせて,ヌクレオソームにはELYSを核膜内膜の近傍に集積させるための足場としての役割があるのではないかと考えた.
5.マウスの受精卵における雄性前核の形成の段階的モデル
過去の知見をあわせ,この研究の結果から,マウスの受精卵における雄性前核の形成に関して以下のような段階的モデルがみえてきた(図2).まず,卵に侵入した精子からは未知の因子によりプロタミンが放出され,それと同時に,NPM2によりDNAが脱凝集する12).つづいて,ヒストンシャペロンであるHIRAによりヒストンH3.3-ヒストンH4が取り込まれたのち,未知のヒストンシャペロンによりヒストンH2A-ヒストンH2Bが取り込まれヌクレオソームが新規に形成される.そののち,雄性クロマチンに核膜が形成され,このタイミングでELYSが核膜の近傍に集積する.このステップにヌクレオソームが必須であるようだが,具体的にどのような機構でヌクレオソームがELYSの局在を制御しているかは明らかではない.そののち,ELYSを中心にNup107-160複合体やPOM121をはじめとしたヌクレオポリンが集合することにより機能的な核膜孔複合体が構築され,Ranを介した核へのタンパク質の輸送が行われるようになる.このようなステップが受精ののちわずか4時間のあいだになしとげられることにより,雄性ゲノムは受精卵において機能的な核を獲得する.一方で,雄性ゲノムへのヒストンH3.3の取り込みが阻害されるとほかのコアヒストンまで取り込まれなくなり,ヌクレオソームを欠損したDNAが生じる.このDNAの周囲に核膜は正常に形成されたことから,核膜の形成それ自体にヌクレオソームは必要ないことが示唆された.しかし,ヌクレオソームが存在しないとELYSが核膜の近傍に集積できないため核膜孔複合体が構築されない.その結果,核へのタンパク質の輸送は起こらず,雄性前核は拡張することなく小さいままとどまる(図2).
おわりに
歴史的に,核膜の形成の機構はおもにアフリカツメガエルの卵抽出液を用いて解明されてきた.しかしながら,卵抽出液には多量のヒストンが存在しており,外来のDNAに対し即座にヒストンが取り込まれてヌクレオソームを形成してしまう13).そのため,これまでの卵抽出液を用いた研究ではヌクレオソームの機能とDNAの機能とを明確に区別することができなかった.今回,筆者らは,HIRAあるいはヒストンH3.3をノックダウンしたマウスの受精卵を用いることによりこれを可能にし,ヌクレオソームの細胞生物学的な役割,すなわち,ELYSの局在の制御を介した核膜孔複合体の形成への関与を示唆することに成功した.なお,同時に掲載された論文では,アフリカツメガエルの卵抽出液から免疫除去によりヒストンを取り除くことによりin vitroにおいてヌクレオソームを形成しないDNAを作製し,この研究と同様の結論にいたっている14).
ヌクレオソームの形成が核膜孔複合体をもつ機能的な核膜の形成の上流にあるという今回の発見は,原核生物がヌクレオソームも核膜ももたない事実を考えると,進化の側面からとても興味深い.すなわち,原核生物から真核生物への進化の過程で,ヌクレオソームが核膜よりさきに獲得されたのではないかと想像(妄想)できるのである.また,コアヒストンをもたないDNAが受精卵において自らの電荷で反発して拡散することなくコンパクトにとどまっていることは特筆すべきことであり,ヌクレオソームを欠損した核においてコアヒストンやプロタミンの代わりにどのようなタンパク質がDNAに結合しているのかも興味深いところである.
文 献
- Margueron, R. & Reinberg, D.: Chromatin structure and the inheritance of epigenetic information. Nat. Rev. Genet., 11, 285-296 (2010)[PubMed]
- Rykowski, M., Wallis, J., Choe, J. et al.: Histone H2B subtypes are dispensable during the yeast cell cycle. Cell, 25, 477-487 (1981)[PubMed]
- Akiyama, T., Suzuki, O., Matsuda, J. et al.: Dynamic replacement of histone H3 variants reprograms epigenetic marks in early mouse embryos. PLoS Genet., 7, e1002279 (2011)[PubMed]
- Luger, K., Dechassa, M. & Tremethick, D.: New insights into nucleosome and chromatin structure: an ordered state or a disordered affair? Nat. Rev. Mol. Cell Biol., 13, 436-447 (2012)[PubMed]
- Loppin, B., Bonnefoy, E., Anselme, C. et al.: The histone H3.3 chaperone HIRA is essential for chromatin assembly in the male pronucleus. Nature, 437, 1386-1390 (2005)[PubMed]
- van der Heijden, G., Dieker, J. W., Derijck, A. A. et al.: Asymmetry in histone H3 variants and lysine methylation between paternal and maternal chromatin of the early mouse zygote. Mech. Dev., 122, 1008-1022 (2005)[PubMed]
- Inoue, A. & Aoki, F.: Role of the nucleoplasmin 2 C-terminal domain in the formation of nucleolus-like bodies in mouse oocytes. FASEB J., 24, 485-494 (2010)[PubMed]
- Smith, S. & Stillman, B.: Stepwise assembly of chromatin during DNA replication in vitro. EMBO J., 10, 971-980 (1991)[PubMed]
- Webster, M., Witkin, K. & Cohen-Fix, O.: Sizing up the nucleus: nuclear shape, size and nuclear-envelope assembly. J. Cell Sci., 122, 1477-1486 (2009)[PubMed]
- Guttinger, S., Laurell, E. & Kutay, U.: Orchestrating nuclear envelope disassembly and reassembly during mitosis. Nat. Rev. Mol. Cell Biol., 10, 178-191 (2009)[PubMed]
- Lau, C., Delmar, V. A., Chan, R. C. et al.: Transportin regulates major mitotic assembly events: from spindle to nuclear pore assembly. Mol. Biol. Cell, 20, 4043-4058 (2009)[PubMed]
- Inoue, A., Ogushi, S., Saitou, M. et al.: Involvement of mouse nucleoplasmin 2 in the decondensation of sperm chromatin after fertilization. Biol. Reprod., 85, 70-77 (2011)[PubMed]
- Newport, J.: Nuclear reconstitution in vitro: stages of assembly around protein-free DNA. Cell, 48, 205-217 (1987)[PubMed]
- Zierhut, C., Jenness, C., Kimura, H. et al.: Nucleosomal regulation of chromatin composition and nuclear assembly revealed by histone depletion. Nat. Struct. Mol. Biol., 21, 617-625 (2014)[PubMed]
著者プロフィール
略歴:2011年 東京大学大学院新領域創成科学研究科 修了,同年 米国North Carolina大学Chapel Hill校 研究員を経て,2012年より米国Harvard Medical School研究員.
研究テーマ:マウスの受精卵における発生プログラムの全貌を分子レベルで明らかにする.
抱負:卵の研究と離れた分野の研究とを融合させてみたい.
© 2014 井上 梓 Licensed under CC 表示 2.1 日本