肝臓における恒常的なmTOR複合体1の阻害は肝臓の障害および炎症を惹起し発がんを促進しうる
楳村敦詩・Michael Karin
(米国California大学San Diego校Department of Pharmacology)
email:楳村敦詩
DOI: 10.7875/first.author.2014.089
Liver damage, inflammation, and enhanced tumorigenesis after persistent mTORC1 inhibition.
Atsushi Umemura, Eek Joong Park, Koji Taniguchi, Jun Hee Lee, Shabnam Shalapour, Mark A. Valasek, Mariam Aghajan, Hayato Nakagawa, Ekihiro Seki, Michael N. Hall, Michael Karin
Cell Metabolism, 20, 133-144 (2014)
肥満はインスリン抵抗性,脂肪肝,非アルコール性脂肪肝炎をもたらすのみならず,肝がんのリスクも上昇させる.その一因としてmTOR複合体1の恒常的な活性化があげられ,mTOR複合体1の阻害剤には非アルコール性脂肪肝炎および肝がんの治療薬としての可能性が検討されている.また,高脂肪食を投与したマウスでは発がん物質により誘発される肝がんの発生および進展が促進されているとの報告がある.この研究では,mTOR複合体1の阻害が肥満における肝臓の炎症および肝がんを抑制しうるか,マウスモデルを用いて検討した.mTOR複合体1を阻害する作用をもつラパマイシンの投与,あるいは,mTOR複合体1の構成タンパク質であるRaptorの肝細胞における特異的な欠損により,脂肪肝は一過性に改善したが,インターロイキン6の産生の増加およびSTAT3の活性化が認められ,さらに,肝がんの増加が認められた.これらの結果,および,ヒトにおいてラパマイシンは炎症を誘発するとの報告より,ラパマイシンの長期にわたる投与は肥満に起因する非アルコール性脂肪肝炎や肝がんの予防および治療には適さない可能性がある.
ラパマイシン(別名:シロリムス)は免疫抑制剤として開発され,1999年に米国Food and Drug Administrationより腎臓移植ののちの投与が認可された.そののち,ラパマイシンとその誘導体であるエベロリムス,テンシロリムスは多くの疾患において適応が認可された.ラパマイシンの標的となるTORは,哺乳類ではmTOR複合体1およびmTOR複合体2という,はたらきを異にする2つのタンパク質複合体を形成する.ラパマイシンの種々の効果はおもにmTOR複合体1を阻害することにより発揮される.mTOR複合体1は栄養や増殖因子により活性化されて細胞の成長および増殖を促進し,タンパク質の生合成,糖代謝,脂質代謝を制御する.
mTOR複合体1は肝がんを含むヒトのがんにおいて活性の亢進が認められ,mTOR複合体1を抑制する腫瘍抑制タンパク質であるPTENもそれらのがんの多くで不活性化が認められることから,ラパマイシンのがん治療への応用が検討されてきた.くわえて,過剰な栄養の摂取によるmTOR複合体1の恒常的な活性化がもたらす肥満,脂肪肝,インスリン抵抗性などの病態も肝がんの強い発症リスクであることから,ラパマイシンとその誘導体の肝がんの予防あるいは治療に対する期待は強い.しかし,これまでの臨床試験ではかぎられた効果しか認められず,肝がんに対してエベロリムスを用いた試験では生存を延長せず1),肝臓の障害の発生を増加させた2).
非アルコール性脂肪肝炎は肝硬変および肝がんに進展する慢性の肝疾患であり,メタボリック症候群と相関して世界的に増加しており,米国では10~20年以内に最多の肝臓移植の適応疾患になると予測されている.そのため,非アルコール性脂肪肝炎やそれにつながるメタボリック症候群に対するラパマイシンとその誘導体の効果を検証することは急務である.肝臓移植ののちのシロリムスの使用は,死亡率,グラフトロス,肝動脈血栓症が増加するとの報告のあることから推奨されていない.エベロリムスは2013年に肝臓移植ののちの使用が適応になったが,臨床治験において対照群より高い死亡率を示したことは懸念材料である.これら予想に反する結果の原因として,肝臓の病態におけるmTOR複合体1のはたらきやその阻害の効果に対する理解がいまだ不十分であることが考えられる.
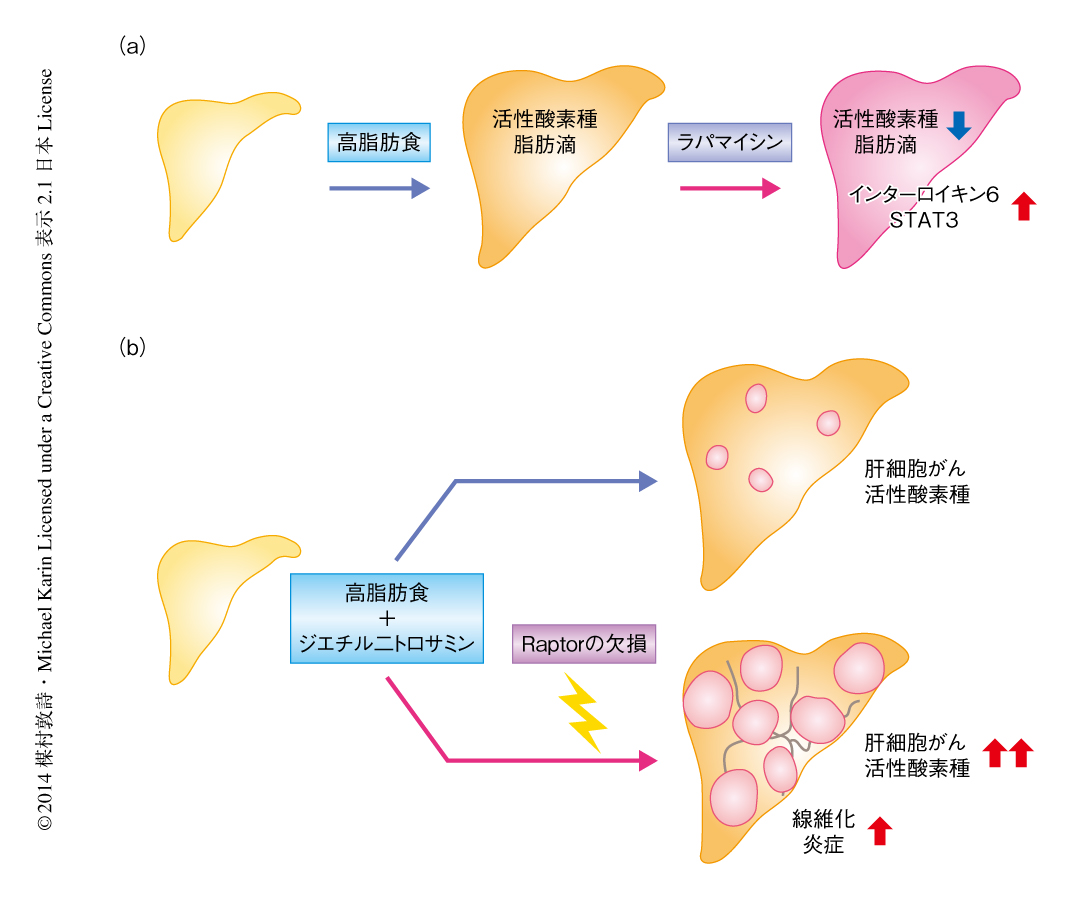
通常食あるいは高脂肪食を3カ月間あたえたマウスに2週間にわたりラパマイシンを投与した.高脂肪食をあたえたマウスは著明な脂肪肝と活性酸素種の蓄積を呈していたが,ラパマイシンの投与ののちにはいずれも減少した.ラパマイシンの投与はp62の蓄積を抑制し,オートファジーを活性化した.さらに,脂質合成にはたらく転写因子SREBP1cの発現を減少させた.他方,ラパマイシンは高脂肪食による肝臓の障害を増強し,炎症性サイトカインであるインターロイキン6の産生を促進してSTAT3を活性化した.つまり,ラパマイシンはオートファジーの活性化および脂質合成の低下により脂肪肝を軽減する一方で,炎症を促進し,肝がんの進展と強い関連が報告されているSTAT3を活性化した3)(図1a).
肝細胞以外におけるmTOR複合体1の阻害の影響を排除するため,mTOR複合体1の構成タンパク質であるRaptorを肝細胞において特異的にノックアウトしたマウスを作製し,長期にわたるmTOR複合体1の阻害の効果について調べた.このノックアウトマウスはmTOR複合体1のおもな標的であるリン酸化p70S6Kはほぼ完全に消失しており,また,リン酸化Aktとその下流の標的タンパク質であるリン酸化GSK3は著明に増加していた.これらは,このノックアウトマウスにおけるmTOR複合体1の阻害,および,それにより負のフィードバックを失ったことによるAktの活性化を示唆した.8週齢のこのノックアウトマウスは,肝臓の障害および肝細胞の形態の異常,細胞および核の肥大化を示し,さらに,肝臓の線維化,免疫細胞の浸潤,肝細胞の細胞死が認められたほか,DNA損傷あるいはDNA複製の異常を示唆するリン酸化γH2AX陽性の肝細胞が出現し,活性酸素種の蓄積およびサイクリンD1陽性細胞の著明な増加がみられた.肝細胞におけるRaptorの欠損によるmTOR複合体1の阻害は,肝細胞の細胞死をはじめとする種々の有害な事象をもたらすことが判明した(図1b).
mTOR複合体1は細胞周期および肝臓の再生の制御に関与していることが知られている4).8週齢の肝細胞に特異的なRaptorノックアウトマウスにおいて肝臓の2/3を部分切除すると,野生型のマウスと比較して,肝臓の障害の指標である血清ALT値の異常な高値および肝細胞の著明な淡明化が認められた.淡明化した肝細胞は強い損傷やグリコーゲンの蓄積をともなう異常な再生を意味する.さらに,野生型マウスと比べると,このノックアウトマウスでは増殖マーカーであるBrdUあるいはKi67に陽性の肝細胞は減少したが,活性酸素種の蓄積およびサイクリンD1陽性細胞の増加がみられた.肝臓の部分切除ののちの細胞分裂の頻度は著明に低下しており,それにともない,細胞周期にかかわるサイクリンB,サイクリンE,Cdc2,p21,p27は減少した.このノックアウトマウスでは,サイクリンD1,リン酸化Akt,リン酸化GSK3にくわえ,リン酸化ERKおよびリン酸化STAT3も増加していたことから,肝細胞がこれらのシグナルの増強により肥大化することで,Raptorの欠損に起因する細胞分裂の障害を代償していると推察された.
肝発がん物質であるジエチルニトロサミンの高用量の投与は,肝臓においてDNA損傷,細胞死,代償性の細胞増殖などの急性反応をひき起こす.8週齢の肝細胞に特異的なRaptorノックアウトマウスおよび野生型のマウスに高用量のジエチルニトロサミンを投与した.ノックアウトマウスではジエチルニトロサミンの投与ののちの血清ALT値が著明に高く,肝細胞の淡明化も高度であった.それに対応して,サイクリンD1の高発現,血清のインターロイキン6の高値,活性酸素種の蓄積も認められた.Ki67陽性の肝細胞およびリン酸化ERK陽性の肝細胞の数は同等であったが,ノックアウトマウスにおいてはサイクリンD1陽性の肝細胞はより多く,肝細胞の細胞死の増加,免疫細胞の浸潤および集積,リン酸化STAT3,リン酸化Akt,リン酸化GSK3,サイクリンD1の増加およびp27の減少がみられた.インターロイキン6やTNFなどの炎症性サイトカイン,および,細胞死のメディエーターであるDR5,TRB3,TRAIL,Bimをコードする遺伝子の発現も上昇していた.つまり,Raptorの欠損はジエチルニトロサミンによる肝臓の障害,炎症,活性酸素種の蓄積,肝細胞の細胞死を著明に増強した.
オスの14日齢の肝細胞に特異的なRaptorノックアウトマウスおよび野生型のマウスに低用量のジエチルニトロサミンを投与したところ,7カ月で典型的な肝がんが発生した.ノックアウトマウスに生じた腫瘍は野生型マウスに生じた腫瘍のおよそ7倍も多く最大径も大きいという際立った違いがみられた.ノックアウトマウスから単離し培養した肝がん細胞では,Raptorおよびリン酸化S6Kのほぼ完全な消失,リン酸化Aktの増加がみられ,細胞の増殖が促進していた.この肝がん細胞の増殖能はAkt阻害剤であるMK2206により低下したことから,Aktの活性化がこのノックアウトマウスにおいて促進する肝がんの発生および進展の一因と考えられた.また,高脂肪食をあたえたノックアウトマウスに発生した肝がんは,通常食をあたえたノックアウトマウスあるいは高脂肪食をあたえた野生型マウスに発生した肝がんに比べ,数および大きさともにうわまわった.結果として,mTOR複合体1の阻害は肥満が促進する肝がんの発生および進展を抑制せず,むしろ,助長した.
高脂肪食をあたえた7カ月齢の肝細胞に特異的なRaptorノックアウトマウスおよび野生型のマウスを比較したところ,脂肪肝および肝臓における中性脂肪は同じ程度であったが,ノックアウトマウスでは血清ALT値がより高く肝臓の線維化の程度も高度であった.耐糖能試験では,通常食をあたえたときにはノックアウトマウスでは耐糖能は改善していたが,高脂肪食をあたえたときにはノックアウトマウスでも改善していなかった.また,ノックアウトマウスでは,高脂肪食をあたえたときあるいは普通食をあたえたときとも,肝臓における還元型グルタチオン,および,還元型グルタチオンと酸化型グルタチオンの比が有意に低値であり,酸化ストレスの上昇が示唆された.
ラパマイシンはmTOR複合体1の恒常的な活性化による種々の有害な生体作用を減弱し腫瘍の増殖も抑制しうるとの考えから,とくに肥満が誘因となる非アルコール性脂肪肝炎および肝がんに対する治療薬として期待されてきた.また,肝臓に特異的なTsc1ノックアウトマウスでは,恒常的かつ強力に活性化したmTOR複合体1が肝がんを自然発症させ,ラパマイシンの投与はこの肝がんの発生および進展を抑制すると報告されている5).しかしながら,この研究により,肥満マウスへのラパマイシンの投与はインターロイキン6の産生などにより炎症を惹起し,肝がんの発生および進展を促進するSTAT3 3) の活性化を助長するという驚くべき事実が判明した.同様に,ヒトにおけるラパマイシンの投与が炎症性サイトカインの産生および炎症を誘発することはすでに報告されている6).さらに,肥満マウスではジエチルニトロサミンによる肝がんの発生および進展が促進されているとの報告があるが7),肝細胞に特異的なRaptorノックアウトマウスでは肝がんの発生および進展は抑制されなかったことから,mTOR複合体1の活性化は肥満が促進する肝がんの発生および進展にあまり寄与していない可能性がある.このノックアウトマウスでは,肝臓の障害,炎症,肝臓の線維化,活性酸素種の蓄積,DNA損傷,サイクリンD1やSTAT3の活性化が,肝がんの発生および進展を促進したと考えられた.活性化したAktは,さらに肝臓の障害の悪化や肝がんの進展を促進しうる.このノックアウトマウスでは肝臓の障害や活性酸素種の蓄積が増強され,異常な肝臓の再生が認められたが,これは,mTOR複合体1の阻害によりタンパク質の生合成が起こらず,細胞分裂も障害されたことによると考えられた.これらの結果は,非アルコール性脂肪肝炎や肝がんのみならず,慢性の肝疾患の全般におけるmTOR複合体1の阻害の問題点として考える必要がある.
進行した非アルコール性脂肪肝炎や肝がんの治療のひとつである肝臓移植においては肝臓の再生が必須であるが,移植ののちのラパマイシンあるいはその誘導体の使用による肝臓の再生の変化あるいは抑制に留意する必要がある4).また,高脂肪食を投与された肝細胞に特異的なRaptorノックアウトマウスでは,代謝パラメーターの改善がみられなかった.これは,ラパマイシンあるいはその誘導体を投与された患者の60%が抗脂質治療を必要とし,移植ののちの糖尿病の発症リスクが高いことと合致した8,9).したがって,ラパマイシンあるいはその誘導体は,とくにメタボリック症候群を背景とする非アルコール性脂肪肝炎および肝がんの治療には適さない可能性がある.
近年,mTOR複合体1およびmTOR複合体2にともに作用する阻害薬の開発が進められている.おもにmTOR複合体1にのみ作用するラパマイシンよりも高い効果が期待されているが,臨床試験において肝臓の障害の発生が増加することが報告された10).また,骨格筋において特異的にmTOR複合体1の活性を欠損させたマウスにおいても組織の障害,炎症,線維化がみられたが,さらにmTOR複合体2の活性を欠損させてもこれらは改善せず,Aktの活性化も抑制されないと報告された11).mTOR複合体1の阻害による有害な事象のいくつかはAktの過剰な活性化によるものであると考えられるため,Aktの活性を抑制しつつオートファジーの活性化により脂肪滴を除去するなど別のアプローチも探ることが,現在,急速に拡大する健康問題である肥満およびメタボリック症候群,および,それらと密接に関連する非アルコール性脂肪肝炎および肝がんの予防および治療に重要であると思われる.
略歴:2008年 京都府立医科大学大学院にて博士号取得,2011年 京都府立医科大学 研究員を経て,同年より米国California大学San Diego校 研究員.
研究テーマ:肝がんの発生および進展の分子機構,とくに,メタボリック症候群,脂肪肝,非アルコール性脂肪肝炎との関連.非アルコール性脂肪肝炎の病態の解明,および,単純性脂肪肝との差異.
抱負:日常の診療に役だてることを念頭において,トランスレーショナルリサーチにかかわっていきたい.
Michael Karin
米国California大学San Diego校Distinguished professor.
© 2014 楳村敦詩・Michael Karin Licensed under CC 表示 2.1 日本
(米国California大学San Diego校Department of Pharmacology)
email:楳村敦詩
DOI: 10.7875/first.author.2014.089
Liver damage, inflammation, and enhanced tumorigenesis after persistent mTORC1 inhibition.
Atsushi Umemura, Eek Joong Park, Koji Taniguchi, Jun Hee Lee, Shabnam Shalapour, Mark A. Valasek, Mariam Aghajan, Hayato Nakagawa, Ekihiro Seki, Michael N. Hall, Michael Karin
Cell Metabolism, 20, 133-144 (2014)
要 約
肥満はインスリン抵抗性,脂肪肝,非アルコール性脂肪肝炎をもたらすのみならず,肝がんのリスクも上昇させる.その一因としてmTOR複合体1の恒常的な活性化があげられ,mTOR複合体1の阻害剤には非アルコール性脂肪肝炎および肝がんの治療薬としての可能性が検討されている.また,高脂肪食を投与したマウスでは発がん物質により誘発される肝がんの発生および進展が促進されているとの報告がある.この研究では,mTOR複合体1の阻害が肥満における肝臓の炎症および肝がんを抑制しうるか,マウスモデルを用いて検討した.mTOR複合体1を阻害する作用をもつラパマイシンの投与,あるいは,mTOR複合体1の構成タンパク質であるRaptorの肝細胞における特異的な欠損により,脂肪肝は一過性に改善したが,インターロイキン6の産生の増加およびSTAT3の活性化が認められ,さらに,肝がんの増加が認められた.これらの結果,および,ヒトにおいてラパマイシンは炎症を誘発するとの報告より,ラパマイシンの長期にわたる投与は肥満に起因する非アルコール性脂肪肝炎や肝がんの予防および治療には適さない可能性がある.
はじめに
ラパマイシン(別名:シロリムス)は免疫抑制剤として開発され,1999年に米国Food and Drug Administrationより腎臓移植ののちの投与が認可された.そののち,ラパマイシンとその誘導体であるエベロリムス,テンシロリムスは多くの疾患において適応が認可された.ラパマイシンの標的となるTORは,哺乳類ではmTOR複合体1およびmTOR複合体2という,はたらきを異にする2つのタンパク質複合体を形成する.ラパマイシンの種々の効果はおもにmTOR複合体1を阻害することにより発揮される.mTOR複合体1は栄養や増殖因子により活性化されて細胞の成長および増殖を促進し,タンパク質の生合成,糖代謝,脂質代謝を制御する.
mTOR複合体1は肝がんを含むヒトのがんにおいて活性の亢進が認められ,mTOR複合体1を抑制する腫瘍抑制タンパク質であるPTENもそれらのがんの多くで不活性化が認められることから,ラパマイシンのがん治療への応用が検討されてきた.くわえて,過剰な栄養の摂取によるmTOR複合体1の恒常的な活性化がもたらす肥満,脂肪肝,インスリン抵抗性などの病態も肝がんの強い発症リスクであることから,ラパマイシンとその誘導体の肝がんの予防あるいは治療に対する期待は強い.しかし,これまでの臨床試験ではかぎられた効果しか認められず,肝がんに対してエベロリムスを用いた試験では生存を延長せず1),肝臓の障害の発生を増加させた2).
非アルコール性脂肪肝炎は肝硬変および肝がんに進展する慢性の肝疾患であり,メタボリック症候群と相関して世界的に増加しており,米国では10~20年以内に最多の肝臓移植の適応疾患になると予測されている.そのため,非アルコール性脂肪肝炎やそれにつながるメタボリック症候群に対するラパマイシンとその誘導体の効果を検証することは急務である.肝臓移植ののちのシロリムスの使用は,死亡率,グラフトロス,肝動脈血栓症が増加するとの報告のあることから推奨されていない.エベロリムスは2013年に肝臓移植ののちの使用が適応になったが,臨床治験において対照群より高い死亡率を示したことは懸念材料である.これら予想に反する結果の原因として,肝臓の病態におけるmTOR複合体1のはたらきやその阻害の効果に対する理解がいまだ不十分であることが考えられる.
1.ラパマイシンは脂肪肝を軽減する一方でインターロイキン6を増加させSTAT3を活性化する
通常食あるいは高脂肪食を3カ月間あたえたマウスに2週間にわたりラパマイシンを投与した.高脂肪食をあたえたマウスは著明な脂肪肝と活性酸素種の蓄積を呈していたが,ラパマイシンの投与ののちにはいずれも減少した.ラパマイシンの投与はp62の蓄積を抑制し,オートファジーを活性化した.さらに,脂質合成にはたらく転写因子SREBP1cの発現を減少させた.他方,ラパマイシンは高脂肪食による肝臓の障害を増強し,炎症性サイトカインであるインターロイキン6の産生を促進してSTAT3を活性化した.つまり,ラパマイシンはオートファジーの活性化および脂質合成の低下により脂肪肝を軽減する一方で,炎症を促進し,肝がんの進展と強い関連が報告されているSTAT3を活性化した3)(図1a).
2.肝細胞において特異的なRaptorノックアウトマウスの解析
肝細胞以外におけるmTOR複合体1の阻害の影響を排除するため,mTOR複合体1の構成タンパク質であるRaptorを肝細胞において特異的にノックアウトしたマウスを作製し,長期にわたるmTOR複合体1の阻害の効果について調べた.このノックアウトマウスはmTOR複合体1のおもな標的であるリン酸化p70S6Kはほぼ完全に消失しており,また,リン酸化Aktとその下流の標的タンパク質であるリン酸化GSK3は著明に増加していた.これらは,このノックアウトマウスにおけるmTOR複合体1の阻害,および,それにより負のフィードバックを失ったことによるAktの活性化を示唆した.8週齢のこのノックアウトマウスは,肝臓の障害および肝細胞の形態の異常,細胞および核の肥大化を示し,さらに,肝臓の線維化,免疫細胞の浸潤,肝細胞の細胞死が認められたほか,DNA損傷あるいはDNA複製の異常を示唆するリン酸化γH2AX陽性の肝細胞が出現し,活性酸素種の蓄積およびサイクリンD1陽性細胞の著明な増加がみられた.肝細胞におけるRaptorの欠損によるmTOR複合体1の阻害は,肝細胞の細胞死をはじめとする種々の有害な事象をもたらすことが判明した(図1b).
3.Raptorの欠損は肝細胞の分裂および増殖を障害する
mTOR複合体1は細胞周期および肝臓の再生の制御に関与していることが知られている4).8週齢の肝細胞に特異的なRaptorノックアウトマウスにおいて肝臓の2/3を部分切除すると,野生型のマウスと比較して,肝臓の障害の指標である血清ALT値の異常な高値および肝細胞の著明な淡明化が認められた.淡明化した肝細胞は強い損傷やグリコーゲンの蓄積をともなう異常な再生を意味する.さらに,野生型マウスと比べると,このノックアウトマウスでは増殖マーカーであるBrdUあるいはKi67に陽性の肝細胞は減少したが,活性酸素種の蓄積およびサイクリンD1陽性細胞の増加がみられた.肝臓の部分切除ののちの細胞分裂の頻度は著明に低下しており,それにともない,細胞周期にかかわるサイクリンB,サイクリンE,Cdc2,p21,p27は減少した.このノックアウトマウスでは,サイクリンD1,リン酸化Akt,リン酸化GSK3にくわえ,リン酸化ERKおよびリン酸化STAT3も増加していたことから,肝細胞がこれらのシグナルの増強により肥大化することで,Raptorの欠損に起因する細胞分裂の障害を代償していると推察された.
4.Raptorの欠損は肝細胞の細胞死および炎症を増強する
肝発がん物質であるジエチルニトロサミンの高用量の投与は,肝臓においてDNA損傷,細胞死,代償性の細胞増殖などの急性反応をひき起こす.8週齢の肝細胞に特異的なRaptorノックアウトマウスおよび野生型のマウスに高用量のジエチルニトロサミンを投与した.ノックアウトマウスではジエチルニトロサミンの投与ののちの血清ALT値が著明に高く,肝細胞の淡明化も高度であった.それに対応して,サイクリンD1の高発現,血清のインターロイキン6の高値,活性酸素種の蓄積も認められた.Ki67陽性の肝細胞およびリン酸化ERK陽性の肝細胞の数は同等であったが,ノックアウトマウスにおいてはサイクリンD1陽性の肝細胞はより多く,肝細胞の細胞死の増加,免疫細胞の浸潤および集積,リン酸化STAT3,リン酸化Akt,リン酸化GSK3,サイクリンD1の増加およびp27の減少がみられた.インターロイキン6やTNFなどの炎症性サイトカイン,および,細胞死のメディエーターであるDR5,TRB3,TRAIL,Bimをコードする遺伝子の発現も上昇していた.つまり,Raptorの欠損はジエチルニトロサミンによる肝臓の障害,炎症,活性酸素種の蓄積,肝細胞の細胞死を著明に増強した.
5.mTOR複合体1の阻害は肝発がんを助長する
オスの14日齢の肝細胞に特異的なRaptorノックアウトマウスおよび野生型のマウスに低用量のジエチルニトロサミンを投与したところ,7カ月で典型的な肝がんが発生した.ノックアウトマウスに生じた腫瘍は野生型マウスに生じた腫瘍のおよそ7倍も多く最大径も大きいという際立った違いがみられた.ノックアウトマウスから単離し培養した肝がん細胞では,Raptorおよびリン酸化S6Kのほぼ完全な消失,リン酸化Aktの増加がみられ,細胞の増殖が促進していた.この肝がん細胞の増殖能はAkt阻害剤であるMK2206により低下したことから,Aktの活性化がこのノックアウトマウスにおいて促進する肝がんの発生および進展の一因と考えられた.また,高脂肪食をあたえたノックアウトマウスに発生した肝がんは,通常食をあたえたノックアウトマウスあるいは高脂肪食をあたえた野生型マウスに発生した肝がんに比べ,数および大きさともにうわまわった.結果として,mTOR複合体1の阻害は肥満が促進する肝がんの発生および進展を抑制せず,むしろ,助長した.
6.肥満マウスにおけるRaptorの欠損は肝臓の障害および線維化を増悪させ代謝パラメーターを改善しない
高脂肪食をあたえた7カ月齢の肝細胞に特異的なRaptorノックアウトマウスおよび野生型のマウスを比較したところ,脂肪肝および肝臓における中性脂肪は同じ程度であったが,ノックアウトマウスでは血清ALT値がより高く肝臓の線維化の程度も高度であった.耐糖能試験では,通常食をあたえたときにはノックアウトマウスでは耐糖能は改善していたが,高脂肪食をあたえたときにはノックアウトマウスでも改善していなかった.また,ノックアウトマウスでは,高脂肪食をあたえたときあるいは普通食をあたえたときとも,肝臓における還元型グルタチオン,および,還元型グルタチオンと酸化型グルタチオンの比が有意に低値であり,酸化ストレスの上昇が示唆された.
おわりに
ラパマイシンはmTOR複合体1の恒常的な活性化による種々の有害な生体作用を減弱し腫瘍の増殖も抑制しうるとの考えから,とくに肥満が誘因となる非アルコール性脂肪肝炎および肝がんに対する治療薬として期待されてきた.また,肝臓に特異的なTsc1ノックアウトマウスでは,恒常的かつ強力に活性化したmTOR複合体1が肝がんを自然発症させ,ラパマイシンの投与はこの肝がんの発生および進展を抑制すると報告されている5).しかしながら,この研究により,肥満マウスへのラパマイシンの投与はインターロイキン6の産生などにより炎症を惹起し,肝がんの発生および進展を促進するSTAT3 3) の活性化を助長するという驚くべき事実が判明した.同様に,ヒトにおけるラパマイシンの投与が炎症性サイトカインの産生および炎症を誘発することはすでに報告されている6).さらに,肥満マウスではジエチルニトロサミンによる肝がんの発生および進展が促進されているとの報告があるが7),肝細胞に特異的なRaptorノックアウトマウスでは肝がんの発生および進展は抑制されなかったことから,mTOR複合体1の活性化は肥満が促進する肝がんの発生および進展にあまり寄与していない可能性がある.このノックアウトマウスでは,肝臓の障害,炎症,肝臓の線維化,活性酸素種の蓄積,DNA損傷,サイクリンD1やSTAT3の活性化が,肝がんの発生および進展を促進したと考えられた.活性化したAktは,さらに肝臓の障害の悪化や肝がんの進展を促進しうる.このノックアウトマウスでは肝臓の障害や活性酸素種の蓄積が増強され,異常な肝臓の再生が認められたが,これは,mTOR複合体1の阻害によりタンパク質の生合成が起こらず,細胞分裂も障害されたことによると考えられた.これらの結果は,非アルコール性脂肪肝炎や肝がんのみならず,慢性の肝疾患の全般におけるmTOR複合体1の阻害の問題点として考える必要がある.
進行した非アルコール性脂肪肝炎や肝がんの治療のひとつである肝臓移植においては肝臓の再生が必須であるが,移植ののちのラパマイシンあるいはその誘導体の使用による肝臓の再生の変化あるいは抑制に留意する必要がある4).また,高脂肪食を投与された肝細胞に特異的なRaptorノックアウトマウスでは,代謝パラメーターの改善がみられなかった.これは,ラパマイシンあるいはその誘導体を投与された患者の60%が抗脂質治療を必要とし,移植ののちの糖尿病の発症リスクが高いことと合致した8,9).したがって,ラパマイシンあるいはその誘導体は,とくにメタボリック症候群を背景とする非アルコール性脂肪肝炎および肝がんの治療には適さない可能性がある.
近年,mTOR複合体1およびmTOR複合体2にともに作用する阻害薬の開発が進められている.おもにmTOR複合体1にのみ作用するラパマイシンよりも高い効果が期待されているが,臨床試験において肝臓の障害の発生が増加することが報告された10).また,骨格筋において特異的にmTOR複合体1の活性を欠損させたマウスにおいても組織の障害,炎症,線維化がみられたが,さらにmTOR複合体2の活性を欠損させてもこれらは改善せず,Aktの活性化も抑制されないと報告された11).mTOR複合体1の阻害による有害な事象のいくつかはAktの過剰な活性化によるものであると考えられるため,Aktの活性を抑制しつつオートファジーの活性化により脂肪滴を除去するなど別のアプローチも探ることが,現在,急速に拡大する健康問題である肥満およびメタボリック症候群,および,それらと密接に関連する非アルコール性脂肪肝炎および肝がんの予防および治療に重要であると思われる.
文 献
- Zhu, A.X., Kudo, M., Assenat, E. et al.: EVOLVE-1: Phase 3 study of everolimus for advanced HCC that progressed during or after sorafenib. J. Clin. Oncol., 32 (suppl.3), 172 (2014)
- Yamanaka, K., Petrulionis, M., Lin, S. et al.: Therapeutic potential and adverse events of everolimus for treatment of hepatocellular carcinoma: systematic review and meta-analysis. Cancer Med., 2, 862-871 (2013)[PubMed]
- He, G., Yu, G. Y., Temkin, V. et al.: Hepatocyte IKKβ/NF-κB inhibits tumor promotion and progression by preventing oxidative stress-driven STAT3 activation. Cancer Cell, 17, 286-297 (2010)[PubMed]
- Espeillac, C., Mitchell, C., Celton-Morizur, S. et al.: S6 kinase 1 is required for rapamycin-sensitive liver proliferation after mouse hepatectomy. J. Clin. Invest., 121, 2821-2832 (2011)[PubMed]
- Menon, S., Yecies, J. L., Zhang, H. H. et al.: Chronic activation of mTOR complex 1 is sufficient to cause hepatocellular carcinoma in mice. Sci. Signal, 5, ra24 (2012)[PubMed]
- Buron, F., Malvezzi, P., Villar, E. et al.: Profiling sirolimus-induced inflammatory syndrome: a prospective tricentric observational study. PLoS One, 8, e53078 (2013)[PubMed]
- Park, E. J., Lee, J. H., Yu, G. Y. et al.: Dietary and genetic obesity promote liver inflammation and tumorigenesis by enhancing IL-6 and TNF expression. Cell, 140, 197-208 (2010)[PubMed]
- Peddi, V. R., Wiseman, A., Chavin, K. et al.: Review of combination therapy with mTOR inhibitors and tacrolimus minimization after transplantation. Transplant. Rev., 27, 97-107 (2013)[PubMed]
- Barlow, A. D., Nicholson, M. L. & Herbert, T. P.: Evidence for rapamycin toxicity in pancreatic β-cells and a review of the underlying molecular mechanisms. Diabetes, 62, 2674-2682 (2013)[PubMed]
- Matter, M. S., Decaens, T., Andersen, J. B. et al.: Targeting the mTOR pathway in hepatocellular carcinoma: current state and future trends. J. Hepatol., 60, 855-865 (2014)[PubMed]
- Bentzinger, C. F., Romanino, K., Cloetta, D. et al.: Skeletal muscle-specific ablation of raptor, but not of rictor, causes metabolic changes and results in muscle dystrophy. Cell Metab., 8, 411-424 (2008)[PubMed]
著者プロフィール
略歴:2008年 京都府立医科大学大学院にて博士号取得,2011年 京都府立医科大学 研究員を経て,同年より米国California大学San Diego校 研究員.
研究テーマ:肝がんの発生および進展の分子機構,とくに,メタボリック症候群,脂肪肝,非アルコール性脂肪肝炎との関連.非アルコール性脂肪肝炎の病態の解明,および,単純性脂肪肝との差異.
抱負:日常の診療に役だてることを念頭において,トランスレーショナルリサーチにかかわっていきたい.
Michael Karin
米国California大学San Diego校Distinguished professor.
© 2014 楳村敦詩・Michael Karin Licensed under CC 表示 2.1 日本