Cushing症候群におけるプロテインキナーゼA触媒サブユニットの変異
佐藤悠佑1・本間之夫2・小川誠司1
(1京都大学大学院医学研究科 腫瘍生物学講座,2東京大学大学院医学系研究科 泌尿器外科学)
email:佐藤悠佑,小川誠司
DOI: 10.7875/first.author.2014.086
Recurrent somatic mutations underlie corticotropin-independent Cushing’s syndrome.
Yusuke Sato, Shigekatsu Maekawa, Ryohei Ishii, Masashi Sanada, Teppei Morikawa, Yuichi Shiraishi, Kenichi Yoshida, Yasunobu Nagata, Aiko Sato-Otsubo, Tetsuichi Yoshizato, Hiromichi Suzuki, Yusuke Shiozawa, Keisuke Kataoka, Ayana Kon, Kosuke Aoki, Kenichi Chiba, Hiroko Tanaka, Haruki Kume, Satoru Miyano, Masashi Fukayama, Osamu Nureki, Yukio Homma, Seishi Ogawa
Science, 344, 917-920 (2014)
Cushing症候群は副腎皮質からコルチゾールが過剰に分泌されることにより生じ,高血圧や糖尿病などの症状を呈する.副腎皮質刺激ホルモン非依存性Cushing症候群では副腎腺腫による自律的なコルチゾールの産生がみられるが,その分子病態はほとんど不明であった.今回,筆者らは,副腎皮質刺激ホルモン非依存性Cushing症候群を生じる副腎腺腫にて,半数以上の症例においてプロテインキナーゼAの触媒サブユニットをコードするPRKACA遺伝子の変異を同定した.変異はすべてLeu206をコードする部位に生じており,この変異により触媒サブユニットと制御サブユニットとの結合が阻害され,cAMPに非依存的にプロテインキナーゼAが活性化していることが明らかになった.また,およそ2割の症例ではアデニル酸シクラーゼを活性化することによりcAMPの産生にかかわるタンパク質をコードするGNAS遺伝子に変異が生じており,合計で約7割の症例においてプロテインキナーゼAの活性化にかかわる遺伝子に体細胞性の変異の生じていることが明らかにされた.
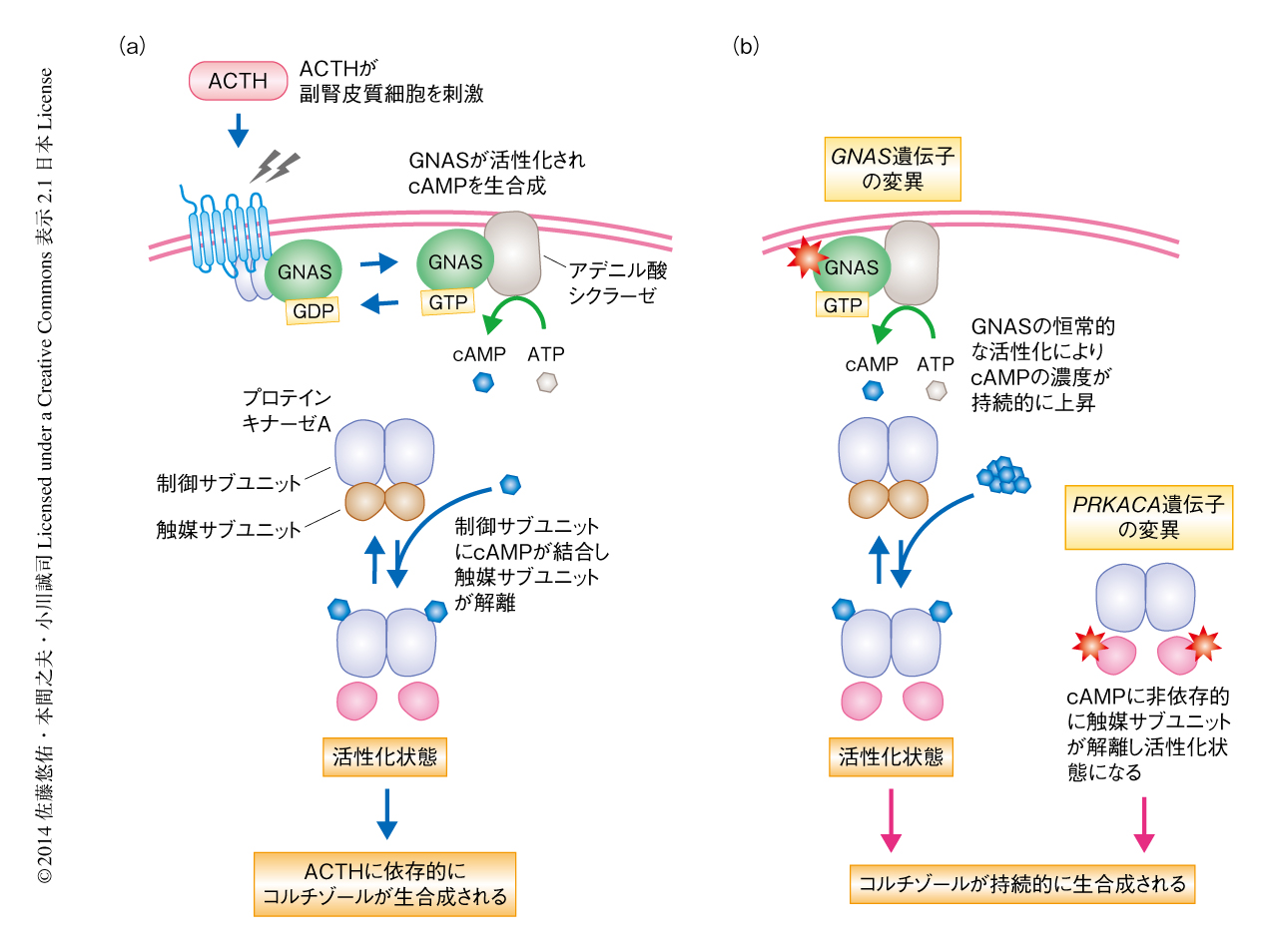
Cushing症候群は副腎から過剰かつ持続的にコルチゾールが分泌されることにより多彩な症状を呈する疾患で,20代~40代の女性に好発する.ステロイドホルモンの一種であるコルチゾールは生命活動の維持に必須であり,その分泌量は早朝の起床時に多く就寝時に低いという日内変動を示す.Cushing症候群ではつねに多量のコルチゾールが分泌されており,それにより,高血圧,糖尿病,中心性肥満,骨粗鬆症,うつなど,さまざまな症状が出現する1).副腎皮質におけるコルチゾールの産生は脳下垂体から分泌される副腎皮質刺激ホルモンにより制御されている.副腎皮質刺激ホルモンが副腎皮質細胞の受容体に結合すると,アデニル酸シクラーゼが活性化されることにより細胞におけるcAMPの濃度が上昇する.さらに,cAMPがセカンドメッセンジャーとなってプロテインキナーゼAを活性化することにより,コルチゾールの生合成が促進される(図1a).
Cushing症候群はその病因により副腎皮質刺激ホルモン依存性と非依存性の2つの病型に分類される.副腎皮質刺激ホルモン依存性Cushing症候群では下垂体腫瘍などが原因となり副腎皮質刺激ホルモンが多量に分泌され,それに反応して副腎がコルチゾールを産生する.一方,副腎皮質刺激ホルモン非依存性Cushing症候群では副腎腫瘍が原因となり,副腎皮質刺激ホルモンによる刺激がなくても自律的にコルチゾールが産生される.副腎皮質刺激ホルモン非依存性Cushing症候群の原因となる副腎腫瘍のほとんどは片側性に生じる腺腫であるが,どのような分子機構によりコルチゾールが持続的に産生されているのかはこれまでほとんど不明であった.今回,筆者らは,全エキソン塩基配列解析によりその原因となる遺伝子の変異を同定した.
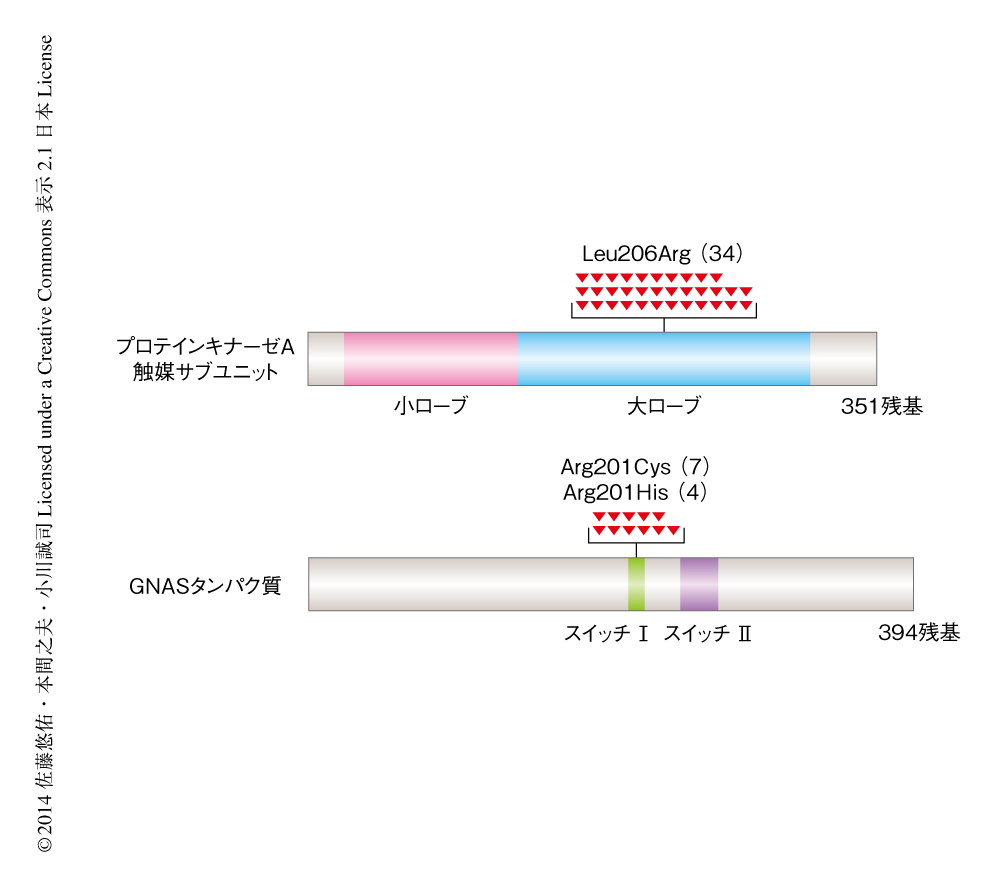
8例の副腎皮質刺激ホルモン非依存性Cushing症候群を対象に,副腎腺腫から採取したDNAおよび正常な細胞(正常な副腎皮質の組織あるいは血液)のDNAを用いて全エキソン塩基配列解析を行った.副腎腺腫において生じている体細胞性の変異を網羅的に検索した結果,1例あたり平均5.6個の遺伝子変異を同定した.このうち,複数の症例に共通して変異のみられた遺伝子はプロテインキナーゼAの触媒サブユニットをコードするPRKACA遺伝子のみであり,8例中4例にこの遺伝子の変異が検出された.また,1例にGNAS遺伝子の変異を認めた.GNAS遺伝子のコードするタンパク質はアデニル酸シクラーゼを活性化することによりcAMPの産生にかかわっており,いくつかの内分泌疾患において機能獲得型の変異を生じることが知られている2-5).これらを合計すると,8例中5例にcAMP-プロテインキナーゼAシグナル伝達経路に関する遺伝子変異の生じていることが明らかになった.さらに57例を追加してこれらの遺伝子の変異解析を行ったところ,合計で65例中34例にPRKACA遺伝子の変異を,11例にGNAS遺伝子の変異を認めた(図2).これらの変異は完全に排他的に生じており,65例中45例の症例にcAMP-プロテインキナーゼAシグナル伝達経路の異常が生じていることが示唆された.興味深いことに,PRKACA遺伝子の変異は特定の部位にのみ生じており,いずれもLeu206がArgに置換する変異であった.また,GNAS遺伝子の変異はいずれもArg201がCysあるいはHisに置換する変異であった.このGNAS遺伝子の変異はほかの疾患において知られているものと同一の変異であり,このアミノ酸残基の置換により細胞におけるcAMPの濃度が持続的に上昇することが明らかにされている2).
PRKACA遺伝子およびGNAS遺伝子の変異の有無と臨床像との関連について検討した.PRKACA遺伝子の変異例では,変異のない例と比較して,1 mgのデキサメサゾンによる抑制試験における血清中のコルチゾールの濃度が有意に高く,副腎腺腫の直径が有意に小さかった.このことから,PRKACA遺伝子の変異例では細胞あたりのコルチゾールの産生能の上昇していることが示唆された.症例が少ないため統計学的な有意差は検出できなかったものの,GNAS遺伝子の変異例においてもこれと同様の傾向がみられた.
PRKACA遺伝子にLeu206がArgに置換する変異の生じることが機能的にどのような意義もつのかを検討した.PRKACA遺伝子はプロテインキナーゼAの触媒サブユニットをコードしている.プロテインキナーゼAは2つの触媒サブユニットと2つの制御サブユニットから構成されており,制御サブユニットが触媒サブユニットと結合することにより触媒サブユニットのもつ酵素活性部位がおおわれ,通常は不活性になっている.外部からの刺激により細胞におけるcAMPの濃度が上昇し制御サブユニットにcAMPが結合すると,制御サブユニットの立体構造が変化し触媒サブユニットとの結合が解離する6,7).制御サブユニットから遊離することにより活性化した触媒サブユニットは核へと移行してその標的タンパク質をリン酸化する.触媒サブユニットのLeu206は制御サブユニットのIle99と疎水性相互作用を形成しており,触媒サブユニットと制御サブユニットとの結合に重要な役割をはたしていると考えられる.触媒サブユニットのLeu206がArgに置換することにより疎水性の側鎖が伸長するため,触媒サブユニットと制御サブユニットとのあいだに立体障害が生じ結合が阻害されることが予想される.つまり,PRKACA遺伝子にLeu206がArgに置換する変異が生じると,触媒サブユニットと制御サブユニットとが結合しなくなることより触媒サブユニットがつねに遊離した状態となるため,cAMPに非依存的にプロテインキナーゼAが活性化するのではないかと考えられた(図1b).
このことを検証するため,精製したタンパク質を用いて免疫沈降実験ならびにプロテインキナーゼA活性の測定を行った.野生型のプロテインキナーゼA触媒サブユニットに制御サブユニットをくわえると,それらの結合がみられると同時にプロテインキナーゼA活性が抑制されたが,これにさらにcAMPを追加することによりそれらは解離し,プロテインキナーゼA活性も回復した.一方,変異型の触媒サブユニットの場合は,制御サブユニットをくわえてもこれと結合せず,cAMPの有無にかかわらずプロテインキナーゼA活性は高い状態を維持していた.HEK293T細胞に野生型あるいは変異型の触媒サブユニットを発現させ同様の検討を行ったところ,in vivoにおいても変異型の触媒サブユニットは制御サブユニットと結合せず,cAMPに非依存的にプロテインキナーゼA活性が上昇していることが確認された.また,変異型の触媒サブユニットを発現させた細胞では,プロテインキナーゼAの主要な標的タンパク質であるCREBがcAMPの非存在下においてもリン酸化されていた.
変異型の触媒サブユニットを発現させたHEK293T細胞に3種類のプロテインキナーゼA阻害剤,H89,KT5720,Rp-cAMPSをくわえたのち,プロテインキナーゼA活性を測定し阻害剤の効果の違いについて検討した.H89およびKT5720は遊離した触媒サブユニットに対し直接的にキナーゼ活性をさまたげる薬剤であり,これらは変異型の触媒サブユニットを発現させた細胞に対しても阻害効果を示した.一方,Rp-cAMPSは制御サブユニットに対するcAMPの結合を競合的に阻害することにより触媒サブユニットの遊離を防ぐ効果をもつ薬剤であるが,変異型の触媒サブユニットを発現させた細胞に対しては十分な効果を示さなかった.このことからも,変異型の触媒サブユニットのプロテインキナーゼA活性はcAMPに依存していないことが確認された.
変異型のプロテインキナーゼA触媒サブユニットは制御サブユニットと結合せずつねに遊離していることから,野生型の触媒サブユニットと比べ不安定で分解されやすいと考えられた.実際に,PRKACA遺伝子に変異をもつ副腎腺腫の組織における触媒サブユニットのタンパク質レベルでの発現量は,変異をもたない副腎腺腫の組織および正常な副腎皮質の組織における発現量と比較して有意に低かった.野生型または変異型の触媒サブユニットを発現させたHEK293T細胞での比較においても,変異型の触媒サブユニットを発現させた細胞では,野生型の触媒サブユニットを発現させた細胞よりも,細胞における触媒サブユニットのタンパク質レベルでの発現量は有意に低かった.しかしながら,細胞質および核における発現量を検討したところ,変異型の触媒サブユニットを発現させた細胞では,触媒サブユニットはほとんどが細胞質から核へと移行していることが明らかになった.
Cushing症候群は1912年に特定された疾患であり,現在では,もっとも代表的な内分泌疾患のひとつである.その病態生理がきわめて特徴的であることから,内分泌学を学ぶ際にはCushing症候群をさけてとおることはできず,そのため,専門外の医師はもちろん,医学部生のあいだにも広く知られている.そのような疾患の分子病態が解明されたことは非常にインパクトの大きい成果であったと考えられる.この論文とほぼ同じ時期に,ほかのグループからも,副腎皮質刺激ホルモン非依存性Cushing症候群におけるPRKACA遺伝子の変異についての論文が合計3報も出版されており8-10),Cushing症候群の分子病態に対する関心の強さがうかがわれた.
この研究において,副腎皮質刺激ホルモン非依存性Cushing症候群におけるPRKACA遺伝子およびGNAS遺伝子の変異が明らかになったことにより,およそ7割の症例の分子病態が説明されたことは大きな成果といえる.しかし,残りの3割の症例についてはいまだ不明であり,今後の研究による解明が望まれる.また,下垂体腫瘍を原因とする副腎皮質刺激ホルモン依存性Cushing症候群やそのほかの内分泌疾患においてGNAS遺伝子に変異の生じていることはよく知られているが,同様に,PRKACA遺伝子にも変異が生じているかどうか,非常に興味深いところである.
略歴:2014年 東京大学大学院医学系研究科博士課程 修了,同年より京都大学大学院医学研究科 特定助教.
研究テーマ:泌尿器の腫瘍におけるゲノム解析.
本間 之夫(Yukio Homma)
東京大学大学院医学系研究科 教授.
小川 誠司(Ogawa Seishi)
京都大学大学院医学研究科 教授.
© 2014 佐藤悠佑・本間之夫・小川誠司 Licensed under CC 表示 2.1 日本
(1京都大学大学院医学研究科 腫瘍生物学講座,2東京大学大学院医学系研究科 泌尿器外科学)
email:佐藤悠佑,小川誠司
DOI: 10.7875/first.author.2014.086
Recurrent somatic mutations underlie corticotropin-independent Cushing’s syndrome.
Yusuke Sato, Shigekatsu Maekawa, Ryohei Ishii, Masashi Sanada, Teppei Morikawa, Yuichi Shiraishi, Kenichi Yoshida, Yasunobu Nagata, Aiko Sato-Otsubo, Tetsuichi Yoshizato, Hiromichi Suzuki, Yusuke Shiozawa, Keisuke Kataoka, Ayana Kon, Kosuke Aoki, Kenichi Chiba, Hiroko Tanaka, Haruki Kume, Satoru Miyano, Masashi Fukayama, Osamu Nureki, Yukio Homma, Seishi Ogawa
Science, 344, 917-920 (2014)
要 約
Cushing症候群は副腎皮質からコルチゾールが過剰に分泌されることにより生じ,高血圧や糖尿病などの症状を呈する.副腎皮質刺激ホルモン非依存性Cushing症候群では副腎腺腫による自律的なコルチゾールの産生がみられるが,その分子病態はほとんど不明であった.今回,筆者らは,副腎皮質刺激ホルモン非依存性Cushing症候群を生じる副腎腺腫にて,半数以上の症例においてプロテインキナーゼAの触媒サブユニットをコードするPRKACA遺伝子の変異を同定した.変異はすべてLeu206をコードする部位に生じており,この変異により触媒サブユニットと制御サブユニットとの結合が阻害され,cAMPに非依存的にプロテインキナーゼAが活性化していることが明らかになった.また,およそ2割の症例ではアデニル酸シクラーゼを活性化することによりcAMPの産生にかかわるタンパク質をコードするGNAS遺伝子に変異が生じており,合計で約7割の症例においてプロテインキナーゼAの活性化にかかわる遺伝子に体細胞性の変異の生じていることが明らかにされた.
はじめに
Cushing症候群は副腎から過剰かつ持続的にコルチゾールが分泌されることにより多彩な症状を呈する疾患で,20代~40代の女性に好発する.ステロイドホルモンの一種であるコルチゾールは生命活動の維持に必須であり,その分泌量は早朝の起床時に多く就寝時に低いという日内変動を示す.Cushing症候群ではつねに多量のコルチゾールが分泌されており,それにより,高血圧,糖尿病,中心性肥満,骨粗鬆症,うつなど,さまざまな症状が出現する1).副腎皮質におけるコルチゾールの産生は脳下垂体から分泌される副腎皮質刺激ホルモンにより制御されている.副腎皮質刺激ホルモンが副腎皮質細胞の受容体に結合すると,アデニル酸シクラーゼが活性化されることにより細胞におけるcAMPの濃度が上昇する.さらに,cAMPがセカンドメッセンジャーとなってプロテインキナーゼAを活性化することにより,コルチゾールの生合成が促進される(図1a).
Cushing症候群はその病因により副腎皮質刺激ホルモン依存性と非依存性の2つの病型に分類される.副腎皮質刺激ホルモン依存性Cushing症候群では下垂体腫瘍などが原因となり副腎皮質刺激ホルモンが多量に分泌され,それに反応して副腎がコルチゾールを産生する.一方,副腎皮質刺激ホルモン非依存性Cushing症候群では副腎腫瘍が原因となり,副腎皮質刺激ホルモンによる刺激がなくても自律的にコルチゾールが産生される.副腎皮質刺激ホルモン非依存性Cushing症候群の原因となる副腎腫瘍のほとんどは片側性に生じる腺腫であるが,どのような分子機構によりコルチゾールが持続的に産生されているのかはこれまでほとんど不明であった.今回,筆者らは,全エキソン塩基配列解析によりその原因となる遺伝子の変異を同定した.
1.Cushing症候群において生じている遺伝子変異
8例の副腎皮質刺激ホルモン非依存性Cushing症候群を対象に,副腎腺腫から採取したDNAおよび正常な細胞(正常な副腎皮質の組織あるいは血液)のDNAを用いて全エキソン塩基配列解析を行った.副腎腺腫において生じている体細胞性の変異を網羅的に検索した結果,1例あたり平均5.6個の遺伝子変異を同定した.このうち,複数の症例に共通して変異のみられた遺伝子はプロテインキナーゼAの触媒サブユニットをコードするPRKACA遺伝子のみであり,8例中4例にこの遺伝子の変異が検出された.また,1例にGNAS遺伝子の変異を認めた.GNAS遺伝子のコードするタンパク質はアデニル酸シクラーゼを活性化することによりcAMPの産生にかかわっており,いくつかの内分泌疾患において機能獲得型の変異を生じることが知られている2-5).これらを合計すると,8例中5例にcAMP-プロテインキナーゼAシグナル伝達経路に関する遺伝子変異の生じていることが明らかになった.さらに57例を追加してこれらの遺伝子の変異解析を行ったところ,合計で65例中34例にPRKACA遺伝子の変異を,11例にGNAS遺伝子の変異を認めた(図2).これらの変異は完全に排他的に生じており,65例中45例の症例にcAMP-プロテインキナーゼAシグナル伝達経路の異常が生じていることが示唆された.興味深いことに,PRKACA遺伝子の変異は特定の部位にのみ生じており,いずれもLeu206がArgに置換する変異であった.また,GNAS遺伝子の変異はいずれもArg201がCysあるいはHisに置換する変異であった.このGNAS遺伝子の変異はほかの疾患において知られているものと同一の変異であり,このアミノ酸残基の置換により細胞におけるcAMPの濃度が持続的に上昇することが明らかにされている2).
2.変異と臨床像との関連
PRKACA遺伝子およびGNAS遺伝子の変異の有無と臨床像との関連について検討した.PRKACA遺伝子の変異例では,変異のない例と比較して,1 mgのデキサメサゾンによる抑制試験における血清中のコルチゾールの濃度が有意に高く,副腎腺腫の直径が有意に小さかった.このことから,PRKACA遺伝子の変異例では細胞あたりのコルチゾールの産生能の上昇していることが示唆された.症例が少ないため統計学的な有意差は検出できなかったものの,GNAS遺伝子の変異例においてもこれと同様の傾向がみられた.
3.Leu206がArgに変異したプロテインキナーゼA触媒サブユニットはcAMPに非依存的に活性をもつ
PRKACA遺伝子にLeu206がArgに置換する変異の生じることが機能的にどのような意義もつのかを検討した.PRKACA遺伝子はプロテインキナーゼAの触媒サブユニットをコードしている.プロテインキナーゼAは2つの触媒サブユニットと2つの制御サブユニットから構成されており,制御サブユニットが触媒サブユニットと結合することにより触媒サブユニットのもつ酵素活性部位がおおわれ,通常は不活性になっている.外部からの刺激により細胞におけるcAMPの濃度が上昇し制御サブユニットにcAMPが結合すると,制御サブユニットの立体構造が変化し触媒サブユニットとの結合が解離する6,7).制御サブユニットから遊離することにより活性化した触媒サブユニットは核へと移行してその標的タンパク質をリン酸化する.触媒サブユニットのLeu206は制御サブユニットのIle99と疎水性相互作用を形成しており,触媒サブユニットと制御サブユニットとの結合に重要な役割をはたしていると考えられる.触媒サブユニットのLeu206がArgに置換することにより疎水性の側鎖が伸長するため,触媒サブユニットと制御サブユニットとのあいだに立体障害が生じ結合が阻害されることが予想される.つまり,PRKACA遺伝子にLeu206がArgに置換する変異が生じると,触媒サブユニットと制御サブユニットとが結合しなくなることより触媒サブユニットがつねに遊離した状態となるため,cAMPに非依存的にプロテインキナーゼAが活性化するのではないかと考えられた(図1b).
このことを検証するため,精製したタンパク質を用いて免疫沈降実験ならびにプロテインキナーゼA活性の測定を行った.野生型のプロテインキナーゼA触媒サブユニットに制御サブユニットをくわえると,それらの結合がみられると同時にプロテインキナーゼA活性が抑制されたが,これにさらにcAMPを追加することによりそれらは解離し,プロテインキナーゼA活性も回復した.一方,変異型の触媒サブユニットの場合は,制御サブユニットをくわえてもこれと結合せず,cAMPの有無にかかわらずプロテインキナーゼA活性は高い状態を維持していた.HEK293T細胞に野生型あるいは変異型の触媒サブユニットを発現させ同様の検討を行ったところ,in vivoにおいても変異型の触媒サブユニットは制御サブユニットと結合せず,cAMPに非依存的にプロテインキナーゼA活性が上昇していることが確認された.また,変異型の触媒サブユニットを発現させた細胞では,プロテインキナーゼAの主要な標的タンパク質であるCREBがcAMPの非存在下においてもリン酸化されていた.
変異型の触媒サブユニットを発現させたHEK293T細胞に3種類のプロテインキナーゼA阻害剤,H89,KT5720,Rp-cAMPSをくわえたのち,プロテインキナーゼA活性を測定し阻害剤の効果の違いについて検討した.H89およびKT5720は遊離した触媒サブユニットに対し直接的にキナーゼ活性をさまたげる薬剤であり,これらは変異型の触媒サブユニットを発現させた細胞に対しても阻害効果を示した.一方,Rp-cAMPSは制御サブユニットに対するcAMPの結合を競合的に阻害することにより触媒サブユニットの遊離を防ぐ効果をもつ薬剤であるが,変異型の触媒サブユニットを発現させた細胞に対しては十分な効果を示さなかった.このことからも,変異型の触媒サブユニットのプロテインキナーゼA活性はcAMPに依存していないことが確認された.
4.変異型プロテインキナーゼA触媒サブユニットの不安定性と核への移行
変異型のプロテインキナーゼA触媒サブユニットは制御サブユニットと結合せずつねに遊離していることから,野生型の触媒サブユニットと比べ不安定で分解されやすいと考えられた.実際に,PRKACA遺伝子に変異をもつ副腎腺腫の組織における触媒サブユニットのタンパク質レベルでの発現量は,変異をもたない副腎腺腫の組織および正常な副腎皮質の組織における発現量と比較して有意に低かった.野生型または変異型の触媒サブユニットを発現させたHEK293T細胞での比較においても,変異型の触媒サブユニットを発現させた細胞では,野生型の触媒サブユニットを発現させた細胞よりも,細胞における触媒サブユニットのタンパク質レベルでの発現量は有意に低かった.しかしながら,細胞質および核における発現量を検討したところ,変異型の触媒サブユニットを発現させた細胞では,触媒サブユニットはほとんどが細胞質から核へと移行していることが明らかになった.
おわりに
Cushing症候群は1912年に特定された疾患であり,現在では,もっとも代表的な内分泌疾患のひとつである.その病態生理がきわめて特徴的であることから,内分泌学を学ぶ際にはCushing症候群をさけてとおることはできず,そのため,専門外の医師はもちろん,医学部生のあいだにも広く知られている.そのような疾患の分子病態が解明されたことは非常にインパクトの大きい成果であったと考えられる.この論文とほぼ同じ時期に,ほかのグループからも,副腎皮質刺激ホルモン非依存性Cushing症候群におけるPRKACA遺伝子の変異についての論文が合計3報も出版されており8-10),Cushing症候群の分子病態に対する関心の強さがうかがわれた.
この研究において,副腎皮質刺激ホルモン非依存性Cushing症候群におけるPRKACA遺伝子およびGNAS遺伝子の変異が明らかになったことにより,およそ7割の症例の分子病態が説明されたことは大きな成果といえる.しかし,残りの3割の症例についてはいまだ不明であり,今後の研究による解明が望まれる.また,下垂体腫瘍を原因とする副腎皮質刺激ホルモン依存性Cushing症候群やそのほかの内分泌疾患においてGNAS遺伝子に変異の生じていることはよく知られているが,同様に,PRKACA遺伝子にも変異が生じているかどうか,非常に興味深いところである.
文 献
- Newell-Price, J., Bertagna, X., Grossman, A. B. et al.: Cushing's syndrome. Lancet, 367, 1605-1617 (2006)[PubMed]
- Landis, C. A., Masters, S. B., Spada, A. et al.: GTPase inhibiting mutations activate the α chain of Gs and stimulate adenylyl cyclase in human pituitary tumours. Nature, 340, 692-696 (1989)[PubMed]
- Spada, A., Vallar, L. & Faglia, G.: G protein oncogenes in pituitary tumors. Trends Endocrinol. Metab., 3, 355-360 (1992)[PubMed]
- Furukawa, T., Kuboki, Y., Tanji, E. et al.: Whole-exome sequencing uncovers frequent GNAS mutations in intraductal papillary mucinous neoplasms of the pancreas. Sci. Rep., 1, 161 (2011)[PubMed]
- Osullivan, C., Barton, C. M., Staddon, S. L. et al.: Activating point mutations of the gsp oncogene in human thyroid adenomas. Mol Carcinog., 4, 345-349 (1991)[PubMed]
- Kim, C., Xuong, N. H. & Taylor, S. S.: Crystal structure of a complex between the catalytic and regulatory (RIα) subunits of PKA. Science, 307, 690-696 (2005)[PubMed]
- Kim, C., Cheng, C. Y., Saldanha, S. A. et al.: PKA-I holoenzyme structure reveals a mechanism for cAMP-dependent activation. Cell, 130, 1032-1043 (2007)[PubMed]
- Beuschlein, F., Fassnacht, M., Assie, G. et al.: Constitutive activation of PKA catalytic subunit in adrenal Cushing's syndrome. N. Engl. J. Med., 370, 1019-1028 (2014)[PubMed]
- Goh, G., Scholl, U. I., Healy, J. M. et al.: Recurrent activating mutation in PRKACA in cortisol-producing adrenal tumors. Nat. Genet., 46, 613-617 (2014)[PubMed]
- Cao, Y., He, M., Gao, Z. et al.: Activating hotspot L205R mutation in PRKACA and adrenal Cushing's syndrome. Science, 344, 913-917 (2014)[PubMed]
著者プロフィール
略歴:2014年 東京大学大学院医学系研究科博士課程 修了,同年より京都大学大学院医学研究科 特定助教.
研究テーマ:泌尿器の腫瘍におけるゲノム解析.
本間 之夫(Yukio Homma)
東京大学大学院医学系研究科 教授.
小川 誠司(Ogawa Seishi)
京都大学大学院医学研究科 教授.
© 2014 佐藤悠佑・本間之夫・小川誠司 Licensed under CC 表示 2.1 日本