脂肪細胞から分泌されるリン脂質分解酵素PLA2G5とPLA2G2Eは肥満において異なる役割を担う
村上 誠・佐藤弘泰・武富芳隆
(東京都医学総合研究所 脂質代謝プロジェクト)
email:村上 誠
DOI: 10.7875/first.author.2014.085
The adipocyte-inducible secreted phospholipases PLA2G5 and PLA2G2E play distinct roles in obesity.
Hiroyasu Sato, Yoshitaka Taketomi, Ayako Ushida, Yuki Isogai, Takumi Kojima, Tetsuya Hirabayashi, Yoshimi Miki, Kei Yamamoto, Yasumasa Nishito, Tetsuyuki Kobayashi, Kazutaka Ikeda, Ryo Taguchi, Shuntaro Hara, Satoshi Ida, Yuji Miyamoto, Masayuki Watanabe, Hideo Baba, Keishi Miyata, Yuichi Oike, Michael H. Gelb, Makoto Murakami
Cell Metabolism, 20, 119-132 (2014)
肥満やインスリン抵抗性などのメタボリック症候群の根幹には脂質代謝の異常および慢性炎症がある.肥満にともない発現の変動した遺伝子をマイクロアレイ解析により網羅的に探索した結果,肥満の脂肪細胞には2つの分泌性ホスホリパーゼA2,すなわち,PLA2G5およびPLA2G2Eの発現が誘導されることを見い出した.それぞれのノックアウトマウスを解析した結果,PLA2G5とPLA2G2Eは肥満において異なる役割をもつことが明らかにされた.PLA2G5は低密度リポタンパク質に含まれる主要なリン脂質から不飽和脂肪酸を遊離し,飽和脂肪酸によるM1マクロファージの発現の誘導に拮抗してM2マクロファージが優位な局所的な環境を導くことにより,脂肪組織の慢性炎症を抑制した.一方,PLA2G2Eはリポタンパク質に含まれる微量なリン脂質の量を制御することにより,脂肪組織や肝臓への脂質の輸送および貯蔵を促進する役割を担っていた.この研究は,代謝制御酵素としての分泌性ホスホリパーゼA2の生理的な機能をはじめて解明したものである.
メタボリック症候群の病態基盤であるインスリン抵抗性は肥満にともなうことが多く,組織に脂質が過剰に蓄積することが脂肪の毒性による小胞体ストレスや慢性炎症をひき起こしインスリン抵抗性の要因となる1).細胞の内外における脂質代謝の異常は肥満,高脂血症,インスリン抵抗性などの病態に密接に関与しているが,その全体像は十分には理解されていない.
リン脂質分解酵素の一群であるホスホリパーゼA2のうち,分泌性ホスホリパーゼA2は最大のタンパク質ファミリーを形成し,炎症や動脈硬化にかかわるものと漠然と考えられてきた2).近年,遺伝子改変マウスの解析をつうじ,分泌性ホスホリパーゼA2のアイソザイムは異なる組織において異なる基質に作用することにより多彩な生命現象にかかわることが明らかになってきたが3,4),メタボリック症候群における分泌性ホスホリパーゼA2の関与については不明であった.分泌性ホスホリパーゼA2を過剰に発現するマウスではリポタンパク質の表面にあるリン脂質が分解されるが5),生理的な条件においてこの反応が起こるかどうかは不明であった.また,分泌性ホスホリパーゼA2は炎症に対し防御的にはたらく場合もあるが,不飽和脂肪酸の一種である抗炎症性のドコサヘキサエン酸を動員する一部のアイソザイムを除き6),分泌性ホスホリパーゼA2による炎症の抑制の分子機構はほとんどが未解明であった.
筆者らは,肥満にともない発現の変動する脂質代謝酵素を網羅的に探索する過程において,2つの分泌性ホスホリパーゼA2,すなわち,PLA2G5およびPLA2G2Eの発現が肥満マウスの脂肪組織においていちじるしく誘導されることを見い出した.これまで,PLA2G5は病態モデルに応じて炎症を促進あるいは抑制することが報告されていたが7,8),その分子基盤は不明であった.興味深いことに,II型糖尿病の患者の血中における低密度リポタンパク質の濃度とPLA2G5をコードする遺伝子の多型とのあいだに相関がみられることから9),PLA2G5とメタボリック症候群にはなんらかの関係のあることが予想された.一方,PLA2G2Eについては,その発見以降,発現の制御や生理的な役割に関する報告は皆無であった.筆者らは,この研究において,PLA2G5およびPLA2G2Eが肥満,高脂血症,インスリン抵抗性の制御にかかわる“メタボリック分泌性ホスホリパーゼA2”として機能することを見い出した.
肥満にともない発現の変動する脂質代謝酵素を一括して同定する目的で,高脂肪食あるいは通常食をあたえたマウスのあいだで内臓脂肪組織のマイクロアレイ解析を行った.その結果,リン脂質分解酵素に関連する遺伝子のうち,PLA2G5およびPLA2G2Eをコードする遺伝子が高脂肪食をあたえたマウスの脂肪組織においてもっとも顕著に発現の誘導された遺伝子として同定された.内臓脂肪組織の細胞分画,定量的PCR法,免疫組織染色の結果,PLA2G5およびPLA2G2Eは肥大化した脂肪細胞に発現していることがわかった.PLA2G5およびPLA2G2Eは遺伝的な肥満モデルマウスであるob/obマウスの内臓脂肪組織においても強く発現していた.さらに,PLA2G5はヒトの内臓脂肪組織にも発現していることが確かめられた.
高脂肪食を負荷したPLA2G5ノックアウトマウスは野生型のマウスと比べ肥満が亢進し,内臓脂肪が増加していた.さらに,PLA2G5ノックアウトマウスでは血中のインスリン濃度およびレプチン濃度が高く,インスリン抵抗性の増悪がみられた.PLA2G5ノックアウトマウスの脂肪細胞は野生型マウスよりも肥大化していたが,脂肪組織における脂肪細胞の分化,脂肪の生合成,脂肪の分解にかかわる遺伝子の発現はPLA2G5の欠損の影響をうけておらず,肥満増悪の表現型は脂肪細胞の本質的な異常によるものではなく,なんらかの外的な要因によるものと考えられた.また,PLA2G5ノックアウトマウスの肝臓は脂肪滴の貯留が顕著であり,脂肪の生合成および炎症にかかわる遺伝子の発現が有意に上昇していた.肝臓におけるPLA2G5の発現は非常に低いことから,脂肪性肝炎の増悪は内臓脂肪組織の異常による2次的な所見と考えられた.
脂肪細胞の肥大化の要因のひとつに,組織への脂質の輸送に影響を及ぼすリポタンパク質が考えられたため,その解析を行った.高脂肪食を負荷したPLA2G5ノックアウトマウスは野生型マウスよりも顕著な高脂血症を呈し,とくに低密度リポタンパク質に含まれるリン脂質,中性脂質,コレステロールの増加が顕著であった.このことは,低密度リポタンパク質が大型化していることを意味していた.質量分析により低密度リポタンパク質に含まれるリン脂質を分析した結果,PLA2G5ノックアウトマウスの低密度リポタンパク質は野生型マウスの低密度リポタンパク質よりも,オレイン酸あるいはリノール酸を含有するホスファチジルコリンの量の多いことが判明した.さらに,内臓脂肪組織の脂質について質量分析を行うと,PLA2G5ノックアウトマウスでは遊離のオレイン酸およびリノール酸の量が有意に減少していたが,アラキドン酸など超高度不飽和脂肪酸およびその代謝産物であるプロスタグランジンの量には有意な差がみられなかった.このことから,肥満により脂肪細胞に発現が誘導されたPLA2G5は,低密度リポタンパク質の主要なリン脂質であるホスファチジルコリンを分解し,オレイン酸やリノール酸などの不飽和脂肪酸を遊離していることが明らかになった.PLA2G5ノックアウトマウスではこの反応が欠落する結果,低密度リポタンパク質に含まれる脂質の量が増加し,これが脂肪組織や肝臓への脂肪の蓄積の亢進に一部が寄与しているものと考えられた.ヒトにおいても,内臓脂肪組織におけるPLA2G5の発現量と血中の低密度リポタンパク質の濃度とのあいだに有意な逆相関が認められ,マウスの解析の結果と一致した.
インスリン抵抗性は脂肪組織における慢性炎症に起因する1).脂肪組織に対する定量的PCR法およびフローサイトメトリー解析の結果,高脂肪食を負荷したPLA2G5ノックアウトマウスでは炎症促進性のM1マクロファージが増加し,抗炎症性のM2マクロファージが減少していた.さらに,PLA2G5ノックアウトマウスの脂肪組織においてはマクロファージによる死細胞のクリアランスが損なわれており,これが炎症の亢進の一因であることが示唆された.これらのことから,PLA2G5は脂肪組織の慢性炎症に対し抑制的に作用することが明らかになった.骨髄移植実験の結果,PLA2G5ノックアウトマウスで観察された肥満の増悪の表現型は,非骨髄系細胞(脂肪細胞)に発現するPLA2G5の欠損に大部分が起因することが確かめられた.
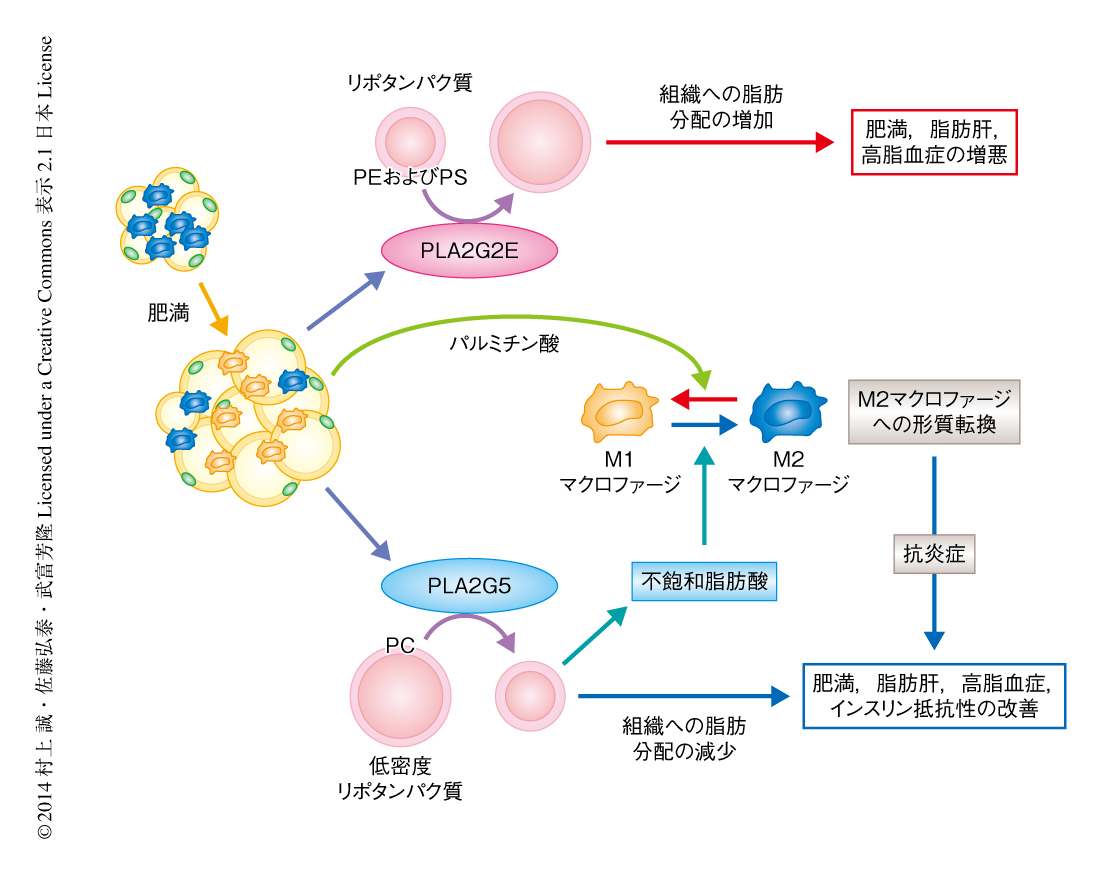
分泌性ホスホリパーゼA2は分泌酵素であることから,脂肪細胞から分泌されたPLA2G5が周縁の免疫細胞に影響を及ぼす可能性が考えられた.実際に,骨髄に由来するマクロファージに組換えPLA2G5を添加すると,パルミチン酸によるM1マクロファージのマーカーの発現の誘導が抑制され,相補的にM2マクロファージのマーカーの発現が上昇した.したがって,PLA2G5はパラクリン的になんらかの脂質代謝を動員してマクロファージの形質を抗炎症性のM2マクロファージのタイプに転換しているものと考えられた.さきに述べたように,PLA2G5は低密度リポタンパク質のリン脂質からオレイン酸やリノール酸などの不飽和脂肪酸を遊離し,また,不飽和脂肪酸にはパルミチン酸による炎症性ストレス応答を軽減するはたらきがある10).そこで,マクロファージ培養系にオレイン酸あるいはリノール酸を添加したところ,パルミチン酸によるM1マクロファージのマーカーの発現の誘導は強く抑制され,逆に,M2マクロファージのマーカーの発現が誘導された.これらの結果から,肥満脂肪組織から分泌されたPLA2G5は,脂肪の過剰な低密度リポタンパク質のリン脂質からオレイン酸およびリノール酸を動員して炎症促進性のパルミチン酸に拮抗することにより,脂肪組織においてM2マクロファージの優位な局所的な環境を導き,炎症を抑制するものと結論した(図1).
PLA2G5はTh2免疫応答に依存する喘息の増悪にかかわることが報告されている8).Th2免疫応答はM2マクロファージと関連が深く,アレルギー応答の促進にかかわる一方で,肥満にともなうメタボリック症候群に対し抑制的に作用する11).PLA2G5の発現はTh2応答にかかわるサイトカインであるインターロイキン4およびインターロイキン13により,マクロファージやT細胞において誘導されることが判明した.野生型マウスに卵白アルブミンを反復投与すると卵白アルブミンに特異的な免疫グロブリンEの血中の力価が上昇するが,PLA2G5ノックアウトマウスではこの応答が半減し,これと合致してリンパ節におけるインターロイキン4およびインターロイキン13の発現が低下した.さらに,PLA2G5ノックアウトマウスの脂肪組織ではTh2応答にかかわるサイトカインのひとつであるインターロイキン33の発現が低下していた.これらの結果から,PLA2G5はTh2応答にかかわるサイトカインにより誘導され,Th2免疫応答を促進することが明らかになった.したがって,PLA2G5ノックアウトマウスは本質的にTh2免疫応答が起こりにくく,このことが肥満の増悪の背景にあるものと考えられた.
脂肪組織において特異的にPLA2G5を過剰に発現させたトランスジェニックマウスについて解析した.その結果,PLA2G5過剰発現マウスは野生型のマウスと比較して脂肪の蓄積が軽微で体重が軽く,低密度リポタンパク質に含まれるリン脂質の減少と脂肪組織における炎症マーカーの発現の低下がみられ,さらに,インスリン抵抗性の改善が認められた.このことから,PLA2G5ノックアウトマウスとPLA2G5過剰発現マウスは肥満の病態において逆の表現型を示すことが確かめられた.
PLA2G2Eノックアウトマウスについて肥満の表現型を解析した.高脂肪食を負荷したPLA2G2Eノックアウトマウスは野生型のマウスと比べ体重が減少する傾向を示し,体脂肪率の低下ならびに脂肪肝の軽減が認められた.しかしながら,内臓脂肪組織における脂肪細胞の分化,脂肪の生合成,炎症関連遺伝子の発現はほとんど正常であった.PLA2G2Eノックアウトマウスでは高脂血症が顕著に改善しており,とくに,低密度リポタンパク質および超低密度リポタンパク質に含まれるリン脂質,中性脂質,コレステロールが減少していた.低密度リポタンパク質のリン脂質を質量分析した結果,PLA2G2Eノックアウトマウスは野生型マウスと比べ,主要なリン脂質であるホスファチジルコリンに変化はなかったが,微量なリン脂質であるホスファチジルエタノールアミンおよびホスファチジルセリンが増加していた.このことから,PLA2G2Eはリポタンパク質に含まれるホスファチジルエタノールアミンおよびホスファチジルセリンを選択的に分解していることがわかった.一般に,ホスファチジルセリンなどの酸性リン脂質が増加したリポタンパク質は小型化し脂質の輸送能が低下することが知られている.したがって,PLA2G2Eはリポタンパク質に含まれる微量なリン脂質の量を制御することにより,組織への脂肪の蓄積に影響をあたえているものと結論した.
これまで一般に,分泌性ホスホリパーゼA2は炎症細胞から分泌され,細胞膜のリン脂質から脂質メディエーターを動員して炎症の増悪にかかわるものと考えられてきた.この研究は,2つの分泌性ホスホリパーゼA2の新しい機能,すなわち,全身の代謝を制御する“メタボリック分泌性ホスホリパーゼA2”の概念を提唱した(図1).メタボリック分泌性ホスホリパーゼA2の作用は,従来の定説であった脂質メディエーターに依存した経路を介してではなく,リポタンパク質からオレイン酸などの不飽和脂肪酸を動員して脂質メディエーターに非依存的に代謝に影響をあたえる点に特徴がある.さらに,この研究は,分泌性ホスホリパーゼA2のアイソザイムのもつ基質特異性の違いが生命応答に異なるインパクトをあたえることを同一の病態条件において示した,はじめての研究成果ともいえる.総じてこの研究は,分泌性ホスホリパーゼA2によるリポタンパク質の代謝の生理的な意義をはじめて解明したと同時に,肥満の新しい制御機構を提示した.内臓脂肪組織における分泌性ホスホリパーゼA2の量や不飽和脂肪酸の量は,新規の肥満の診断マーカーとなる可能性がある.また,分泌性ホスホリパーゼA2を標的とした創薬はメタボリック症候群の新しい予防法あるいは治療法の開発につながることが期待される.
略歴:1991年 東京大学大学院薬学系研究科博士課程 修了,1993年 米国Harvard大学 研究員,1995年 昭和大学薬学部 講師,1997年 同 准教授,2005年 東京都臨床医学総合研究所 副参事研究員(2010年 東京都医学総合研究所に改組)を経て,2013年より同 参事研究員.
研究テーマ:ホスホリパーゼA2の分子細胞生物学.
抱負:脂質研究のおもしろさと重要性を広く世の中に訴えたい.
研究室URL:http://www.igakuken.or.jp/research/project/res_prj23.html
佐藤 弘泰(Hiroyasu Sato)
東京都医学総合研究所 研究員.
武富 芳隆(Yoshitaka Taketomi)
東京都医学総合研究所 主席研究員.
© 2014 村上 誠・佐藤弘泰・武富芳隆 Licensed under CC 表示 2.1 日本
(東京都医学総合研究所 脂質代謝プロジェクト)
email:村上 誠
DOI: 10.7875/first.author.2014.085
The adipocyte-inducible secreted phospholipases PLA2G5 and PLA2G2E play distinct roles in obesity.
Hiroyasu Sato, Yoshitaka Taketomi, Ayako Ushida, Yuki Isogai, Takumi Kojima, Tetsuya Hirabayashi, Yoshimi Miki, Kei Yamamoto, Yasumasa Nishito, Tetsuyuki Kobayashi, Kazutaka Ikeda, Ryo Taguchi, Shuntaro Hara, Satoshi Ida, Yuji Miyamoto, Masayuki Watanabe, Hideo Baba, Keishi Miyata, Yuichi Oike, Michael H. Gelb, Makoto Murakami
Cell Metabolism, 20, 119-132 (2014)
要 約
肥満やインスリン抵抗性などのメタボリック症候群の根幹には脂質代謝の異常および慢性炎症がある.肥満にともない発現の変動した遺伝子をマイクロアレイ解析により網羅的に探索した結果,肥満の脂肪細胞には2つの分泌性ホスホリパーゼA2,すなわち,PLA2G5およびPLA2G2Eの発現が誘導されることを見い出した.それぞれのノックアウトマウスを解析した結果,PLA2G5とPLA2G2Eは肥満において異なる役割をもつことが明らかにされた.PLA2G5は低密度リポタンパク質に含まれる主要なリン脂質から不飽和脂肪酸を遊離し,飽和脂肪酸によるM1マクロファージの発現の誘導に拮抗してM2マクロファージが優位な局所的な環境を導くことにより,脂肪組織の慢性炎症を抑制した.一方,PLA2G2Eはリポタンパク質に含まれる微量なリン脂質の量を制御することにより,脂肪組織や肝臓への脂質の輸送および貯蔵を促進する役割を担っていた.この研究は,代謝制御酵素としての分泌性ホスホリパーゼA2の生理的な機能をはじめて解明したものである.
はじめに
メタボリック症候群の病態基盤であるインスリン抵抗性は肥満にともなうことが多く,組織に脂質が過剰に蓄積することが脂肪の毒性による小胞体ストレスや慢性炎症をひき起こしインスリン抵抗性の要因となる1).細胞の内外における脂質代謝の異常は肥満,高脂血症,インスリン抵抗性などの病態に密接に関与しているが,その全体像は十分には理解されていない.
リン脂質分解酵素の一群であるホスホリパーゼA2のうち,分泌性ホスホリパーゼA2は最大のタンパク質ファミリーを形成し,炎症や動脈硬化にかかわるものと漠然と考えられてきた2).近年,遺伝子改変マウスの解析をつうじ,分泌性ホスホリパーゼA2のアイソザイムは異なる組織において異なる基質に作用することにより多彩な生命現象にかかわることが明らかになってきたが3,4),メタボリック症候群における分泌性ホスホリパーゼA2の関与については不明であった.分泌性ホスホリパーゼA2を過剰に発現するマウスではリポタンパク質の表面にあるリン脂質が分解されるが5),生理的な条件においてこの反応が起こるかどうかは不明であった.また,分泌性ホスホリパーゼA2は炎症に対し防御的にはたらく場合もあるが,不飽和脂肪酸の一種である抗炎症性のドコサヘキサエン酸を動員する一部のアイソザイムを除き6),分泌性ホスホリパーゼA2による炎症の抑制の分子機構はほとんどが未解明であった.
筆者らは,肥満にともない発現の変動する脂質代謝酵素を網羅的に探索する過程において,2つの分泌性ホスホリパーゼA2,すなわち,PLA2G5およびPLA2G2Eの発現が肥満マウスの脂肪組織においていちじるしく誘導されることを見い出した.これまで,PLA2G5は病態モデルに応じて炎症を促進あるいは抑制することが報告されていたが7,8),その分子基盤は不明であった.興味深いことに,II型糖尿病の患者の血中における低密度リポタンパク質の濃度とPLA2G5をコードする遺伝子の多型とのあいだに相関がみられることから9),PLA2G5とメタボリック症候群にはなんらかの関係のあることが予想された.一方,PLA2G2Eについては,その発見以降,発現の制御や生理的な役割に関する報告は皆無であった.筆者らは,この研究において,PLA2G5およびPLA2G2Eが肥満,高脂血症,インスリン抵抗性の制御にかかわる“メタボリック分泌性ホスホリパーゼA2”として機能することを見い出した.
1.PLA2G5およびPLA2G2Eは肥満の脂肪細胞に発現が誘導される
肥満にともない発現の変動する脂質代謝酵素を一括して同定する目的で,高脂肪食あるいは通常食をあたえたマウスのあいだで内臓脂肪組織のマイクロアレイ解析を行った.その結果,リン脂質分解酵素に関連する遺伝子のうち,PLA2G5およびPLA2G2Eをコードする遺伝子が高脂肪食をあたえたマウスの脂肪組織においてもっとも顕著に発現の誘導された遺伝子として同定された.内臓脂肪組織の細胞分画,定量的PCR法,免疫組織染色の結果,PLA2G5およびPLA2G2Eは肥大化した脂肪細胞に発現していることがわかった.PLA2G5およびPLA2G2Eは遺伝的な肥満モデルマウスであるob/obマウスの内臓脂肪組織においても強く発現していた.さらに,PLA2G5はヒトの内臓脂肪組織にも発現していることが確かめられた.
2.PLA2G5の欠損は肥満を増悪する
高脂肪食を負荷したPLA2G5ノックアウトマウスは野生型のマウスと比べ肥満が亢進し,内臓脂肪が増加していた.さらに,PLA2G5ノックアウトマウスでは血中のインスリン濃度およびレプチン濃度が高く,インスリン抵抗性の増悪がみられた.PLA2G5ノックアウトマウスの脂肪細胞は野生型マウスよりも肥大化していたが,脂肪組織における脂肪細胞の分化,脂肪の生合成,脂肪の分解にかかわる遺伝子の発現はPLA2G5の欠損の影響をうけておらず,肥満増悪の表現型は脂肪細胞の本質的な異常によるものではなく,なんらかの外的な要因によるものと考えられた.また,PLA2G5ノックアウトマウスの肝臓は脂肪滴の貯留が顕著であり,脂肪の生合成および炎症にかかわる遺伝子の発現が有意に上昇していた.肝臓におけるPLA2G5の発現は非常に低いことから,脂肪性肝炎の増悪は内臓脂肪組織の異常による2次的な所見と考えられた.
脂肪細胞の肥大化の要因のひとつに,組織への脂質の輸送に影響を及ぼすリポタンパク質が考えられたため,その解析を行った.高脂肪食を負荷したPLA2G5ノックアウトマウスは野生型マウスよりも顕著な高脂血症を呈し,とくに低密度リポタンパク質に含まれるリン脂質,中性脂質,コレステロールの増加が顕著であった.このことは,低密度リポタンパク質が大型化していることを意味していた.質量分析により低密度リポタンパク質に含まれるリン脂質を分析した結果,PLA2G5ノックアウトマウスの低密度リポタンパク質は野生型マウスの低密度リポタンパク質よりも,オレイン酸あるいはリノール酸を含有するホスファチジルコリンの量の多いことが判明した.さらに,内臓脂肪組織の脂質について質量分析を行うと,PLA2G5ノックアウトマウスでは遊離のオレイン酸およびリノール酸の量が有意に減少していたが,アラキドン酸など超高度不飽和脂肪酸およびその代謝産物であるプロスタグランジンの量には有意な差がみられなかった.このことから,肥満により脂肪細胞に発現が誘導されたPLA2G5は,低密度リポタンパク質の主要なリン脂質であるホスファチジルコリンを分解し,オレイン酸やリノール酸などの不飽和脂肪酸を遊離していることが明らかになった.PLA2G5ノックアウトマウスではこの反応が欠落する結果,低密度リポタンパク質に含まれる脂質の量が増加し,これが脂肪組織や肝臓への脂肪の蓄積の亢進に一部が寄与しているものと考えられた.ヒトにおいても,内臓脂肪組織におけるPLA2G5の発現量と血中の低密度リポタンパク質の濃度とのあいだに有意な逆相関が認められ,マウスの解析の結果と一致した.
3.PLA2G5の欠損は脂肪組織における慢性炎症を増悪する
インスリン抵抗性は脂肪組織における慢性炎症に起因する1).脂肪組織に対する定量的PCR法およびフローサイトメトリー解析の結果,高脂肪食を負荷したPLA2G5ノックアウトマウスでは炎症促進性のM1マクロファージが増加し,抗炎症性のM2マクロファージが減少していた.さらに,PLA2G5ノックアウトマウスの脂肪組織においてはマクロファージによる死細胞のクリアランスが損なわれており,これが炎症の亢進の一因であることが示唆された.これらのことから,PLA2G5は脂肪組織の慢性炎症に対し抑制的に作用することが明らかになった.骨髄移植実験の結果,PLA2G5ノックアウトマウスで観察された肥満の増悪の表現型は,非骨髄系細胞(脂肪細胞)に発現するPLA2G5の欠損に大部分が起因することが確かめられた.
4.PLA2G5はリポタンパク質の代謝と抗炎症とを結びつける酵素である
分泌性ホスホリパーゼA2は分泌酵素であることから,脂肪細胞から分泌されたPLA2G5が周縁の免疫細胞に影響を及ぼす可能性が考えられた.実際に,骨髄に由来するマクロファージに組換えPLA2G5を添加すると,パルミチン酸によるM1マクロファージのマーカーの発現の誘導が抑制され,相補的にM2マクロファージのマーカーの発現が上昇した.したがって,PLA2G5はパラクリン的になんらかの脂質代謝を動員してマクロファージの形質を抗炎症性のM2マクロファージのタイプに転換しているものと考えられた.さきに述べたように,PLA2G5は低密度リポタンパク質のリン脂質からオレイン酸やリノール酸などの不飽和脂肪酸を遊離し,また,不飽和脂肪酸にはパルミチン酸による炎症性ストレス応答を軽減するはたらきがある10).そこで,マクロファージ培養系にオレイン酸あるいはリノール酸を添加したところ,パルミチン酸によるM1マクロファージのマーカーの発現の誘導は強く抑制され,逆に,M2マクロファージのマーカーの発現が誘導された.これらの結果から,肥満脂肪組織から分泌されたPLA2G5は,脂肪の過剰な低密度リポタンパク質のリン脂質からオレイン酸およびリノール酸を動員して炎症促進性のパルミチン酸に拮抗することにより,脂肪組織においてM2マクロファージの優位な局所的な環境を導き,炎症を抑制するものと結論した(図1).
5.PLA2G5はTh2免疫応答を促進する
PLA2G5はTh2免疫応答に依存する喘息の増悪にかかわることが報告されている8).Th2免疫応答はM2マクロファージと関連が深く,アレルギー応答の促進にかかわる一方で,肥満にともなうメタボリック症候群に対し抑制的に作用する11).PLA2G5の発現はTh2応答にかかわるサイトカインであるインターロイキン4およびインターロイキン13により,マクロファージやT細胞において誘導されることが判明した.野生型マウスに卵白アルブミンを反復投与すると卵白アルブミンに特異的な免疫グロブリンEの血中の力価が上昇するが,PLA2G5ノックアウトマウスではこの応答が半減し,これと合致してリンパ節におけるインターロイキン4およびインターロイキン13の発現が低下した.さらに,PLA2G5ノックアウトマウスの脂肪組織ではTh2応答にかかわるサイトカインのひとつであるインターロイキン33の発現が低下していた.これらの結果から,PLA2G5はTh2応答にかかわるサイトカインにより誘導され,Th2免疫応答を促進することが明らかになった.したがって,PLA2G5ノックアウトマウスは本質的にTh2免疫応答が起こりにくく,このことが肥満の増悪の背景にあるものと考えられた.
6.PLA2G5の過剰な発現は肥満を抑制する
脂肪組織において特異的にPLA2G5を過剰に発現させたトランスジェニックマウスについて解析した.その結果,PLA2G5過剰発現マウスは野生型のマウスと比較して脂肪の蓄積が軽微で体重が軽く,低密度リポタンパク質に含まれるリン脂質の減少と脂肪組織における炎症マーカーの発現の低下がみられ,さらに,インスリン抵抗性の改善が認められた.このことから,PLA2G5ノックアウトマウスとPLA2G5過剰発現マウスは肥満の病態において逆の表現型を示すことが確かめられた.
7.PLA2G2Eの欠損は脂肪の蓄積を促進する
PLA2G2Eノックアウトマウスについて肥満の表現型を解析した.高脂肪食を負荷したPLA2G2Eノックアウトマウスは野生型のマウスと比べ体重が減少する傾向を示し,体脂肪率の低下ならびに脂肪肝の軽減が認められた.しかしながら,内臓脂肪組織における脂肪細胞の分化,脂肪の生合成,炎症関連遺伝子の発現はほとんど正常であった.PLA2G2Eノックアウトマウスでは高脂血症が顕著に改善しており,とくに,低密度リポタンパク質および超低密度リポタンパク質に含まれるリン脂質,中性脂質,コレステロールが減少していた.低密度リポタンパク質のリン脂質を質量分析した結果,PLA2G2Eノックアウトマウスは野生型マウスと比べ,主要なリン脂質であるホスファチジルコリンに変化はなかったが,微量なリン脂質であるホスファチジルエタノールアミンおよびホスファチジルセリンが増加していた.このことから,PLA2G2Eはリポタンパク質に含まれるホスファチジルエタノールアミンおよびホスファチジルセリンを選択的に分解していることがわかった.一般に,ホスファチジルセリンなどの酸性リン脂質が増加したリポタンパク質は小型化し脂質の輸送能が低下することが知られている.したがって,PLA2G2Eはリポタンパク質に含まれる微量なリン脂質の量を制御することにより,組織への脂肪の蓄積に影響をあたえているものと結論した.
おわりに
これまで一般に,分泌性ホスホリパーゼA2は炎症細胞から分泌され,細胞膜のリン脂質から脂質メディエーターを動員して炎症の増悪にかかわるものと考えられてきた.この研究は,2つの分泌性ホスホリパーゼA2の新しい機能,すなわち,全身の代謝を制御する“メタボリック分泌性ホスホリパーゼA2”の概念を提唱した(図1).メタボリック分泌性ホスホリパーゼA2の作用は,従来の定説であった脂質メディエーターに依存した経路を介してではなく,リポタンパク質からオレイン酸などの不飽和脂肪酸を動員して脂質メディエーターに非依存的に代謝に影響をあたえる点に特徴がある.さらに,この研究は,分泌性ホスホリパーゼA2のアイソザイムのもつ基質特異性の違いが生命応答に異なるインパクトをあたえることを同一の病態条件において示した,はじめての研究成果ともいえる.総じてこの研究は,分泌性ホスホリパーゼA2によるリポタンパク質の代謝の生理的な意義をはじめて解明したと同時に,肥満の新しい制御機構を提示した.内臓脂肪組織における分泌性ホスホリパーゼA2の量や不飽和脂肪酸の量は,新規の肥満の診断マーカーとなる可能性がある.また,分泌性ホスホリパーゼA2を標的とした創薬はメタボリック症候群の新しい予防法あるいは治療法の開発につながることが期待される.
文 献
- Despres, J. P. & Lemieux, I.: Abdominal obesity and metabolic syndrome. Nature, 444, 881-887 (2006)[PubMed]
- Murakami, M., Taketomi, Y., Miki, Y. et al.: Recent progress in phospholipase A2 research: from cells to animals to humans. Prog. Lipid Res., 50, 152-192 (2011)[PubMed]
- Taketomi, Y., Ueno, N., Kojima, T. et al.: Mast cell maturation is driven via a group III phospholipase A2-prostaglandin D2-DP1 receptor paracrine axis. Nat. Immunol., 14, 554-563 (2013)[PubMed] [新着論文レビュー]
- Sato, H., Taketomi, T., Isogai, Y. et al.: Group III secreted phospholipase A2 regulates epididymal sperm maturation and fertility in mice. J. Clin. Invest., 120, 1400-1414 (2010)[PubMed]
- Sato, H., Kato, R., Isogai, Y., et al.: Analyses of group III secreted phospholipase A2 transgenic mice reveal potential participation of this enzyme in plasma lipoprotein modification, macrophage foam cell formation, and atherosclerosis. J. Biol. Chem., 283, 33483-33497 (2008)[PubMed]
- Miki, Y., Yamamoto, K., Taketomi, Y. et al.: Lymphoid tissue phospholipase A2 group IID resolves contact hypersensitivity by driving anti-inflammatory lipid mediators. J. Exp. Med., 210, 1217-1234 (2013)[PubMed]
- Boilard, E., Lai, Y., Larabee, K. et al.: A novel anti-inflammatory role for secretory phospholipase A2 in immune complex-mediated arthritis. EMBO Mol. Med., 2, 172-187 (2010)[PubMed]
- Giannattasio, G., Fujioka, D., Xing, W. et al.: Group V secretory phospholipase A2 reveals its role in house dust mite-induced allergic pulmonary inflammation by regulation of dendritic cell function. J. Immunol., 185, 4430-4438 (2010)[PubMed]
- Wootton, P. T., Arora, N. L., Drenos, F. et al.: Tagging SNP haplotype analysis of the secretory PLA2-V gene, PLA2G5, shows strong association with LDL and oxLDL levels, suggesting functional distinction from sPLA2-IIA: results from the UDACS study. Hum. Mol. Genet., 16, 1437-1444 (2007)[PubMed]
- Hotamisligil, G. S.: Inflammation and metabolic disorders. Nature, 444, 860-867 (2006)[PubMed]
- Odegaard, J. I. & Chawla, A.: The immune system as a sensor of the metabolic state. Immunity, 38, 644-654 (2013)[PubMed]
著者プロフィール
略歴:1991年 東京大学大学院薬学系研究科博士課程 修了,1993年 米国Harvard大学 研究員,1995年 昭和大学薬学部 講師,1997年 同 准教授,2005年 東京都臨床医学総合研究所 副参事研究員(2010年 東京都医学総合研究所に改組)を経て,2013年より同 参事研究員.
研究テーマ:ホスホリパーゼA2の分子細胞生物学.
抱負:脂質研究のおもしろさと重要性を広く世の中に訴えたい.
研究室URL:http://www.igakuken.or.jp/research/project/res_prj23.html
佐藤 弘泰(Hiroyasu Sato)
東京都医学総合研究所 研究員.
武富 芳隆(Yoshitaka Taketomi)
東京都医学総合研究所 主席研究員.
© 2014 村上 誠・佐藤弘泰・武富芳隆 Licensed under CC 表示 2.1 日本