びまん性胃がんにおいて高い頻度でみられるRHOA遺伝子の機能獲得性の変異
垣内美和子・石川俊平
(東京大学先端科学技術研究センター ゲノムサイエンス分野)
email:石川俊平
DOI: 10.7875/first.author.2014.084
Recurrent gain-of-function mutations of RHOA in diffuse-type gastric carcinoma.
Miwako Kakiuchi, Takashi Nishizawa, Hiroki Ueda, Kengo Gotoh, Atsushi Tanaka, Akimasa Hayashi, Shogo Yamamoto, Kenji Tatsuno, Hiroto Katoh, Yoshiaki Watanabe, Takashi Ichimura, Tetsuo Ushiku, Shinichi Funahashi, Keisuke Tateishi, Ikuo Wada, Nobuyuki Shimizu, Sachiyo Nomura, Kazuhiko Koike, Yasuyuki Seto, Masashi Fukayama, Hiroyuki Aburatani, Shumpei Ishikawa
Nature Genetics, 46, 583-587 (2014)
胃がんは組織学的に腸型胃がんとびまん性胃がんに大別され,びまん性胃がんは悪性度の高い難治がんのひとつである.びまん性胃がんに特徴的なゲノムプロファイルを解明し新たな治療標的を探索する目的で,30例のびまん性胃がんに対し全エキソン塩基配列解析を行った.複数の検体においてRHOA遺伝子の変異を同定し,そのうち3例は同一の変異であった.この結果にもとづき,さらに57例のびまん性胃がんおよび51例の腸型胃がんをくわえ,RHOA遺伝子,RHOA遺伝子に関連する遺伝子,既知の胃がんにおいて変異をもつ遺伝子を含め46の遺伝子を標的にしたターゲット遺伝子塩基配列解析を行った.その結果,びまん性胃がんに特異的に22例の症例においてRHOA遺伝子の変異が認められ,そのアミノ酸置換が3つの部位に集中していたことから機能獲得性の変異である可能性が示唆された.さらに,細胞株における機能解析により,変異型のRHOA遺伝子をもつ細胞は野生型のRHOA遺伝子をもつ細胞と異なり,RHOA遺伝子に依存的に増殖していることが明らかになった.難治性かつ有効な治療法のないびまん性胃がんにおいて,変異型RHOA遺伝子はドライバー遺伝子としての役割をはたしていると考えられ,新規の治療標的としても期待される.
胃がんはわが国をはじめとして世界的に減少の傾向にあるものの,依然としてがんによる死因の上位をしめている.わが国において胃がんの死亡率が減少の傾向にある理由として,胃がん検診の普及や内視鏡の開発および発展により早期の発見および治療が可能になったことがあげられるが,さらに,発がんリスクとされるピロリ菌が発見され除菌治療が確立されたことから,今後も減少の傾向にあると考えられる.しかし,胃がんには全体の30~50%をしめるびまん性胃がんというサブグループがあり1),そのほかの腸型胃がんと比較して進行が非常に速く,手術の可能な病期に発見されたとしても手術後の5年生存率は低く予後不良である2).びまん性胃がんの病理組織学的な特徴として,低分化腺がんあるいは印環細胞がんが小塊状あるいは個細胞性に進展し,粘膜の下層へと豊富な間質をともない浸潤していくことにより胃壁の肥厚および硬化を呈することから,“スキルス(= 硬い)胃がん”とよばれることも多い.臨床的な特徴からびまん性胃がんの高リスク群の解明が進められているが,米国では腸型胃がんが減少の傾向にある一方でびまん性胃がんは徐々に増加しているといわれ3),その発がん機構は腸型胃がんとは異なることが予想される.びまん性胃がんはピロリ菌の感染との関連も低いといわれている.
発がんにかかわる分子生物学的な研究としては,家族性のびまん性胃がんの研究から細胞接着因子のひとつであるEカドヘリンをコードするCDH1遺伝子の胚細胞変異が認められ,孤発性のびまん性胃がんにおいてもCDH1遺伝子の体細胞変異,ヘテロ接合性の消失(loss of heterozygosity:LOH),遺伝子プロモーター領域におけるDNAの高メチル化が認められるとされる.これらの報告をもとに,胃壁細胞におけるEカドヘリンとp53のダブルノックアウトマウスがびまん性胃がんの発がんモデルとして提唱されているものの4),びまん性胃がんの症例の全例においてこの2つの遺伝子の異常があるわけではなく,その発がん機構には未解明な点が多い.また,胃がんの一部にはHER2遺伝子の増幅がありモノクローナル抗体による分子標的治療が可能になっているが,腸型胃がんでは陽性率が約30%であるのに対し,びまん性胃がんでは約10%しか陽性にならない5).このような臨床的および病理組織学的な特徴をもつびまん性胃がんについて,その分子生物学的なプロファイルを確立することは新たな治療戦略を見い出すうえで不可欠であると考えられる.
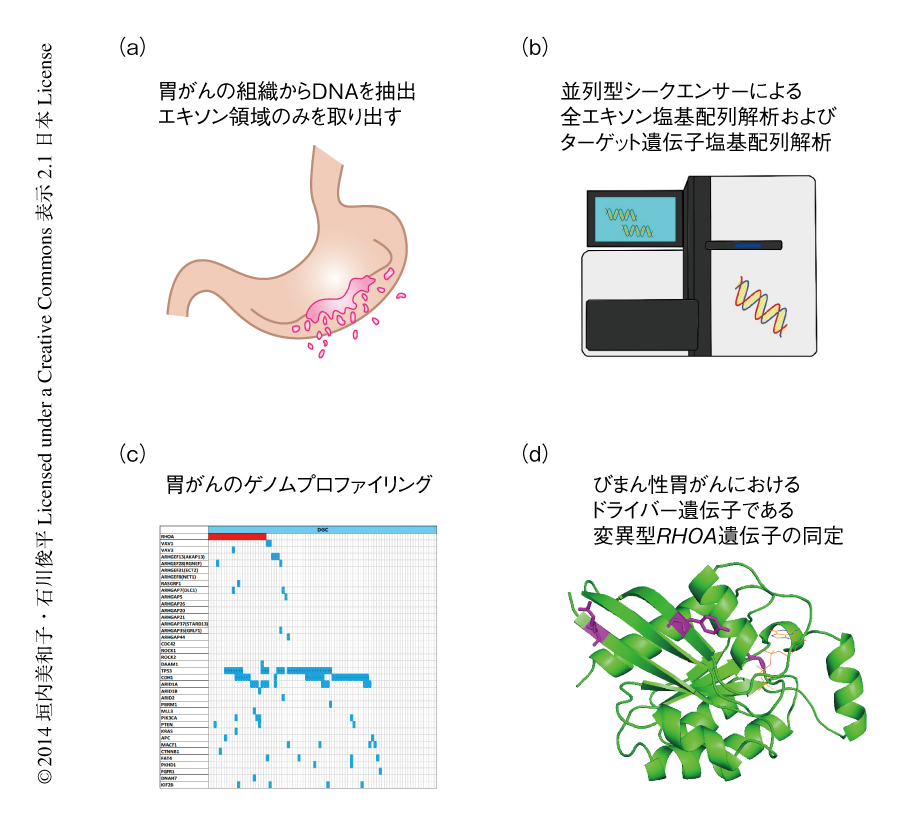
並列型シークエンサーの登場により,がんの全ゲノム塩基配列解析および全エキソン塩基配列解析が数多く報告されてきた.胃がんについても,2012年,それぞれ22例6) および15例7) の全エキソン塩基配列解析が報告されたが,その組織学的な内訳はびまん性胃がんが2例および3例と非常に少なかった.びまん性胃がんの少ない理由として,間質を多くともなうため標本におけるがん細胞の含有率が低く変異の検出力が劣ることがあげられる.今回の研究では,この問題をカバーしてびまん性胃がんの網羅的なゲノムプロファイルを明らかにすることにより,新たな治療標的を探索することが可能になった.
30例のびまん性胃がんの全エキソン塩基配列解析においては,平均で100倍以上のカバー度を目標とすることにより,がん細胞の含有率の低いびまん性胃がんにおける変異検出力を担保した(図1).また,塩基配列データからがん細胞の含有率を推定し体細胞変異の同定において補正を行う独自の解析ツールを用いた(URL:http://sourceforge.net/projects/karkinos/).その結果,全30例においてアミノ酸の置換をともなう1680個の1塩基変異および158個の挿入欠失の合計1838個の体細胞変異が見い出され,1つの症例あたりの平均として56個の1塩基変異と5個の挿入欠失がみられた.この変異の頻度は,既報の腸型胃がんを中心としたエキソン塩基配列解析6) のレベルとほぼ同等であった.アレル頻度のデータから推定されたがん細胞の含有率と検出された変異の数に明らかな相関はなく,変異アレルの検出力に大きな問題はないと考えられた.びまん性胃がんにおける塩基置換のパターンを調べてみると,CからTへの変換がめだち,これは既報の腸型胃がんと同様に多くのがんに認められる特徴でもあった.びまん性胃がんではそれにくわえTからGへの変換がめだち,なかでも,GTGからGGG,CTTからCGTの変換が顕著に認められた.この傾向は腸型胃がんにはほとんど認められず,びまん性胃がんに特徴的なものと考えられた.こうした体細胞変異,とくに塩基置換のパターンは,がん種や個々の症例により特徴があり,発がんにかかわる内的および外的な環境要因を反映しているといわれているが8),今回のケースではその正確な原因は不明であった.全エキソン塩基配列解析により得られた結果のなかで高頻度に認められた体細胞変異は,胃がんにおける変異が知られている遺伝子として,TTN遺伝子(11例),TP53遺伝子(11例),ARID1A遺伝子(5例)に変異が認められ,家族性のびまん性胃がんにおいて指摘されているCDH1遺伝子の変異も5例に認められた.新規の変異としてRHOA遺伝子の変異を7例に認め,さらには,RHOA遺伝子に変異のある7例のうち4例においてはTyr42がCysに置換するという同一の変異であった.
全エキソン塩基配列解析において認められた体細胞変異に関して,症例における頻度や分布をより正確に明らかにするため,いくつかの遺伝子を選択してターゲット遺伝子塩基配列解析を行った.また,既報の腸型胃がんを中心とした全エキソン塩基配列解析においてはRHOA遺伝子の変異は指摘されていないが6,7),今回のコホートは日本人に限定されており人種や生活習慣などによる相違も懸念されたことから,RHOA遺伝子の変異がびまん性胃がんに特異的であるかどうか確認するため,びまん性胃がんにくわえ腸型胃がんの症例も追加した.胃がんにおけるメジャーな変異を包括的にプロファイルすることも目的とし,ターゲットとなる遺伝子としてRHOA遺伝子およびその関連遺伝子であるRhoGEFあるいはRhoGAPをコードする遺伝子,既報の全エキソン塩基配列解析において変異の頻度の高かった遺伝子を含め合計46遺伝子を選択し,びまん性胃がん合計87例および腸型胃がん51例について解析した.ターゲット遺伝子塩基配列解析の利点は,全エキソン塩基配列解析と比較して標的となる領域を限定することにより,より高いカバー率で精度高く変異を検出できる点にあり,がん細胞の含有率の低いびまん性胃がんではカバー率の不足のため全エキソン塩基配列解析では検出できなかった変異も検出することが可能である.
結果として,87例のびまん性胃がんのうち22例でRHOA遺伝子の変異が認められた.Sanger法による塩基配列の決定では10%以上のアリル頻度のもののみ検出が可能であり,がん細胞の含有率が低いと予想される試料における変異の検出には高いカバー率で塩基配列を決定することが有用であると考えられた.RHOA遺伝子の変異は解析した51例の腸型胃がんには1例も認められず,びまん性胃がんにきわめて特異的であると考えられた.CDH1遺伝子の変異も腸型胃がんにおいて1例のみ同定されたものの,びまん性胃がんでは28例と,明らかにびまん性胃がんに集中しており,これらの遺伝子の変異がびまん性胃がんと腸型胃がんとの生物学的な違いに重要である可能性が示唆された.CDH1遺伝子の変異とRHOA遺伝子の変異の両方をもつ症例は7例あり,統計的にはこの2つの変異は背反とはいえず詳細はいまだ不明であるが,CDH1遺伝子とRHOA遺伝子はいわゆる同じシグナル伝達経路にあるわけではないと思われた.
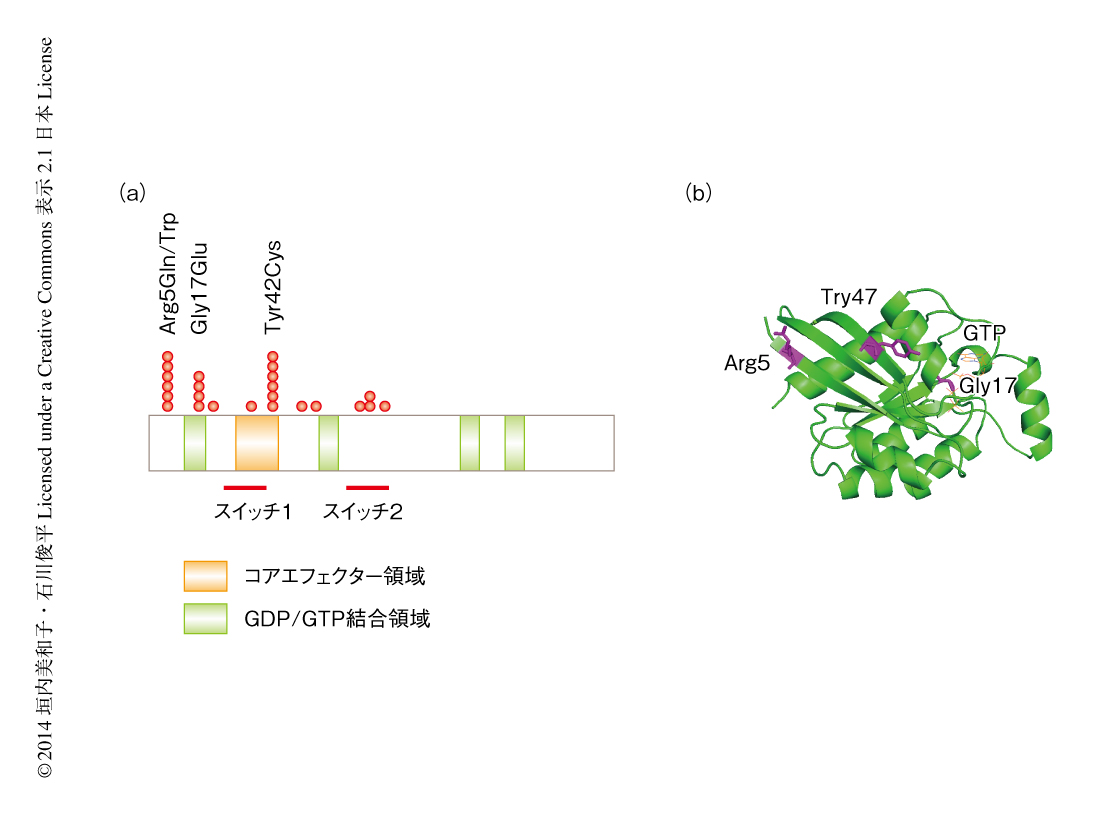
87例のびまん性胃がんにおけるターゲット遺伝子塩基配列解析の結果,RHOA遺伝子の変異においてアミノ酸置換の生じた部位はTyr42,Arg5,Gly17に集中していた(図2).RHOAのこれらのアミノ酸残基は,ヒト以外のRHOAやヒトのRHOファミリーにおいて保存されており,構造および機能において重要であると考えられた.とくに,Tyr42はエフェクタータンパク質やRhoGEFあるいはRhoGAPとの相互作用に重要なコアエフェクター領域とよばれる領域に含まれていた.また,RHOA遺伝子に関連する遺伝子として,RhoGEF,RhoGAP,エフェクタータンパク質をコードする遺伝子を含めると,31例に変異が認められた.ただし,RhoGEFあるいはRhoGAPをコードする遺伝子は概して大きな遺伝子であり,パッセンジャー変異の可能性を含めた意義を調べる必要があるだろう.RHOA遺伝子に変異をもつ症例はその大部分がBorrmann3型(潰瘍浸潤型)の肉眼像をもち,粘膜の下層より深層の浸潤部では線維性間質をともない1つから数個の細胞からなる胞巣状の構造をとるびまん性胃がんの典型像を示したが,粘膜部の一部に分化した不明瞭な腺管の構造が認められる症例が多かった.びまん性胃がんの粘膜部にこうした分化した腺管の構造がみられるという現象は一般にもよく知られており,早期の病変であるという考え方もある9).この部分を単離して解析した結果,粘膜の病変にも同様にRHOA遺伝子の変異が認められ,発がんの過程の初期からRHOA遺伝子の変異の存在する可能性が考えられた.
変異型RHOAの機能を明らかにするため,変異型RHOAをもつ細胞株と野生型RHOAをもつ細胞株を用いてノックダウン実験を行った.野生型RHOAをもつ細胞株にRHOAに対するsiRNAを添加しても大きな変化はみられなかった一方,変異型RHOAをもつ細胞株においてはsiRNAの添加により大幅な増殖抑制の効果がみられた.さらに,siRNAの作用しない変異型RHOAを強制発現させたうえで同様の実験を行うと,このような変異型RHOAを強制発現させた細胞株では増殖抑制の効果がキャンセルされた.すなわち,変異型RHOAをもつ細胞株は変異型RHOAに依存的に増殖および生存していることが示唆され,変異型RHOA遺伝子がびまん性胃がんにおけるドライバー遺伝子であることが考えられた.
この研究では,並列型シークエンサーを用いて網羅的な全エキソン塩基配列解析および高感度なターゲット遺伝子塩基配列解析を行うことにより,びまん性胃がんの遺伝子変異プロファイルを明らかにし,新たに特異的かつ高頻度なRHOA遺伝子の変異を同定した.変異型RHOA遺伝子はそのアミノ酸置換の様式や機能解析からびまん性胃がんにおける機能獲得型のドライバー遺伝子であると示唆され,治療標的となる可能性が考えられた.
略歴:東京大学大学院医学系研究科博士課程 在学中.
研究テーマ:消化器がんにおけるゲノム解析およびエピゲノム解析.
抱負:がんは不均一な細胞集団であり,その進展には正常な組織あるいは細胞とのクロストークや治療への反応などもくわわり,非常に複雑な系である.このがんの複雑性に立ち向かい,個別化治療への手がかりを得るべく柔軟な発想をもって研究を進めていきたい.
石川 俊平(Shumpei Ishikawa)
東京医科歯科大学難治疾患研究所 教授.
研究室URL:http://www.tmd.ac.jp/gpat/
(東京大学先端科学技術研究センター ゲノムサイエンス分野)
email:石川俊平
DOI: 10.7875/first.author.2014.084
Recurrent gain-of-function mutations of RHOA in diffuse-type gastric carcinoma.
Miwako Kakiuchi, Takashi Nishizawa, Hiroki Ueda, Kengo Gotoh, Atsushi Tanaka, Akimasa Hayashi, Shogo Yamamoto, Kenji Tatsuno, Hiroto Katoh, Yoshiaki Watanabe, Takashi Ichimura, Tetsuo Ushiku, Shinichi Funahashi, Keisuke Tateishi, Ikuo Wada, Nobuyuki Shimizu, Sachiyo Nomura, Kazuhiko Koike, Yasuyuki Seto, Masashi Fukayama, Hiroyuki Aburatani, Shumpei Ishikawa
Nature Genetics, 46, 583-587 (2014)
この論文に出現する遺伝子・タンパク質のUniprot ID
RHOA(P61586), Eカドヘリン(P12830), CDH1(P12830), p53(P02340), HER2(P04626), TTN(Q8WZ42), TP53(P04637), ARID1A(O14497), RhoGEF, RhoGAP, RHOファミリー, エフェクタータンパク質
要 約
胃がんは組織学的に腸型胃がんとびまん性胃がんに大別され,びまん性胃がんは悪性度の高い難治がんのひとつである.びまん性胃がんに特徴的なゲノムプロファイルを解明し新たな治療標的を探索する目的で,30例のびまん性胃がんに対し全エキソン塩基配列解析を行った.複数の検体においてRHOA遺伝子の変異を同定し,そのうち3例は同一の変異であった.この結果にもとづき,さらに57例のびまん性胃がんおよび51例の腸型胃がんをくわえ,RHOA遺伝子,RHOA遺伝子に関連する遺伝子,既知の胃がんにおいて変異をもつ遺伝子を含め46の遺伝子を標的にしたターゲット遺伝子塩基配列解析を行った.その結果,びまん性胃がんに特異的に22例の症例においてRHOA遺伝子の変異が認められ,そのアミノ酸置換が3つの部位に集中していたことから機能獲得性の変異である可能性が示唆された.さらに,細胞株における機能解析により,変異型のRHOA遺伝子をもつ細胞は野生型のRHOA遺伝子をもつ細胞と異なり,RHOA遺伝子に依存的に増殖していることが明らかになった.難治性かつ有効な治療法のないびまん性胃がんにおいて,変異型RHOA遺伝子はドライバー遺伝子としての役割をはたしていると考えられ,新規の治療標的としても期待される.
はじめに
胃がんはわが国をはじめとして世界的に減少の傾向にあるものの,依然としてがんによる死因の上位をしめている.わが国において胃がんの死亡率が減少の傾向にある理由として,胃がん検診の普及や内視鏡の開発および発展により早期の発見および治療が可能になったことがあげられるが,さらに,発がんリスクとされるピロリ菌が発見され除菌治療が確立されたことから,今後も減少の傾向にあると考えられる.しかし,胃がんには全体の30~50%をしめるびまん性胃がんというサブグループがあり1),そのほかの腸型胃がんと比較して進行が非常に速く,手術の可能な病期に発見されたとしても手術後の5年生存率は低く予後不良である2).びまん性胃がんの病理組織学的な特徴として,低分化腺がんあるいは印環細胞がんが小塊状あるいは個細胞性に進展し,粘膜の下層へと豊富な間質をともない浸潤していくことにより胃壁の肥厚および硬化を呈することから,“スキルス(= 硬い)胃がん”とよばれることも多い.臨床的な特徴からびまん性胃がんの高リスク群の解明が進められているが,米国では腸型胃がんが減少の傾向にある一方でびまん性胃がんは徐々に増加しているといわれ3),その発がん機構は腸型胃がんとは異なることが予想される.びまん性胃がんはピロリ菌の感染との関連も低いといわれている.
発がんにかかわる分子生物学的な研究としては,家族性のびまん性胃がんの研究から細胞接着因子のひとつであるEカドヘリンをコードするCDH1遺伝子の胚細胞変異が認められ,孤発性のびまん性胃がんにおいてもCDH1遺伝子の体細胞変異,ヘテロ接合性の消失(loss of heterozygosity:LOH),遺伝子プロモーター領域におけるDNAの高メチル化が認められるとされる.これらの報告をもとに,胃壁細胞におけるEカドヘリンとp53のダブルノックアウトマウスがびまん性胃がんの発がんモデルとして提唱されているものの4),びまん性胃がんの症例の全例においてこの2つの遺伝子の異常があるわけではなく,その発がん機構には未解明な点が多い.また,胃がんの一部にはHER2遺伝子の増幅がありモノクローナル抗体による分子標的治療が可能になっているが,腸型胃がんでは陽性率が約30%であるのに対し,びまん性胃がんでは約10%しか陽性にならない5).このような臨床的および病理組織学的な特徴をもつびまん性胃がんについて,その分子生物学的なプロファイルを確立することは新たな治療戦略を見い出すうえで不可欠であると考えられる.
並列型シークエンサーの登場により,がんの全ゲノム塩基配列解析および全エキソン塩基配列解析が数多く報告されてきた.胃がんについても,2012年,それぞれ22例6) および15例7) の全エキソン塩基配列解析が報告されたが,その組織学的な内訳はびまん性胃がんが2例および3例と非常に少なかった.びまん性胃がんの少ない理由として,間質を多くともなうため標本におけるがん細胞の含有率が低く変異の検出力が劣ることがあげられる.今回の研究では,この問題をカバーしてびまん性胃がんの網羅的なゲノムプロファイルを明らかにすることにより,新たな治療標的を探索することが可能になった.
1.びまん性胃がんの全エキソン塩基配列解析
30例のびまん性胃がんの全エキソン塩基配列解析においては,平均で100倍以上のカバー度を目標とすることにより,がん細胞の含有率の低いびまん性胃がんにおける変異検出力を担保した(図1).また,塩基配列データからがん細胞の含有率を推定し体細胞変異の同定において補正を行う独自の解析ツールを用いた(URL:http://sourceforge.net/projects/karkinos/).その結果,全30例においてアミノ酸の置換をともなう1680個の1塩基変異および158個の挿入欠失の合計1838個の体細胞変異が見い出され,1つの症例あたりの平均として56個の1塩基変異と5個の挿入欠失がみられた.この変異の頻度は,既報の腸型胃がんを中心としたエキソン塩基配列解析6) のレベルとほぼ同等であった.アレル頻度のデータから推定されたがん細胞の含有率と検出された変異の数に明らかな相関はなく,変異アレルの検出力に大きな問題はないと考えられた.びまん性胃がんにおける塩基置換のパターンを調べてみると,CからTへの変換がめだち,これは既報の腸型胃がんと同様に多くのがんに認められる特徴でもあった.びまん性胃がんではそれにくわえTからGへの変換がめだち,なかでも,GTGからGGG,CTTからCGTの変換が顕著に認められた.この傾向は腸型胃がんにはほとんど認められず,びまん性胃がんに特徴的なものと考えられた.こうした体細胞変異,とくに塩基置換のパターンは,がん種や個々の症例により特徴があり,発がんにかかわる内的および外的な環境要因を反映しているといわれているが8),今回のケースではその正確な原因は不明であった.全エキソン塩基配列解析により得られた結果のなかで高頻度に認められた体細胞変異は,胃がんにおける変異が知られている遺伝子として,TTN遺伝子(11例),TP53遺伝子(11例),ARID1A遺伝子(5例)に変異が認められ,家族性のびまん性胃がんにおいて指摘されているCDH1遺伝子の変異も5例に認められた.新規の変異としてRHOA遺伝子の変異を7例に認め,さらには,RHOA遺伝子に変異のある7例のうち4例においてはTyr42がCysに置換するという同一の変異であった.
2.びまん性胃がんおよび腸型胃がんにおけるターゲット遺伝子塩基配列解析
全エキソン塩基配列解析において認められた体細胞変異に関して,症例における頻度や分布をより正確に明らかにするため,いくつかの遺伝子を選択してターゲット遺伝子塩基配列解析を行った.また,既報の腸型胃がんを中心とした全エキソン塩基配列解析においてはRHOA遺伝子の変異は指摘されていないが6,7),今回のコホートは日本人に限定されており人種や生活習慣などによる相違も懸念されたことから,RHOA遺伝子の変異がびまん性胃がんに特異的であるかどうか確認するため,びまん性胃がんにくわえ腸型胃がんの症例も追加した.胃がんにおけるメジャーな変異を包括的にプロファイルすることも目的とし,ターゲットとなる遺伝子としてRHOA遺伝子およびその関連遺伝子であるRhoGEFあるいはRhoGAPをコードする遺伝子,既報の全エキソン塩基配列解析において変異の頻度の高かった遺伝子を含め合計46遺伝子を選択し,びまん性胃がん合計87例および腸型胃がん51例について解析した.ターゲット遺伝子塩基配列解析の利点は,全エキソン塩基配列解析と比較して標的となる領域を限定することにより,より高いカバー率で精度高く変異を検出できる点にあり,がん細胞の含有率の低いびまん性胃がんではカバー率の不足のため全エキソン塩基配列解析では検出できなかった変異も検出することが可能である.
結果として,87例のびまん性胃がんのうち22例でRHOA遺伝子の変異が認められた.Sanger法による塩基配列の決定では10%以上のアリル頻度のもののみ検出が可能であり,がん細胞の含有率が低いと予想される試料における変異の検出には高いカバー率で塩基配列を決定することが有用であると考えられた.RHOA遺伝子の変異は解析した51例の腸型胃がんには1例も認められず,びまん性胃がんにきわめて特異的であると考えられた.CDH1遺伝子の変異も腸型胃がんにおいて1例のみ同定されたものの,びまん性胃がんでは28例と,明らかにびまん性胃がんに集中しており,これらの遺伝子の変異がびまん性胃がんと腸型胃がんとの生物学的な違いに重要である可能性が示唆された.CDH1遺伝子の変異とRHOA遺伝子の変異の両方をもつ症例は7例あり,統計的にはこの2つの変異は背反とはいえず詳細はいまだ不明であるが,CDH1遺伝子とRHOA遺伝子はいわゆる同じシグナル伝達経路にあるわけではないと思われた.
3.変異型RHOAの機能
87例のびまん性胃がんにおけるターゲット遺伝子塩基配列解析の結果,RHOA遺伝子の変異においてアミノ酸置換の生じた部位はTyr42,Arg5,Gly17に集中していた(図2).RHOAのこれらのアミノ酸残基は,ヒト以外のRHOAやヒトのRHOファミリーにおいて保存されており,構造および機能において重要であると考えられた.とくに,Tyr42はエフェクタータンパク質やRhoGEFあるいはRhoGAPとの相互作用に重要なコアエフェクター領域とよばれる領域に含まれていた.また,RHOA遺伝子に関連する遺伝子として,RhoGEF,RhoGAP,エフェクタータンパク質をコードする遺伝子を含めると,31例に変異が認められた.ただし,RhoGEFあるいはRhoGAPをコードする遺伝子は概して大きな遺伝子であり,パッセンジャー変異の可能性を含めた意義を調べる必要があるだろう.RHOA遺伝子に変異をもつ症例はその大部分がBorrmann3型(潰瘍浸潤型)の肉眼像をもち,粘膜の下層より深層の浸潤部では線維性間質をともない1つから数個の細胞からなる胞巣状の構造をとるびまん性胃がんの典型像を示したが,粘膜部の一部に分化した不明瞭な腺管の構造が認められる症例が多かった.びまん性胃がんの粘膜部にこうした分化した腺管の構造がみられるという現象は一般にもよく知られており,早期の病変であるという考え方もある9).この部分を単離して解析した結果,粘膜の病変にも同様にRHOA遺伝子の変異が認められ,発がんの過程の初期からRHOA遺伝子の変異の存在する可能性が考えられた.
変異型RHOAの機能を明らかにするため,変異型RHOAをもつ細胞株と野生型RHOAをもつ細胞株を用いてノックダウン実験を行った.野生型RHOAをもつ細胞株にRHOAに対するsiRNAを添加しても大きな変化はみられなかった一方,変異型RHOAをもつ細胞株においてはsiRNAの添加により大幅な増殖抑制の効果がみられた.さらに,siRNAの作用しない変異型RHOAを強制発現させたうえで同様の実験を行うと,このような変異型RHOAを強制発現させた細胞株では増殖抑制の効果がキャンセルされた.すなわち,変異型RHOAをもつ細胞株は変異型RHOAに依存的に増殖および生存していることが示唆され,変異型RHOA遺伝子がびまん性胃がんにおけるドライバー遺伝子であることが考えられた.
おわりに
この研究では,並列型シークエンサーを用いて網羅的な全エキソン塩基配列解析および高感度なターゲット遺伝子塩基配列解析を行うことにより,びまん性胃がんの遺伝子変異プロファイルを明らかにし,新たに特異的かつ高頻度なRHOA遺伝子の変異を同定した.変異型RHOA遺伝子はそのアミノ酸置換の様式や機能解析からびまん性胃がんにおける機能獲得型のドライバー遺伝子であると示唆され,治療標的となる可能性が考えられた.
文 献
- Hayashi, T., Yoshikawa, T., Bonam, K. et al.: The superiority of the seventh edition of the TNM classification depends on the overall survival of the patient cohort: comparative analysis of the sixth and seventh TNM editions in patients with gastric cancer from Japan and the United Kingdom. Cancer, 119, 1330-1337 (2013)[PubMed]
- Stiekema, J., Cats, A., Kuijpers, A. et al.: Surgical treatment results of intestinal and diffuse type gastric cancer. Implications for a differentiated therapeutic approach? Eur. J. Surg. Oncol., 39, 686-693 (2013)[PubMed]
- Henson, D. E., Dittus, C., Younes, M. et al.: Differential trends in the intestinal and diffuse types of gastric carcinoma in the United States, 1973-2000: increase in the signet ring cell type. Arch. Pathol. Lab. Med., 128, 765-770 (2004)[PubMed]
- Shimada, S., Mimata, A., Sekine, M. et al.: Synergistic tumour suppressor activity of E-cadherin and p53 in a conditional mouse model for metastatic diffuse-type gastric cancer. Gut, 61, 344-353 (2012)[PubMed]
- Bang, Y., Chung, H., Xu, J. et al.: Pathological features of advanced gastric cancer (GC): relationship to human epidermal growth factor receptor 2 (HER2) positivity in the global screening programme of the ToGA trial. J. Clin. Oncol., 27, 4556 (2009)
- Wang, K., Kan, J., Yuen, S. T. et al.: Exome sequencing identifies frequent mutation of ARID1A in molecular subtypes of gastric cancer. Nat. Genet., 43, 1219-1223 (2011)[PubMed]
- Zang, Z. J., Cutcutache, I., Poon, S. L. et al.: Exome sequencing of gastric adenocarcinoma identifies recurrent somatic mutations in cell adhesion and chromatin remodeling genes. Nat. Genet., 44, 570-574 (2012)[PubMed]
- Alexandrov, L. B., Nik-Zainal, S., Wedge, D. C. et al.: Signatures of mutational processes in human cancer. Nature, 500, 415-421 (2013)[PubMed]
- Saito, A., Shimoda, T., Nakanishi, Y. et al.: Histologic heterogeneity and mucin phenotypic expression in early gastric cancer. Pathol. Int., 51, 165-171 (2001)[PubMed]
著者プロフィール
略歴:東京大学大学院医学系研究科博士課程 在学中.
研究テーマ:消化器がんにおけるゲノム解析およびエピゲノム解析.
抱負:がんは不均一な細胞集団であり,その進展には正常な組織あるいは細胞とのクロストークや治療への反応などもくわわり,非常に複雑な系である.このがんの複雑性に立ち向かい,個別化治療への手がかりを得るべく柔軟な発想をもって研究を進めていきたい.
石川 俊平(Shumpei Ishikawa)
東京医科歯科大学難治疾患研究所 教授.
研究室URL:http://www.tmd.ac.jp/gpat/
© 2014 垣内美和子・石川俊平 Licensed under CC 表示 2.1 日本