B細胞受容体シグナル伝達系における正のフィードバック制御によるNF-κBの活性化のスイッチ様の応答
篠原久明・井上健太郎・岡田眞里子
(理化学研究所統合生命医科学研究センター 統合細胞システム研究チーム)
email:篠原久明,井上健太郎,岡田眞里子
DOI: 10.7875/first.author.2014.082
Positive feedback within a kinase signaling complex functions as a switch mechanism for NF-κB activation.
Hisaaki Shinohara, Marcelo Behar, Kentaro Inoue, Michio Hiroshima, Tomoharu Yasuda, Takeshi Nagashima, Shuhei Kimura, Hideki Sanjo, Shiori Maeda, Noriko Yumoto, Sewon Ki, Shizuo Akira, Yasushi Sako, Alexander Hoffmann, Tomohiro Kurosaki, Mariko Okada-Hatakeyama
Science, 344, 760-764 (2014)
NF-κBは免疫応答や炎症反応において中心的な役割を担う転写因子であり,細胞の増殖,分化,アポトーシスなど,細胞のさまざまな運命を制御している.筆者らは,この研究において,B細胞において抗原の刺激に対するNF-κBの活性化は全か無かのスイッチ様の応答であること,さらに,この細胞の挙動が正のフィードバックにより制御されていることを,定量的な実験と数理モデルを用いて明らかにした.B細胞受容体シグナル伝達系の構成タンパク質であるCARMA1,TAK1,IKKβに焦点をあわせ,実験データをもとにCARMA1-TAK1-IKKβモジュールのダイナミクスについてシミュレーションを行った.その結果,CARMA1のSer578のリン酸化を介した正のフィードバックがTAK1活性の持続化およびIKKβ活性の増幅を促進し,NF-κBの活性化のスイッチ様の応答を誘導していることがわかった.また,1細胞計測により,このNF-κBの活性化のスイッチ様の応答を1細胞レベルでも確認することができた.これらの結果より,CARMA1-TAK1-IKKβモジュールにおける正のフィードバック制御が,B細胞への刺激に対するNF-κBの活性化の閾値を決定する機構として機能していると考えられた.
B細胞はさまざまな病原体に対する抗体を産生し感染防御に主要な役割をはたす.抗体産生能をもつ成熟したB細胞への分化の過程には,幾重もの分子制御の関門が用意されている.興味深いことに,B細胞受容体シグナルの活性が一定の閾値をこえなければ,B細胞の増殖あるいは分化は起こらない1).このことから,B細胞にはB細胞受容体シグナルの活性の閾値を決定する分子機構が存在すると考えられていたが,その機構は不明であった.
NF-κBは抗原やサイトカインなど細胞へのさまざまな刺激により活性化される転写因子である.TNFαにより刺激した線維芽細胞を用いた研究から,NF-κBの活性は刺激の量に応じて徐々に上昇するのではなく,ある一定の量の刺激(閾値)をこえると急激に活性が上昇する全か無かのスイッチ様の応答を示すことが報告されていた2).しかし,NF-κBの活性化のスイッチ様の応答をつかさどる分子機構は明らかではなかった.筆者らは,B細胞受容体におけるNF-κBシグナル伝達系において,IKKβの活性がアダプタータンパク質であるCARMA1を介した正のフィードバックにより増幅されることに着目した3).この研究では,B細胞受容体シグナル伝達系のダイナミクスを定量的な実験と数理モデルを用いて詳細に調べることにより,CARMA1-TAK1-IKKβモジュールにおける正のフィードバックが,TAK1活性の持続化,IKK活性の増幅,そして,NF-κBの活性化のスイッチ様の応答を制御していることを明らかにした.
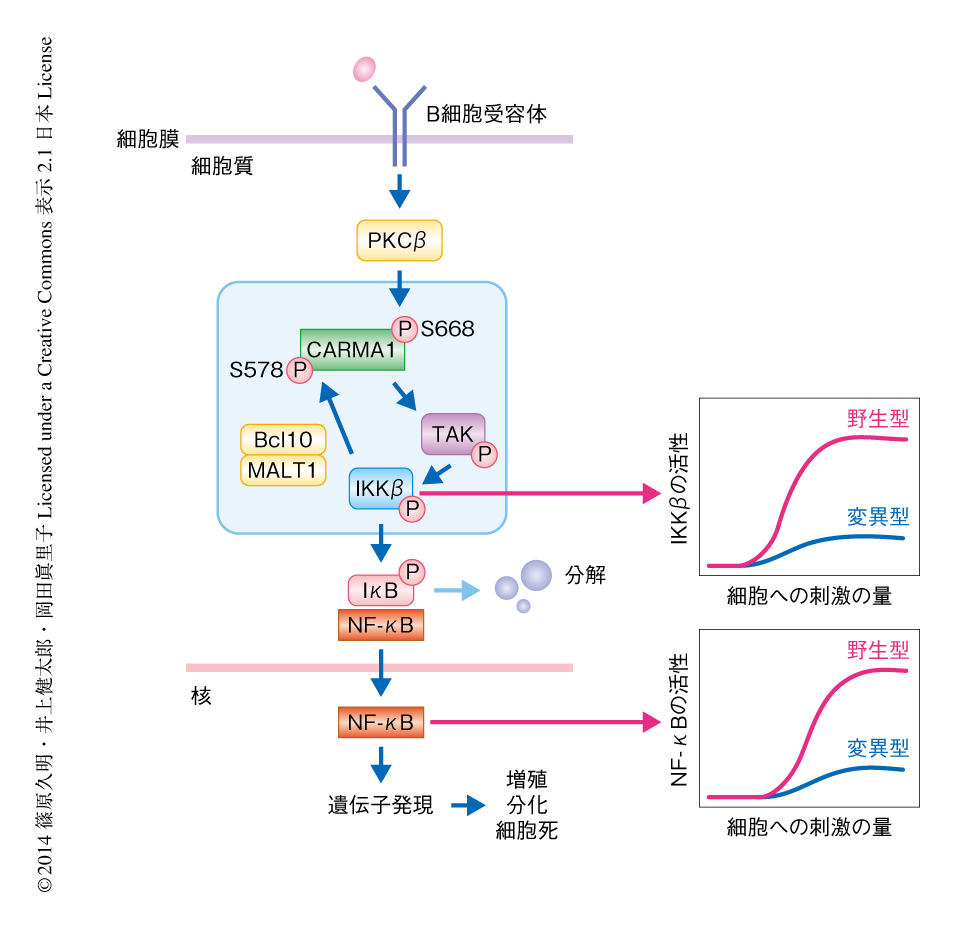
B細胞受容体シグナル伝達系においては,B細胞受容体の抗原による刺激によりプロテインキナーゼであるPKCβが活性化され,それによりCARMA1のSer668がリン酸化される.このリン酸化がCARMA1の構造変化をひき起こし,アダプタータンパク質であるBcl10およびMALT1,セリン-スレオニンキナーゼであるTAK1およびIKK複合体(IKKα,IKKβ,IKKγ)を互いに引き寄せる(図1).CARMA1はアダプタータンパク質としてはたらきこれらのタンパク質との複合体を形成することにより,TAK1およびIKKβの活性化を誘導する.このIKKβの活性化によりIκBのリン酸化および分解が促進され,IκBと結合して細胞質にとどまっていたNF-κBは核へと移行し転写因子としてはたらく4).さらに先行研究では,活性化されたIKKβがCARMA1のSer578をリン酸化し,このリン酸化がIKKβそれ自体の活性を増幅させることがわかっていた3).このようなことから,B細胞受容体シグナル伝達系においてCARMA1-TAK1-IKKβモジュールに注目し,これらの活性を定量的に解析することにした.
CARMA1-TAK1-IKKβモジュールにおけるTAK1の機能について調べた.B細胞において特異的にTAK1を欠損させたマウスの脾臓に由来する細胞を用いて,B細胞受容体への刺激による細胞の増殖をみた.野生型のB細胞では,B細胞受容体への刺激の量をだんだんに増やしていくと,ある量を境に細胞の数が急激に増加するスイッチ様の応答がみられた.しかし,TAK1を欠損したB細胞ではこのような応答はみられず,刺激の量に応じてゆるやかに増殖の上昇するようすがみられた.また,このとき,TAK1を欠損したB細胞ではNF-κBの活性化やNF-κBの標的遺伝子の発現の低下も観察された.このことから,TAK1はB細胞受容体への刺激により活性化するNF-κBシグナルおよび細胞の増殖に重要であると考えられた.
B細胞受容体への刺激に依存的なNF-κBの活性化の制御機構を詳細に調べるため,トリに由来するB細胞であるDT40細胞を用いて,抗M4抗体による刺激ののちのTAK1およびIKKβの酵素活性(細胞集団の平均値)を90秒間隔の時系列にて定量的に測定した.その結果,B細胞受容体への刺激の1.5分後および6分後の2点にTAK1活性のピークが観察された.一方,IKKβ活性については刺激の6分後だけに1つのピークがみられた.この時間パターンの相違から,TAK1とIKKβの1.5分後と6分後の活性のあいだには非線形な制御の存在する可能性が示唆された.そこで,この1.5分後と6分後の時間点に注目し,抗M4抗体の濃度に対する細胞の用量応答について調べた.その結果,TAK1活性およびIKKβ活性はともに,刺激の1.5分後には刺激の量に応じて活性が徐々に上昇したが,刺激の6分後にはある刺激の量を境に急激に活性の上昇するスイッチ様の応答が観察された.また,IKKβの酵素活性を欠失させた細胞ではTAK1活性の2つ目のピークは喪失することがわかった.
これらの酵素活性のダイナミクスから,TAK1-IKKβ経路に正のフィードバック制御の存在することが強く示唆された.そこで,先行研究の知見から,IKKβの正のフィードバック制御の標的と考えられるCARMA1のSer578をAlaに置換した細胞を解析した.この細胞では,刺激の6分後のTAK1活性のピークがなくなり,また,IKKβ活性においては抗M4抗体の濃度の上昇に対するスイッチ様の応答の喪失がみられた(図1).これらの実験から,IKKβによるCARMA1のSer578のリン酸化は,TAK1活性の持続化およびIKKβ活性を増強する正のフィードバックとして機能していることが示された(図1).また同様に,野生型のB細胞に対しB細胞受容体への刺激の45分後におけるNF-κB(RelA)の核への移行に対する用量応答(ブロットを用いた細胞集団の平均値)を調べたところ,IKKβの活性と同様に,NF-κBの核への移行にもスイッチ様の応答を観察することができた.しかし,CARMA1のSer578をAlaに置換した細胞ではこのような活性はみられなかった(図1).よって,この正のフィードバックがNF-κBの活性化を全か無かに制御していることが考えられた.
定量的な実験とともに,CARMA1-TAK1-IKKβモジュールに対する数理モデルを構築し,その制御機構を詳細に調べた.実験により測定されたシグナル伝達タンパク質のダイナミクスを常微分方程式により表わすことにより,そのダイナミクスを数理モデルとしてコンピューターにおいて再現することができる.多くの実験データを再現できる数理モデルは,そのネットワークを正しく表現していると考えられる.また,信頼性の高い数理モデルが構築できれば,反応強度のわずかな変化からそのネットワークのもつ制御の特性を高い精度で予測できるようになる.
IKKβからTAK1への正のフィードバックの強さ(速度パラメーター)を変化させることにより,そのフィードバックがTAK1活性やIKKβ活性にあたえる影響について解析した.まず,野生型のB細胞あるいは変異をもつB細胞におけるTAK1とIKKβの活性時間の変化および用量応答を再現できる数理モデルを,パラメーターフィッティングにより構築した.さらに,その数理モデルを用いて正のフィードバックの有無を再現した.フィードバックを阻害したとき(実験的にはCARMA1のSer578をAlaに置換した細胞を用いた測定値だが,シミュレーションではフィードバックの速度パラメーターを0に設定したとき)には,B細胞受容体への刺激の6分後においてTAK1の活性は上昇せず,IKKβの活性化のスイッチ様の応答も喪失した.フィードバックの速度パラメーターを“徐々に”変化させると,TAK1活性の1つ目のピークに変化はなかったが,速度パラメーターの変化の量に応じて2つ目のピークの高さだけが徐々に変化するという結果が得られた.このことから,TAK1活性の2つ目のピークはIKKβからTAK1へのフィードバックにより制御されていることが示唆された.構築された数理モデルは,CARMA1のSer578のリン酸化を介したIKKβからTAK1への正のフィードバックが,CARMA1-TAK1-IKKβモジュールのさまざまな活性のダイナミクスを制御していることを理論的に裏づけた(図1).
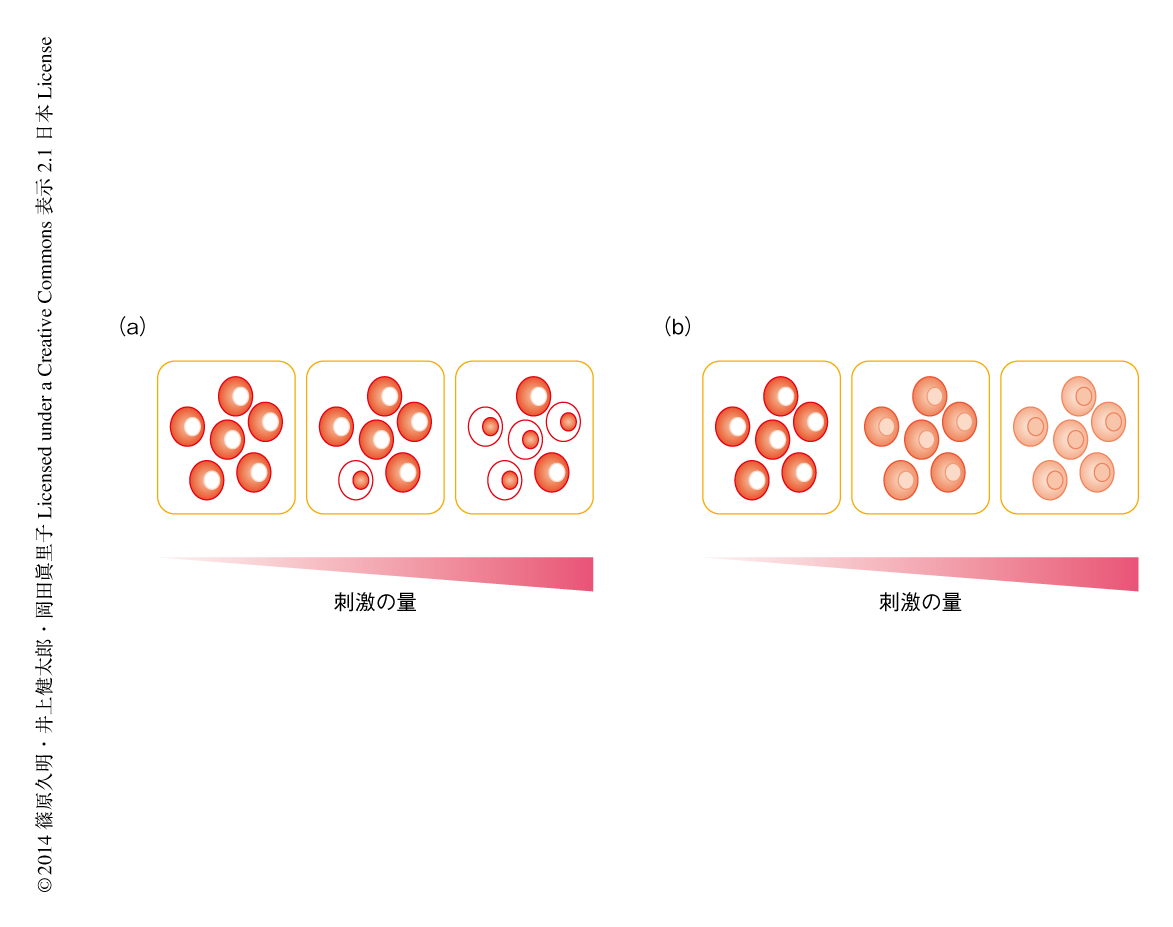
NF-κBの核への移行における用量応答は,細胞集団の平均値としてはスイッチ様であったが,免疫細胞の運命の制御という観点からは1細胞のレベルで起こっていなければその機能の意味は小さい.そこで,生細胞イメージングにより,刺激ののちのおのおのの細胞におけるNF-κB(RelA)の局在を定量的に測定することにした(図2).野生型のB細胞を用いて時系列解析を行うと,細胞質に存在していたNF-κBが刺激の45分後をピークに徐々に核へと移行するようすが測定できた.よって,この時間点における抗M4抗体の濃度に対する用量応答を1つの濃度あたり約50個の細胞を用いて測定した.すると,濃度が高くても低くても,NF-κBはすべての細胞において細胞質か核のどちらかに偏在した.しかし,濃度が高くなるにしたがい,NF-κBが核に局在する細胞の“数”が増加することがわかった.しかし一方で,CARMA1のSer578をAlaに置換した細胞の場合には,抗M4抗体の濃度が上昇してもNF-κBが細胞質と核とにほぼ同じ程度に存在する細胞が多くみられ,核への局在の変化はゆるやかであった.これらの結果から,NF-κBの活性化のスイッチ様の応答は1細胞のレベルで起こっていること,また,この制御はCARMA1-TAK1-IKKβモジュールの正のフィードバックによるものであることが明らかになった.
この研究により,NF-κBの活性化の細胞ごとの全か無かの応答はCARMA1のSer578のリン酸化を介したIKKβからTAK1への正のフィードバックにより制御されていることがわかった.B細胞の分化は適切な閾値に設定された刺激にともない作動し,この破綻は過剰な反応あるいは細胞死の原因となる.このようなフィードバック制御による細胞の全か無かの応答は,性ホルモンの刺激のもとでのアフリカツメガエルの卵の成熟においても認められ5),細胞を制御するための重要なしくみであると考えられる.また,この研究においてNF-κBの活性制御に対する役割の明らかになったアダプタータンパク質CARMA1は,アトピー性皮膚炎6) や悪性リンパ腫7) のような疾患においてその遺伝子の異常が報告されている.また,NF-κBシグナルネットワークの異常は免疫不全,がん,代謝性疾患,自己免疫疾患など,さまざまな疾患に関与していることから,システムレベルでの疾患の機構の解明や創薬への貢献が期待される.筆者らは,数理モデルがこのような疾患の機構の解明や治療に利用できると考え,現在,定量的な実験および数理モデルを拡張しNF-κBの制御の全容の理解を進めている.
略歴:2002年 東京医科歯科大学大学院医学系研究科博士課程 修了,同年 東京医科歯科大学難治疾患研究所 博士研究員を経て,2004年より理化学研究所免疫・アレルギー科学総合センター(現 統合生命医科学研究センター)研究員.
研究テーマ:免疫シグナルの定量的な解析.
井上 健太郎(Kentaro Inoue)
理化学研究所統合生命医科学研究センター 特別研究員.
岡田 眞里子(Mariko Okada-Hatakeyama)
理化学研究所統合生命医科学研究センター チームリーダー.
© 2014 篠原久明・井上健太郎・岡田眞里子 Licensed under CC 表示 2.1 日本
(理化学研究所統合生命医科学研究センター 統合細胞システム研究チーム)
email:篠原久明,井上健太郎,岡田眞里子
DOI: 10.7875/first.author.2014.082
Positive feedback within a kinase signaling complex functions as a switch mechanism for NF-κB activation.
Hisaaki Shinohara, Marcelo Behar, Kentaro Inoue, Michio Hiroshima, Tomoharu Yasuda, Takeshi Nagashima, Shuhei Kimura, Hideki Sanjo, Shiori Maeda, Noriko Yumoto, Sewon Ki, Shizuo Akira, Yasushi Sako, Alexander Hoffmann, Tomohiro Kurosaki, Mariko Okada-Hatakeyama
Science, 344, 760-764 (2014)
要 約
NF-κBは免疫応答や炎症反応において中心的な役割を担う転写因子であり,細胞の増殖,分化,アポトーシスなど,細胞のさまざまな運命を制御している.筆者らは,この研究において,B細胞において抗原の刺激に対するNF-κBの活性化は全か無かのスイッチ様の応答であること,さらに,この細胞の挙動が正のフィードバックにより制御されていることを,定量的な実験と数理モデルを用いて明らかにした.B細胞受容体シグナル伝達系の構成タンパク質であるCARMA1,TAK1,IKKβに焦点をあわせ,実験データをもとにCARMA1-TAK1-IKKβモジュールのダイナミクスについてシミュレーションを行った.その結果,CARMA1のSer578のリン酸化を介した正のフィードバックがTAK1活性の持続化およびIKKβ活性の増幅を促進し,NF-κBの活性化のスイッチ様の応答を誘導していることがわかった.また,1細胞計測により,このNF-κBの活性化のスイッチ様の応答を1細胞レベルでも確認することができた.これらの結果より,CARMA1-TAK1-IKKβモジュールにおける正のフィードバック制御が,B細胞への刺激に対するNF-κBの活性化の閾値を決定する機構として機能していると考えられた.
はじめに
B細胞はさまざまな病原体に対する抗体を産生し感染防御に主要な役割をはたす.抗体産生能をもつ成熟したB細胞への分化の過程には,幾重もの分子制御の関門が用意されている.興味深いことに,B細胞受容体シグナルの活性が一定の閾値をこえなければ,B細胞の増殖あるいは分化は起こらない1).このことから,B細胞にはB細胞受容体シグナルの活性の閾値を決定する分子機構が存在すると考えられていたが,その機構は不明であった.
NF-κBは抗原やサイトカインなど細胞へのさまざまな刺激により活性化される転写因子である.TNFαにより刺激した線維芽細胞を用いた研究から,NF-κBの活性は刺激の量に応じて徐々に上昇するのではなく,ある一定の量の刺激(閾値)をこえると急激に活性が上昇する全か無かのスイッチ様の応答を示すことが報告されていた2).しかし,NF-κBの活性化のスイッチ様の応答をつかさどる分子機構は明らかではなかった.筆者らは,B細胞受容体におけるNF-κBシグナル伝達系において,IKKβの活性がアダプタータンパク質であるCARMA1を介した正のフィードバックにより増幅されることに着目した3).この研究では,B細胞受容体シグナル伝達系のダイナミクスを定量的な実験と数理モデルを用いて詳細に調べることにより,CARMA1-TAK1-IKKβモジュールにおける正のフィードバックが,TAK1活性の持続化,IKK活性の増幅,そして,NF-κBの活性化のスイッチ様の応答を制御していることを明らかにした.
1.B細胞受容体におけるシグナルネットワーク
B細胞受容体シグナル伝達系においては,B細胞受容体の抗原による刺激によりプロテインキナーゼであるPKCβが活性化され,それによりCARMA1のSer668がリン酸化される.このリン酸化がCARMA1の構造変化をひき起こし,アダプタータンパク質であるBcl10およびMALT1,セリン-スレオニンキナーゼであるTAK1およびIKK複合体(IKKα,IKKβ,IKKγ)を互いに引き寄せる(図1).CARMA1はアダプタータンパク質としてはたらきこれらのタンパク質との複合体を形成することにより,TAK1およびIKKβの活性化を誘導する.このIKKβの活性化によりIκBのリン酸化および分解が促進され,IκBと結合して細胞質にとどまっていたNF-κBは核へと移行し転写因子としてはたらく4).さらに先行研究では,活性化されたIKKβがCARMA1のSer578をリン酸化し,このリン酸化がIKKβそれ自体の活性を増幅させることがわかっていた3).このようなことから,B細胞受容体シグナル伝達系においてCARMA1-TAK1-IKKβモジュールに注目し,これらの活性を定量的に解析することにした.
2.TAK1はNF-κBの活性化および細胞の増殖において重要である
CARMA1-TAK1-IKKβモジュールにおけるTAK1の機能について調べた.B細胞において特異的にTAK1を欠損させたマウスの脾臓に由来する細胞を用いて,B細胞受容体への刺激による細胞の増殖をみた.野生型のB細胞では,B細胞受容体への刺激の量をだんだんに増やしていくと,ある量を境に細胞の数が急激に増加するスイッチ様の応答がみられた.しかし,TAK1を欠損したB細胞ではこのような応答はみられず,刺激の量に応じてゆるやかに増殖の上昇するようすがみられた.また,このとき,TAK1を欠損したB細胞ではNF-κBの活性化やNF-κBの標的遺伝子の発現の低下も観察された.このことから,TAK1はB細胞受容体への刺激により活性化するNF-κBシグナルおよび細胞の増殖に重要であると考えられた.
3.TAK1およびIKKβの活性化のダイナミクスは正のフィードバックにより促進されNF-κBの活性化を全か無かに制御する
B細胞受容体への刺激に依存的なNF-κBの活性化の制御機構を詳細に調べるため,トリに由来するB細胞であるDT40細胞を用いて,抗M4抗体による刺激ののちのTAK1およびIKKβの酵素活性(細胞集団の平均値)を90秒間隔の時系列にて定量的に測定した.その結果,B細胞受容体への刺激の1.5分後および6分後の2点にTAK1活性のピークが観察された.一方,IKKβ活性については刺激の6分後だけに1つのピークがみられた.この時間パターンの相違から,TAK1とIKKβの1.5分後と6分後の活性のあいだには非線形な制御の存在する可能性が示唆された.そこで,この1.5分後と6分後の時間点に注目し,抗M4抗体の濃度に対する細胞の用量応答について調べた.その結果,TAK1活性およびIKKβ活性はともに,刺激の1.5分後には刺激の量に応じて活性が徐々に上昇したが,刺激の6分後にはある刺激の量を境に急激に活性の上昇するスイッチ様の応答が観察された.また,IKKβの酵素活性を欠失させた細胞ではTAK1活性の2つ目のピークは喪失することがわかった.
これらの酵素活性のダイナミクスから,TAK1-IKKβ経路に正のフィードバック制御の存在することが強く示唆された.そこで,先行研究の知見から,IKKβの正のフィードバック制御の標的と考えられるCARMA1のSer578をAlaに置換した細胞を解析した.この細胞では,刺激の6分後のTAK1活性のピークがなくなり,また,IKKβ活性においては抗M4抗体の濃度の上昇に対するスイッチ様の応答の喪失がみられた(図1).これらの実験から,IKKβによるCARMA1のSer578のリン酸化は,TAK1活性の持続化およびIKKβ活性を増強する正のフィードバックとして機能していることが示された(図1).また同様に,野生型のB細胞に対しB細胞受容体への刺激の45分後におけるNF-κB(RelA)の核への移行に対する用量応答(ブロットを用いた細胞集団の平均値)を調べたところ,IKKβの活性と同様に,NF-κBの核への移行にもスイッチ様の応答を観察することができた.しかし,CARMA1のSer578をAlaに置換した細胞ではこのような活性はみられなかった(図1).よって,この正のフィードバックがNF-κBの活性化を全か無かに制御していることが考えられた.
4.CARMA1-TAK1-IKKβモジュールのダイナミクスを数理モデルにより理解する
定量的な実験とともに,CARMA1-TAK1-IKKβモジュールに対する数理モデルを構築し,その制御機構を詳細に調べた.実験により測定されたシグナル伝達タンパク質のダイナミクスを常微分方程式により表わすことにより,そのダイナミクスを数理モデルとしてコンピューターにおいて再現することができる.多くの実験データを再現できる数理モデルは,そのネットワークを正しく表現していると考えられる.また,信頼性の高い数理モデルが構築できれば,反応強度のわずかな変化からそのネットワークのもつ制御の特性を高い精度で予測できるようになる.
IKKβからTAK1への正のフィードバックの強さ(速度パラメーター)を変化させることにより,そのフィードバックがTAK1活性やIKKβ活性にあたえる影響について解析した.まず,野生型のB細胞あるいは変異をもつB細胞におけるTAK1とIKKβの活性時間の変化および用量応答を再現できる数理モデルを,パラメーターフィッティングにより構築した.さらに,その数理モデルを用いて正のフィードバックの有無を再現した.フィードバックを阻害したとき(実験的にはCARMA1のSer578をAlaに置換した細胞を用いた測定値だが,シミュレーションではフィードバックの速度パラメーターを0に設定したとき)には,B細胞受容体への刺激の6分後においてTAK1の活性は上昇せず,IKKβの活性化のスイッチ様の応答も喪失した.フィードバックの速度パラメーターを“徐々に”変化させると,TAK1活性の1つ目のピークに変化はなかったが,速度パラメーターの変化の量に応じて2つ目のピークの高さだけが徐々に変化するという結果が得られた.このことから,TAK1活性の2つ目のピークはIKKβからTAK1へのフィードバックにより制御されていることが示唆された.構築された数理モデルは,CARMA1のSer578のリン酸化を介したIKKβからTAK1への正のフィードバックが,CARMA1-TAK1-IKKβモジュールのさまざまな活性のダイナミクスを制御していることを理論的に裏づけた(図1).
5.CARMA1を介した正のフィードバックは細胞ごとのNF-κBの活性化を全か無か制御する
NF-κBの核への移行における用量応答は,細胞集団の平均値としてはスイッチ様であったが,免疫細胞の運命の制御という観点からは1細胞のレベルで起こっていなければその機能の意味は小さい.そこで,生細胞イメージングにより,刺激ののちのおのおのの細胞におけるNF-κB(RelA)の局在を定量的に測定することにした(図2).野生型のB細胞を用いて時系列解析を行うと,細胞質に存在していたNF-κBが刺激の45分後をピークに徐々に核へと移行するようすが測定できた.よって,この時間点における抗M4抗体の濃度に対する用量応答を1つの濃度あたり約50個の細胞を用いて測定した.すると,濃度が高くても低くても,NF-κBはすべての細胞において細胞質か核のどちらかに偏在した.しかし,濃度が高くなるにしたがい,NF-κBが核に局在する細胞の“数”が増加することがわかった.しかし一方で,CARMA1のSer578をAlaに置換した細胞の場合には,抗M4抗体の濃度が上昇してもNF-κBが細胞質と核とにほぼ同じ程度に存在する細胞が多くみられ,核への局在の変化はゆるやかであった.これらの結果から,NF-κBの活性化のスイッチ様の応答は1細胞のレベルで起こっていること,また,この制御はCARMA1-TAK1-IKKβモジュールの正のフィードバックによるものであることが明らかになった.
おわりに
この研究により,NF-κBの活性化の細胞ごとの全か無かの応答はCARMA1のSer578のリン酸化を介したIKKβからTAK1への正のフィードバックにより制御されていることがわかった.B細胞の分化は適切な閾値に設定された刺激にともない作動し,この破綻は過剰な反応あるいは細胞死の原因となる.このようなフィードバック制御による細胞の全か無かの応答は,性ホルモンの刺激のもとでのアフリカツメガエルの卵の成熟においても認められ5),細胞を制御するための重要なしくみであると考えられる.また,この研究においてNF-κBの活性制御に対する役割の明らかになったアダプタータンパク質CARMA1は,アトピー性皮膚炎6) や悪性リンパ腫7) のような疾患においてその遺伝子の異常が報告されている.また,NF-κBシグナルネットワークの異常は免疫不全,がん,代謝性疾患,自己免疫疾患など,さまざまな疾患に関与していることから,システムレベルでの疾患の機構の解明や創薬への貢献が期待される.筆者らは,数理モデルがこのような疾患の機構の解明や治療に利用できると考え,現在,定量的な実験および数理モデルを拡張しNF-κBの制御の全容の理解を進めている.
文 献
- Shih, T. A., Roederer, M. & Nussenzweig, M. C.: Role of antigen receptor affinity in T cell-independent antibody responses in vivo. Nat. Immunol., 3, 399-406 (2002)[PubMed]
- Tay, S., Hughey, J. J., Lee, T. K. et al.: Single-cell NF-κB dynamics reveal digital activation and analogue information processing. Nature, 466, 267-271 (2010)[PubMed]
- Shinohara, H., Maeda, S., Watarai, H. et al.: IκB kinase β-induced phosphorylation of CARMA1 contributes to CARMA1 Bcl10 MALT1 complex formation in B cells. J. Exp. Med., 204, 3285-3293 (2007)[PubMed]
- Shinohara, H. & Kurosaki, T.: Comprehending the complex connection between PKCβ, TAK1, and IKK in BCR signaling. Immunol. Rev., 232, 300-318 (2009)[PubMed]
- Ferrell, J. E. Jr. & Machleder, E. M.: The biochemical basis of an all-or-none cell fate switch in Xenopus oocytes. Science, 280, 895-898 (1998)[PubMed]
- Hirota, T., Takahashi, A., Kubo, M. et al.: Genome-wide association study identifies eight new susceptibility loci for atopic dermatitis in the Japanese population. Nat. Genet., 44, 1222-1226 (2012)[PubMed]
- Lenz, G., Davis, R. E., Ngo, V. N. et al.: Oncogenic CARD11 mutations in human diffuse large B cell lymphoma. Science, 319, 1676-1679 (2008)[PubMed]
著者プロフィール
略歴:2002年 東京医科歯科大学大学院医学系研究科博士課程 修了,同年 東京医科歯科大学難治疾患研究所 博士研究員を経て,2004年より理化学研究所免疫・アレルギー科学総合センター(現 統合生命医科学研究センター)研究員.
研究テーマ:免疫シグナルの定量的な解析.
井上 健太郎(Kentaro Inoue)
理化学研究所統合生命医科学研究センター 特別研究員.
岡田 眞里子(Mariko Okada-Hatakeyama)
理化学研究所統合生命医科学研究センター チームリーダー.
© 2014 篠原久明・井上健太郎・岡田眞里子 Licensed under CC 表示 2.1 日本