Osterix陽性細胞は発生の過程において一時的な骨髄間質細胞および成体における骨髄間葉系幹細胞の起源を含む
溝口利英・Paul S. Frenette
(米国Albert Einstein College of Medicine,Ruth L. and David S. Gottesman Institute for Stem Cell and Regenerative Medicine Research)
email:溝口利英
DOI: 10.7875/first.author.2014.081
Osterix marks distinct waves of primitive and definitive stromal progenitors during bone marrow development.
Toshihide Mizoguchi, Sandra Pinho, Jalal Ahmed, Yuya Kunisaki, Maher Hanoun, Avital Mendelson, Noriaki Ono, Henry M. Kronenberg, Paul S. Frenette
Developmental Cell, 29, 340-349 (2014)
骨髄間葉系幹細胞は生涯をとおして骨芽細胞,脂肪細胞,軟骨細胞へと分化し,骨および骨髄の環境の維持において中心的な役割をはたす.しかし,その発生の過程における挙動および局在については不明であった.一方,転写因子であるOsterixは成体における骨芽細胞のマーカータンパク質として知られている.今回,筆者らは,マウスのさまざまな発生時期におけるOsterix陽性細胞の系譜を解析し,胎仔期におけるOsterix陽性細胞は幼若期の一時的な骨髄間質細胞に寄与すること,新生仔期におけるOsterix陽性細胞は骨髄間葉系幹細胞に寄与すること,成体期におけるOsterix陽性細胞は骨髄間質細胞には寄与しないこと,を明らかにした.以上より,Osterixはその発生の時期に依存して,異なる運命をもつ間葉系に属する細胞にて発現すること,そして,新生仔期におけるOsterix陽性細胞は骨髄間葉系幹細胞の起源を含むことが明らかになった.
骨髄間葉系幹細胞は間葉系に属する種々の細胞に分化するのみならず,造血幹細胞の支持を担うことが報告されている1,2).このように,骨髄間葉系幹細胞は骨および骨髄の環境の維持において中心的な役割をはたすことが明らかになってきた.これまで,生体における骨髄間葉系幹細胞として,Nestin陽性細胞2),CXCL12発現細胞3),PDGF受容体α/Sca-1陽性細胞4),そしてCD51/PDGF受容体α陽性細胞5) などが報告されており,そのマーカータンパク質は多岐にわたる.これらのマーカータンパク質にもとづき分取した細胞のいくつかはオーバーラップしているとの報告もあるが5),生体における骨髄間葉系幹細胞の実態についてはいまだ不明な点が多い.
一方,Osterix(Osx)は骨髄間葉系幹細胞から骨芽細胞への分化において必須の転写因子であり,そのノックアウトマウスは骨形成の不全を呈する6).発生の初期においてOsx陽性細胞は軟骨原基の周辺に出現し,そののち,1次骨化中心へと血管にそって侵入し,成熟した骨芽細胞へと分化する7).その一方で,発生の過程において骨芽細胞以外の細胞にOsxの発現が認められるとの報告もあるが7),詳細な解析はなされていない.そこで,筆者らは,発生の過程におけるOsx陽性細胞の系譜を解析した.
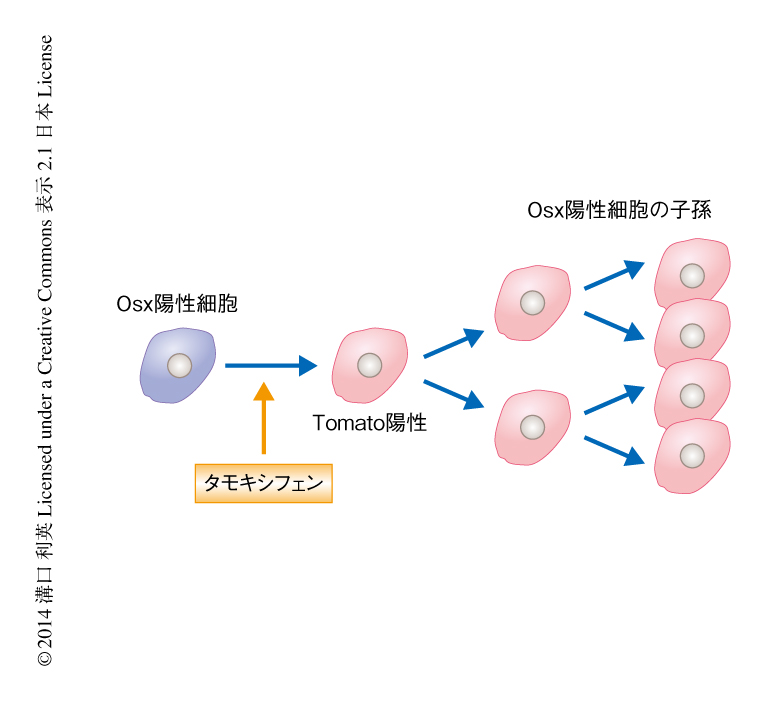
Osx陽性細胞の系譜を解析するため,タモキシフェンの投与に依存してOsx陽性細胞において蛍光タンパク質であるTomatoを特異的に発現するトランスジェニックマウスを作製した.このトランスジェニックマウスではOsx陽性細胞の子孫細胞をTomato陽性細胞として永続的に検出することができる(図1).このトランスジェニックマウスにタモキシフェンを,胎生13.5日目(胎生期),生後5日目(新生仔期),8週齢(成体期)において投与し,それぞれについてOsx陽性細胞の系譜を解析した.その結果,胎生期におけるOsx陽性細胞の子孫は,骨芽細胞および骨細胞だけでなく,骨髄間質細胞として骨髄の組織の全体にわたり認められた.しかし,これらの子孫細胞は成長にともない減少した.また,新生仔期におけるOsx陽性細胞も,その子孫細胞は骨芽細胞,骨細胞,骨髄間質細胞として認められ,新生仔期におけるOsx陽性細胞に由来する骨髄間質細胞は長期間(少なくとも8カ月間)にわたり骨髄の組織の全体に存在した.そして,成体期におけるOsx陽性細胞の子孫細胞は,骨芽細胞への一時的な寄与のみが認められた.以上の結果より,Osxの発現はマウスの発生の時期に依存して3種類の間葉系に属する細胞で認められること,胎生期におけるOsx陽性細胞は幼若期における一時的な骨髄間質細胞を形成し,新生仔期におけるOsx陽性細胞は長寿命な骨髄間質細胞に寄与することが明らかになった(図2).この新生仔期におけるOsx陽性細胞に由来する長寿命な骨髄間質細胞を“definitiveストローマ細胞”と名づけた(図2).
長期間にわたり骨髄組織に存在するというdefinitiveストローマ細胞の挙動は,自己複製能をもつ骨髄間葉系幹細胞の性質を連想させた1).そこで,骨髄間葉系幹細胞のマーカーであるNestin 2) のdefinitiveストローマ細胞における発現を調べた.その結果,約85%のdefinitiveストローマ細胞はNestin陽性であった.CFU-Fアッセイは培養環境における間葉系細胞のコロニー形成能を調べることにより幹細胞能の有無をみきわめる方法である1,2,5).definitiveストローマ細胞を蛍光セルソーターにより骨髄から分取し,このCFU-Fアッセイによりコロニー形成能について調べたところ,それ以外の骨髄間質細胞の画分と比較し有意に高いことが明らかになった.さらに,骨髄より分取およびクローン化したdefinitiveストローマ細胞はin vitroにおいて骨芽細胞,脂肪細胞,軟骨細胞に分化した.一方,definitiveストローマ細胞はマウスの成長にともない骨髄において増殖したが,その細胞周期は徐々に静止期へと移行した.くわえて,培養環境において自己複製能をもつことが証明された.以上の結果より,definitiveストローマ細胞は骨髄間葉系幹細胞としての特徴および性質をもつことが示唆された(図2).
definitiveストローマ細胞の骨芽細胞への分化能をin vivoにおいて検討した.そのため,definitiveストローマ細胞に特異的に発現するタンパク質を免疫染色およびフローサイトメトリー解析により探索し,レプチン受容体の発現を確認した.以前に,レプチン受容体は骨芽細胞に発現しないことが示唆されていた8).そこで,レプチン受容体陽性細胞において蛍光タンパク質であるTomatoを特異的に発現するトランスジェニックマウスを作製し,レプチン受容体陽性細胞の細胞系譜を解析した.このトランスジェニックマウスではレプチン受容体陽性細胞およびその子孫細胞をTomato陽性細胞として検出することができる.このトランスジェニックマウスにおいて,Tomato陽性細胞は胎生17.5日目の骨髄の成長板の直下に出現し,1週齢では骨髄の組織の全体にわたり認められた.フローサイトメトリー解析の結果,約90%のTomato陽性細胞がNestin陽性であった.さらに,骨髄組織より分取およびクローン化したTomato陽性細胞はin vitroにおいて骨芽細胞,脂肪細胞,軟骨細胞に分化する能力を呈し,骨髄間葉系幹細胞としての性質をもっていた.以上の結果は,レプチン受容体陽性細胞とdefinitiveストローマ細胞とがオーバーラップすることを示していた.
レプチン受容体陽性細胞の骨芽細胞への寄与について調べるため,このトランスジェニックマウスの骨組織を3週齢および15週齢において解析した.その結果,3週齢のマウスではTomato陽性細胞は骨髄間質細胞として骨髄の全体にわたり認められたが,骨形成細胞への寄与は認められなかった.一方,15週齢のマウスにおいて,Tomato陽性細胞は骨髄間質細胞だけでなく骨芽細胞および骨細胞としても認められた.免疫染色およびリアルタイムPCR法により,レプチン受容体は骨芽細胞および骨細胞に発現していないことが確認された.以上の結果は,レプチン受容体陽性細胞が成長にともない骨形成細胞に分化したことを示しており,definitiveストローマ細胞がin vivoにおいて骨形成細胞に分化することが示唆された(図2).
骨髄間葉系幹細胞は骨芽細胞だけでなく脂肪細胞にも分化することが知られているが,in vivoにおける挙動についてはいまだ不明な点が多い9).そこで,definitiveストローマ細胞のin vivoにおける脂肪細胞への分化能について検討した.マウスへの放射線の照射は骨髄間葉系幹細胞から脂肪細胞への分化を誘導することが知られている10).タモキシフェンの投与に依存してOsx陽性細胞においてTomatoを特異的に発現するトランスジェニックマウスに対し,新生仔期においてタモキシフェンを投与することによりdefinitiveストローマ細胞を標識した.15週間の飼育ののち放射線を照射し,その6日後に骨髄の脂肪細胞を解析した.その結果,放射線の照射により骨髄の成長板直下の領域において脂肪細胞の分化が誘導され,その脂肪細胞はTomato陽性細胞として認められた.さらに,definitiveストローマ細胞においてジフテリア毒素受容体を特異的に発現するトランスジェニックマウスを作製した.このトランスジェニックマウスへのジフテリア毒素の投与はdefinitiveストローマ細胞を特異的に枯渇させ,それにともない放射線の照射により分化の誘導される脂肪細胞の数も減少した.以上の結果より,definitiveストローマ細胞はin vivoにおいて脂肪細胞に分化することが示唆された(図2).
骨折の治癒の過程において,骨折した部位の周囲には仮骨が形成されることが知られている11).そのとき,仮骨に出現する軟骨細胞は骨髄間葉系幹細胞から分化すると考えられているが,その由来の詳細はいまだ不明である.そこで,definitiveストローマ細胞の骨折の治癒の過程における軟骨細胞への分化能について検討した.タモキシフェンの投与に依存してOsx陽性細胞においてTomatoを特異的に発現するトランスジェニックマウスに対し,新生仔期においてタモキシフェンを投与することによりdefinitiveストローマ細胞を標識した.32週間の飼育ののち骨折の処置をし,その8日後に骨折の治癒組織を解析した.その結果,仮骨にはSox9陽性の軟骨細胞が分化しており,そのいくつかはTomato陽性細胞として認められた.以上の結果より,definitiveストローマ細胞は骨折の治癒の過程において形成される軟骨細胞に寄与することが示唆された(図2).
近年,骨膜細胞が骨折の治癒の過程における仮骨の形成に寄与することが報告された12).タモキシフェンの投与に依存してOsx陽性細胞においてTomatoを特異的に発現するトランスジェニックマウスに対し,新生仔期においてタモキシフェンを投与したところ,骨膜細胞もTomato陽性細胞として認められた.以上より,definitiveストローマ細胞と骨膜細胞のどちらがおもに骨折の治癒の過程における軟骨細胞の形成に寄与するのかは不明であり,今後のさらなる解析が必要である.
今回,筆者らは,転写因子Osxは発生の時期に依存して,運命の異なる間葉系に属する細胞に発現することを明らかにした.そして,新生仔期におけるOsx陽性細胞は,骨芽細胞に寄与するだけでなく骨髄間葉系幹細胞として成体の骨髄の全体に分布する運命をもつことを示した.さらに,これらの骨髄間葉系幹細胞が生体において骨芽細胞,脂肪細胞,そして,骨折の治癒の過程において軟骨細胞に分化することを細胞系譜の解析により証明することに成功した.
一方,骨髄間葉系幹細胞の細胞周期は,マウスの成長にともない静止期へと移行することも明らかになった.このことは,成体におけるなんらかの骨髄の環境が骨髄間葉系幹細胞の細胞周期を静止期に維持し,未分化な状態を保っていることを示唆した.さらに,未分化な状態の骨髄間葉系幹細胞が間葉系に属する種々の細胞に分化する分子機構についても不明であり,今後のさらなる研究の発展が期待される.
略歴:2005年 東京薬科大学大学院生命科学研究科にて博士号取得,松本歯科大学総合歯科医学研究所 助手,2011年 米国Albert Einstein College of Medicine博士研究員を経て,松本歯科大学総合歯科医学研究所 講師.
研究テーマ:骨髄の環境および骨代謝.
抱負:未知の骨代謝の制御機構を見い出したい.
Paul S. Frenette
米国Albert Einstein College of MedicineにてProfessor.
研究室URL:http://www.einstein.yu.edu/labs/paul-frenette/
© 2014 溝口利英・Paul S. Frenette Licensed under CC 表示 2.1 日本
(米国Albert Einstein College of Medicine,Ruth L. and David S. Gottesman Institute for Stem Cell and Regenerative Medicine Research)
email:溝口利英
DOI: 10.7875/first.author.2014.081
Osterix marks distinct waves of primitive and definitive stromal progenitors during bone marrow development.
Toshihide Mizoguchi, Sandra Pinho, Jalal Ahmed, Yuya Kunisaki, Maher Hanoun, Avital Mendelson, Noriaki Ono, Henry M. Kronenberg, Paul S. Frenette
Developmental Cell, 29, 340-349 (2014)
要 約
骨髄間葉系幹細胞は生涯をとおして骨芽細胞,脂肪細胞,軟骨細胞へと分化し,骨および骨髄の環境の維持において中心的な役割をはたす.しかし,その発生の過程における挙動および局在については不明であった.一方,転写因子であるOsterixは成体における骨芽細胞のマーカータンパク質として知られている.今回,筆者らは,マウスのさまざまな発生時期におけるOsterix陽性細胞の系譜を解析し,胎仔期におけるOsterix陽性細胞は幼若期の一時的な骨髄間質細胞に寄与すること,新生仔期におけるOsterix陽性細胞は骨髄間葉系幹細胞に寄与すること,成体期におけるOsterix陽性細胞は骨髄間質細胞には寄与しないこと,を明らかにした.以上より,Osterixはその発生の時期に依存して,異なる運命をもつ間葉系に属する細胞にて発現すること,そして,新生仔期におけるOsterix陽性細胞は骨髄間葉系幹細胞の起源を含むことが明らかになった.
はじめに
骨髄間葉系幹細胞は間葉系に属する種々の細胞に分化するのみならず,造血幹細胞の支持を担うことが報告されている1,2).このように,骨髄間葉系幹細胞は骨および骨髄の環境の維持において中心的な役割をはたすことが明らかになってきた.これまで,生体における骨髄間葉系幹細胞として,Nestin陽性細胞2),CXCL12発現細胞3),PDGF受容体α/Sca-1陽性細胞4),そしてCD51/PDGF受容体α陽性細胞5) などが報告されており,そのマーカータンパク質は多岐にわたる.これらのマーカータンパク質にもとづき分取した細胞のいくつかはオーバーラップしているとの報告もあるが5),生体における骨髄間葉系幹細胞の実態についてはいまだ不明な点が多い.
一方,Osterix(Osx)は骨髄間葉系幹細胞から骨芽細胞への分化において必須の転写因子であり,そのノックアウトマウスは骨形成の不全を呈する6).発生の初期においてOsx陽性細胞は軟骨原基の周辺に出現し,そののち,1次骨化中心へと血管にそって侵入し,成熟した骨芽細胞へと分化する7).その一方で,発生の過程において骨芽細胞以外の細胞にOsxの発現が認められるとの報告もあるが7),詳細な解析はなされていない.そこで,筆者らは,発生の過程におけるOsx陽性細胞の系譜を解析した.
1.新生仔期におけるOsx陽性細胞は長寿命な骨髄間質細胞に寄与する
Osx陽性細胞の系譜を解析するため,タモキシフェンの投与に依存してOsx陽性細胞において蛍光タンパク質であるTomatoを特異的に発現するトランスジェニックマウスを作製した.このトランスジェニックマウスではOsx陽性細胞の子孫細胞をTomato陽性細胞として永続的に検出することができる(図1).このトランスジェニックマウスにタモキシフェンを,胎生13.5日目(胎生期),生後5日目(新生仔期),8週齢(成体期)において投与し,それぞれについてOsx陽性細胞の系譜を解析した.その結果,胎生期におけるOsx陽性細胞の子孫は,骨芽細胞および骨細胞だけでなく,骨髄間質細胞として骨髄の組織の全体にわたり認められた.しかし,これらの子孫細胞は成長にともない減少した.また,新生仔期におけるOsx陽性細胞も,その子孫細胞は骨芽細胞,骨細胞,骨髄間質細胞として認められ,新生仔期におけるOsx陽性細胞に由来する骨髄間質細胞は長期間(少なくとも8カ月間)にわたり骨髄の組織の全体に存在した.そして,成体期におけるOsx陽性細胞の子孫細胞は,骨芽細胞への一時的な寄与のみが認められた.以上の結果より,Osxの発現はマウスの発生の時期に依存して3種類の間葉系に属する細胞で認められること,胎生期におけるOsx陽性細胞は幼若期における一時的な骨髄間質細胞を形成し,新生仔期におけるOsx陽性細胞は長寿命な骨髄間質細胞に寄与することが明らかになった(図2).この新生仔期におけるOsx陽性細胞に由来する長寿命な骨髄間質細胞を“definitiveストローマ細胞”と名づけた(図2).
2.definitiveストローマ細胞は骨髄間葉系幹細胞としての性質をもつ
長期間にわたり骨髄組織に存在するというdefinitiveストローマ細胞の挙動は,自己複製能をもつ骨髄間葉系幹細胞の性質を連想させた1).そこで,骨髄間葉系幹細胞のマーカーであるNestin 2) のdefinitiveストローマ細胞における発現を調べた.その結果,約85%のdefinitiveストローマ細胞はNestin陽性であった.CFU-Fアッセイは培養環境における間葉系細胞のコロニー形成能を調べることにより幹細胞能の有無をみきわめる方法である1,2,5).definitiveストローマ細胞を蛍光セルソーターにより骨髄から分取し,このCFU-Fアッセイによりコロニー形成能について調べたところ,それ以外の骨髄間質細胞の画分と比較し有意に高いことが明らかになった.さらに,骨髄より分取およびクローン化したdefinitiveストローマ細胞はin vitroにおいて骨芽細胞,脂肪細胞,軟骨細胞に分化した.一方,definitiveストローマ細胞はマウスの成長にともない骨髄において増殖したが,その細胞周期は徐々に静止期へと移行した.くわえて,培養環境において自己複製能をもつことが証明された.以上の結果より,definitiveストローマ細胞は骨髄間葉系幹細胞としての特徴および性質をもつことが示唆された(図2).
3.definitiveストローマ細胞はin vivoにおいて骨芽細胞に分化する
definitiveストローマ細胞の骨芽細胞への分化能をin vivoにおいて検討した.そのため,definitiveストローマ細胞に特異的に発現するタンパク質を免疫染色およびフローサイトメトリー解析により探索し,レプチン受容体の発現を確認した.以前に,レプチン受容体は骨芽細胞に発現しないことが示唆されていた8).そこで,レプチン受容体陽性細胞において蛍光タンパク質であるTomatoを特異的に発現するトランスジェニックマウスを作製し,レプチン受容体陽性細胞の細胞系譜を解析した.このトランスジェニックマウスではレプチン受容体陽性細胞およびその子孫細胞をTomato陽性細胞として検出することができる.このトランスジェニックマウスにおいて,Tomato陽性細胞は胎生17.5日目の骨髄の成長板の直下に出現し,1週齢では骨髄の組織の全体にわたり認められた.フローサイトメトリー解析の結果,約90%のTomato陽性細胞がNestin陽性であった.さらに,骨髄組織より分取およびクローン化したTomato陽性細胞はin vitroにおいて骨芽細胞,脂肪細胞,軟骨細胞に分化する能力を呈し,骨髄間葉系幹細胞としての性質をもっていた.以上の結果は,レプチン受容体陽性細胞とdefinitiveストローマ細胞とがオーバーラップすることを示していた.
レプチン受容体陽性細胞の骨芽細胞への寄与について調べるため,このトランスジェニックマウスの骨組織を3週齢および15週齢において解析した.その結果,3週齢のマウスではTomato陽性細胞は骨髄間質細胞として骨髄の全体にわたり認められたが,骨形成細胞への寄与は認められなかった.一方,15週齢のマウスにおいて,Tomato陽性細胞は骨髄間質細胞だけでなく骨芽細胞および骨細胞としても認められた.免疫染色およびリアルタイムPCR法により,レプチン受容体は骨芽細胞および骨細胞に発現していないことが確認された.以上の結果は,レプチン受容体陽性細胞が成長にともない骨形成細胞に分化したことを示しており,definitiveストローマ細胞がin vivoにおいて骨形成細胞に分化することが示唆された(図2).
4.definitiveストローマ細胞はin vivoにおいて脂肪細胞に分化する
骨髄間葉系幹細胞は骨芽細胞だけでなく脂肪細胞にも分化することが知られているが,in vivoにおける挙動についてはいまだ不明な点が多い9).そこで,definitiveストローマ細胞のin vivoにおける脂肪細胞への分化能について検討した.マウスへの放射線の照射は骨髄間葉系幹細胞から脂肪細胞への分化を誘導することが知られている10).タモキシフェンの投与に依存してOsx陽性細胞においてTomatoを特異的に発現するトランスジェニックマウスに対し,新生仔期においてタモキシフェンを投与することによりdefinitiveストローマ細胞を標識した.15週間の飼育ののち放射線を照射し,その6日後に骨髄の脂肪細胞を解析した.その結果,放射線の照射により骨髄の成長板直下の領域において脂肪細胞の分化が誘導され,その脂肪細胞はTomato陽性細胞として認められた.さらに,definitiveストローマ細胞においてジフテリア毒素受容体を特異的に発現するトランスジェニックマウスを作製した.このトランスジェニックマウスへのジフテリア毒素の投与はdefinitiveストローマ細胞を特異的に枯渇させ,それにともない放射線の照射により分化の誘導される脂肪細胞の数も減少した.以上の結果より,definitiveストローマ細胞はin vivoにおいて脂肪細胞に分化することが示唆された(図2).
5.definitiveストローマ細胞は骨折の治癒の過程において軟骨細胞へと分化する
骨折の治癒の過程において,骨折した部位の周囲には仮骨が形成されることが知られている11).そのとき,仮骨に出現する軟骨細胞は骨髄間葉系幹細胞から分化すると考えられているが,その由来の詳細はいまだ不明である.そこで,definitiveストローマ細胞の骨折の治癒の過程における軟骨細胞への分化能について検討した.タモキシフェンの投与に依存してOsx陽性細胞においてTomatoを特異的に発現するトランスジェニックマウスに対し,新生仔期においてタモキシフェンを投与することによりdefinitiveストローマ細胞を標識した.32週間の飼育ののち骨折の処置をし,その8日後に骨折の治癒組織を解析した.その結果,仮骨にはSox9陽性の軟骨細胞が分化しており,そのいくつかはTomato陽性細胞として認められた.以上の結果より,definitiveストローマ細胞は骨折の治癒の過程において形成される軟骨細胞に寄与することが示唆された(図2).
近年,骨膜細胞が骨折の治癒の過程における仮骨の形成に寄与することが報告された12).タモキシフェンの投与に依存してOsx陽性細胞においてTomatoを特異的に発現するトランスジェニックマウスに対し,新生仔期においてタモキシフェンを投与したところ,骨膜細胞もTomato陽性細胞として認められた.以上より,definitiveストローマ細胞と骨膜細胞のどちらがおもに骨折の治癒の過程における軟骨細胞の形成に寄与するのかは不明であり,今後のさらなる解析が必要である.
おわりに
今回,筆者らは,転写因子Osxは発生の時期に依存して,運命の異なる間葉系に属する細胞に発現することを明らかにした.そして,新生仔期におけるOsx陽性細胞は,骨芽細胞に寄与するだけでなく骨髄間葉系幹細胞として成体の骨髄の全体に分布する運命をもつことを示した.さらに,これらの骨髄間葉系幹細胞が生体において骨芽細胞,脂肪細胞,そして,骨折の治癒の過程において軟骨細胞に分化することを細胞系譜の解析により証明することに成功した.
一方,骨髄間葉系幹細胞の細胞周期は,マウスの成長にともない静止期へと移行することも明らかになった.このことは,成体におけるなんらかの骨髄の環境が骨髄間葉系幹細胞の細胞周期を静止期に維持し,未分化な状態を保っていることを示唆した.さらに,未分化な状態の骨髄間葉系幹細胞が間葉系に属する種々の細胞に分化する分子機構についても不明であり,今後のさらなる研究の発展が期待される.
文 献
- Frenette, P. S., Pinho, S., Lucas, D. et al.: Mesenchymal stem cell: keystone of the hematopoietic stem cell niche and a stepping-stone for regenerative medicine. Annu. Rev. Immunol., 31, 285-316 (2013)[PubMed]
- Mendez-Ferrer, S., Michurina, T. V., Ferraro, F. et al.: Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature, 466, 829-834 (2010)[PubMed]
- Omatsu, Y., Sugiyama, T., Kohara, H. et al.: The essential functions of adipo-osteogenic progenitors as the hematopoietic stem and progenitor cell niche. Immunity, 33, 387-399 (2010)[PubMed]
- Morikawa, S., Mabuchi, Y., Kubota, Y. et al.: Prospective identification, isolation, and systemic transplantation of multipotent mesenchymal stem cells in murine bone marrow. J. Exp. Med., 206, 2483-2496 (2009)[PubMed]
- Pinho, S., Lacombe, J., Hanoun, M. et al.: PDGFRα and CD51 mark human nestin+ sphere-forming mesenchymal stem cells capable of hematopoietic progenitor cell expansion. J. Exp. Med., 210, 1351-1367 (2013)[PubMed]
- Nakashima, K., Zhou, X., Kunkel, G. et al.: The novel zinc finger-containing transcription factor osterix is required for osteoblast differentiation and bone formation. Cell,108, 17-29 (2002)[PubMed]
- Maes, C., Kobayashi, T., Selig, M. K. et al.: Osteoblast precursors, but not mature osteoblasts, move into developing and fractured bones along with invading blood vessels. Dev. Cell, 19, 329-344 (2010)[PubMed]
- Ding, L., Saunders, T. L., Enikolopov, G. et al.: Endothelial and perivascular cells maintain haematopoietic stem cells. Nature, 481, 457-462 (2012)[PubMed]
- Takada, I., Kouzmenko, A. P. & Kato, S.: Wnt and PPARγ signaling in osteoblastogenesis and adipogenesis. Nat. Rev. Rheumatol., 5, 442-447 (2009)[PubMed]
- Bryon, P. A., Gentilhomme, O. & Fiere, D.: [Histomorphometric analysis of bone-marrow adipose density and heterogeneity in myeloid aplasia and dysplasia (author's transl)]. Pathol. Biol. (Paris), 27, 209-213 (1979)[PubMed]
- Maes, C., Coenegrachts, L., Stockmans, I. et al.: Placental growth factor mediates mesenchymal cell development, cartilage turnover, and bone remodeling during fracture repair. J. Clin. Invest., 116, 1230-1242 (2006)[PubMed]
- Grcevic, D., Pejda, S., Matthews, B. G. et al.: In vivo fate mapping identifies mesenchymal progenitor cells. Stem Cells, 30, 187-196 (2012)[PubMed]
著者プロフィール
略歴:2005年 東京薬科大学大学院生命科学研究科にて博士号取得,松本歯科大学総合歯科医学研究所 助手,2011年 米国Albert Einstein College of Medicine博士研究員を経て,松本歯科大学総合歯科医学研究所 講師.
研究テーマ:骨髄の環境および骨代謝.
抱負:未知の骨代謝の制御機構を見い出したい.
Paul S. Frenette
米国Albert Einstein College of MedicineにてProfessor.
研究室URL:http://www.einstein.yu.edu/labs/paul-frenette/
© 2014 溝口利英・Paul S. Frenette Licensed under CC 表示 2.1 日本