エンドサイトーシス経路によるNotchシグナルの温度補償
志水 英之
(英国Manchester大学Faculty of Life Sciences)
email:志水英之
DOI: 10.7875/first.author.2014.080
Compensatory flux changes within an endocytic trafficking network maintain thermal robustness of Notch signaling.
Hideyuki Shimizu, Simon A. Woodcock, Marian B. Wilkin, Barbora Trubenová, Nicholas A.M. Monk, Martin Baron
Cell, 157, 1160-1174 (2014)
発生にかかわるシグナルは温度をはじめとしたさまざまな環境の変化に対し高い堅牢性を示す.たとえば,変温動物であるショウジョウバエのNotchシグナルは,広い温度範囲において一定の機能を維持している.筆者らは,実験的な手法と理論的な手法とを組み合わせることにより,多様なエンドサイトーシス経路によるNotchの活性化とリガンドに依存的なNotchの活性化をあわせたものが,Notchシグナルの温度補償をはたしていることを示した.これは相反するNotchのエンドサイトーシス経路が温度によりバランスを変化させることによるものであった.低温ではNotchシグナルを亢進し高温では抑制するエンドサイトーシス経路のアンサンブルが,リガンドに依存的なNotchシグナルの活性化に備わる温度に対する依存性をおぎなっていた.その結果,正常な発生の起こりうる生理的な温度の範囲が広がることになる.ほかのシグナルにおいても,同様の機構が温度に対する堅牢性に貢献しているのかもしれない.
生物の発生はある程度の内的あるいは外的な差異に影響されず正常に起こり,この概念は堅牢性(robustness)とよばれる1,2).いい換えれば,個々の細胞内シグナルはつねに一定の強度を保つようデザインされていると考えられる.とくに,ショウジョウバエなどの変温動物は広い範囲の温度のもと正常に発生するが,その過程において,温度補償の機構がさまざまなシグナル伝達経路をどのように一定の結果に導くのかについてはほとんど明らかにされていない.
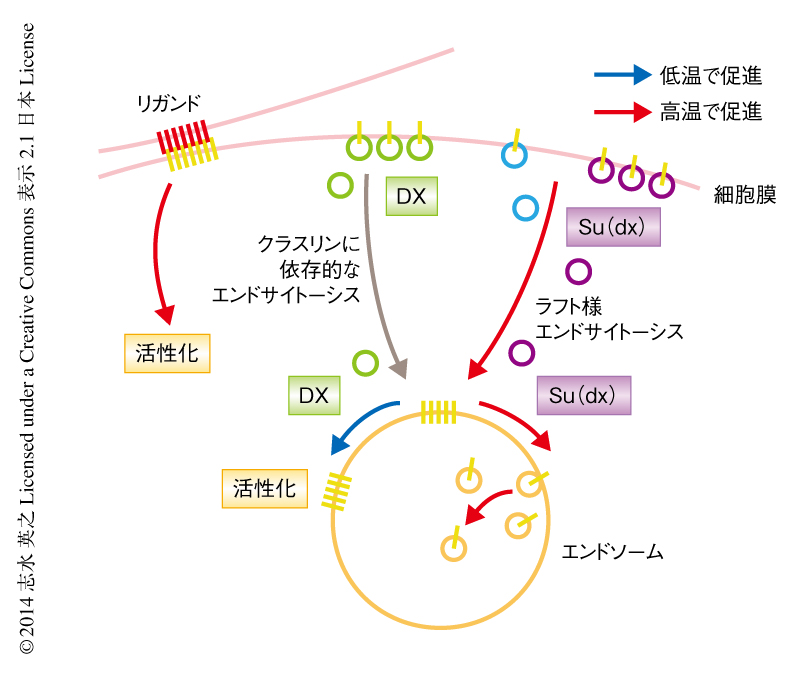
Notchシグナルは発生の過程においてさまざまな細胞運命の決定に機能している3).Delta(Dl)やSerrateなどのリガンドがNotchに結合すると,Notch細胞外ドメイン(Notch extracellular domain:NECD)およびNotch細胞内ドメイン(Notch intracellular domain:NICD)がそれぞれKuzbanian(Kuz)およびPresenilinにより段階的に切り離され,このNICDが活性型のNotchとして核においてSuppressor of HairlessやMastermindと複合体を形成し標的遺伝子の転写を制御する.一方,Deltex(Dx)によるNotchの活性化はリガンドを必要とせずエンドサイトーシスを介して行われ,エンドソームの表面にてNICDがPresenilinによりNICDが切り離されることによりNotchは活性化する.Su(dx) はHECT型ユビキチンリガーゼであり,Notchをエンドソームの内部に導くことによりDxによる活性化をさまたげる4).Notchシグナルは温度の変化に対し高い安定性を示すが5),dx変異体やSu(dx) 変異体など小胞輸送にかかわる変異体ではそれが損なわれることがある6).この研究では,DxとSu(dx) によるNotchのエンドサイトーシス経路の正と負のネットワークが存在し,それぞれが異なる分子機構および温度感受性をもつことを明らかにした.このエンドサイトーシス経路のネットワークがNotchシグナルの温度補償性に貢献し,ショウジョウバエが正常に発生できる温度の範囲を広げていると考えられた.
Notchの活性化はリガンドとの結合,あるいは,エンドソームへのエンドサイトーシスにより起こる.まず,ショウジョウバエの培養細胞であるS2細胞を用いたルシフェラーゼアッセイにより,これらを再現することに成功した.さらに,Dxあるいはリガンドの過剰発現,および,それぞれの結合部位の変異体を用いることにより,これら2つのNotchの活性化の経路は互いに独立したものであることがわかった.
それぞれのNotchの活性化の経路について温度感受性を調べてみたところ,Dxは低温において,リガンドは高温において,より高くシグナルを活性化することがわかった.本来,Notchシグナルは広い温度範囲のもと安定しているが,dx変異体ではNotchの活性化が十分ではなく,その影響は高温でより大きくなる.これは,Su(dx) がNotchシグナル(Dxあるいはリガンドに依存的なものを含め)を高温でより効果的に不活性化するためであることが明らかになり,Su(dx) には高温におけるNotchの過剰な活性化を防止する機能があると考えられた.すなわち,ここで見い出されたものは,異なる温度依存性をもつNotchシグナルの正と負の制御機構であり,それらが組み合わさることにより,さまざまな条件のもとでも一定のNotchシグナルを維持できる温度補償の機構がなりたっていると思われた(図1).
Notchが単独で存在するときにもそのエンドサイトーシスはゆるやかに起こるが,Su(dx) の過剰発現によりNotchのエンドサイトーシスは大きく促進される.これらの速度はともに高温においてより速くなるが,Dxに依存的なNotchのエンドサイトーシスは温度の変化の影響をうけない.DxあるいはSu(dx) によるエンドサイトーシスはどちらも初期エンドソームおよび後期エンドソームを通過するという点は共通している.しかし,DxはNotchをシグナルの活性化の起こるエンドソームの表面に局在させ,一方,Su(dx) はNotchを分解が起こるエンドソームの内部へと誘導する.このDxおよびSu(dx) の機能は温度に依存的であり,それぞれ高温および低温で失われることがわかった.また,Su(dx) の機能はDxに対し優先された.
Su(dx) はHECT型ユビキチンリガーゼであり,NotchはSu(dx) のHECTドメインによりユビキチン化されエンドソームの内部へと誘導される.この機能は温度に依存していたことから,HECTドメインによるNotchのエンドソームの内部への移行は,温度に依存的なもうひとつの現象であることがわかった.HECTドメインが機能しないSu(dx) 変異体はNotchをユビキチン化することができなかった.その結果,Notchはエンドソームの表面にとどまり,逆に,Notchシグナルを活性化した.これが,Su(dx) が低温においてNotchを活性化する理由と思われた.
以上の結果から,DxおよびSu(dx) によるNotchのエンドサイトーシスの経路は互いに異なることが示唆された.RNAi法を用いた解析により,これらのエンドサイトーシスはともにダイナミンに依存的であったが,Dxによるエンドサイトーシス経路のみがクラスリンに依存的であることがわかった(図1).
GPIアンカー型タンパク質はラフトのような膜ドメインのマーカーとして用いられる.25℃において,NotchはSu(dx) によりGPI陽性の膜ドメインにエンドサイトーシスされ,一方,DxはNotchをGPI陰性の膜ドメインに局在させることがわかった.また,DxとSu(dx) を共発現する細胞ではNotchはGPI陽性の膜ドメインにエンドサイトーシスされた.このようなDxあるいはSu(dx) に依存した異なるNotchの局在は翅原基においても観察された.このようなラフト様膜ドメインの機能はコレステロールに依存することが知られている.Dxに依存的なNotchのエンドサイトーシスはコレステロールを必要としなかったが,過剰なコレステロールはDxの機能を阻害した.一方,コレステロールの除去はSu(dx) に依存的なエンドサイトーシスを阻害し,これはコレステロールの添加によりレスキューされた.
Dxの機能とSu(dx) の機能との競合性と温度変化との関連性をより詳細に調べた.25℃ではNotchのエンドサイトーシスは一貫して,Su(dx) によりGPI陽性の膜ドメインへの経路,DxによりGPI陰性の膜ドメインへの経路をとった.DxとSu(dx) を共発現した場合,最初はおもにGPI陰性の膜ドメインへの経路をとったが,そののち,GPI陽性の膜ドメインへの経路に移行することがわかった.このことは,Notchのエンドサイトーシスの経路は途中で転換可能であることを示していた.実際に,DxによるNotchのエンドサイトーシスは,同じエンドソームにおいてGPI陽性の膜ドメインに隣接することがあった.さらに,温度の変化はこのDxの機能とSu(dx) の機能とのバランスに影響し,18℃ではSu(dx) によるNotchのGPI陽性の膜ドメインへの経路への移行はほとんど起こらなかった一方で,29℃ではこの移行はより速く進んだ.すなわち,Dxの機能とSu(dx) の機能が温度に依存して競合し,その結果,Notchの最終的な運命,つまり,エンドソームの表面における活性化あるいは内部における不活性化が決定されると思われた(図1).
Notch単独での活性化とDxに依存的なNotchの活性化とでは逆の温度依存性がみられたことから,異なる活性化の機構の関与が予測された.コレステロールの枯渇はNotch単独での活性化を抑制したが,Dxの機能には影響をあたえず,すなわち,Notch単独での活性化はGPI陽性の膜ドメインへの経路によると考えられた.さらに,リガンドによるNotchの活性化はコレステロールには依存しなかった.
RNAi法によるノックダウン,特異的な阻害剤,ドミナントネガティブ変異体により,それぞれの分子機構を調べた.エンドサイトーシスに関して,Dxに依存的なNotchの活性化にはエンドサイトーシスの初期過程および後期過程に必須のタンパク質が必要とされた.一方,Notch単独での活性化あるいはリガンドによるNotchの活性化には,エンドサイトーシスの初期過程に必須なタンパク質はかかわっていたがエンドサイトーシスの後期過程に必須なタンパク質は必要ではないことがわかった.スフィンゴ糖脂質はラフト様膜ドメインの構成因子である.そこで,スフィンゴ糖脂質合成酵素の関与について調べてみた.その結果,スフィンゴ糖脂質合成酵素はNotch単独の活性化には必要であったが,DxあるいはリガンドによるNotchの活性化には必要ではないことが明らかになった.Kuzの関与については,Dxに依存的なNotchの活性化は必要とせず,Notchでの活性化単独あるいはリガンドによるNotchの活性化には必要であることが示された.このように,3つの経路にはそれぞれ独自の機構が備わっていると思われた(図1).
Notchのエンドサイトーシス経路のネットワークのさらなる可能性を探るため,その数理モデルを確立した.これは,リガンドによるNotchの活性化に,DxおよびSu(dx) によるエンドサイトーシスの効果を組み入れたものになった.おのおののパラメーターは29℃におけるdx変異体およびSu(dx) 変異体の翅での表現型をもとに最適化した.
このNotchシグナルの数理モデルが温度感受性を再現できるかどうか調べてみた.この数理モデルでは,Notchの活性化の3つの経路のバランスの変化による広い温度範囲におけるNotchシグナルの安定性,および,翅におけるdx変異体およびSu(dx) 変異体の表現型とその温度依存性が再現された.また,ある一定の温度以下ではdx変異体における温度依存性が逆転する,また,低温においてはdx単独の変異体よりdxとSu(dx) の二重変異体のほうがNotchシグナルが大きく減少する,といった意外と思える結果も予測され,これらはともにin vivoにおいて証明された.以上のように,このNotchシグナルの数理モデルは,おのおのの温度において表現型や遺伝的な相互作用を予測あるいは説明することが可能であった(図2).
dx遺伝子およびSu(dx) 遺伝子をともに欠損した場合,その結果はエンドソームにおけるNotchの活性化あるいは不活性化の効率しだいであることが予測された.パラメーターを操作することにより,エンドソームにおけるNotchの活性化への寄与が高い場合,中間の場合,低い場合のモデルを検討した.翅にみられたように,dx遺伝子とSu(dx) 遺伝子とが互いに抑制しあうのはNotchの活性化への寄与が中間のモデルのみであった.
Notchの活性化への寄与が低い場合のモデルでは,DxのNotchの活性化への寄与はむしろマイナスになり,dxとSu(dx) の二重変異体はSu(dx) 単独の変異体よりもNotchの活性化が高くなった.そこで,実際にこのような表現型の観察される組織が存在するかどうかを探索し,成虫の脚関節に注目したところ,Su(dx) 単独の変異体あるいはdx単独の変異体ではほぼ正常であった一方,dxとSu(dx) の二重変異体ではNotchの過剰な活性化による異所的な関節の形成がみられた.さらに,これは数理モデルにより予測されたように温度に依存的な表現型であった.脚と翅について比較してみると,脚ではエンドソームにおけるNotchの活性化が限定的であることが示された.
Su(dx) およびDxの機能の多様性について,ほかの組織において検討した.ショウジョウバエの胚の中枢神経系において,Su(dx) 単独の変異体あるいはdx単独の変異体では,それぞれ,弱い神経欠損あるいは神経形成の表現型がみられたが,dxとSu(dx) の二重変異体では非常に強い神経欠損が起こり,これはNotchの活性化への寄与が低い場合のモデルで予測された現象であった.dxの過剰発現により強い神経欠損が起こったこともこれを支持した.胚の正中線の形成におけるNotchシグナルについても調べてみたが,Notchの活性化はdx変異やHOPS変異により温度に依存的に減少した.これがSu(dx) 変異により抑制されなかったことは,Notchの活性化への寄与が高い場合のモデルの予測と一致していた.このように,dxとSu(dx) の二重変異の結果には多様性があり,場合によっては機能が重複することがわかった.
多くのシグナルは細胞膜において生じると理解されているが,エンドサイトーシスを介した別の経路も数多く報告されている.これらにはNotchシグナルにくわえ,EGFシグナル,TGFβシグナル,Wntシグナルなど,多様なシグナルが含まれる7,8).細胞膜においてはより急速なシグナルの活性化が可能である一方,エンドソームは核により近いというそれぞれの利点も議論されているが,複数の活性化の機構が存在する理由はわかっていない.この研究では,2つの機構によるNotchシグナルの温度補償性の確立と,組織や状況によりシグナルを柔軟に変化できる多様性の獲得という,2つの可能性について論じた.エンドサイトーシスは外的あるいは内的な多くの因子を感知し変化することができる.Notchシグナルは温度をはじめとして,栄養状態,脂質の構成,低酸素,老化,細胞密度など多様な因子により影響をうけるが,これらはエンドサイトーシス,あるいは,DxおよびSu(dx) の機能のバランスに作用しているのかもしれない.
今回,高い温度感受性について,ラフト様の膜ドメインの流動性という脂質の性質にもとづくものと,Su(dx) のもつHECTドメインの機能というタンパク質の性質に起因するものの2つの分子機構が示唆された.現在,筆者らは,より詳細な分子機構について研究を進めている.たとえば,Notchは糖鎖の付加,リン酸化,ユビキチン化など多くの翻訳後修飾をうけているが,なかでもとくに,チロシンリン酸化,そして,モノユビキチン化あるいはポリユビキチン化により小胞輸送が変化することがすでに見い出されている.また,Notchの変異によるシグナルの異常はがんを含む多くの疾病の原因となりうるが,そのなかにはNotchのエンドサイトーシスに影響を及ぼす変異も知られている.これらの影響をより詳細に観察し解析するため,現在,ライブイメージング法によるNotchのエンドサイトーシスとシグナル活性化の可視化のプロジェクトが進めている.
略歴:英国Manchester大学Research Associate.
研究テーマ:エンドサイトーシスによるシグナルの制御.
© 2014 志水 英之 Licensed under CC 表示 2.1 日本
(英国Manchester大学Faculty of Life Sciences)
email:志水英之
DOI: 10.7875/first.author.2014.080
Compensatory flux changes within an endocytic trafficking network maintain thermal robustness of Notch signaling.
Hideyuki Shimizu, Simon A. Woodcock, Marian B. Wilkin, Barbora Trubenová, Nicholas A.M. Monk, Martin Baron
Cell, 157, 1160-1174 (2014)
要 約
発生にかかわるシグナルは温度をはじめとしたさまざまな環境の変化に対し高い堅牢性を示す.たとえば,変温動物であるショウジョウバエのNotchシグナルは,広い温度範囲において一定の機能を維持している.筆者らは,実験的な手法と理論的な手法とを組み合わせることにより,多様なエンドサイトーシス経路によるNotchの活性化とリガンドに依存的なNotchの活性化をあわせたものが,Notchシグナルの温度補償をはたしていることを示した.これは相反するNotchのエンドサイトーシス経路が温度によりバランスを変化させることによるものであった.低温ではNotchシグナルを亢進し高温では抑制するエンドサイトーシス経路のアンサンブルが,リガンドに依存的なNotchシグナルの活性化に備わる温度に対する依存性をおぎなっていた.その結果,正常な発生の起こりうる生理的な温度の範囲が広がることになる.ほかのシグナルにおいても,同様の機構が温度に対する堅牢性に貢献しているのかもしれない.
はじめに
生物の発生はある程度の内的あるいは外的な差異に影響されず正常に起こり,この概念は堅牢性(robustness)とよばれる1,2).いい換えれば,個々の細胞内シグナルはつねに一定の強度を保つようデザインされていると考えられる.とくに,ショウジョウバエなどの変温動物は広い範囲の温度のもと正常に発生するが,その過程において,温度補償の機構がさまざまなシグナル伝達経路をどのように一定の結果に導くのかについてはほとんど明らかにされていない.
Notchシグナルは発生の過程においてさまざまな細胞運命の決定に機能している3).Delta(Dl)やSerrateなどのリガンドがNotchに結合すると,Notch細胞外ドメイン(Notch extracellular domain:NECD)およびNotch細胞内ドメイン(Notch intracellular domain:NICD)がそれぞれKuzbanian(Kuz)およびPresenilinにより段階的に切り離され,このNICDが活性型のNotchとして核においてSuppressor of HairlessやMastermindと複合体を形成し標的遺伝子の転写を制御する.一方,Deltex(Dx)によるNotchの活性化はリガンドを必要とせずエンドサイトーシスを介して行われ,エンドソームの表面にてNICDがPresenilinによりNICDが切り離されることによりNotchは活性化する.Su(dx) はHECT型ユビキチンリガーゼであり,Notchをエンドソームの内部に導くことによりDxによる活性化をさまたげる4).Notchシグナルは温度の変化に対し高い安定性を示すが5),dx変異体やSu(dx) 変異体など小胞輸送にかかわる変異体ではそれが損なわれることがある6).この研究では,DxとSu(dx) によるNotchのエンドサイトーシス経路の正と負のネットワークが存在し,それぞれが異なる分子機構および温度感受性をもつことを明らかにした.このエンドサイトーシス経路のネットワークがNotchシグナルの温度補償性に貢献し,ショウジョウバエが正常に発生できる温度の範囲を広げていると考えられた.
1.Notchの活性化における複数のシグナル伝達経路と相反する温度依存性
Notchの活性化はリガンドとの結合,あるいは,エンドソームへのエンドサイトーシスにより起こる.まず,ショウジョウバエの培養細胞であるS2細胞を用いたルシフェラーゼアッセイにより,これらを再現することに成功した.さらに,Dxあるいはリガンドの過剰発現,および,それぞれの結合部位の変異体を用いることにより,これら2つのNotchの活性化の経路は互いに独立したものであることがわかった.
それぞれのNotchの活性化の経路について温度感受性を調べてみたところ,Dxは低温において,リガンドは高温において,より高くシグナルを活性化することがわかった.本来,Notchシグナルは広い温度範囲のもと安定しているが,dx変異体ではNotchの活性化が十分ではなく,その影響は高温でより大きくなる.これは,Su(dx) がNotchシグナル(Dxあるいはリガンドに依存的なものを含め)を高温でより効果的に不活性化するためであることが明らかになり,Su(dx) には高温におけるNotchの過剰な活性化を防止する機能があると考えられた.すなわち,ここで見い出されたものは,異なる温度依存性をもつNotchシグナルの正と負の制御機構であり,それらが組み合わさることにより,さまざまな条件のもとでも一定のNotchシグナルを維持できる温度補償の機構がなりたっていると思われた(図1).
2.DxあるいはSu(dx) によるNotchエンドサイトーシスの異なる温度依存性
Notchが単独で存在するときにもそのエンドサイトーシスはゆるやかに起こるが,Su(dx) の過剰発現によりNotchのエンドサイトーシスは大きく促進される.これらの速度はともに高温においてより速くなるが,Dxに依存的なNotchのエンドサイトーシスは温度の変化の影響をうけない.DxあるいはSu(dx) によるエンドサイトーシスはどちらも初期エンドソームおよび後期エンドソームを通過するという点は共通している.しかし,DxはNotchをシグナルの活性化の起こるエンドソームの表面に局在させ,一方,Su(dx) はNotchを分解が起こるエンドソームの内部へと誘導する.このDxおよびSu(dx) の機能は温度に依存的であり,それぞれ高温および低温で失われることがわかった.また,Su(dx) の機能はDxに対し優先された.
Su(dx) はHECT型ユビキチンリガーゼであり,NotchはSu(dx) のHECTドメインによりユビキチン化されエンドソームの内部へと誘導される.この機能は温度に依存していたことから,HECTドメインによるNotchのエンドソームの内部への移行は,温度に依存的なもうひとつの現象であることがわかった.HECTドメインが機能しないSu(dx) 変異体はNotchをユビキチン化することができなかった.その結果,Notchはエンドソームの表面にとどまり,逆に,Notchシグナルを活性化した.これが,Su(dx) が低温においてNotchを活性化する理由と思われた.
以上の結果から,DxおよびSu(dx) によるNotchのエンドサイトーシスの経路は互いに異なることが示唆された.RNAi法を用いた解析により,これらのエンドサイトーシスはともにダイナミンに依存的であったが,Dxによるエンドサイトーシス経路のみがクラスリンに依存的であることがわかった(図1).
3.DxとSu(dx) によるNotchの2つのエンドサイトーシス経路
GPIアンカー型タンパク質はラフトのような膜ドメインのマーカーとして用いられる.25℃において,NotchはSu(dx) によりGPI陽性の膜ドメインにエンドサイトーシスされ,一方,DxはNotchをGPI陰性の膜ドメインに局在させることがわかった.また,DxとSu(dx) を共発現する細胞ではNotchはGPI陽性の膜ドメインにエンドサイトーシスされた.このようなDxあるいはSu(dx) に依存した異なるNotchの局在は翅原基においても観察された.このようなラフト様膜ドメインの機能はコレステロールに依存することが知られている.Dxに依存的なNotchのエンドサイトーシスはコレステロールを必要としなかったが,過剰なコレステロールはDxの機能を阻害した.一方,コレステロールの除去はSu(dx) に依存的なエンドサイトーシスを阻害し,これはコレステロールの添加によりレスキューされた.
Dxの機能とSu(dx) の機能との競合性と温度変化との関連性をより詳細に調べた.25℃ではNotchのエンドサイトーシスは一貫して,Su(dx) によりGPI陽性の膜ドメインへの経路,DxによりGPI陰性の膜ドメインへの経路をとった.DxとSu(dx) を共発現した場合,最初はおもにGPI陰性の膜ドメインへの経路をとったが,そののち,GPI陽性の膜ドメインへの経路に移行することがわかった.このことは,Notchのエンドサイトーシスの経路は途中で転換可能であることを示していた.実際に,DxによるNotchのエンドサイトーシスは,同じエンドソームにおいてGPI陽性の膜ドメインに隣接することがあった.さらに,温度の変化はこのDxの機能とSu(dx) の機能とのバランスに影響し,18℃ではSu(dx) によるNotchのGPI陽性の膜ドメインへの経路への移行はほとんど起こらなかった一方で,29℃ではこの移行はより速く進んだ.すなわち,Dxの機能とSu(dx) の機能が温度に依存して競合し,その結果,Notchの最終的な運命,つまり,エンドソームの表面における活性化あるいは内部における不活性化が決定されると思われた(図1).
4.Notchの活性化のそれぞれの経路と異なる分子機構
Notch単独での活性化とDxに依存的なNotchの活性化とでは逆の温度依存性がみられたことから,異なる活性化の機構の関与が予測された.コレステロールの枯渇はNotch単独での活性化を抑制したが,Dxの機能には影響をあたえず,すなわち,Notch単独での活性化はGPI陽性の膜ドメインへの経路によると考えられた.さらに,リガンドによるNotchの活性化はコレステロールには依存しなかった.
RNAi法によるノックダウン,特異的な阻害剤,ドミナントネガティブ変異体により,それぞれの分子機構を調べた.エンドサイトーシスに関して,Dxに依存的なNotchの活性化にはエンドサイトーシスの初期過程および後期過程に必須のタンパク質が必要とされた.一方,Notch単独での活性化あるいはリガンドによるNotchの活性化には,エンドサイトーシスの初期過程に必須なタンパク質はかかわっていたがエンドサイトーシスの後期過程に必須なタンパク質は必要ではないことがわかった.スフィンゴ糖脂質はラフト様膜ドメインの構成因子である.そこで,スフィンゴ糖脂質合成酵素の関与について調べてみた.その結果,スフィンゴ糖脂質合成酵素はNotch単独の活性化には必要であったが,DxあるいはリガンドによるNotchの活性化には必要ではないことが明らかになった.Kuzの関与については,Dxに依存的なNotchの活性化は必要とせず,Notchでの活性化単独あるいはリガンドによるNotchの活性化には必要であることが示された.このように,3つの経路にはそれぞれ独自の機構が備わっていると思われた(図1).
5.Notchシグナルの温度補償の数理モデル
Notchのエンドサイトーシス経路のネットワークのさらなる可能性を探るため,その数理モデルを確立した.これは,リガンドによるNotchの活性化に,DxおよびSu(dx) によるエンドサイトーシスの効果を組み入れたものになった.おのおののパラメーターは29℃におけるdx変異体およびSu(dx) 変異体の翅での表現型をもとに最適化した.
このNotchシグナルの数理モデルが温度感受性を再現できるかどうか調べてみた.この数理モデルでは,Notchの活性化の3つの経路のバランスの変化による広い温度範囲におけるNotchシグナルの安定性,および,翅におけるdx変異体およびSu(dx) 変異体の表現型とその温度依存性が再現された.また,ある一定の温度以下ではdx変異体における温度依存性が逆転する,また,低温においてはdx単独の変異体よりdxとSu(dx) の二重変異体のほうがNotchシグナルが大きく減少する,といった意外と思える結果も予測され,これらはともにin vivoにおいて証明された.以上のように,このNotchシグナルの数理モデルは,おのおのの温度において表現型や遺伝的な相互作用を予測あるいは説明することが可能であった(図2).
6.パラメーターの変化により予測されるDxとSu(dx) によるNotchの不活性化
dx遺伝子およびSu(dx) 遺伝子をともに欠損した場合,その結果はエンドソームにおけるNotchの活性化あるいは不活性化の効率しだいであることが予測された.パラメーターを操作することにより,エンドソームにおけるNotchの活性化への寄与が高い場合,中間の場合,低い場合のモデルを検討した.翅にみられたように,dx遺伝子とSu(dx) 遺伝子とが互いに抑制しあうのはNotchの活性化への寄与が中間のモデルのみであった.
Notchの活性化への寄与が低い場合のモデルでは,DxのNotchの活性化への寄与はむしろマイナスになり,dxとSu(dx) の二重変異体はSu(dx) 単独の変異体よりもNotchの活性化が高くなった.そこで,実際にこのような表現型の観察される組織が存在するかどうかを探索し,成虫の脚関節に注目したところ,Su(dx) 単独の変異体あるいはdx単独の変異体ではほぼ正常であった一方,dxとSu(dx) の二重変異体ではNotchの過剰な活性化による異所的な関節の形成がみられた.さらに,これは数理モデルにより予測されたように温度に依存的な表現型であった.脚と翅について比較してみると,脚ではエンドソームにおけるNotchの活性化が限定的であることが示された.
Su(dx) およびDxの機能の多様性について,ほかの組織において検討した.ショウジョウバエの胚の中枢神経系において,Su(dx) 単独の変異体あるいはdx単独の変異体では,それぞれ,弱い神経欠損あるいは神経形成の表現型がみられたが,dxとSu(dx) の二重変異体では非常に強い神経欠損が起こり,これはNotchの活性化への寄与が低い場合のモデルで予測された現象であった.dxの過剰発現により強い神経欠損が起こったこともこれを支持した.胚の正中線の形成におけるNotchシグナルについても調べてみたが,Notchの活性化はdx変異やHOPS変異により温度に依存的に減少した.これがSu(dx) 変異により抑制されなかったことは,Notchの活性化への寄与が高い場合のモデルの予測と一致していた.このように,dxとSu(dx) の二重変異の結果には多様性があり,場合によっては機能が重複することがわかった.
おわりに
多くのシグナルは細胞膜において生じると理解されているが,エンドサイトーシスを介した別の経路も数多く報告されている.これらにはNotchシグナルにくわえ,EGFシグナル,TGFβシグナル,Wntシグナルなど,多様なシグナルが含まれる7,8).細胞膜においてはより急速なシグナルの活性化が可能である一方,エンドソームは核により近いというそれぞれの利点も議論されているが,複数の活性化の機構が存在する理由はわかっていない.この研究では,2つの機構によるNotchシグナルの温度補償性の確立と,組織や状況によりシグナルを柔軟に変化できる多様性の獲得という,2つの可能性について論じた.エンドサイトーシスは外的あるいは内的な多くの因子を感知し変化することができる.Notchシグナルは温度をはじめとして,栄養状態,脂質の構成,低酸素,老化,細胞密度など多様な因子により影響をうけるが,これらはエンドサイトーシス,あるいは,DxおよびSu(dx) の機能のバランスに作用しているのかもしれない.
今回,高い温度感受性について,ラフト様の膜ドメインの流動性という脂質の性質にもとづくものと,Su(dx) のもつHECTドメインの機能というタンパク質の性質に起因するものの2つの分子機構が示唆された.現在,筆者らは,より詳細な分子機構について研究を進めている.たとえば,Notchは糖鎖の付加,リン酸化,ユビキチン化など多くの翻訳後修飾をうけているが,なかでもとくに,チロシンリン酸化,そして,モノユビキチン化あるいはポリユビキチン化により小胞輸送が変化することがすでに見い出されている.また,Notchの変異によるシグナルの異常はがんを含む多くの疾病の原因となりうるが,そのなかにはNotchのエンドサイトーシスに影響を及ぼす変異も知られている.これらの影響をより詳細に観察し解析するため,現在,ライブイメージング法によるNotchのエンドサイトーシスとシグナル活性化の可視化のプロジェクトが進めている.
文 献
- Waddington, C. H.: Canalization of development and genetic assimilation of acquired characters. Nature, 183, 1654-1655 (1959)[PubMed]
- Kitano, H.: Biological robustness. Nat. Rev. Genet., 5, 826-837 (2004)[PubMed]
- Guruharsha, K. G., Kankel, M. W. & Artavanis-Tsakonas, S.: The Notch signalling system: recent insights into the complexity of a conserved pathway. Nat. Rev. Genet., 13, 654-666 (2012)[PubMed]
- Baron, M.: Endocytic routes to Notch activation. Semin. Cell Dev. Biol., 23, 437-442 (2012)[PubMed]
- Mazaleyrat, S. L., Fostier, M., Wilkin, M. B. et al.: Down-regulation of Notch target gene expression by Suppressor of deltex. Dev. Biol., 255, 363-372 (2003)[PubMed]
- Wilkin, M., Tongngok, P., Gensch, N. et al.: Drosophila HOPS and AP-3 complex genes are required for a Deltex-regulated activation of notch in the endosomal trafficking pathway. Dev. Cell, 15, 762-772 (2008)[PubMed]
- Seto, E. S., Bellen, H. J. & Lloyd, T. E.: When cell biology meets development: endocytic regulation of signaling pathways. Genes Dev., 16, 1314-1336 (2002)[PubMed]
- Sorkin, A. & von Zastrow, M.: Endocytosis and signalling: intertwining molecular networks. Nat. Rev. Mol. Cell Biol., 10, 609-622 (2009)[PubMed]
著者プロフィール
略歴:英国Manchester大学Research Associate.
研究テーマ:エンドサイトーシスによるシグナルの制御.
© 2014 志水 英之 Licensed under CC 表示 2.1 日本