細胞表面タンパク質Dscam1のアイソフォーム多様性は軸索の分枝の形成に1細胞のレベルで必要である
木瀬 孔明
(ベルギーVIB Vesalius Research Center,Neuronal Wiring Laboratory)
email:木瀬孔明
DOI: 10.7875/first.author.2014.079
Cell-intrinsic requirement of Dscam1 isoform diversity for axon collateral formation.
Haihuai He, Yoshiaki Kise, Azadeh Izadifar, Olivier Urwyler, Derya Ayaz, Akhila Parthasarthy, Bing Yan, Maria-Luise Erfurth, Dan Dascenco, Dietmar Schmucker
Science, 344, 1182-1186 (2014)
ショウジョウバエの細胞表面タンパク質Dscam1はそのアイソフォーム多様性とホモフィリック相互作用を分子基盤として,神経回路の形成においてニューロンの自己と非自己の識別に必要である.今回,筆者らは,樹状突起の分枝パターンの形成においてDscam1のアイソフォーム多様性は必要ないのに対し,軸索の分枝パターンの形成にはDscam1のアイソフォーム多様性が細胞自律的に必要であることを明らかにした.単一の細胞におけるアイソフォームの発現解析および軸索の成長円錐の形態解析の結果から,Dscam1のアイソフォーム多様性が減少すると軸索におけるDscam1-Dscam1ホモフィリック相互作用の上昇によりDscam1シグナルが異所的に活性化され,軸索の伸長や分枝の形成に必要な成長円錐の正常な形態形成が抑制される,というモデルを提唱した.すなわち,Dscam1のアイソフォーム多様性には軸索の成長円錐におけるDscam1シグナルを適切な強さに保つという,いわば,緩衝材のような役割のあることが示唆された.
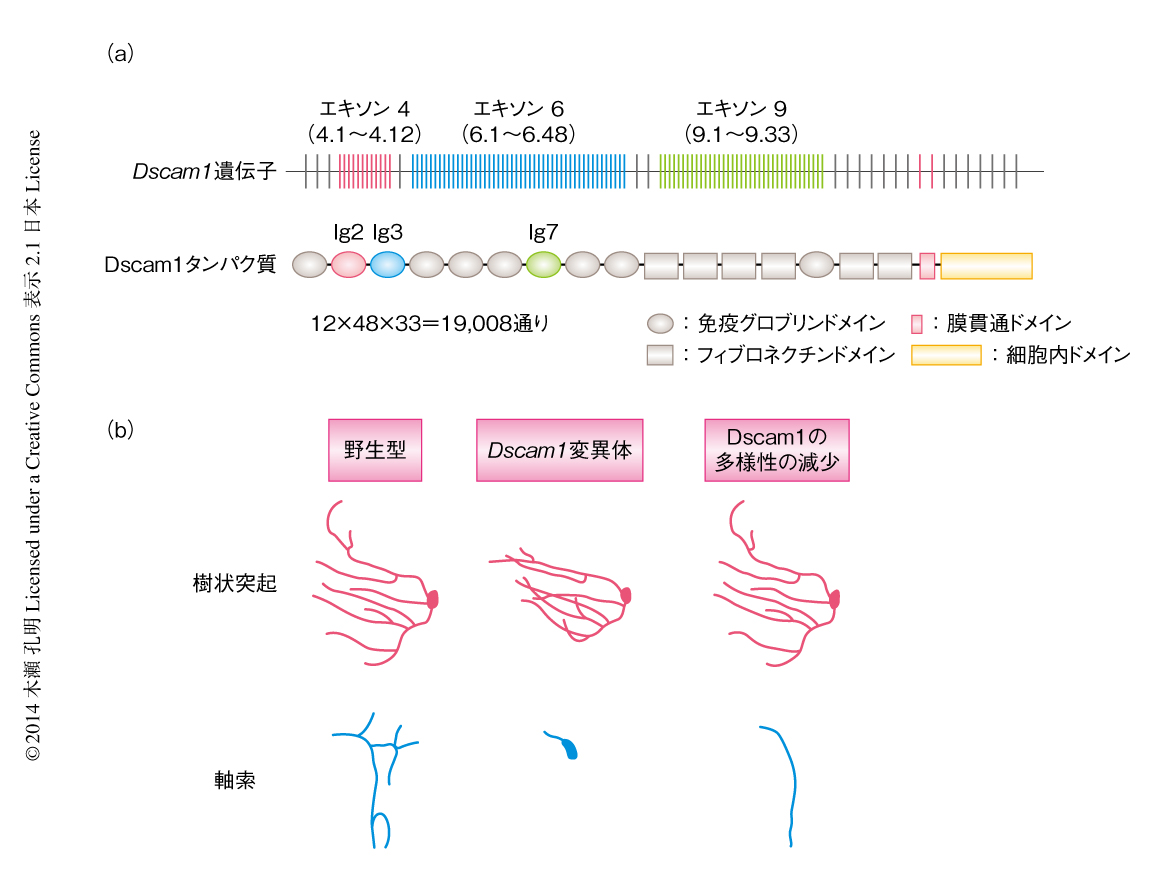
これまで約10年間にわたり,神経回路の形成において基盤となる機構としてニューロンの自己と非自己の識別という概念が確立されてきた1-5).ショウジョウバエの細胞表面タンパク質Dscam1は,mRNAの選択的スプライシングによりおよそ19,000通りもの膨大な数のアイソフォームをつくりだすことができる6)(図1a).個々のニューロンはそれぞれ異なったアイソフォームのセットを発現することにより異なる“分子標識”でラベルされており,自己と非自己の違いが生み出されている.それでは,自己と非自己はどのように識別されているのであろうか.Dscam1のもうひとつの重要な特徴は,同じアイソフォームどうしで厳密にホモフィリックな相互作用を示すことである.さらに,このホモフィリックな相互作用は最終的に軸索あるいは樹状突起における反発シグナルを誘起する.これにより,自己の軸索あるいは樹状突起のあいだには交差が起こらないことが保証されている(自己交差忌避という).一方,非自己どうしではDscam1-Dscam1ホモフィリック相互作用が起こらないため自由な交差が保証されている.
このように,Dscam1のアイソフォーム多様性の役割がニューロンの自己と非自己の識別だけであるならば,ひとつのニューロンにおいてDscam1のアイソフォーム多様性は必要ないことが予想される.実際に,樹状突起の分枝パターンの形成および自己交差忌避にはある1種類のアイソフォームが発現していれば十分であることが示されている7-9).しかしながら,筆者らの研究室において研究を進めている,msニューロンにおける軸索の分枝パターンの形成においては,強制発現実験の結果ではあるものの,1種類のアイソフォームの発現では十分ではないことが報告されていた10).今回,筆者らは,内在性のDscam1のアイソフォーム多様性を細胞種において特異的に(究極的には,1細胞のレベルで)操作することの可能なコンストラクトを作製し,軸索の分枝形成にはDscam1のアイソフォーム多様性が細胞自律的に必要であることを明らかにした.
Dscam1遺伝子のアイソフォーム多様性を操作するため,細菌人工染色体のコンストラクトを作製した.細菌人工染色体を用いた手法は,およそ80 kbもあるDscam1遺伝子のような巨大な遺伝子に修飾や変異を導入するのに非常に有効である11).細胞外ドメインをコードする3つの可変エキソンのうちエキソン6に着目し,エキソン6.1および6.48の直後のイントロン領域にFRT配列を挿入した.これにより,細胞種において特異的にFlp組換え酵素を発現させることにより,エキソン6.2からエキソン6.48の領域を削除してDscam1のアイソフォーム多様性を時空間に特異的に19,008(12×48×33)通りから396(12×1×33)通りにまで減少させることが可能になった.このコンストラクトを第3染色体に挿入したトランスジェニック系統を確立した.Dscam1遺伝子をもたないバックグラウンドにおいてこのコンストラクトによるレスキュー実験を行ったところ,キノコ体,msニューロン,daニューロンといった系において表現型を完全にレスキューすることが確認でき,実際にこのコンストラクトが内在性のDscam1遺伝子と同等のはたらきをもつことが示された.
生殖系列細胞においてFlp組換え酵素を発現させることにより,Dscam1のアイソフォーム多様性が396通りしかないコンストラクトをもつ個体を作製した.このコンストラクトのタンパク質発現量は内在性のDscam1遺伝子と同等であり,さらに,エキソン6.2からエキソン6.48の欠失がエキソン4およびエキソン9の選択的スプライシングのパターンに影響を及ぼさないことも確認された.
Dscam1遺伝子をもたないバックグラウンドにおいてこのコンストラクトをもつ個体(すなわち,すべての細胞においてDscam1のアイソフォーム多様性が396通りしかない)について,msニューロンにおける軸索の分枝パターンを解析したところ,主要な軸索伸長のみがレスキューされ,分枝形成がほぼ阻害されるという強い表現型がみられた(図1b).これまでに,エキソン9の多様性をなくした個体において同様の表現型が報告されていることから5),この表現型はエキソン6に特異的なものではないこともわかった.
野生型のDscam1遺伝子およびDscam1のアイソフォーム多様性を低下させたコンストラクトのコピー数の異なる組合せをもつ個体において,msニューロンにおける軸索の分枝パターンを調べた.すると,2コピーの野生型Dscam1遺伝子をもつバックグラウンドにおいて,アイソフォーム多様性を低下させたコンストラクトのコピー数を1コピー,2コピーと増やすごとに軸索の分枝の数は徐々に減少していき,逆に,1コピーのアイソフォーム多様性を低下させたコンストラクトをもつバックグラウンドにおいて,野生型Dscam1遺伝子のコピー数を増やすごとに軸索の分枝形成の阻害が徐々にレスキューされることがわかった.すなわち,Dscam1のアイソフォーム多様性を低下させたアリルコンストラクトが,その相対的な発現量に比例して軸索の分枝形成を阻害するというドミナントな効果を見い出した.
以上の結果は,Dscam1のアイソフォーム多様性を低下させたコンストラクトの導入により,Dscam1-Dscam1ホモフィリック相互作用の確率が上昇し,それによりひき起こされるDscam1シグナルの強さが上昇することにより軸索の分枝形成が阻害される,というストーリーに合致した.それでは,このDscam1-Dscam1ホモフィリック相互作用の上昇は,過去の報告において自己と非自己の識別モデルにもとづいて解釈されたように5),msニューロンとその周辺のニューロンとのあいだで起こることに起因しているのであろうか,それとも,msニューロンにおける細胞自律的なものに起因しているのであろうか.この問いに答えるため,msニューロンにおいて特異的にDscam1のアイソフォーム多様性を減少させてその表現型を調べた.
左右に1つずつある2組のmsニューロンであるpScニューロンおよびaScニューロン(すなわち,合計で4細胞)において特異的にDscam1のアイソフォーム多様性を減少させたところ,驚くべきことに,個体の全体においてアイソフォーム多様性を減少させたときと同等の強い軸索の分枝形成の阻害がみられた.さらに,pScニューロンのみ(合計で2細胞)において特異的にアイソフォーム多様性を減少させても結果は同様であった.さらに,弱い熱ショックによりFlp組換え酵素の発現を確率的に誘導させることで左右どちらかのpScニューロンのみでアイソフォーム多様性を減少させても,依然として強い軸索の分枝形成の阻害がみられた.さらに,1細胞のpDcニューロンにおいてDscam1の1種類のアイソフォームを野生型のバックグラウンドにおいて強制発現させても同等の表現型がみられた.また,msニューロンの軸索の標的となる領域であるVNCにおいてのみ,Dscam1のアイソフォーム多様性を減少させたところ,軸索の分枝パターンに影響はみられなかった.すなわち,msニューロンとその標的となる領域とのあいだでのDscam1-Dscam1ホモフィリック相互作用は,軸索の分枝形成に必要ではないことが強く示唆された.これらの結果により,Dscam1のアイソフォーム多様性が軸索の分枝形成に細胞自律的に必要であることが明らかになった.
以上の結果から,Dscam1のアイソフォーム多様性を低下させたコンストラクトをもつ個体においてみられる軸索の分枝形成の阻害は,1細胞においてDscam1-Dscam1ホモフィリック相互作用が増大することによりひき起こされることが明らかにされたが,ここでひとつの疑問が生じた.これまでに,1細胞において発現しているDscam1アイソフォームはおよそ50通りまでであろうことが推定されていたからである1,2).すなわち,もし選択的スプライシングがランダムであるならば,理論上,Dscam1のアイソフォーム多様性を低下させたコンストラクトのもつ396通りのアイソフォームのレパートリーからは依然として50通りのアイソフォームを発現させることが可能であり,Dscam1-Dscam1ホモフィリック相互作用の確率は野生型と変わらないのである.そこで,1細胞のmsニューロンにおいて何種類のアイソフォームが発現しているのかを実際に確かめることにした.
単一のpScニューロンをマイクロピペットで単離し,単一細胞RT-PCR法により可変エキソン領域を増幅し塩基配列を解析したところ,野生型のpScニューロンおよびアイソフォーム多様性を低下させたコンストラクトをもつpScニューロンにおいてエキソン4.2およびエキソン4.8が高い頻度で検出された.さらに,筆者らは最近,エキソン9においては選択的スプライシングにバイアスがかかっていることを報告しており12),実際に,発現量の高いとされるエキソン9のバリアントがpScニューロンからも検出された.野生型のpScニューロンにおいて,エキソン6に関してはそのような選択的スプライシングのバイアスを示す結果は得られなかった.以上のことから,Dscam1のアイソフォーム多様性を低下させたコンストラクトをもつmsニューロンにおいては,50通りよりもはるかに少ない種類のアイソフォームが支配的に発現していることが推測され,これによって,Dscam1-Dscam1ホモフィリック相互作用の確率が野生型に比べ上昇していることが示唆された.
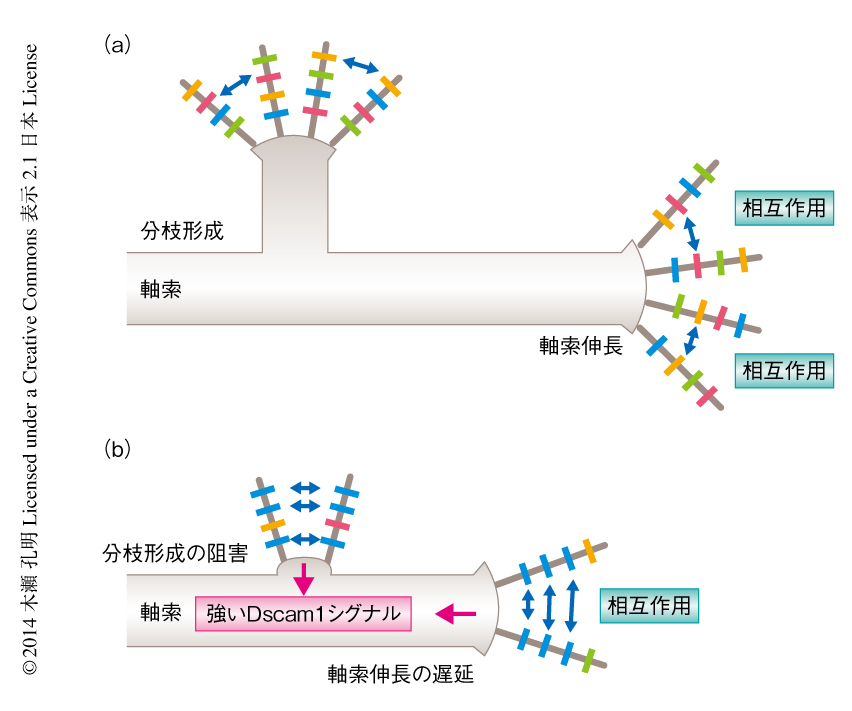
Dscam1のアイソフォーム多様性が失われることにより軸索の分枝形成が阻害される機構について解析した.msニューロンを1細胞のレベルでGFPにより標識して可視化する系を開発し,蛹期のおのおのの発生段階におけるスナップショットを撮ることにより軸索伸長や軸索の分枝形成の過程を観察した.野生型のmsニューロンの軸索は標的となる領域であるVNCに到達すると,成長円錐から多数のフィロポディア状の突起を四方に伸ばした.そののち,これらフィロポディア状の突起は主要な軸索および分枝の伸長の方向にそうようになり,やがて,正常な軸索の分枝パターンが形成された.一方,Dscam1のアイソフォーム多様性を低下させたコンストラクトをもつ(すなわち,Dscam1シグナルの活性が野生型より高い)msニューロンの軸索は野生型に比べ数時間ほど遅れてVNCに到達し,その成長円錐は野生型に比べるとフィロポディア状の突起の数が少なく形態が非常に単純であった.さらに,分枝を形成する部位においてもフィロポディア状の突起の形成はほとんどみられなかった.逆に,Dscam1をRNAi法によりノックダウンした(すなわち,Dscam1の活性を失った)msニューロンの軸索の成長円錐においては,フィロポディア状の突起の数が野生型に比べ増加しており,かつ,それらの伸長はほぼ同一の方向に限定され束状に重なりあうという異常な形態を示し,のちの軸索伸長が阻害されていた.これらの結果は,msニューロンにおけるDscam1シグナルの活性化の状態が軸索の成長円錐の形態形成,さらには,軸索伸長や軸索の分枝形成を制御していることを強く示唆した(図2).
今回,筆者らは,ショウジョウバエの細胞表面タンパク質Dscam1のアイソフォーム多様性が自己と非自己の識別だけでなく,ひとつのニューロンにおける軸索の分枝形成に細胞自律的に必要であるという新たな役割を明らかにした.その分子機構としては,ともにDscam1-Dscam1ホモフィリック相互作用とそれによる反発シグナルにもとづくと考えられた.Dscam1シグナル伝達系の分子機構はいまだ明らかになっておらず,今後,解明すべき主要なテーマである.
細胞表面タンパク質のアイソフォーム多様性による神経回路の形成の制御は,生物種を問わず共通の基本原理であり,近年,哺乳類ではクラスター型プロトカドヘリンがその役割を担うことが明らかになってきている1-3,13,14).クラスター型プロトカドヘリンの多様性にもDscam1と同様に,軸索の分枝形成も含め細胞自律的な役割があるのかについて調べるのも興味深い.Dscam1およびクラスター型プロトカドヘリンの多様性には,まだ知られていないさらなる機能が秘められているかもしれず,今後の研究の展開が楽しみである.
略歴:2009年 東京大学大学院医学系研究科 修了,同年 米国Harvard Medical School博士研究員を経て,同年よりベルギーLeuven大学 博士研究員.
研究テーマ:ショウジョウバエにおけるDscam1による神経回路の形成の機構.
抱負:神経回路の形成の基本原理および分子機構を,これまでに培った生化学および遺伝学を用いて明らかにしていきたい.将来的には,記憶,学習,心といった神経回路が生み出す高次機能についての研究にも興味があります.
© 2014 木瀬 孔明 Licensed under CC 表示 2.1 日本
(ベルギーVIB Vesalius Research Center,Neuronal Wiring Laboratory)
email:木瀬孔明
DOI: 10.7875/first.author.2014.079
Cell-intrinsic requirement of Dscam1 isoform diversity for axon collateral formation.
Haihuai He, Yoshiaki Kise, Azadeh Izadifar, Olivier Urwyler, Derya Ayaz, Akhila Parthasarthy, Bing Yan, Maria-Luise Erfurth, Dan Dascenco, Dietmar Schmucker
Science, 344, 1182-1186 (2014)
要 約
ショウジョウバエの細胞表面タンパク質Dscam1はそのアイソフォーム多様性とホモフィリック相互作用を分子基盤として,神経回路の形成においてニューロンの自己と非自己の識別に必要である.今回,筆者らは,樹状突起の分枝パターンの形成においてDscam1のアイソフォーム多様性は必要ないのに対し,軸索の分枝パターンの形成にはDscam1のアイソフォーム多様性が細胞自律的に必要であることを明らかにした.単一の細胞におけるアイソフォームの発現解析および軸索の成長円錐の形態解析の結果から,Dscam1のアイソフォーム多様性が減少すると軸索におけるDscam1-Dscam1ホモフィリック相互作用の上昇によりDscam1シグナルが異所的に活性化され,軸索の伸長や分枝の形成に必要な成長円錐の正常な形態形成が抑制される,というモデルを提唱した.すなわち,Dscam1のアイソフォーム多様性には軸索の成長円錐におけるDscam1シグナルを適切な強さに保つという,いわば,緩衝材のような役割のあることが示唆された.
はじめに
これまで約10年間にわたり,神経回路の形成において基盤となる機構としてニューロンの自己と非自己の識別という概念が確立されてきた1-5).ショウジョウバエの細胞表面タンパク質Dscam1は,mRNAの選択的スプライシングによりおよそ19,000通りもの膨大な数のアイソフォームをつくりだすことができる6)(図1a).個々のニューロンはそれぞれ異なったアイソフォームのセットを発現することにより異なる“分子標識”でラベルされており,自己と非自己の違いが生み出されている.それでは,自己と非自己はどのように識別されているのであろうか.Dscam1のもうひとつの重要な特徴は,同じアイソフォームどうしで厳密にホモフィリックな相互作用を示すことである.さらに,このホモフィリックな相互作用は最終的に軸索あるいは樹状突起における反発シグナルを誘起する.これにより,自己の軸索あるいは樹状突起のあいだには交差が起こらないことが保証されている(自己交差忌避という).一方,非自己どうしではDscam1-Dscam1ホモフィリック相互作用が起こらないため自由な交差が保証されている.
このように,Dscam1のアイソフォーム多様性の役割がニューロンの自己と非自己の識別だけであるならば,ひとつのニューロンにおいてDscam1のアイソフォーム多様性は必要ないことが予想される.実際に,樹状突起の分枝パターンの形成および自己交差忌避にはある1種類のアイソフォームが発現していれば十分であることが示されている7-9).しかしながら,筆者らの研究室において研究を進めている,msニューロンにおける軸索の分枝パターンの形成においては,強制発現実験の結果ではあるものの,1種類のアイソフォームの発現では十分ではないことが報告されていた10).今回,筆者らは,内在性のDscam1のアイソフォーム多様性を細胞種において特異的に(究極的には,1細胞のレベルで)操作することの可能なコンストラクトを作製し,軸索の分枝形成にはDscam1のアイソフォーム多様性が細胞自律的に必要であることを明らかにした.
1.Dscam1のアイソフォーム多様性を時空間的に操作することが可能なコンストラクトの作製
Dscam1遺伝子のアイソフォーム多様性を操作するため,細菌人工染色体のコンストラクトを作製した.細菌人工染色体を用いた手法は,およそ80 kbもあるDscam1遺伝子のような巨大な遺伝子に修飾や変異を導入するのに非常に有効である11).細胞外ドメインをコードする3つの可変エキソンのうちエキソン6に着目し,エキソン6.1および6.48の直後のイントロン領域にFRT配列を挿入した.これにより,細胞種において特異的にFlp組換え酵素を発現させることにより,エキソン6.2からエキソン6.48の領域を削除してDscam1のアイソフォーム多様性を時空間に特異的に19,008(12×48×33)通りから396(12×1×33)通りにまで減少させることが可能になった.このコンストラクトを第3染色体に挿入したトランスジェニック系統を確立した.Dscam1遺伝子をもたないバックグラウンドにおいてこのコンストラクトによるレスキュー実験を行ったところ,キノコ体,msニューロン,daニューロンといった系において表現型を完全にレスキューすることが確認でき,実際にこのコンストラクトが内在性のDscam1遺伝子と同等のはたらきをもつことが示された.
2.個体の全体でDscam1のアイソフォーム多様性を減少させるとmsニューロンにおける軸索の分枝形成が阻害される
生殖系列細胞においてFlp組換え酵素を発現させることにより,Dscam1のアイソフォーム多様性が396通りしかないコンストラクトをもつ個体を作製した.このコンストラクトのタンパク質発現量は内在性のDscam1遺伝子と同等であり,さらに,エキソン6.2からエキソン6.48の欠失がエキソン4およびエキソン9の選択的スプライシングのパターンに影響を及ぼさないことも確認された.
Dscam1遺伝子をもたないバックグラウンドにおいてこのコンストラクトをもつ個体(すなわち,すべての細胞においてDscam1のアイソフォーム多様性が396通りしかない)について,msニューロンにおける軸索の分枝パターンを解析したところ,主要な軸索伸長のみがレスキューされ,分枝形成がほぼ阻害されるという強い表現型がみられた(図1b).これまでに,エキソン9の多様性をなくした個体において同様の表現型が報告されていることから5),この表現型はエキソン6に特異的なものではないこともわかった.
野生型のDscam1遺伝子およびDscam1のアイソフォーム多様性を低下させたコンストラクトのコピー数の異なる組合せをもつ個体において,msニューロンにおける軸索の分枝パターンを調べた.すると,2コピーの野生型Dscam1遺伝子をもつバックグラウンドにおいて,アイソフォーム多様性を低下させたコンストラクトのコピー数を1コピー,2コピーと増やすごとに軸索の分枝の数は徐々に減少していき,逆に,1コピーのアイソフォーム多様性を低下させたコンストラクトをもつバックグラウンドにおいて,野生型Dscam1遺伝子のコピー数を増やすごとに軸索の分枝形成の阻害が徐々にレスキューされることがわかった.すなわち,Dscam1のアイソフォーム多様性を低下させたアリルコンストラクトが,その相対的な発現量に比例して軸索の分枝形成を阻害するというドミナントな効果を見い出した.
3.Dscam1のアイソフォーム多様性の減少による軸索の分枝形成の阻害は細胞自律的な効果である
以上の結果は,Dscam1のアイソフォーム多様性を低下させたコンストラクトの導入により,Dscam1-Dscam1ホモフィリック相互作用の確率が上昇し,それによりひき起こされるDscam1シグナルの強さが上昇することにより軸索の分枝形成が阻害される,というストーリーに合致した.それでは,このDscam1-Dscam1ホモフィリック相互作用の上昇は,過去の報告において自己と非自己の識別モデルにもとづいて解釈されたように5),msニューロンとその周辺のニューロンとのあいだで起こることに起因しているのであろうか,それとも,msニューロンにおける細胞自律的なものに起因しているのであろうか.この問いに答えるため,msニューロンにおいて特異的にDscam1のアイソフォーム多様性を減少させてその表現型を調べた.
左右に1つずつある2組のmsニューロンであるpScニューロンおよびaScニューロン(すなわち,合計で4細胞)において特異的にDscam1のアイソフォーム多様性を減少させたところ,驚くべきことに,個体の全体においてアイソフォーム多様性を減少させたときと同等の強い軸索の分枝形成の阻害がみられた.さらに,pScニューロンのみ(合計で2細胞)において特異的にアイソフォーム多様性を減少させても結果は同様であった.さらに,弱い熱ショックによりFlp組換え酵素の発現を確率的に誘導させることで左右どちらかのpScニューロンのみでアイソフォーム多様性を減少させても,依然として強い軸索の分枝形成の阻害がみられた.さらに,1細胞のpDcニューロンにおいてDscam1の1種類のアイソフォームを野生型のバックグラウンドにおいて強制発現させても同等の表現型がみられた.また,msニューロンの軸索の標的となる領域であるVNCにおいてのみ,Dscam1のアイソフォーム多様性を減少させたところ,軸索の分枝パターンに影響はみられなかった.すなわち,msニューロンとその標的となる領域とのあいだでのDscam1-Dscam1ホモフィリック相互作用は,軸索の分枝形成に必要ではないことが強く示唆された.これらの結果により,Dscam1のアイソフォーム多様性が軸索の分枝形成に細胞自律的に必要であることが明らかになった.
4.msニューロンにおけるDscam1アイソフォームの発現プロファイリング
以上の結果から,Dscam1のアイソフォーム多様性を低下させたコンストラクトをもつ個体においてみられる軸索の分枝形成の阻害は,1細胞においてDscam1-Dscam1ホモフィリック相互作用が増大することによりひき起こされることが明らかにされたが,ここでひとつの疑問が生じた.これまでに,1細胞において発現しているDscam1アイソフォームはおよそ50通りまでであろうことが推定されていたからである1,2).すなわち,もし選択的スプライシングがランダムであるならば,理論上,Dscam1のアイソフォーム多様性を低下させたコンストラクトのもつ396通りのアイソフォームのレパートリーからは依然として50通りのアイソフォームを発現させることが可能であり,Dscam1-Dscam1ホモフィリック相互作用の確率は野生型と変わらないのである.そこで,1細胞のmsニューロンにおいて何種類のアイソフォームが発現しているのかを実際に確かめることにした.
単一のpScニューロンをマイクロピペットで単離し,単一細胞RT-PCR法により可変エキソン領域を増幅し塩基配列を解析したところ,野生型のpScニューロンおよびアイソフォーム多様性を低下させたコンストラクトをもつpScニューロンにおいてエキソン4.2およびエキソン4.8が高い頻度で検出された.さらに,筆者らは最近,エキソン9においては選択的スプライシングにバイアスがかかっていることを報告しており12),実際に,発現量の高いとされるエキソン9のバリアントがpScニューロンからも検出された.野生型のpScニューロンにおいて,エキソン6に関してはそのような選択的スプライシングのバイアスを示す結果は得られなかった.以上のことから,Dscam1のアイソフォーム多様性を低下させたコンストラクトをもつmsニューロンにおいては,50通りよりもはるかに少ない種類のアイソフォームが支配的に発現していることが推測され,これによって,Dscam1-Dscam1ホモフィリック相互作用の確率が野生型に比べ上昇していることが示唆された.
5.Dscam1のアイソフォーム多様性は軸索の成長円錐の正常な形態形成に必要である
Dscam1のアイソフォーム多様性が失われることにより軸索の分枝形成が阻害される機構について解析した.msニューロンを1細胞のレベルでGFPにより標識して可視化する系を開発し,蛹期のおのおのの発生段階におけるスナップショットを撮ることにより軸索伸長や軸索の分枝形成の過程を観察した.野生型のmsニューロンの軸索は標的となる領域であるVNCに到達すると,成長円錐から多数のフィロポディア状の突起を四方に伸ばした.そののち,これらフィロポディア状の突起は主要な軸索および分枝の伸長の方向にそうようになり,やがて,正常な軸索の分枝パターンが形成された.一方,Dscam1のアイソフォーム多様性を低下させたコンストラクトをもつ(すなわち,Dscam1シグナルの活性が野生型より高い)msニューロンの軸索は野生型に比べ数時間ほど遅れてVNCに到達し,その成長円錐は野生型に比べるとフィロポディア状の突起の数が少なく形態が非常に単純であった.さらに,分枝を形成する部位においてもフィロポディア状の突起の形成はほとんどみられなかった.逆に,Dscam1をRNAi法によりノックダウンした(すなわち,Dscam1の活性を失った)msニューロンの軸索の成長円錐においては,フィロポディア状の突起の数が野生型に比べ増加しており,かつ,それらの伸長はほぼ同一の方向に限定され束状に重なりあうという異常な形態を示し,のちの軸索伸長が阻害されていた.これらの結果は,msニューロンにおけるDscam1シグナルの活性化の状態が軸索の成長円錐の形態形成,さらには,軸索伸長や軸索の分枝形成を制御していることを強く示唆した(図2).
おわりに
今回,筆者らは,ショウジョウバエの細胞表面タンパク質Dscam1のアイソフォーム多様性が自己と非自己の識別だけでなく,ひとつのニューロンにおける軸索の分枝形成に細胞自律的に必要であるという新たな役割を明らかにした.その分子機構としては,ともにDscam1-Dscam1ホモフィリック相互作用とそれによる反発シグナルにもとづくと考えられた.Dscam1シグナル伝達系の分子機構はいまだ明らかになっておらず,今後,解明すべき主要なテーマである.
細胞表面タンパク質のアイソフォーム多様性による神経回路の形成の制御は,生物種を問わず共通の基本原理であり,近年,哺乳類ではクラスター型プロトカドヘリンがその役割を担うことが明らかになってきている1-3,13,14).クラスター型プロトカドヘリンの多様性にもDscam1と同様に,軸索の分枝形成も含め細胞自律的な役割があるのかについて調べるのも興味深い.Dscam1およびクラスター型プロトカドヘリンの多様性には,まだ知られていないさらなる機能が秘められているかもしれず,今後の研究の展開が楽しみである.
文 献
- Kise, Y. & Schmucker, D.: Role of self-avoidance in neuronal wiring. Curr. Opin. Neurobiol., 23, 983-989 (2013)[PubMed]
- Zipursky, S. L. & Grueber, W. B.: The molecular mechanism of self-avoidance. Annu. Rev. Neurosci., 36, 547-568 (2013)[PubMed]
- Zipursky, S. L. & Sanes, J. R.: Chemoaffinity revisited: Dscams, protocadherins, and neural circuit assembly. Cell, 143, 343-353 (2010)[PubMed]
- Hattori, D., Demir, E., Kim, H. W. et al.: Dscam diversity is essential for neuronal wiring and self-recognition. Nature, 449, 223-227 (2007)[PubMed]
- Hattori, D., Chen, Y., Matthews, B. J. et al.: Robust discrimination between self and non-self neurites requires thousands of Dscam1 isoforms. Nature, 461, 644-648 (2009)[PubMed]
- Schmucker, D., Clemens, J. C., Shu, H. et al.: Drosophila Dscam is an axon guidance receptor exhibiting extraordinary molecular diversity. Cell, 101, 671-684 (2000)[PubMed]
- Hughes, M. E., Bortnick, R., Tsubouchi, A. et al.: Homophilic Dscam interactions control complex dendrite morphogenesis. Neuron, 54, 417-427 (2007)[PubMed]
- Matthews, B. J., Kim, M. E., Flanagan, J. J. et al.: Dendrite self-avoidance is controlled by Dscam. Cell, 129, 593-604 (2007)[PubMed]
- Soba, P., Zhu, S., Emoto, K. et al.: Drosophila sensory neurons require Dscam for dendritic self-avoidance and proper dendritic field organization. Neuron, 54, 403-416 (2007)[PubMed]
- Chen, B. E., Kondo, M., Garnier, A. et al.: The molecular diversity of Dscam is functionally required for neuronal wiring specificity in Drosophila. Cell, 125, 607-620 (2006)[PubMed]
- Venken, K. J., He, Y., Hoskins, R. A. et al.: P[acman]: a BAC transgenic platform for targeted insertion of large DNA fragments in D. melanogaster. Science, 314, 1747-1751 (2006)[PubMed]
- Sun, W., You, X., Gogol-Doring, A. et al.: Ultra-deep profiling of alternatively spliced Drosophila Dscam isoforms by circularization-assisted multi-segment sequencing. EMBO J., 32, 2029-2038 (2013)[PubMed]
- Lefebvre, J. L., Kostadinov, D., Chen, W. V., et al.: Protocadherins mediate dendritic self-avoidance in the mammalian nervous system. Nature, 488, 517-521 (2012)[PubMed]
- Schreiner, D. & Weiner, J. A.: Combinatorial homophilic interaction between γ-protocadherin multimers greatly expands the molecular diversity of cell adhesion. Proc. Natl. Acad. Sci. USA, 107, 14893-14898 (2010)[PubMed]
著者プロフィール
略歴:2009年 東京大学大学院医学系研究科 修了,同年 米国Harvard Medical School博士研究員を経て,同年よりベルギーLeuven大学 博士研究員.
研究テーマ:ショウジョウバエにおけるDscam1による神経回路の形成の機構.
抱負:神経回路の形成の基本原理および分子機構を,これまでに培った生化学および遺伝学を用いて明らかにしていきたい.将来的には,記憶,学習,心といった神経回路が生み出す高次機能についての研究にも興味があります.
© 2014 木瀬 孔明 Licensed under CC 表示 2.1 日本