気道性アレルギー炎症における好塩基球およびナチュラルヘルパー細胞の機能の制御
本村泰隆・久保允人
(東京理科大学生命医科学研究所 分子病態学研究部門)
email:本村泰隆,久保允人
DOI: 10.7875/first.author.2014.077
Basophil-derived interleukin-4 controls the function of natural helper cells, a member of ILC2s, in lung inflammation.
Yasutaka Motomura, Hideaki Morita, Kazuyo Moro, Susumu Nakae, David Artis, Takaho A. Endo, Yoko Kuroki, Osamu Ohara, Shigeo Koyasu, Masato Kubo
Immunity, 40, 758-771 (2014)
好塩基球は白血球の全体の0.5%しか存在しない自然免疫細胞であり,2型サイトカインを産生することによりアレルギー炎症に関与すると考えられてきた.しかしながら,アレルギーの病態における好塩基球の機能については不明な点が多い.この研究では,ぜんそくなどのアレルゲンであるイエダニや植物に由来するシステインプロテアーゼによりひき起こされる肺アレルギー炎症に焦点をあて,好塩基球の重要性を明らかにした.好塩基球を欠失したマウス,および,好塩基球において特異的にインターロイキン4の産生を抑制したマウスにおいて,システインプロテアーゼにより誘導されるアレルギー肺炎症は顕著に反応が抑制される.好塩基球に由来するインターロイキン4は,自然リンパ球であるナチュラルヘルパー細胞にはたらいてインターロイキン5,インターロイキン9,インターロイキン13,eotaxinの産生を誘導することにより,気道への好酸球の集積やムチンの産生を制御していた.これらの結果から,システインプロテアーゼによりひき起こされるアレルギー性肺炎症は,好塩基球から産生されるインターロイキン4がナチュラルヘルパー細胞を活性化することにより制御されていることが明らかにされ,ぜんそくなどの気道の炎症における好塩基球の新しい側面が示された.
気管支ぜんそくや花粉症などのI型アレルギーはB細胞から産生される免疫グロブリンEによりひき起こされ,免疫グロブリンEはマスト細胞や好塩基球のもつ受容体に結合することによりアレルゲンに特異的にアレルギー反応を誘導すると考えられてきた1).この免疫グロブリンEの産生はT細胞から産生される2型サイトカインを必要とする.ところが,マスト細胞やT細胞だけでなく,好塩基球や自然リンパ球による免疫反応系の存在が明らかになり,これら自然免疫系の細胞に注目があつまっている.さらに,アレルギーはT細胞や免疫グロブリンEを介した反応系が存在しなくても起こりうることが知られるようになってきた2,3).たとえば,アレルゲンとして知られるイエダニや植物に共通して含まれるシステインプロテアーゼは,気道上皮のバリア機能を破壊することにより,細胞に蓄積される損傷関連分子パターン(damage-associated molecular pattern:DAMP)の放出を誘導する.インターロイキン33は上皮系の細胞に発現する損傷関連分子パターンとしてはたらくサイトカインであり,近年,見い出された新規の自然リンパ球であるナチュラルヘルパー細胞はインターロイキン33に対する受容体を発現している.そのため,ナチュラルヘルパー細胞はインターロイキン33に反応して2型サイトカインであるインターロイキン5およびインターロイキン13を産生し,好酸球の浸潤や杯細胞の過形成およびムチンの産生を誘導すると考えられている4).
従来から,細胞の表面に免疫グロブリンE受容体を発現する好塩基球やマスト細胞は,免疫グロブリンEにアレルゲンが結合することにより2型サイトカインを産生することでアレルギーの病態に重要な役割を担うと考えられている5).ところが,これらの細胞は免疫グロブリンEやアレルゲンを介さずとも,インターロイキン33やTSLPなどさまざまなサイトカインによりアレルギー炎症にかかわる2型サイトカインを産生することができる6).そこで,筆者らは,この免疫グロブリンEに依存しないアレルギー炎症における好塩基球およびマスト細胞の役割に焦点をあて,好塩基球あるいはマスト細胞の欠損を誘導できる系を用いて,システインプロテアーゼにより誘導されるアレルギー炎症における,これまで知られていなかった好塩基球の役割を明らかにした.
筆者らは,インターロイキン4の産生において細胞に特異的な発現を制御する遺伝子制御領域(エンハンサー)の存在を明らかにしてきた.その一連の解析から,好塩基球において特異的にはたらくエンハンサー領域として3’ UTR,および,マスト細胞において特異的にはたらくエンハンサー領域としてHS-2を同定した7).これらのエンハンサーの制御のもとジフテリア毒素受容体を発現するトランスジェニックマウスを作製することにより,ジフテリア毒素に依存して好塩基球あるいはマスト細胞を除去できる系を構築した8).これらの系を用いて,システインプロテアーゼであるパパインの点鼻投与により誘導されるアレルギー肺炎症について解析したところ,マスト細胞を除去したマウスでは野生型のマウスと同様に好酸球の浸潤およびムチンの産生が観察されたのに対し,好塩基球を除去したマウスではこれらの炎症の所見が顕著に抑制されていた.一方,この炎症の抑制は野生型マウスから単離した肺に由来する好塩基球を移入することにより回復したことから,システインプロテアーゼにより誘導されるアレルギー炎症において好塩基球は重要な存在であることが明らかになった.
これまでに,システインプロテアーゼによるアレルギー性炎症におけるインターロイキン4の重要性はノックアウトマウスを用いた解析により証明されている9).そこで,好塩基球から産生されるインターロイキン4の重要性を検討するため,さきに述べた好塩基球において特異的にはたらくエンハンサーである3’ UTRを欠損したマウスを作製し,肺炎症の系においてインターロイキン4の役割について解析した.3’ UTRを欠損したマウスでは好塩基球からのインターロイキン4の産生が選択的に低下していた.システインプロテアーゼであるパパインにより誘導される肺への好酸球の浸潤およびムチンの産生は,3’ UTRを欠損したマウスにおいて顕著に抑制されていた.また,この抑制はインターロイキン4を正常なレベルで産生する好塩基球を移入することにより回復したことから,好塩基球から産生されるインターロイキン4がシステインプロテアーゼにより誘導されるアレルギー肺炎症を制御していることが明らかになった.
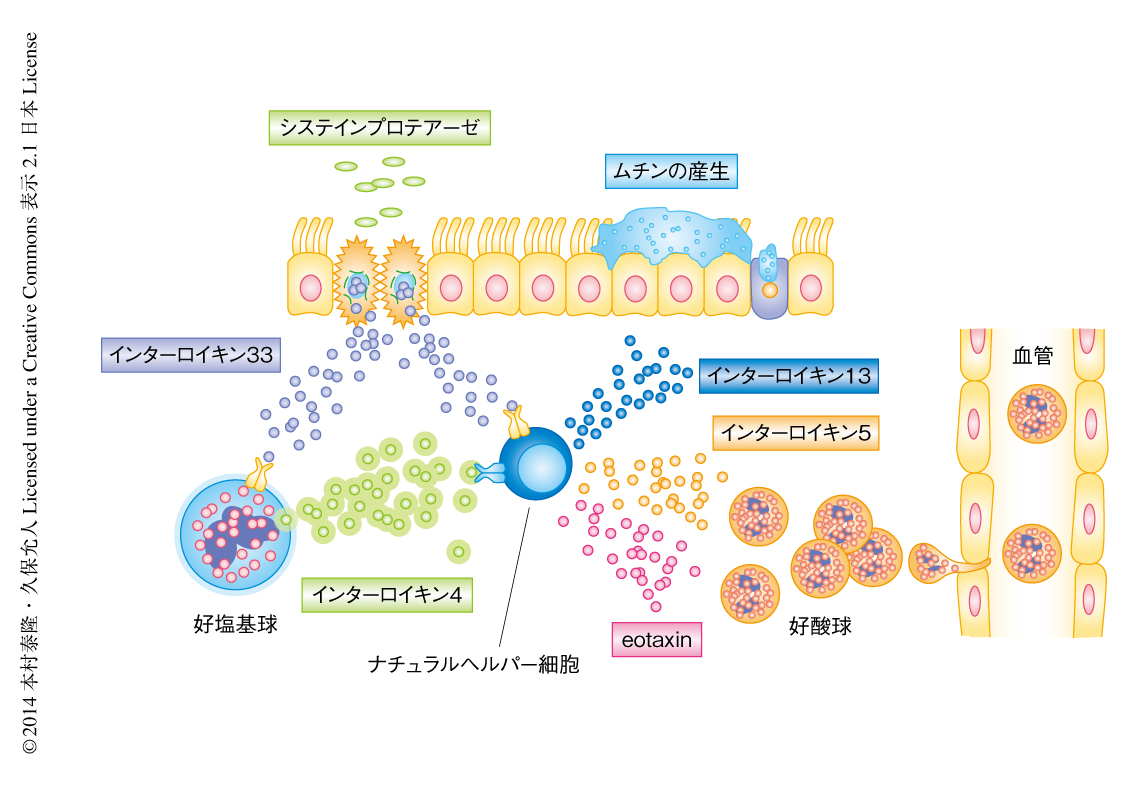
肺に存在する自然免疫系の免疫細胞における遺伝子発現の解析から,ナチュラルヘルパー細胞はインターロイキン4に対する受容体を高く発現していることが明らかにされた.このナチュラルヘルパー細胞はインターロイキン4の存在のもと,好酸球の遊走やムチンの産生を制御するサイトカインであるインターロイキン9およびインターロイキン13,好塩基球の遊走を制御するケモカインeotaxinの産生が強く誘導されていた.また,好酸球の浸潤を制御するインターロイキン5の産生は,インターロイキン33の刺激にインターロイキン4がくわわることにより顕著に促進された.この結果,インターロイキン4はときには単独で,ときにはインターロイキン33と協調的に,ナチュラルヘルパー細胞の機能を制御しうることが明らかになった(図1).
現代社会においてアレルギー疾患は3人に1人が罹患する国民病となっている.アレルギーは日常生活に支障をきたすほどの影響のでることもあり,生活環境を見直す必要が生じるなど,非常に大きな社会問題をひき起こしている.これまで,アレルギーの発症の中心として考えられてきたT細胞や免疫グロブリンEを必要としない,システインプロテアーゼなどのタンパク質分解酵素によりひき起こされるアレルギーの発症機構が解明されつつある.この研究により,システインプロテアーゼによりひき起こされるぜんそくの発症にナチュラルヘルパー細胞と好塩基球との相互作用が関与していることが明らかになった.また同時に,アレルギーの発症にはさまざまな免疫細胞による複雑なネットワークの関与していることが想定される.今後,このネットワークを標的とした新しい視点からのアレルギー治療法の開発や,さまざまなアレルギーの原因や症状に適合した治療法の構築が期待される.
略歴:2010年 東京医科歯科大学大学院生命情報科学教育部博士課程 修了,同年 東京理科大学生命科学研究所 ポストドクトラル研究員を経て,2013年より理化学研究所統合生命医科学研究センター 特別研究員.
研究テーマ:ナチュラルヘルパー細胞の機能.
久保 允人(Masato Kubo)
東京理科大学生命科学研究所 教授,理化学研究所統合生命医科学研究センター チームリーダー.
研究室URL:http://www.rs.noda.tus.ac.jp/~ribsjm/kubolab/
© 2014 本村泰隆・久保允人 Licensed under CC 表示 2.1 日本
(東京理科大学生命医科学研究所 分子病態学研究部門)
email:本村泰隆,久保允人
DOI: 10.7875/first.author.2014.077
Basophil-derived interleukin-4 controls the function of natural helper cells, a member of ILC2s, in lung inflammation.
Yasutaka Motomura, Hideaki Morita, Kazuyo Moro, Susumu Nakae, David Artis, Takaho A. Endo, Yoko Kuroki, Osamu Ohara, Shigeo Koyasu, Masato Kubo
Immunity, 40, 758-771 (2014)
要 約
好塩基球は白血球の全体の0.5%しか存在しない自然免疫細胞であり,2型サイトカインを産生することによりアレルギー炎症に関与すると考えられてきた.しかしながら,アレルギーの病態における好塩基球の機能については不明な点が多い.この研究では,ぜんそくなどのアレルゲンであるイエダニや植物に由来するシステインプロテアーゼによりひき起こされる肺アレルギー炎症に焦点をあて,好塩基球の重要性を明らかにした.好塩基球を欠失したマウス,および,好塩基球において特異的にインターロイキン4の産生を抑制したマウスにおいて,システインプロテアーゼにより誘導されるアレルギー肺炎症は顕著に反応が抑制される.好塩基球に由来するインターロイキン4は,自然リンパ球であるナチュラルヘルパー細胞にはたらいてインターロイキン5,インターロイキン9,インターロイキン13,eotaxinの産生を誘導することにより,気道への好酸球の集積やムチンの産生を制御していた.これらの結果から,システインプロテアーゼによりひき起こされるアレルギー性肺炎症は,好塩基球から産生されるインターロイキン4がナチュラルヘルパー細胞を活性化することにより制御されていることが明らかにされ,ぜんそくなどの気道の炎症における好塩基球の新しい側面が示された.
はじめに
気管支ぜんそくや花粉症などのI型アレルギーはB細胞から産生される免疫グロブリンEによりひき起こされ,免疫グロブリンEはマスト細胞や好塩基球のもつ受容体に結合することによりアレルゲンに特異的にアレルギー反応を誘導すると考えられてきた1).この免疫グロブリンEの産生はT細胞から産生される2型サイトカインを必要とする.ところが,マスト細胞やT細胞だけでなく,好塩基球や自然リンパ球による免疫反応系の存在が明らかになり,これら自然免疫系の細胞に注目があつまっている.さらに,アレルギーはT細胞や免疫グロブリンEを介した反応系が存在しなくても起こりうることが知られるようになってきた2,3).たとえば,アレルゲンとして知られるイエダニや植物に共通して含まれるシステインプロテアーゼは,気道上皮のバリア機能を破壊することにより,細胞に蓄積される損傷関連分子パターン(damage-associated molecular pattern:DAMP)の放出を誘導する.インターロイキン33は上皮系の細胞に発現する損傷関連分子パターンとしてはたらくサイトカインであり,近年,見い出された新規の自然リンパ球であるナチュラルヘルパー細胞はインターロイキン33に対する受容体を発現している.そのため,ナチュラルヘルパー細胞はインターロイキン33に反応して2型サイトカインであるインターロイキン5およびインターロイキン13を産生し,好酸球の浸潤や杯細胞の過形成およびムチンの産生を誘導すると考えられている4).
従来から,細胞の表面に免疫グロブリンE受容体を発現する好塩基球やマスト細胞は,免疫グロブリンEにアレルゲンが結合することにより2型サイトカインを産生することでアレルギーの病態に重要な役割を担うと考えられている5).ところが,これらの細胞は免疫グロブリンEやアレルゲンを介さずとも,インターロイキン33やTSLPなどさまざまなサイトカインによりアレルギー炎症にかかわる2型サイトカインを産生することができる6).そこで,筆者らは,この免疫グロブリンEに依存しないアレルギー炎症における好塩基球およびマスト細胞の役割に焦点をあて,好塩基球あるいはマスト細胞の欠損を誘導できる系を用いて,システインプロテアーゼにより誘導されるアレルギー炎症における,これまで知られていなかった好塩基球の役割を明らかにした.
1.システインプロテアーゼ活性をもつアレルゲンによるアレルギー性肺炎症には好塩基球が必要である
筆者らは,インターロイキン4の産生において細胞に特異的な発現を制御する遺伝子制御領域(エンハンサー)の存在を明らかにしてきた.その一連の解析から,好塩基球において特異的にはたらくエンハンサー領域として3’ UTR,および,マスト細胞において特異的にはたらくエンハンサー領域としてHS-2を同定した7).これらのエンハンサーの制御のもとジフテリア毒素受容体を発現するトランスジェニックマウスを作製することにより,ジフテリア毒素に依存して好塩基球あるいはマスト細胞を除去できる系を構築した8).これらの系を用いて,システインプロテアーゼであるパパインの点鼻投与により誘導されるアレルギー肺炎症について解析したところ,マスト細胞を除去したマウスでは野生型のマウスと同様に好酸球の浸潤およびムチンの産生が観察されたのに対し,好塩基球を除去したマウスではこれらの炎症の所見が顕著に抑制されていた.一方,この炎症の抑制は野生型マウスから単離した肺に由来する好塩基球を移入することにより回復したことから,システインプロテアーゼにより誘導されるアレルギー炎症において好塩基球は重要な存在であることが明らかになった.
2.好塩基球から産生されるインターロイキン4はシステインプロテアーゼによるアレルギー性肺炎症を制御する
これまでに,システインプロテアーゼによるアレルギー性炎症におけるインターロイキン4の重要性はノックアウトマウスを用いた解析により証明されている9).そこで,好塩基球から産生されるインターロイキン4の重要性を検討するため,さきに述べた好塩基球において特異的にはたらくエンハンサーである3’ UTRを欠損したマウスを作製し,肺炎症の系においてインターロイキン4の役割について解析した.3’ UTRを欠損したマウスでは好塩基球からのインターロイキン4の産生が選択的に低下していた.システインプロテアーゼであるパパインにより誘導される肺への好酸球の浸潤およびムチンの産生は,3’ UTRを欠損したマウスにおいて顕著に抑制されていた.また,この抑制はインターロイキン4を正常なレベルで産生する好塩基球を移入することにより回復したことから,好塩基球から産生されるインターロイキン4がシステインプロテアーゼにより誘導されるアレルギー肺炎症を制御していることが明らかになった.
肺に存在する自然免疫系の免疫細胞における遺伝子発現の解析から,ナチュラルヘルパー細胞はインターロイキン4に対する受容体を高く発現していることが明らかにされた.このナチュラルヘルパー細胞はインターロイキン4の存在のもと,好酸球の遊走やムチンの産生を制御するサイトカインであるインターロイキン9およびインターロイキン13,好塩基球の遊走を制御するケモカインeotaxinの産生が強く誘導されていた.また,好酸球の浸潤を制御するインターロイキン5の産生は,インターロイキン33の刺激にインターロイキン4がくわわることにより顕著に促進された.この結果,インターロイキン4はときには単独で,ときにはインターロイキン33と協調的に,ナチュラルヘルパー細胞の機能を制御しうることが明らかになった(図1).
おわりに
現代社会においてアレルギー疾患は3人に1人が罹患する国民病となっている.アレルギーは日常生活に支障をきたすほどの影響のでることもあり,生活環境を見直す必要が生じるなど,非常に大きな社会問題をひき起こしている.これまで,アレルギーの発症の中心として考えられてきたT細胞や免疫グロブリンEを必要としない,システインプロテアーゼなどのタンパク質分解酵素によりひき起こされるアレルギーの発症機構が解明されつつある.この研究により,システインプロテアーゼによりひき起こされるぜんそくの発症にナチュラルヘルパー細胞と好塩基球との相互作用が関与していることが明らかになった.また同時に,アレルギーの発症にはさまざまな免疫細胞による複雑なネットワークの関与していることが想定される.今後,このネットワークを標的とした新しい視点からのアレルギー治療法の開発や,さまざまなアレルギーの原因や症状に適合した治療法の構築が期待される.
文 献
- Gould, H. J. & Sutton, B. J.: IgE in allergy and asthma today. Nat. Rev. Immunol., 3, 205-217 (2008)[PubMed]
- Oboki, K., Ohno, T., Kajiwara, N. et al.: IL-33 is a crucial amplifier of innate rather than acquired immunity. Proc. Natl. Acad. Sci. USA, 107, 18581-18586 (2010)[PubMed]
- Halim, T. Y., Krauss, R. H., Sun, A. C. et al.: Lung natural helper cells are a critical source of Th2 cell-type cytokines in protease allergeninduced airway inflammation. Immunity, 36, 451-463 (2012)[PubMed]
- Moro, K., Yamada, T., Tanabe, M. et al.: Innate production of TH2 cytokines by adipose tissue-associated c-Kit+Sca-1+ lymphoid cells. Nature, 463, 540-544 (2010)[PubMed]
- Stone, K. D., Prussin, C. & Metcalfe, D. D.: IgE, mast cells, basophils, and eosinophils. J. Allergy Clin. Immunol., 125(2 Suppl.2), S73-S80 (2010)[PubMed]
- Nakae, S., Morita, H., Ohno, T. et al.: Role of interleukin-33 in innate-type immune cells in allergy. Allergol. Int., 1, 13-20 (2013)[PubMed]
- Yagi, R., Tanaka, S., Motomura, Y. et al.: Regulation of the Il4 gene is independently controlled by proximal and distal 3’ enhancers in mast cells and basophils. Mol. Cell. Biol., 27, 8087-8097 (2007)[PubMed]
- Sawaguchi, M., Tanaka, S., Nakatani, Y. et al.: Role of mast cells and basophils in IgE responses and in allergic airway hyperresponsiveness. J. Immunol., 188, 1809-1818 (2012)[PubMed]
- Johnson, J. R., Swirski, F. K., Gajewska, B. U. et al.: Divergent immune responses to house dust mite lead to distinct structural-functional phenotypes. Am. J. Physiol. Lung Cell. Mol. Physiol., 293, L730-739 (2007)[PubMed]
著者プロフィール
略歴:2010年 東京医科歯科大学大学院生命情報科学教育部博士課程 修了,同年 東京理科大学生命科学研究所 ポストドクトラル研究員を経て,2013年より理化学研究所統合生命医科学研究センター 特別研究員.
研究テーマ:ナチュラルヘルパー細胞の機能.
久保 允人(Masato Kubo)
東京理科大学生命科学研究所 教授,理化学研究所統合生命医科学研究センター チームリーダー.
研究室URL:http://www.rs.noda.tus.ac.jp/~ribsjm/kubolab/
© 2014 本村泰隆・久保允人 Licensed under CC 表示 2.1 日本