2つのセマフォリンが逆行性シグナルとして発達期におけるシナプス刈り込みを制御する
上阪直史・狩野方伸
(東京大学大学院医学系研究科 神経生理学分野)
email:上阪直史,狩野方伸
DOI: 10.7875/first.author.2014.076
Retrograde semaphorin signaling regulates synapse elimination in the developing mouse brain.
Naofumi Uesaka, Motokazu Uchigashima, Takayasu Mikuni, Takanobu Nakazawa, Harumi Nakao, Hirokazu Hirai, Atsu Aiba, Masahiko Watanabe, Masanobu Kano
Science, 344, 1020-1023 (2014)
生まれたばかりの動物の脳には過剰なシナプスが存在するが,発達の過程において必要なシナプスは強化および維持され,一方で,不要なシナプスは除去されて機能的な神経回路が完成する.この過程は“シナプス刈り込み”とよばれており,機能的な神経回路が形成されるために不可欠な過程である.これまでの研究により,シナプス刈り込みにシナプス後細胞からシナプス前細胞へと伝達される逆行性シグナルのかかわる可能性が示されてきたが,その実体は不明であった.今回,筆者らは,マウスの小脳の登上線維-プルキンエ細胞シナプスにおいて,シナプス刈り込みの起こる時期にプルキンエ細胞に発現するタンパク質のなかで逆行性シグナルとしてはたらきうるタンパク質を網羅的にスクリーニングした結果,セマフォリンファミリーのひとつSema3Aがシナプスを強化および維持することによりシナプス刈り込みに拮抗するはたらきをし,一方,別のセマフォリンファミリーであるSema7Aがシナプス刈り込みを促進することを示した.さらに,Sema3AおよびSema7Aは登上線維に存在するそれぞれの受容体にシグナルを直接に伝達していることが明らかにされた.今回の研究から,シナプス刈り込みが逆行性シグナルにより制御され,その実体としてシナプス後細胞からのSema3AシグナルおよびSema7Aシグナルが明らかにされた.
脳が正常に機能するためには,ニューロンが適切な相手と適切な数および強さの結合を形成し,機能的な神経回路が形成されなければならない.生まれたばかりの動物の脳には過剰なシナプスが存在するが,これらは機能的に未熟な状態にある.生後の発達の過程において必要なシナプスは強化および維持され,一方,不要なシナプスは除去されることにより機能的な神経回路が完成する.この過程は“シナプス刈り込み”とよばれており,生後の発達期において生育環境に適応するよう神経回路を最適化するしくみであり,成熟した機能的な神経回路が形成されるために不可欠とされている.これまでの研究により,シナプス刈り込みにはシナプス後細胞の神経活動あるいは分子が必要なことが証明されてきた1,2).しかし,シナプス後細胞の神経活動あるいは分子がどのようにシナプス前細胞にはたらきかけ,シナプスを強化および維持したりあるいは除去したりするのかは不明のままであった.ひとつの有力な仮説として,シナプス後細胞にある分子が逆行性シグナルとしてシナプス前細胞に直接にはたらきかけ,シナプスを強化および維持あるいは除去する可能性が考えられていたが,その実体は不明であった.
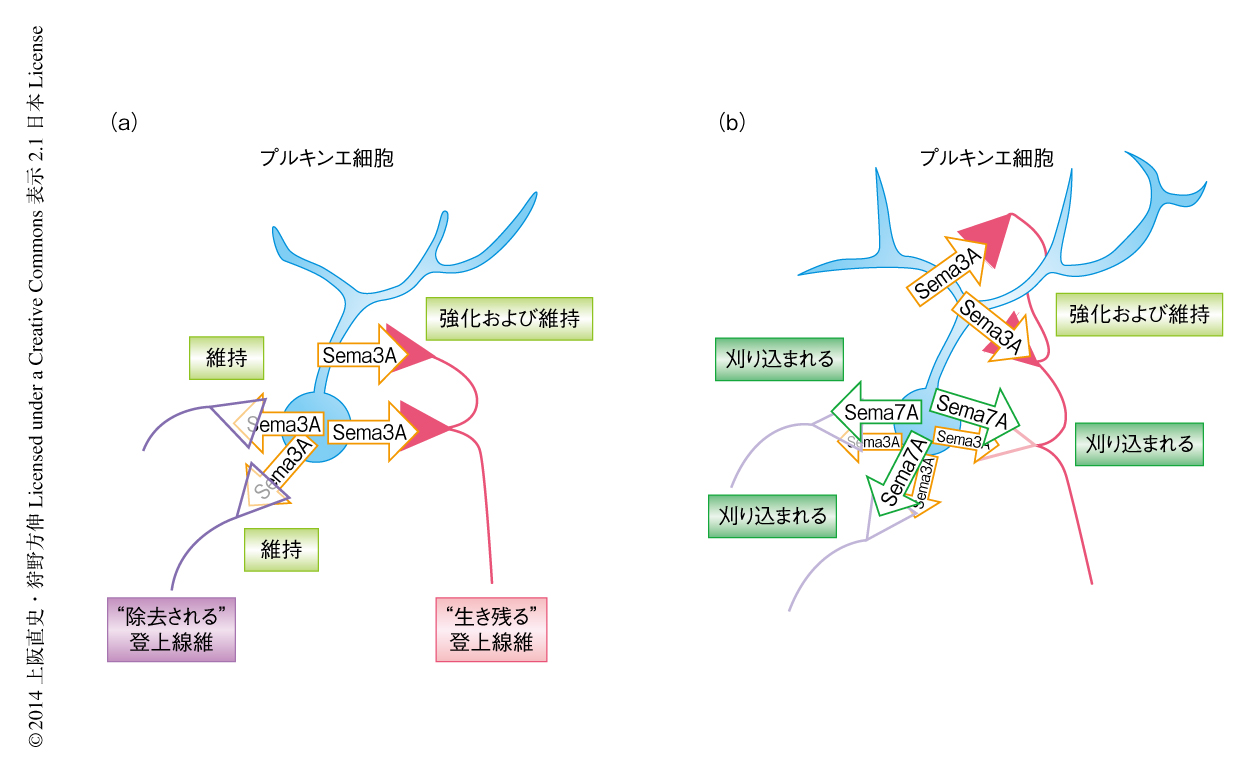
今回の研究においては,中枢神経系においてシナプス刈り込みの分子機構の解明に先導的な役割をはたしている小脳の登上線維とプルキンエ細胞とのあいだのシナプスの生後の発達を対象とした3,4)(図1).生後まもない動物のプルキンエ細胞においては5本以上の登上線維がプルキンエ細胞の細胞体にシナプスを形成するが,生後の発達の過程において1本の登上線維が強化され,強くなった登上線維だけがシナプスの領域を樹状突起へ拡大し,細胞体に残された弱い登上線維シナプスは除去される.この結果,成熟した動物では1本の強い登上線維が樹状突起にシナプスを形成するようになる.これまでの研究により,登上線維-プルキンエ細胞シナプスの刈り込みにおいて,シナプス後細胞であるプルキンエ細胞における神経活動あるいは受容体,チャネルが必要なことが示されている1,3,4).今回,この登上線維-プルキンエ細胞シナプスの刈り込みを制御する逆行性シグナルタンパク質を探索した.
登上線維-プルキンエ細胞シナプスが刈り込まれる生後4日目から生後18日目において,シナプス後細胞であるプルキンエ細胞において発現するタンパク質を検索し,逆行性シグナルとして機能しうる膜タンパク質および分泌タンパク質を候補タンパク質とした.これらのスクリーニングには,以前に開発した,延髄-小脳の共培養標本を用いた5).おのおののタンパク質の発現をプルキンエ細胞でのみ抑制するため,プルキンエ細胞でのみ機能するレンチウイルスノックダウンベクターを培養標本に注入し,それから約2週間のちにプルキンエ細胞に何本の登上線維が結合しているかを電気生理学的に調べた.すなわち,プルキンエ細胞からホールセル記録を行い,延髄の切片を電気刺激することによりプルキンエ細胞に誘発される登上線維シナプスの応答の数を指標にして,プルキンエ細胞に結合する登上線維の本数を評価した.
その結果,セマフォリンファミリーに属するSema3AあるいはSema7Aをノックダウンしたときにシナプス刈り込みに異常が観察された.Sema3Aをノックダウンしたプルキンエ細胞ではシナプス結合している登上線維の数が有意に減少し,さらに,登上線維に由来する興奮性シナプス後電流の振幅が減弱していた.一方,Sema7Aをノックダウンしたときはプルキンエ細胞にシナプス結合している登上線維の数が有意に増加した.これらの結果から,Sema3Aは登上線維シナプスを強化および維持することによりシナプスの除去に拮抗するはたらきをもち,Sema7Aは登上線維シナプスの除去を促進するはたらきをもつ可能性が考えられた.Sema3AあるいはSema7Aが生体においてシナプス刈り込みを制御しているかどうかを調べるため,レンチウイルスノックダウンベクターをシナプス刈り込みの過程がはじまる直前の生後1日目あるいは生後2日目のマウスの小脳に注入し,さまざまな時期においてシナプス刈り込みを解析した.その結果,プルキンエ細胞におけるSema3Aのノックダウンは生後8日目からのシナプス刈り込みを促進し,生後18日目までその促進効果が観察された.また,Sema3Aがノックダウンされたプルキンエ細胞では登上線維シナプスの興奮性シナプス後電流の振幅が生後30日目まで減弱していた.一方,Sema7Aをノックダウンしたプルキンエ細胞では生後14日目までは異常はみられなかったが,生後15日目から登上線維の数が有意に多くなり,その効果は生後50日目以降も観察された.これらの結果から,Sema3Aは生後8日目から登上線維シナプスを強化および維持し,Sema7Aは生後15日目から登上線維シナプスの除去を促進していることがわかった(図2).
これまでの研究により,1型代謝型グルタミン酸受容体,P/Q型電位依存性Ca2+チャネル,グルタミン酸受容体デルタ2が登上線維シナプスの除去を進める役割をはたすことが示されている4).これらとSema7Aとの関係を調べるため,1型代謝型グルタミン酸受容体,P/Q型電位依存性Ca2+チャネル,グルタミン酸受容体デルタ2のいずれか1つとSema7Aとのダブルノックダウンを行った.もし,それらが同じシグナル伝達経路にあるならダブルノックダウンの効果は1型代謝型グルタミン酸受容体,P/Q型電位依存性Ca2+チャネル,グルタミン酸受容体デルタ2のシングルノックダウンと同じ効果になり,それらが異なるシグナル伝達経路にあるならダブルノックダウンの効果はシングルノックダウンの効果が足し合わされた効果になると予想される.その結果,P/Q型電位依存性Ca2+チャネルあるいはグルタミン酸受容体デルタ2とSema7Aとをダブルノックダウンしたときにはシングルノックダウンと比べ加算的な効果が観察された.一方,1型代謝型グルタミン酸受容体とSema7Aとをダブルノックダウンしたときにはシングルノックダウンと同じ効果が観察された.これらの結果から,Sema7Aは1型代謝型グルタミン酸受容体と同じシグナル伝達経路にある可能性が示唆された.
Sema7Aと1型代謝型グルタミン酸受容体との関係を明らかにするため,1型代謝型グルタミン酸受容体のノックアウトマウスにおいてSema7Aの発現を調べた.その結果,細胞の全体におけるSema7Aの発現および細胞膜におけるSema7Aの発現が有意に減少していた.さらに,プルキンエ細胞において1型代謝型グルタミン酸受容体をノックダウンすると同時にSema7Aを過剰に発現させると,1型代謝型グルタミン酸受容体のノックダウンによるシナプス刈り込みの障害が改善された.これらの結果より,1型代謝型グルタミン酸受容体がSema7Aの発現を制御し登上線維シナプスを除去することが明らかになった.
Sema3Aがプルキンエ細胞から登上線維に直接にはたらきかける逆行性シグナルであるかどうかを明らかにするため,登上線維においてSema3Aの受容体であるPlxnA4の発現をノックダウンしシナプス刈り込みへの影響について調べた.その結果,Sema3Aのノックダウンと同じくシナプス刈り込みが促進された.この結果から,プルキンエ細胞のSema3Aから登上線維のPlxnA4にシグナルが伝達され,登上線維シナプスを強化および維持している可能性が考えられた.この可能性を検証するため,プルキンエ細胞にてSema3Aをノックダウンしたマウスにおいて,登上線維でのPlxnA4のノックダウンがシナプス刈り込みをさらに阻害するかどうかを調べた.その結果,Sema3AおよびPlxnA4をダブルノックダウンしたときと,Sema3Aのみをノックダウンしたときとでは,シナプス刈り込みの促進される程度は同等であった.この結果は,プルキンエ細胞のSema3Aと登上線維のPlxnA4とが同じシグナル伝達経路にあり,プルキンエ細胞から分泌されたSema3Aが登上線維のPlxnA4にシグナルを直接に伝達していることを示唆した.
Sema7Aがプルキンエ細胞から登上線維に直接にはたらきかける逆行性シグナルであるかどうかを調べるため,登上線維においてSema7Aの受容体であるインテグリンB1あるいはPlxnC1の発現をノックダウンしシナプス刈り込みへの影響について調べた.その結果,Sema7Aのノックダウンと同じくシナプス刈り込みが障害された.この結果から,プルキンエ細胞のSema7Aから登上線維のインテグリンB1およびPlxnC1にシグナルが伝達され,登上線維シナプスを除去している可能性が考えられた.この可能性を検証するため,プルキンエ細胞にてSema7Aをノックダウンしたマウスにおいて,登上線維でのインテグリンB1あるいはPlxnC1のノックダウンがシナプス刈り込みをさらに阻害するかどうかを調べた.その結果,インテグリンB1あるいはPlxnC1のどちらかおよびSema7Aをダブルノックダウンしたときと,Sema7Aのみをノックダウンしたときとでは,シナプス刈り込みの阻害される程度は同等であった.この結果は,プルキンエ細胞のSema7Aと登上線維のインテグリンB1およびPlxnC1とが同じシグナル伝達経路にあり,プルキンエ細胞にあるSema7Aが登上線維のインテグリンB1およびPlxnC1にシグナルを直接に伝達していることを示唆した.
以上から,Sema3AおよびSema7Aはシナプス後細胞であるプルキンエ細胞からシナプス前細胞である登上線維シナプスに直接にはたらきかける逆行性シグナルであること,Sema3Aは登上線維にあるPlxnA4にはたらきかけ登上線維シナプスを維持および強化し,Sema7Aは登上線維にあるインテグリンB1およびPlxnC1にはたらきかけ弱い登上線維シナプスの細胞体からの除去を促進していることが明らかにされた.
セマフォリンは軸索ガイダンスにおいて軸索伸長の反発因子として同定されたタンパク質である6).現在では,多くのタンパク質がセマフォリンファミリーに属することが知られ,脳において軸索ガイダンスだけでなく,ニューロンの極性化,細胞移動,樹状突起の形成,シナプスの形成などさまざまな過程において重要な役割をはたすことが明らかにされている7-11).しかしながら,神経活動に依存的な神経回路の再編成の過程にセマフォリンが関与しているかどうかは,はっきりわかっていなかった.また,逆行性シグナルは軸索の成長,シナプスの形成,神経回路の再編成の過程において重要な役割をはたすことが示唆されており,軸索の成長やシナプスの形成においてはいくつかの分子が同定されてきたが12,13),神経回路の再編成の過程においては逆行性シグナルの実体はまったく不明であった.今回の研究により,神経回路の再編成を担うシナプス刈り込みを制御する逆行性シグナルが同定されたとともに,セマフォリンが神経活動に依存的な神経回路の再編成にも関与するという新規の知見が得られた.
シナプス刈り込みはさまざまな動物の神経系において観察されていることから脳の発達や機能において重要であることに疑いはないが,その生理的な意義に関してはまだはっきりわかっていない.興味深いことに,ヒトの精神神経疾患の研究からシナプス刈り込みの生理的な意義が示唆されている.幻覚や妄想を主症状とする代表的な精神疾患である統合失調症を発症した患者の脳では,樹状突起のスパインの密度が低下しており過度のシナプス刈り込みが示唆されている.逆に,自閉症の患者の脳では樹状突起のスパインの密度が上昇しており,シナプス刈り込みの障害が示唆されている.さらに,ヒトの精神遅滞や自閉症に関連する分子がマウスにおいてシナプス刈り込みにかかわることも報告されている.今回,明らかにされたセマフォリンやその受容体も,自閉症や統合失調症を発症した患者の脳において遺伝子の変異や発現の異常が報告されている.今後,さらに分子機構を調べることにより,シナプス刈り込みの機構および生理的な意義の解明が期待される.
略歴:2006年 大阪大学大学院基礎工学研究科博士課程 修了,2010年より東京大学大学院医学系研究科 助教.
研究テーマ:発達期に起こるシナプス刈り込みの分子機構.
狩野 方伸(Masanobu Kano)
東京大学大学院医学系研究科 教授.
研究室URL:http://plaza.umin.ac.jp/~neurophy/Kano_Lab_j/Top_j.html
© 2014 上阪直史・狩野方伸 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 神経生理学分野)
email:上阪直史,狩野方伸
DOI: 10.7875/first.author.2014.076
Retrograde semaphorin signaling regulates synapse elimination in the developing mouse brain.
Naofumi Uesaka, Motokazu Uchigashima, Takayasu Mikuni, Takanobu Nakazawa, Harumi Nakao, Hirokazu Hirai, Atsu Aiba, Masahiko Watanabe, Masanobu Kano
Science, 344, 1020-1023 (2014)
要 約
生まれたばかりの動物の脳には過剰なシナプスが存在するが,発達の過程において必要なシナプスは強化および維持され,一方で,不要なシナプスは除去されて機能的な神経回路が完成する.この過程は“シナプス刈り込み”とよばれており,機能的な神経回路が形成されるために不可欠な過程である.これまでの研究により,シナプス刈り込みにシナプス後細胞からシナプス前細胞へと伝達される逆行性シグナルのかかわる可能性が示されてきたが,その実体は不明であった.今回,筆者らは,マウスの小脳の登上線維-プルキンエ細胞シナプスにおいて,シナプス刈り込みの起こる時期にプルキンエ細胞に発現するタンパク質のなかで逆行性シグナルとしてはたらきうるタンパク質を網羅的にスクリーニングした結果,セマフォリンファミリーのひとつSema3Aがシナプスを強化および維持することによりシナプス刈り込みに拮抗するはたらきをし,一方,別のセマフォリンファミリーであるSema7Aがシナプス刈り込みを促進することを示した.さらに,Sema3AおよびSema7Aは登上線維に存在するそれぞれの受容体にシグナルを直接に伝達していることが明らかにされた.今回の研究から,シナプス刈り込みが逆行性シグナルにより制御され,その実体としてシナプス後細胞からのSema3AシグナルおよびSema7Aシグナルが明らかにされた.
はじめに
脳が正常に機能するためには,ニューロンが適切な相手と適切な数および強さの結合を形成し,機能的な神経回路が形成されなければならない.生まれたばかりの動物の脳には過剰なシナプスが存在するが,これらは機能的に未熟な状態にある.生後の発達の過程において必要なシナプスは強化および維持され,一方,不要なシナプスは除去されることにより機能的な神経回路が完成する.この過程は“シナプス刈り込み”とよばれており,生後の発達期において生育環境に適応するよう神経回路を最適化するしくみであり,成熟した機能的な神経回路が形成されるために不可欠とされている.これまでの研究により,シナプス刈り込みにはシナプス後細胞の神経活動あるいは分子が必要なことが証明されてきた1,2).しかし,シナプス後細胞の神経活動あるいは分子がどのようにシナプス前細胞にはたらきかけ,シナプスを強化および維持したりあるいは除去したりするのかは不明のままであった.ひとつの有力な仮説として,シナプス後細胞にある分子が逆行性シグナルとしてシナプス前細胞に直接にはたらきかけ,シナプスを強化および維持あるいは除去する可能性が考えられていたが,その実体は不明であった.
今回の研究においては,中枢神経系においてシナプス刈り込みの分子機構の解明に先導的な役割をはたしている小脳の登上線維とプルキンエ細胞とのあいだのシナプスの生後の発達を対象とした3,4)(図1).生後まもない動物のプルキンエ細胞においては5本以上の登上線維がプルキンエ細胞の細胞体にシナプスを形成するが,生後の発達の過程において1本の登上線維が強化され,強くなった登上線維だけがシナプスの領域を樹状突起へ拡大し,細胞体に残された弱い登上線維シナプスは除去される.この結果,成熟した動物では1本の強い登上線維が樹状突起にシナプスを形成するようになる.これまでの研究により,登上線維-プルキンエ細胞シナプスの刈り込みにおいて,シナプス後細胞であるプルキンエ細胞における神経活動あるいは受容体,チャネルが必要なことが示されている1,3,4).今回,この登上線維-プルキンエ細胞シナプスの刈り込みを制御する逆行性シグナルタンパク質を探索した.
1.延髄-小脳の共培養標本を用いた逆行性シグナルタンパク質のスクリーニング
登上線維-プルキンエ細胞シナプスが刈り込まれる生後4日目から生後18日目において,シナプス後細胞であるプルキンエ細胞において発現するタンパク質を検索し,逆行性シグナルとして機能しうる膜タンパク質および分泌タンパク質を候補タンパク質とした.これらのスクリーニングには,以前に開発した,延髄-小脳の共培養標本を用いた5).おのおののタンパク質の発現をプルキンエ細胞でのみ抑制するため,プルキンエ細胞でのみ機能するレンチウイルスノックダウンベクターを培養標本に注入し,それから約2週間のちにプルキンエ細胞に何本の登上線維が結合しているかを電気生理学的に調べた.すなわち,プルキンエ細胞からホールセル記録を行い,延髄の切片を電気刺激することによりプルキンエ細胞に誘発される登上線維シナプスの応答の数を指標にして,プルキンエ細胞に結合する登上線維の本数を評価した.
その結果,セマフォリンファミリーに属するSema3AあるいはSema7Aをノックダウンしたときにシナプス刈り込みに異常が観察された.Sema3Aをノックダウンしたプルキンエ細胞ではシナプス結合している登上線維の数が有意に減少し,さらに,登上線維に由来する興奮性シナプス後電流の振幅が減弱していた.一方,Sema7Aをノックダウンしたときはプルキンエ細胞にシナプス結合している登上線維の数が有意に増加した.これらの結果から,Sema3Aは登上線維シナプスを強化および維持することによりシナプスの除去に拮抗するはたらきをもち,Sema7Aは登上線維シナプスの除去を促進するはたらきをもつ可能性が考えられた.Sema3AあるいはSema7Aが生体においてシナプス刈り込みを制御しているかどうかを調べるため,レンチウイルスノックダウンベクターをシナプス刈り込みの過程がはじまる直前の生後1日目あるいは生後2日目のマウスの小脳に注入し,さまざまな時期においてシナプス刈り込みを解析した.その結果,プルキンエ細胞におけるSema3Aのノックダウンは生後8日目からのシナプス刈り込みを促進し,生後18日目までその促進効果が観察された.また,Sema3Aがノックダウンされたプルキンエ細胞では登上線維シナプスの興奮性シナプス後電流の振幅が生後30日目まで減弱していた.一方,Sema7Aをノックダウンしたプルキンエ細胞では生後14日目までは異常はみられなかったが,生後15日目から登上線維の数が有意に多くなり,その効果は生後50日目以降も観察された.これらの結果から,Sema3Aは生後8日目から登上線維シナプスを強化および維持し,Sema7Aは生後15日目から登上線維シナプスの除去を促進していることがわかった(図2).
2.Sema7Aは代謝型グルタミン酸受容体からのシグナルをうけシナプス刈り込みに影響する
これまでの研究により,1型代謝型グルタミン酸受容体,P/Q型電位依存性Ca2+チャネル,グルタミン酸受容体デルタ2が登上線維シナプスの除去を進める役割をはたすことが示されている4).これらとSema7Aとの関係を調べるため,1型代謝型グルタミン酸受容体,P/Q型電位依存性Ca2+チャネル,グルタミン酸受容体デルタ2のいずれか1つとSema7Aとのダブルノックダウンを行った.もし,それらが同じシグナル伝達経路にあるならダブルノックダウンの効果は1型代謝型グルタミン酸受容体,P/Q型電位依存性Ca2+チャネル,グルタミン酸受容体デルタ2のシングルノックダウンと同じ効果になり,それらが異なるシグナル伝達経路にあるならダブルノックダウンの効果はシングルノックダウンの効果が足し合わされた効果になると予想される.その結果,P/Q型電位依存性Ca2+チャネルあるいはグルタミン酸受容体デルタ2とSema7Aとをダブルノックダウンしたときにはシングルノックダウンと比べ加算的な効果が観察された.一方,1型代謝型グルタミン酸受容体とSema7Aとをダブルノックダウンしたときにはシングルノックダウンと同じ効果が観察された.これらの結果から,Sema7Aは1型代謝型グルタミン酸受容体と同じシグナル伝達経路にある可能性が示唆された.
Sema7Aと1型代謝型グルタミン酸受容体との関係を明らかにするため,1型代謝型グルタミン酸受容体のノックアウトマウスにおいてSema7Aの発現を調べた.その結果,細胞の全体におけるSema7Aの発現および細胞膜におけるSema7Aの発現が有意に減少していた.さらに,プルキンエ細胞において1型代謝型グルタミン酸受容体をノックダウンすると同時にSema7Aを過剰に発現させると,1型代謝型グルタミン酸受容体のノックダウンによるシナプス刈り込みの障害が改善された.これらの結果より,1型代謝型グルタミン酸受容体がSema7Aの発現を制御し登上線維シナプスを除去することが明らかになった.
3.Sema3AおよびSema7Aは逆行性シグナルとして登上線維シナプスに直接に作用する
Sema3Aがプルキンエ細胞から登上線維に直接にはたらきかける逆行性シグナルであるかどうかを明らかにするため,登上線維においてSema3Aの受容体であるPlxnA4の発現をノックダウンしシナプス刈り込みへの影響について調べた.その結果,Sema3Aのノックダウンと同じくシナプス刈り込みが促進された.この結果から,プルキンエ細胞のSema3Aから登上線維のPlxnA4にシグナルが伝達され,登上線維シナプスを強化および維持している可能性が考えられた.この可能性を検証するため,プルキンエ細胞にてSema3Aをノックダウンしたマウスにおいて,登上線維でのPlxnA4のノックダウンがシナプス刈り込みをさらに阻害するかどうかを調べた.その結果,Sema3AおよびPlxnA4をダブルノックダウンしたときと,Sema3Aのみをノックダウンしたときとでは,シナプス刈り込みの促進される程度は同等であった.この結果は,プルキンエ細胞のSema3Aと登上線維のPlxnA4とが同じシグナル伝達経路にあり,プルキンエ細胞から分泌されたSema3Aが登上線維のPlxnA4にシグナルを直接に伝達していることを示唆した.
Sema7Aがプルキンエ細胞から登上線維に直接にはたらきかける逆行性シグナルであるかどうかを調べるため,登上線維においてSema7Aの受容体であるインテグリンB1あるいはPlxnC1の発現をノックダウンしシナプス刈り込みへの影響について調べた.その結果,Sema7Aのノックダウンと同じくシナプス刈り込みが障害された.この結果から,プルキンエ細胞のSema7Aから登上線維のインテグリンB1およびPlxnC1にシグナルが伝達され,登上線維シナプスを除去している可能性が考えられた.この可能性を検証するため,プルキンエ細胞にてSema7Aをノックダウンしたマウスにおいて,登上線維でのインテグリンB1あるいはPlxnC1のノックダウンがシナプス刈り込みをさらに阻害するかどうかを調べた.その結果,インテグリンB1あるいはPlxnC1のどちらかおよびSema7Aをダブルノックダウンしたときと,Sema7Aのみをノックダウンしたときとでは,シナプス刈り込みの阻害される程度は同等であった.この結果は,プルキンエ細胞のSema7Aと登上線維のインテグリンB1およびPlxnC1とが同じシグナル伝達経路にあり,プルキンエ細胞にあるSema7Aが登上線維のインテグリンB1およびPlxnC1にシグナルを直接に伝達していることを示唆した.
以上から,Sema3AおよびSema7Aはシナプス後細胞であるプルキンエ細胞からシナプス前細胞である登上線維シナプスに直接にはたらきかける逆行性シグナルであること,Sema3Aは登上線維にあるPlxnA4にはたらきかけ登上線維シナプスを維持および強化し,Sema7Aは登上線維にあるインテグリンB1およびPlxnC1にはたらきかけ弱い登上線維シナプスの細胞体からの除去を促進していることが明らかにされた.
おわりに
セマフォリンは軸索ガイダンスにおいて軸索伸長の反発因子として同定されたタンパク質である6).現在では,多くのタンパク質がセマフォリンファミリーに属することが知られ,脳において軸索ガイダンスだけでなく,ニューロンの極性化,細胞移動,樹状突起の形成,シナプスの形成などさまざまな過程において重要な役割をはたすことが明らかにされている7-11).しかしながら,神経活動に依存的な神経回路の再編成の過程にセマフォリンが関与しているかどうかは,はっきりわかっていなかった.また,逆行性シグナルは軸索の成長,シナプスの形成,神経回路の再編成の過程において重要な役割をはたすことが示唆されており,軸索の成長やシナプスの形成においてはいくつかの分子が同定されてきたが12,13),神経回路の再編成の過程においては逆行性シグナルの実体はまったく不明であった.今回の研究により,神経回路の再編成を担うシナプス刈り込みを制御する逆行性シグナルが同定されたとともに,セマフォリンが神経活動に依存的な神経回路の再編成にも関与するという新規の知見が得られた.
シナプス刈り込みはさまざまな動物の神経系において観察されていることから脳の発達や機能において重要であることに疑いはないが,その生理的な意義に関してはまだはっきりわかっていない.興味深いことに,ヒトの精神神経疾患の研究からシナプス刈り込みの生理的な意義が示唆されている.幻覚や妄想を主症状とする代表的な精神疾患である統合失調症を発症した患者の脳では,樹状突起のスパインの密度が低下しており過度のシナプス刈り込みが示唆されている.逆に,自閉症の患者の脳では樹状突起のスパインの密度が上昇しており,シナプス刈り込みの障害が示唆されている.さらに,ヒトの精神遅滞や自閉症に関連する分子がマウスにおいてシナプス刈り込みにかかわることも報告されている.今回,明らかにされたセマフォリンやその受容体も,自閉症や統合失調症を発症した患者の脳において遺伝子の変異や発現の異常が報告されている.今後,さらに分子機構を調べることにより,シナプス刈り込みの機構および生理的な意義の解明が期待される.
文 献
- Kano, M. & Hashimoto, K.: Synapse elimination in the central nervous system. Curr. Opin. Neurobiol., 19, 154-161 (2009)[PubMed]
- Lichtman, J. W. & Colman, H.: Synapse elimination and indelible memory. Neuron, 25, 269-278 (2000)[PubMed]
- Hashimoto, K. & Kano, M.: Synapse elimination in the developing cerebellum. Cell. Mol. Life Sci., 70, 4667-4680 (2013)[PubMed]
- Watanabe, M. & Kano, M.: Climbing fiber synapse elimination in cerebellar Purkinje cells. Eur. J. Neurosci., 34, 1697-1710 (2011)[PubMed]
- Uesaka, N., Mikuni, T., Hashimoto, K. et al.: Organotypic coculture preparation for the study of developmental synapse elimination in mammalian brain. J. Neurosci., 32, 11657-11670 (2012)[PubMed]
- Luo, Y., Raible, D. & Raper, J. A.: Collapsin: a protein in brain that induces the collapse and paralysis of neuronal growth cones. Cell, 75, 217-227 (1993)[PubMed]
- Chen, G., Sima, J., Jin, M. et al.: Semaphorin-3A guides radial migration of cortical neurons during development. Nat. Neurosci., 11, 36-44 (2008)[PubMed]
- Pasterkamp, R. J.: Getting neural circuits into shape with semaphorins. Nat. Rev. Neurosci., 13, 605-618 (2012)[PubMed]
- Fukunishi, A., Maruyama, T., Zhao, H. et al.: The action of Semaphorin7A on thalamocortical axon branching. J. Neurochem., 118, 1008-1015 (2011)[PubMed]
- Shelly, M., Cancedda, L., Lim, B. K. et al.: Semaphorin3A regulates neuronal polarization by suppressing axon formation and promoting dendrite growth. Neuron, 71, 433-446 (2011)[PubMed]
- Tran, T. S., Rubio, M. E., Clem, R. L. et al.: Secreted semaphorins control spine distribution and morphogenesis in the postnatal CNS. Nature, 462, 1065-1069 (2009)[PubMed]
- da Silva, S. & Wang, F.: Retrograde neural circuit specification by target-derived neurotrophins and growth factors. Curr. Opin. Neurobiol., 21, 61-67 (2011)[PubMed]
- Johnson-Venkatesh, E. M. & Umemori, H.: Secreted factors as synaptic organizers. Eur. J. Neurosci., 32, 181-190 (2010)[PubMed]
著者プロフィール
略歴:2006年 大阪大学大学院基礎工学研究科博士課程 修了,2010年より東京大学大学院医学系研究科 助教.
研究テーマ:発達期に起こるシナプス刈り込みの分子機構.
狩野 方伸(Masanobu Kano)
東京大学大学院医学系研究科 教授.
研究室URL:http://plaza.umin.ac.jp/~neurophy/Kano_Lab_j/Top_j.html
© 2014 上阪直史・狩野方伸 Licensed under CC 表示 2.1 日本