エピゲノム制御タンパク質Uhrf1は腸内細菌の定着にともなう制御性T細胞の増殖および機能的な成熟を保証することにより炎症応答を抑制する
尾畑佑樹・長谷耕二
(東京大学医科学研究所 国際粘膜ワクチン開発研究センター粘膜バリア学分野)
email:長谷耕二
DOI: 10.7875/first.author.2014.072
The epigenetic regulator Uhrf1 facilitates the proliferation and maturation of colonic regulatory T cells.
Yuuki Obata, Yukihiro Furusawa, Takaho A. Endo, Jafar Sharif, Daisuke Takahashi, Koji Atarashi, Manabu Nakayama, Satoshi Onawa, Yumiko Fujimura, Masumi Takahashi, Tomokatsu Ikawa, Takeshi Otsubo, Yuki I. Kawamura, Taeko Dohi, Shoji Tajima, Hiroshi Masumoto, Osamu Ohara, Kenya Honda, Shohei Hori, Hiroshi Ohno, Haruhiko Koseki, Koji Hase
Nature Immunology, 15, 571-579 (2014)
消化管の粘膜にはおよそ100兆個の腸内細菌が生息している.腸内細菌は宿主の免疫系の成熟を促進する一方で,腸内細菌に対する過剰な免疫応答は消化管における慢性炎症の発症の原因となる.こうした病理的な炎症を防ぐため,腸管には免疫抑制能をもつ制御性T細胞が多く存在している.この研究において,筆者らは,DNA維持メチル化を介するエピゲノム制御タンパク質であるUhrf1が,大腸における制御性T細胞の増殖および機能的な成熟に必須であることを見い出した.Uhrf1の発現は腸内細菌が定着した直後の大腸に存在する制御性T細胞において顕著に上昇していた.T細胞に特異的なUhrf1ノックアウトマウスは,大腸における制御性T細胞の恒常性の破綻により慢性大腸炎を自然発症した.ゲノムワイドなDNAメチル化およびトランスクリプトームの解析から,Uhrf1は細胞周期制御タンパク質であるp21をコードするCdkn1a遺伝子のプロモーター領域におけるDNAメチル化の維持に必須であることが判明した.以上の結果から,Uhrf1は大腸における制御性T細胞の増殖および機能的な成熟を保証することにより,腸管免疫系が腸内細菌に対し過剰に応答することを未然に防ぎ,大腸における免疫恒常性の維持に必須の役割をはたしていることが明らかになった.
哺乳類の胎児は,母体においては無菌の状態で維持されているが,出生の直後には膨大な数の微生物にさらされる.これらは,おもに皮膚や消化管の粘膜など外界の環境との境界となる部位に常在細菌として定着する.とくに,ヒトの消化管には100兆個にもおよぶ常在細菌が定着している.大腸はこれら常在細菌が増殖するのに適した環境であり,おもに嫌気性の細菌が糞便1 gあたり約1000億個というきわめて高い密度で生息している.これらおのおのの細菌は互いに影響しあい一定のバランスを保ちながら腸内細菌叢(腸内フローラ)を形成している.
腸内細菌の定着は宿主免疫系の成熟や機能の維持に大きく影響する1).腸内細菌のまったく存在しない無菌マウスでは,腸管における免疫誘導組織である腸管関連リンパ組織の発達が悪いほか,γδT細胞をはじめとする上皮内リンパ球,また,粘膜における主要な免疫グロブリンである分泌型免疫グロブリンAを産生する形質細胞の数も少ない.無菌マウスでは通常に飼育したマウスと比較して上皮性の抗菌ペプチドの産生が少なく,腸上皮の細胞のターンオーバーが遅いなど,粘膜のバリア機能も低下している.よって,腸内細菌の存在は腸管免疫系の構築にきわめて重要な役割をはたしているといえる.その一方で,腸内細菌に対する腸管免疫系の異常な活性化は,消化管における病理的な慢性炎症の発症の原因となる.したがって,出生ののちの無菌状態から腸内細菌が定着する際には,腸内細菌に対する過剰な免疫応答を抑制する機構がはたらかなければならない.腸管において免疫応答を抑制する細胞の代表として制御性T細胞があげられる.大腸において制御性T細胞は腸内細菌の定着により誘導され2,3),成獣のマウスでは最終的にCD4陽性T細胞のうちおよそ1/3から半数をしめることが知られている.これら大腸に存在する制御性T細胞はCTLA-4やインターロイキン10を高く発現しており,腸内細菌に対する免疫制御に深くかかわっていることが予想される.しかしながら,制御性T細胞がどのような機構により機能的に成熟し,病理的な炎症が惹起されることなく腸内細菌と宿主免疫系との共生関係が構築されるのかは不明であった.
なお,免疫系における恒常性の維持と制御性T細胞については,濱口真英・坂口志文, 領域融合レビュー, 2, e005, 2013,腸内細菌と腸管免疫については,本田 賢也, 領域融合レビュー, 2, e011, 2013 も参照されたい.
母体の無菌状態から出生ののち腸内細菌が定着するまでの過程を模倣して,無菌マウスを無菌環境から通常の環境(SPF環境,SPF:specific pathogen free,特定病原体除去)へと移動した際の制御性T細胞の応答を調べた.その結果,腸内細菌の定着が大腸の粘膜固有層における制御性T細胞の増殖を顕著に誘導することがわかった.また,大腸における制御性T細胞の増殖応答にさきだち,インターロイキン2を産生するエフェクターT細胞が大腸においてのみ一過性に増加した.インターロイキン2を中和すると制御性T細胞の増殖が抑制されたことから,細菌の定着の初期に誘導されるインターロイキン2に対する応答が制御性T細胞の増殖をひき起こすと考えられた.制御性T細胞の活発な増殖は,腸内細菌が定着してまもない授乳中のマウスにおいても顕著に認められた.一方,脾臓においては制御性T細胞の増殖応答は認められなかった.したがって,腸内細菌の定着は大腸の局所において制御性T細胞の活発な増殖を誘導することが示唆された.
最近,筆者らは,腸内細菌が食物繊維などの発酵分解により産生する代謝産物のひとつである酪酸が,大腸の粘膜固有層における制御性T細胞の分化を誘導することを見い出した4)(新着論文レビュー でも掲載).一方で,酪酸は大腸における制御性T細胞の増殖には影響しない.したがって,大腸における制御性T細胞の分化および増殖は,それぞれ異なる機構により制御されていると考えられた.そこで,腸内細菌に応答して大腸において制御性T細胞の増殖を制御する責任遺伝子の同定を試みた.無菌マウス,および,無菌マウスにSPFマウスに由来する腸内細菌を定着させたSPF化マウスの大腸の粘膜固有層から,制御性T細胞の集団およびそれ以外のヘルパーT細胞の集団を取得し,ゲノムワイドな遺伝子発現解析を行った.このデータをもとに,腸内細菌の定着に応答して制御性T細胞において特異的に発現が上昇する,インターロイキン2に応答性の遺伝子を抽出した.さらに,遺伝子オントロジー解析により細胞増殖に関連する遺伝子を絞り込んだ結果,候補遺伝子としてUhrf1をコードする遺伝子が同定された.Uhrf1はDNA維持メチル化を介するエピゲノム制御タンパク質である5,6).Uhrf1の発現は生後から離乳までの活発な増殖期にある制御性T細胞においても上昇していた.一方で,腸内細菌の定着したマウスの脾臓に存在する制御性T細胞においてはUhrf1の発現の誘導は起こらなかったことから,Uhrf1は大腸の局所における制御性T細胞の増殖応答にかかわる可能性が示唆された.
制御性T細胞の増殖応答におけるUhrf1の役割を調べるため,T細胞において特異的なUhrf1ノックアウトマウスを作出した.このUhrf1ノックアウトマウスの大腸では,離乳の直後において制御性T細胞の割合が顕著に減少していた.これは,大腸における制御性T細胞の増殖の低下によるものであった.さらに,このUhrf1ノックアウトマウスを無菌化し腸内細菌を定着させた場合にも,大腸における制御性T細胞の増殖は起こりにくくなっていた.一方で,脾臓や胸腺における制御性T細胞の割合は,対照となるマウスとこのUhrf1ノックアウトマウスとのあいだで差がなかったことから,Uhrf1は大腸の局所における制御性T細胞の細胞増殖の維持に必須であることが明らかになった.
in vitroにおける観察の結果から制御性T細胞は複数回の細胞分裂により免疫制御作用を獲得することが示唆されている7).そこで,大腸に存在する制御性T細胞において,制御性T細胞の増殖活性と免疫制御タンパク質の発現との相関を調べたところ,増殖性の制御性T細胞のほうが非増殖性の制御性T細胞よりもより高いレベルで免疫制御タンパク質を発現していることがわかった.つまり,大腸における制御性T細胞の活発な増殖は機能的な成熟を促進することが示唆された.T細胞に特異的なUhrf1ノックアウトマウスの大腸に残存する制御性T細胞においては,対照となるマウスの制御性T細胞に比較して,インターロイキン10,CTLA4,ICOS,GITRといった免疫制御タンパク質の発現が顕著に低下していた.これより,大腸における制御性T細胞の機能的な成熟にはUhrf1に依存的な細胞増殖が必須であることが明らかとなった.
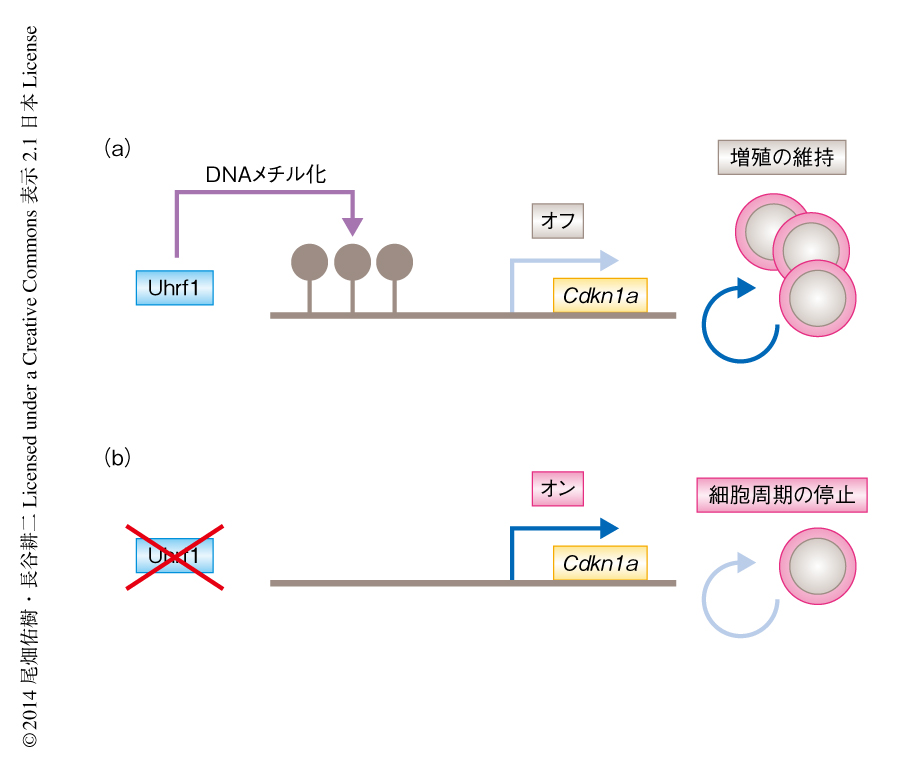
Uhrf1はDNA複製の際にヘミメチル化部位を認識してDNAメチル化転移酵素Dnmt1をリクルートすることにより,DNAメチル化の維持に必須の役割をはたしている5,6).そこで,Uhrf1を欠損した制御性T細胞および正常な制御性T細胞において,ゲノムワイドなDNAメチル化およびトランスクリプトームの解析を行った.これらのデータの統合解析から,Uhrf1は細胞周期制御タンパク質であるp21をコードするCdkn1a遺伝子の遠位プロモーター領域におけるDNAメチル化を促進することにより,その発現を抑制していることが明らかになった(図1).Uhrf1を欠損したナイーブT細胞から制御性T細胞の分化を誘導すると,G1期において細胞周期は停止し細胞増殖が起こらないが,このときCdkn1a遺伝子をノックダウンすると細胞周期の停止が軽減された.これより,Uhrf1はDNAメチル化を介しCdkn1a遺伝子の発現をエピジェネティックに抑制することにより,制御性T細胞の増殖を保証することが証明された.
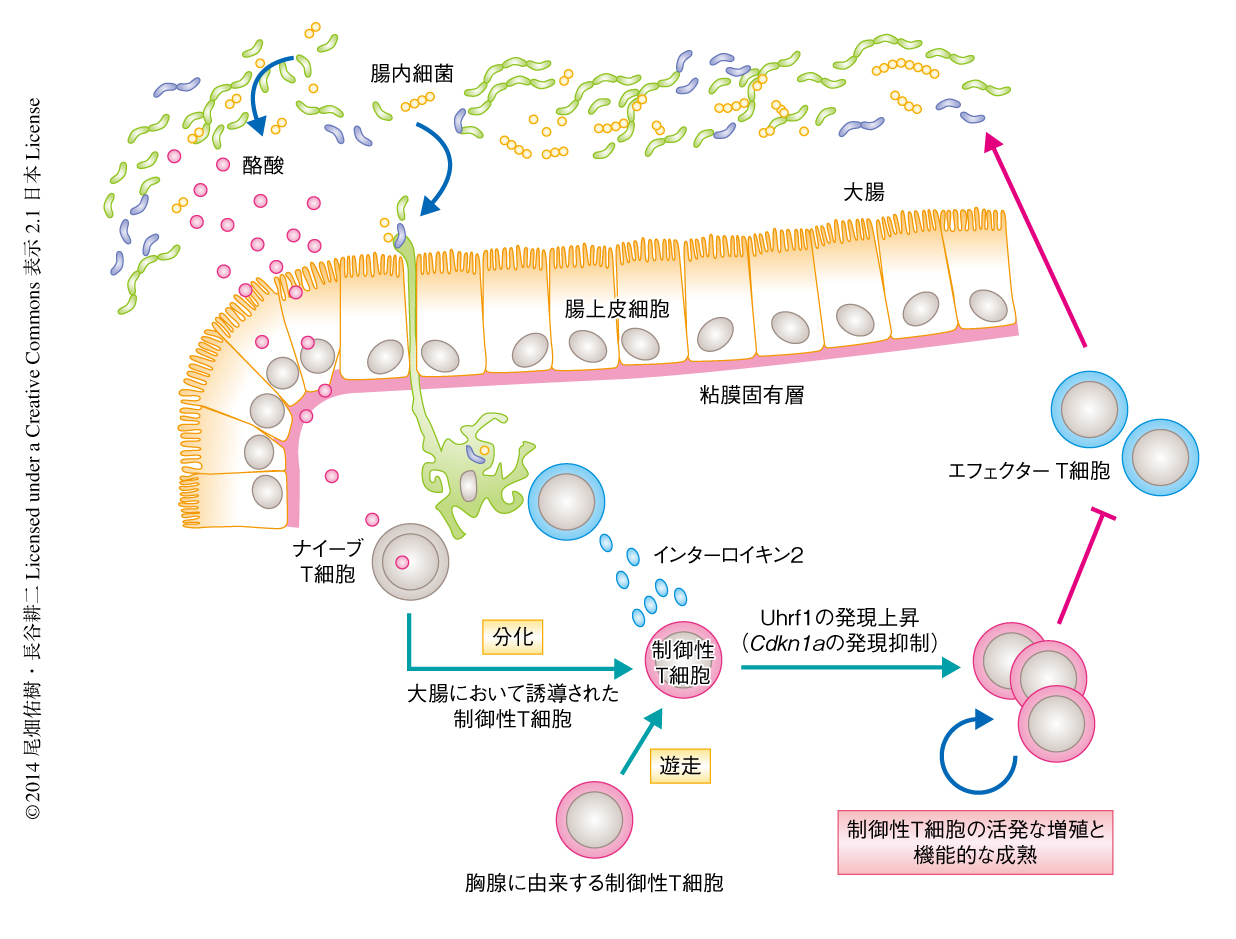
大腸において制御性T細胞は腸内細菌に対する過剰な免疫応答を抑制することにより炎症の発症を未然に防いでいる8).この機構の異常は,クローン病や潰瘍性大腸炎などの炎症性腸疾患の発症につながる.T細胞に特異的なUhrf1ノックアウトマウスにおいては,加齢とともに大腸へのリンパ球の浸潤と粘膜の肥厚を特徴とする慢性大腸炎を自然発症した.一方で,大腸以外の臓器では炎症は認められなかった.これは,このUhrf1ノックアウトマウスにおいて,大腸以外の組織では制御性T細胞が正常に維持されているためであった.無菌環境において飼育したT細胞に特異的なUhrf1ノックアウトマウスは大腸炎を発症しなかったことから,腸内細菌に対する過剰な免疫応答が炎症の原因と考えられた.SPF環境において飼育したT細胞に特異的なUhrf1ノックアウトマウスでは,大腸における炎症性サイトカインの発現が顕著に上昇し,インターフェロンγおよびインターロイキン17Aを産生するT細胞がいちじるしく増加していることがわかった.さらに,正常なマウスに由来する制御性T細胞を若齢のT細胞に特異的なUhrf1ノックアウトマウスに移入すると大腸炎の発症が抑制されたことから,このUhrf1ノックアウトマウスに認められる大腸炎は制御性T細胞の恒常性の破綻によるものであると結論づけられた.以上の結果から,Uhrf1は大腸において制御性T細胞の増殖と機能的な成熟を保証することにより,腸管のエフェクターT細胞が腸内細菌に過剰に応答するのを防ぎ,大腸における免疫恒常性の維持に重要な役割をはたすことが明らかになった(図2).
腸内細菌と哺乳類は1億年以上の共進化の過程をへて適応し共生関係を構築してきた.その結果,腸内フローラと宿主免疫系とは互いに深く影響しあいながら生体の恒常性を維持している.この研究から,腸内細菌の定着は大腸の局所におけるUhrf1に依存的な制御性T細胞の増殖を誘導することがわかった.T細胞においてUhrf1を欠損させると大腸における制御性T細胞の恒常性の破綻により慢性大腸炎をひき起こしたことから,Uhrf1は宿主免疫系と腸内細菌とが共生関係を構築するうえで必須であると考えられた.難治性疾患である炎症性腸疾患は消化管における慢性炎症であり,その発症の機序や原因は完全には明らかにされていない.Uhrf1に依存的な制御性T細胞の増殖や機能的な成熟が炎症性腸疾患の患者においてどのように変化しているのか,さらなる解析が必要であるものの,この研究の成果は炎症性腸疾患の病態の解明にむけた新たな手がかりともなりうる.
略歴:千葉大学大学院医学薬学府博士課程 在学中.
長谷 耕二(Koji Hase)
慶應義塾大学薬学部 教授.
研究室URL:http://www.ims.u-tokyo.ac.jp/dmb/index.html
© 2014 尾畑佑樹・長谷耕二 Licensed under CC 表示 2.1 日本
(東京大学医科学研究所 国際粘膜ワクチン開発研究センター粘膜バリア学分野)
email:長谷耕二
DOI: 10.7875/first.author.2014.072
The epigenetic regulator Uhrf1 facilitates the proliferation and maturation of colonic regulatory T cells.
Yuuki Obata, Yukihiro Furusawa, Takaho A. Endo, Jafar Sharif, Daisuke Takahashi, Koji Atarashi, Manabu Nakayama, Satoshi Onawa, Yumiko Fujimura, Masumi Takahashi, Tomokatsu Ikawa, Takeshi Otsubo, Yuki I. Kawamura, Taeko Dohi, Shoji Tajima, Hiroshi Masumoto, Osamu Ohara, Kenya Honda, Shohei Hori, Hiroshi Ohno, Haruhiko Koseki, Koji Hase
Nature Immunology, 15, 571-579 (2014)
要 約
消化管の粘膜にはおよそ100兆個の腸内細菌が生息している.腸内細菌は宿主の免疫系の成熟を促進する一方で,腸内細菌に対する過剰な免疫応答は消化管における慢性炎症の発症の原因となる.こうした病理的な炎症を防ぐため,腸管には免疫抑制能をもつ制御性T細胞が多く存在している.この研究において,筆者らは,DNA維持メチル化を介するエピゲノム制御タンパク質であるUhrf1が,大腸における制御性T細胞の増殖および機能的な成熟に必須であることを見い出した.Uhrf1の発現は腸内細菌が定着した直後の大腸に存在する制御性T細胞において顕著に上昇していた.T細胞に特異的なUhrf1ノックアウトマウスは,大腸における制御性T細胞の恒常性の破綻により慢性大腸炎を自然発症した.ゲノムワイドなDNAメチル化およびトランスクリプトームの解析から,Uhrf1は細胞周期制御タンパク質であるp21をコードするCdkn1a遺伝子のプロモーター領域におけるDNAメチル化の維持に必須であることが判明した.以上の結果から,Uhrf1は大腸における制御性T細胞の増殖および機能的な成熟を保証することにより,腸管免疫系が腸内細菌に対し過剰に応答することを未然に防ぎ,大腸における免疫恒常性の維持に必須の役割をはたしていることが明らかになった.
はじめに
哺乳類の胎児は,母体においては無菌の状態で維持されているが,出生の直後には膨大な数の微生物にさらされる.これらは,おもに皮膚や消化管の粘膜など外界の環境との境界となる部位に常在細菌として定着する.とくに,ヒトの消化管には100兆個にもおよぶ常在細菌が定着している.大腸はこれら常在細菌が増殖するのに適した環境であり,おもに嫌気性の細菌が糞便1 gあたり約1000億個というきわめて高い密度で生息している.これらおのおのの細菌は互いに影響しあい一定のバランスを保ちながら腸内細菌叢(腸内フローラ)を形成している.
腸内細菌の定着は宿主免疫系の成熟や機能の維持に大きく影響する1).腸内細菌のまったく存在しない無菌マウスでは,腸管における免疫誘導組織である腸管関連リンパ組織の発達が悪いほか,γδT細胞をはじめとする上皮内リンパ球,また,粘膜における主要な免疫グロブリンである分泌型免疫グロブリンAを産生する形質細胞の数も少ない.無菌マウスでは通常に飼育したマウスと比較して上皮性の抗菌ペプチドの産生が少なく,腸上皮の細胞のターンオーバーが遅いなど,粘膜のバリア機能も低下している.よって,腸内細菌の存在は腸管免疫系の構築にきわめて重要な役割をはたしているといえる.その一方で,腸内細菌に対する腸管免疫系の異常な活性化は,消化管における病理的な慢性炎症の発症の原因となる.したがって,出生ののちの無菌状態から腸内細菌が定着する際には,腸内細菌に対する過剰な免疫応答を抑制する機構がはたらかなければならない.腸管において免疫応答を抑制する細胞の代表として制御性T細胞があげられる.大腸において制御性T細胞は腸内細菌の定着により誘導され2,3),成獣のマウスでは最終的にCD4陽性T細胞のうちおよそ1/3から半数をしめることが知られている.これら大腸に存在する制御性T細胞はCTLA-4やインターロイキン10を高く発現しており,腸内細菌に対する免疫制御に深くかかわっていることが予想される.しかしながら,制御性T細胞がどのような機構により機能的に成熟し,病理的な炎症が惹起されることなく腸内細菌と宿主免疫系との共生関係が構築されるのかは不明であった.
なお,免疫系における恒常性の維持と制御性T細胞については,濱口真英・坂口志文, 領域融合レビュー, 2, e005, 2013,腸内細菌と腸管免疫については,本田 賢也, 領域融合レビュー, 2, e011, 2013 も参照されたい.
1.腸内細菌の定着による制御性T細胞の活発な増殖とUhrf1の発現の上昇
母体の無菌状態から出生ののち腸内細菌が定着するまでの過程を模倣して,無菌マウスを無菌環境から通常の環境(SPF環境,SPF:specific pathogen free,特定病原体除去)へと移動した際の制御性T細胞の応答を調べた.その結果,腸内細菌の定着が大腸の粘膜固有層における制御性T細胞の増殖を顕著に誘導することがわかった.また,大腸における制御性T細胞の増殖応答にさきだち,インターロイキン2を産生するエフェクターT細胞が大腸においてのみ一過性に増加した.インターロイキン2を中和すると制御性T細胞の増殖が抑制されたことから,細菌の定着の初期に誘導されるインターロイキン2に対する応答が制御性T細胞の増殖をひき起こすと考えられた.制御性T細胞の活発な増殖は,腸内細菌が定着してまもない授乳中のマウスにおいても顕著に認められた.一方,脾臓においては制御性T細胞の増殖応答は認められなかった.したがって,腸内細菌の定着は大腸の局所において制御性T細胞の活発な増殖を誘導することが示唆された.
最近,筆者らは,腸内細菌が食物繊維などの発酵分解により産生する代謝産物のひとつである酪酸が,大腸の粘膜固有層における制御性T細胞の分化を誘導することを見い出した4)(新着論文レビュー でも掲載).一方で,酪酸は大腸における制御性T細胞の増殖には影響しない.したがって,大腸における制御性T細胞の分化および増殖は,それぞれ異なる機構により制御されていると考えられた.そこで,腸内細菌に応答して大腸において制御性T細胞の増殖を制御する責任遺伝子の同定を試みた.無菌マウス,および,無菌マウスにSPFマウスに由来する腸内細菌を定着させたSPF化マウスの大腸の粘膜固有層から,制御性T細胞の集団およびそれ以外のヘルパーT細胞の集団を取得し,ゲノムワイドな遺伝子発現解析を行った.このデータをもとに,腸内細菌の定着に応答して制御性T細胞において特異的に発現が上昇する,インターロイキン2に応答性の遺伝子を抽出した.さらに,遺伝子オントロジー解析により細胞増殖に関連する遺伝子を絞り込んだ結果,候補遺伝子としてUhrf1をコードする遺伝子が同定された.Uhrf1はDNA維持メチル化を介するエピゲノム制御タンパク質である5,6).Uhrf1の発現は生後から離乳までの活発な増殖期にある制御性T細胞においても上昇していた.一方で,腸内細菌の定着したマウスの脾臓に存在する制御性T細胞においてはUhrf1の発現の誘導は起こらなかったことから,Uhrf1は大腸の局所における制御性T細胞の増殖応答にかかわる可能性が示唆された.
2.Uhrf1を介した大腸における制御性T細胞の恒常性の維持の機構
制御性T細胞の増殖応答におけるUhrf1の役割を調べるため,T細胞において特異的なUhrf1ノックアウトマウスを作出した.このUhrf1ノックアウトマウスの大腸では,離乳の直後において制御性T細胞の割合が顕著に減少していた.これは,大腸における制御性T細胞の増殖の低下によるものであった.さらに,このUhrf1ノックアウトマウスを無菌化し腸内細菌を定着させた場合にも,大腸における制御性T細胞の増殖は起こりにくくなっていた.一方で,脾臓や胸腺における制御性T細胞の割合は,対照となるマウスとこのUhrf1ノックアウトマウスとのあいだで差がなかったことから,Uhrf1は大腸の局所における制御性T細胞の細胞増殖の維持に必須であることが明らかになった.
in vitroにおける観察の結果から制御性T細胞は複数回の細胞分裂により免疫制御作用を獲得することが示唆されている7).そこで,大腸に存在する制御性T細胞において,制御性T細胞の増殖活性と免疫制御タンパク質の発現との相関を調べたところ,増殖性の制御性T細胞のほうが非増殖性の制御性T細胞よりもより高いレベルで免疫制御タンパク質を発現していることがわかった.つまり,大腸における制御性T細胞の活発な増殖は機能的な成熟を促進することが示唆された.T細胞に特異的なUhrf1ノックアウトマウスの大腸に残存する制御性T細胞においては,対照となるマウスの制御性T細胞に比較して,インターロイキン10,CTLA4,ICOS,GITRといった免疫制御タンパク質の発現が顕著に低下していた.これより,大腸における制御性T細胞の機能的な成熟にはUhrf1に依存的な細胞増殖が必須であることが明らかとなった.
Uhrf1はDNA複製の際にヘミメチル化部位を認識してDNAメチル化転移酵素Dnmt1をリクルートすることにより,DNAメチル化の維持に必須の役割をはたしている5,6).そこで,Uhrf1を欠損した制御性T細胞および正常な制御性T細胞において,ゲノムワイドなDNAメチル化およびトランスクリプトームの解析を行った.これらのデータの統合解析から,Uhrf1は細胞周期制御タンパク質であるp21をコードするCdkn1a遺伝子の遠位プロモーター領域におけるDNAメチル化を促進することにより,その発現を抑制していることが明らかになった(図1).Uhrf1を欠損したナイーブT細胞から制御性T細胞の分化を誘導すると,G1期において細胞周期は停止し細胞増殖が起こらないが,このときCdkn1a遺伝子をノックダウンすると細胞周期の停止が軽減された.これより,Uhrf1はDNAメチル化を介しCdkn1a遺伝子の発現をエピジェネティックに抑制することにより,制御性T細胞の増殖を保証することが証明された.
3.大腸における免疫恒常性の維持にはたすUhrf1の役割
大腸において制御性T細胞は腸内細菌に対する過剰な免疫応答を抑制することにより炎症の発症を未然に防いでいる8).この機構の異常は,クローン病や潰瘍性大腸炎などの炎症性腸疾患の発症につながる.T細胞に特異的なUhrf1ノックアウトマウスにおいては,加齢とともに大腸へのリンパ球の浸潤と粘膜の肥厚を特徴とする慢性大腸炎を自然発症した.一方で,大腸以外の臓器では炎症は認められなかった.これは,このUhrf1ノックアウトマウスにおいて,大腸以外の組織では制御性T細胞が正常に維持されているためであった.無菌環境において飼育したT細胞に特異的なUhrf1ノックアウトマウスは大腸炎を発症しなかったことから,腸内細菌に対する過剰な免疫応答が炎症の原因と考えられた.SPF環境において飼育したT細胞に特異的なUhrf1ノックアウトマウスでは,大腸における炎症性サイトカインの発現が顕著に上昇し,インターフェロンγおよびインターロイキン17Aを産生するT細胞がいちじるしく増加していることがわかった.さらに,正常なマウスに由来する制御性T細胞を若齢のT細胞に特異的なUhrf1ノックアウトマウスに移入すると大腸炎の発症が抑制されたことから,このUhrf1ノックアウトマウスに認められる大腸炎は制御性T細胞の恒常性の破綻によるものであると結論づけられた.以上の結果から,Uhrf1は大腸において制御性T細胞の増殖と機能的な成熟を保証することにより,腸管のエフェクターT細胞が腸内細菌に過剰に応答するのを防ぎ,大腸における免疫恒常性の維持に重要な役割をはたすことが明らかになった(図2).
おわりに
腸内細菌と哺乳類は1億年以上の共進化の過程をへて適応し共生関係を構築してきた.その結果,腸内フローラと宿主免疫系とは互いに深く影響しあいながら生体の恒常性を維持している.この研究から,腸内細菌の定着は大腸の局所におけるUhrf1に依存的な制御性T細胞の増殖を誘導することがわかった.T細胞においてUhrf1を欠損させると大腸における制御性T細胞の恒常性の破綻により慢性大腸炎をひき起こしたことから,Uhrf1は宿主免疫系と腸内細菌とが共生関係を構築するうえで必須であると考えられた.難治性疾患である炎症性腸疾患は消化管における慢性炎症であり,その発症の機序や原因は完全には明らかにされていない.Uhrf1に依存的な制御性T細胞の増殖や機能的な成熟が炎症性腸疾患の患者においてどのように変化しているのか,さらなる解析が必要であるものの,この研究の成果は炎症性腸疾患の病態の解明にむけた新たな手がかりともなりうる.
文 献
- Chung, H., Pamp, S. J., Hill, J. A. et al.: Gut immune maturation depends on colonization with a host-specific microbiota. Cell, 149, 1578-1593 (2012)[PubMed]
- Atarashi, K., Tanoue, T., Shima, T. et al.: Induction of colonic regulatory T cells by indigenous Clostridium species. Science, 331, 337-341 (2011)[PubMed]
- Atarashi, K., Tanoue, T., Oshima, K. et al.: Treg induction by a rationally selected mixture of Clostridia strains from the human microbiota. Nature, 500, 232-236 (2013)[PubMed]
- Furusawa, Y., Obata, Y., Fukuda, S. et al.: Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature, 504, 446-450 (2013)[PubMed][新着論文レビュー]
- Sharif, J., Muto, M., Takebayashi, S. et al.: The SRA protein Np95 mediates epigenetic inheritance by recruiting Dnmt1 to methylated DNA. Nature, 450, 908-912 (2007)[PubMed]
- Bostick, M., Kim, J. K., Esteve, P. O. et al.: UHRF1 plays a role in maintaining DNA methylation in mammalian cells. Science, 317, 1760-1764 (2007)[PubMed]
- Barthlott, T., Moncrieffe, H., Veldhoen, M. et al.: CD25+CD4+ T cells compete with naive CD4+ T cells for IL-2 and exploit it for the induction of IL-10 production. Int. Immunol., 17, 279-288 (2005)[PubMed]
- Round, J. L. & Mazmanian, S. K.: The gut microbiota shapes intestinal immune responses during health and disease. Nat. Rev. Immunol., 9, 313-323 (2009)[PubMed]
著者プロフィール
略歴:千葉大学大学院医学薬学府博士課程 在学中.
長谷 耕二(Koji Hase)
慶應義塾大学薬学部 教授.
研究室URL:http://www.ims.u-tokyo.ac.jp/dmb/index.html
© 2014 尾畑佑樹・長谷耕二 Licensed under CC 表示 2.1 日本