成体脳を移動する新生ニューロンは周囲のアストロサイトの形態を制御することにより移動経路を形成・維持している
金子奈穂子・澤本和延
(名古屋市立大学大学院医学研究科 再生医学分野)
email:澤本和延
DOI: 10.7875/first.author.2010.016
New neurons clear the path of astrocytic processes for their rapid migration in the adult brain.
Naoko Kaneko, Oscar Marín, Masato Koike, Yuki Hirota, Yasuo Uchiyama, Jane Y. Wu, Qiang Lu, Marc Tessier-Lavigne, Arturo Alvarez-Buylla, Hideyuki Okano, John L.R. Rubenstein, Kazunobu Sawamoto
Neuron, 67, 213-223 (2010)
発達期をおえた成体脳でも側脳室の周囲の“脳室下帯”では持続的にニューロンが産生されている.新生ニューロンはアストロサイトにより形成されたトンネルの内部をとおって嗅球へと高速度で移動しているが,このトンネルの形成・維持や新生ニューロンとの相互作用の分子機構については不明であった.筆者らは,この研究で,新生ニューロンが分泌するタンパク質Slitが,トンネルを形成するアストロサイトに発現している受容体Roboを介してその形態や分布を制御し,自らの移動経路を維持しているという,成体脳に独自の細胞間相互作用による新規の移動制御の分子機構を明らかにした.
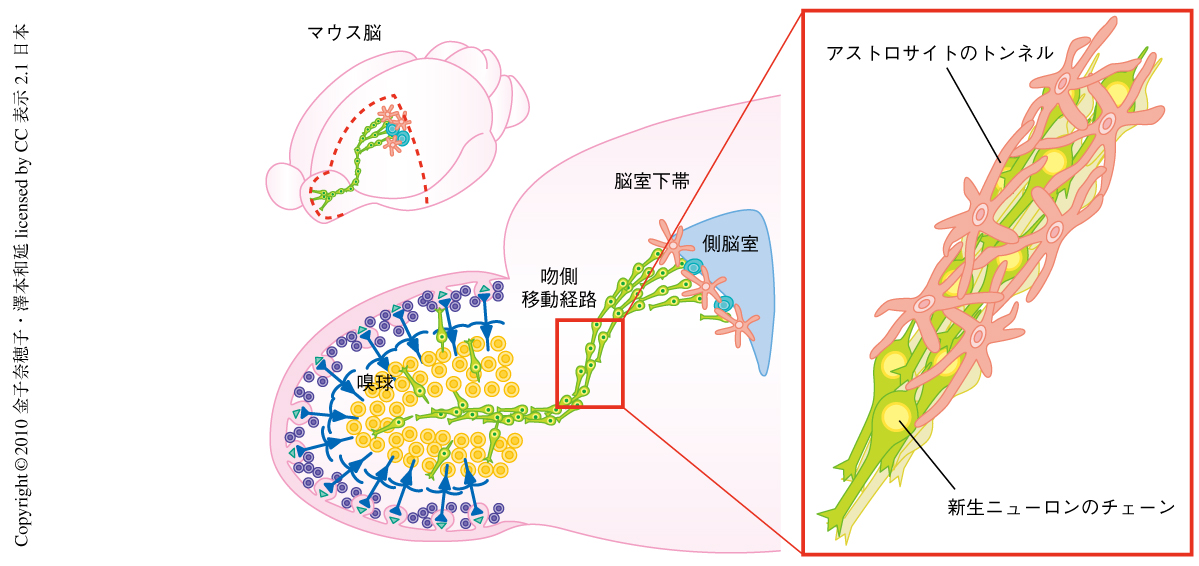
成体脳においても,側脳室の外側壁に存在する脳室下帯,および,大脳辺縁系に属する海馬歯状回では神経幹細胞がニューロンを産生しつづけていることが明らかになっている.脳室下帯で産生された新生ニューロンは吻側移動経路(rostral migratory stream,RMS)とよばれる移動経路をとおって,脳の最前端の嗅球までの長距離をわずか数日のうちに移動していく1-3)(図1,左).新生ニューロンの役割や生理的な意義についてはいまだ不明な点が多いが,発達をおえた成体脳の内部でこのようなダイナミックなニューロンの移動が行われているということには驚くべきである.
ニューロンの移動は脳の形成過程において大規模に行われる.特定の場所で産生された未熟なニューロンは,最終的にニューロンとしての機能をはたす場所へ移動し分化・成熟する.発達過程において新生ニューロンの移動を制御することが知られているタンパク質の一部は,成体脳の吻側移動経路における新生ニューロンの移動にも関与していることが近年の研究により明らかになった.しかし,成体脳は神経線維やグリア細胞の突起の発達した組織であり,この成熟した組織の内部を移動するには発達期とは異なった分子機構による制御が必要であるものと考えられる.
一般的に,細胞の移動方向は移動環境における多様な誘引性因子および忌避性因子の分布と,移動する細胞自体の受容体の発現パターンによって制御されている.Slitタンパク質は脳の発達過程において忌避性因子として移動する細胞や軸索の伸長方向を反発性に誘導することが広く知られている分泌性のガイダンス因子である4,5).脳においては機能や構造がよく似たSlit1とSlit2が発現しており,発達期をおえた脳でも一部の領域では発現が持続するが,これらのSlitの役割はほとんどわかっていない.しかし,興味深いことに,成体脳の吻側移動経路においてSlit1が移動する新生ニューロンに発現していることが報告された6).移動する細胞自体が忌避性因子Slitを発現するという典型的なガイダンス因子としての作用モデルとは明らかに異なったこの発現パターンから,筆者らは,Slit1が新生ニューロンと周囲組織との相互作用に関与しているのではないかと考えた.
成体脳の内部の吻側移動経路における新生ニューロンの移動には,胎生期のニューロンの移動とは異なった2つの大きな形態的な特徴が知られている1-3)(図1,右).ひとつは,移動する新生ニューロンが細長い鎖状の細胞塊“チェーン”を形成し,このなかで互いを足場として乗り越えながら移動する“鎖状移動”(chain-migration)という移動形式である.もうひとつは,このチェーンが移動する通路を形成するトンネル構造である.このトンネルは,脳の発達の末期から現われるグリア細胞の一種であるアストロサイトの突起によって形成され,“グリアチューブ”とよばれている.ニューロンの鎖状移動が障害されるいくつかの遺伝子変異マウスにおいて同時にアストロサイトのトンネル構造にも異常がみられるため7-10),この構造の形成・維持と新生ニューロンの正常な鎖状移動とは関連の深い事象であると推測された.吻側移動経路のアストロサイトの機能に焦点をあてた研究はごく少数しかないが,分泌性タンパク質および非分泌性タンパク質の発現や細胞外環境に供された移動調節タンパク質の量や分布の調節によって新生ニューロンの移動の制御されていることが報告されている.しかし,この特徴的なアストロサイトのトンネル構造がどのように形成・維持されているのか,また,新生ニューロンとの相互作用がどのような分子機構で調節されているのかは解明されていなかった.筆者らは,この研究で,新生ニューロンが忌避性因子Slit1の分泌によってこのトンネル構造を制御し自らの移動経路を形成・維持するという新規の分子機構を明らかにした.
Slit1ノックアウトマウスの新生ニューロンの移動経路(脳室下帯-吻側移動経路-嗅球)では,脳室下帯前方が拡大し嗅球側の経路が狭小化するという新生ニューロンの移動障害を示唆する組織像が得られた.まず,新生ニューロンの移動へのSlit1の関与を明らかにするため,野生型マウスとSlit1ノックアウトマウスの脳切片において吻側移動経路を移動する新生ニューロンを蛍光色素で標識し,実際に組織の内部を移動するようすを経時的に観察した.野生型マウスの吻側移動経路では新生ニューロンは嗅球へむかって直線的に移動し,その平均速度は時速120μm以上であったが,Slit1ノックアウトマウスの吻側移動経路では新生ニューロンの移動方向は不規則で,移動速度も40%ほど低下していた.
つぎに,Slit1の新生ニューロンの移動における機能が細胞自律的なものであるかどうかを,野生型マウス脳およびSlit1ノックアウトマウス脳の切片培養への野生型新生ニューロンおよびSlit1ノックアウト新生ニューロンの移植実験によって検討した.すると,野生型マウス脳切片の吻側移動経路を移動する野生型ニューロンの移動速度に対し,野生型マウス脳切片におけるSlit1ノックアウトニューロンの移動速度,および,Slit1ノックアウトマウス脳切片における野生型ニューロンの移動速度は有意に低下しており,新生ニューロンの発現するSlit1は,細胞自律的な面および細胞非自律的な面の両方の側面から自らの細胞移動を制御していることが明らかになった.
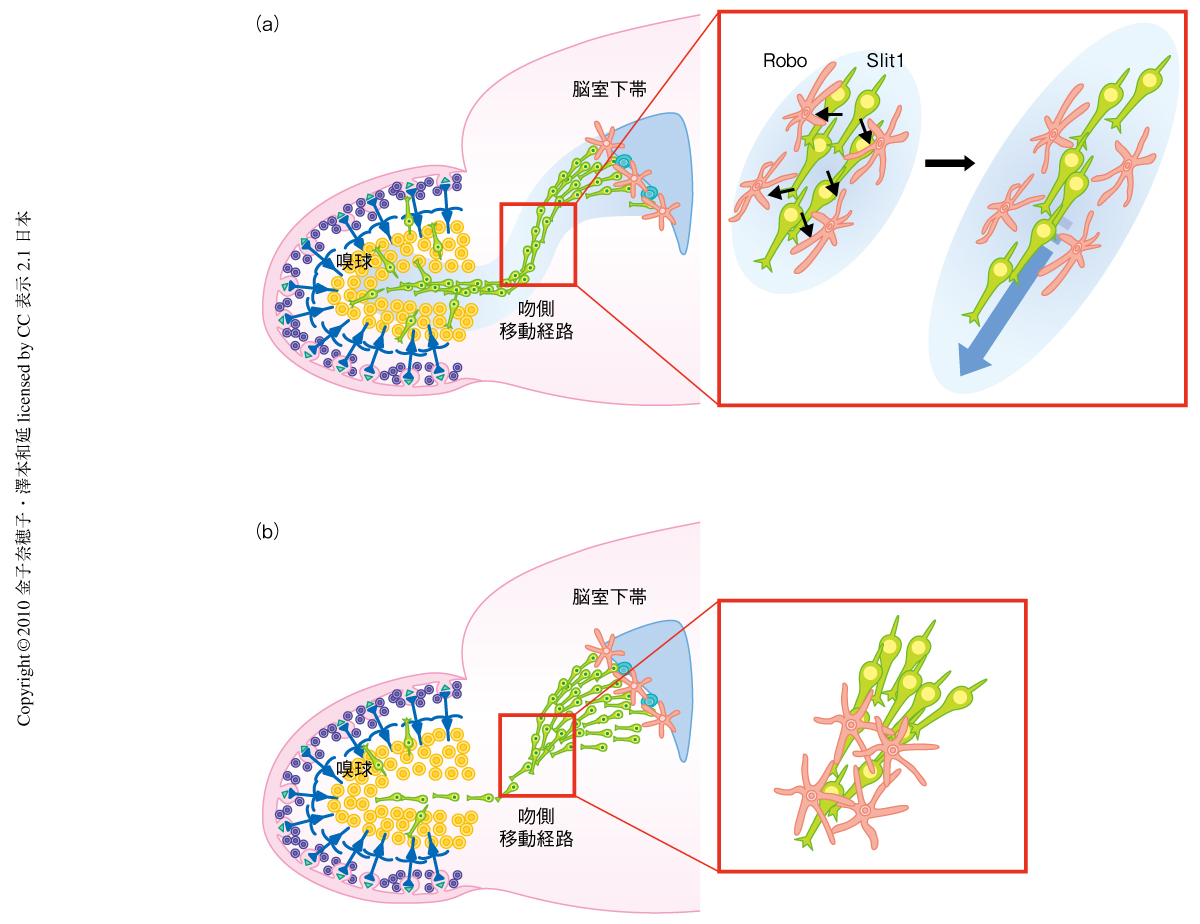
Slitはその受容体Roboに結合することで細胞内シグナルに変換される.Roboサブタイプには,Robo1,Robo2,Robo3/Rig1と,血管内皮細胞に発現するRobo4の4種類が存在する.各タンパク質に特異的な抗体(大阪大学大学院生命機能研究科 村上富士夫教授より供与)を用いた免疫染色により,脳室下帯-吻側移動経路-嗅球周辺領域におけるRobo1,Robo2,Robo3の発現パターンを調べた.すると,Robo2とRobo3はこの経路にそって強く発現していることがわかった.また,Robo2とRobo3の両者とも移動する新生ニューロンに発現していたが,意外なことに,周囲でトンネルを形成するアストロサイトの細胞体および突起により強く発現していた.つまり,吻側移動経路では,新生ニューロンにリガンドであるSlitが,周囲のアストロサイトにその受容体Roboが発現しているという,従来の忌避性ガイダンスシグナルとしての作用から推測された分布とは異なるパターンをとっていることがわかった.これらから,新生ニューロンとアストロサイトとの相互作用にSlit-Roboシグナルが関与している可能性が示唆された.
この可能性を検討するため,Slit1ノックアウトマウスの吻側移動経路におけるアストロサイトのトンネル構造を詳細に解析した.脳室下帯-吻側移動経路-嗅球を含む矢状断切片における新生ニューロンのチェーンとアストロサイトの突起の配列を二重免疫染色により解析したところ,野生型マウスの吻側移動経路では大部分のアストロサイトの突起が新生ニューロンのチェーンにそって伸展しているのに対し,Slit1ノックアウトマウスではアストロサイトの突起の伸展方向は不規則で,チェーンと交差して走行する突起も多数みられた.吻側移動経路の新生ニューロンおよびアストロサイトの形態や細胞間の相互関係および配置は,電子顕微鏡を用いた解析により詳細に記述されている.この方法を用いてSlit1ノックアウトマウスの吻側移動経路を解析したところ,野生型マウスにおいてアストロサイトの突起は新生ニューロンのチェーンの周囲を被覆するように配置されその内部にはほとんど存在していなかったが,Slit1ノックアウトマウスではチェーンの内部への突起の侵入がしばしば観察された.これらの結果から,新生ニューロンに由来するSlit1が周囲のアストロサイトの形態や突起の配列に関与していることが示唆された.
そこで,これらのアストロサイトに対するSlitの直接の作用をin vitroで検証した.Slitを安定的に産生するHEK細胞株を混ぜ込んだコラーゲンゲルの小塊を中央に固定した培養プレートの周囲に,脳室下帯および吻側移動経路から単離培養したRoboを発現するアストロサイトを共培養したところ,Slitを分泌しない対照群のHEK細胞を混和したゲル上には多数のアストロサイトが移動してきていたのに対し,Slitを含むゲル上へのアストロサイトの移動は抑制されていた.また,このSlit含有ゲルのアストロサイト反発作用は,Roboのドミナントネガティブ体や,Robo2およびRobo3のshRNAの導入により消失したことから,アストロサイトのRoboを介したものであることが示された.
吻側移動経路を移動する新生ニューロンのダイナミックな形態変化やその分子機構についてはこれまでに詳細に研究されてきたが,その移動経路であるトンネルを形成するアストロサイトの挙動については過去に報告はない.筆者らは,蛍光タンパク質で標識されたアストロサイトと新生ニューロンとを生体組織を模した3次元ゲル内で共培養し,タイムラプス撮影を行って両者の相互作用を3次元的に観察した.すると,新生ニューロンが接した部分のアストロサイトの細胞膜がその移動方向にそって陥入し,溝のような構造をつくっていることが見い出された.この溝は新生ニューロンが通過すると消失する一時的なもので,アストロサイトは新生ニューロンの移動にともなって非常に動的にその形態を変化させていることがわかった.
この形態変化を定量的に評価するため,アストロサイトの単層培養上を新生ニューロンの集団が移動する2次元的な培養条件をつくりだした.Roboのドミナントネガティブ体の導入によりアストロサイトのRoboシグナル伝達を抑制させたとき,あるいは,共培養する新生ニューロンのSlit1が欠損しているときのいずれも,この形態変化の出現頻度は低下した.よって,新生ニューロンとの接点におけるアストロサイトの形態変化は,移動する新生ニューロンに由来するSlit1とアストロサイトに存在する受容体Roboとを介するものであることが示唆された.
つぎに,アストロサイトの形態変化と新生ニューロンの移動速度との関係を調べた.Roboのドミナントネガティブ体の導入によってアストロサイトの形態変化を抑制すると,同時に,新生ニューロンの移動速度も低下した.また,Slit1ノックアウトマウスの新生ニューロンは,アストロサイトが存在しない培養条件における移動では野生型の新生ニューロンと比較して障害はみられないのにもかかわらず,アストロサイトとの共培養条件ではその移動は抑制されていた.つまり,新生ニューロンはアストロサイトのうえを高速で移動するため,自らの分泌するSlit1とアストロサイトの受容体Roboとの相互作用を必要とすることが明らかになった.
以上の結果から,新生ニューロンに由来するSlit1とアストロサイトにある受容体Roboとの相互作用がアストロサイトの形態および分布を制御し,新生ニューロンの移動経路であるトンネル構造を維持することによりその高速移動を可能にする,という成体脳のニューロン移動における新たな分子機構が示された(図2).
ニューロンの移動が大規模に行われる発生期の知見を基盤とした研究により,成体脳における新生ニューロンの移動に関与するさまざまな分子機構が報告されてきたが,成体脳の細胞構築や細胞外環境は発生過程とは大きく異なっている.この研究の対象である吻側移動経路のアストロサイトのトンネルは胎生期には存在せず,ニューロンの移動が吻側移動経路のみに限定された現象となる生後に形成されるため,成体脳の内部でニューロンの長距離かつ高速の移動を可能にする重要な構造であるものと考えられている.筆者らは,この研究により,新生ニューロンが自らSlit1の分泌を介してその受容体Roboを発現している周囲のアストロサイトの形態を変化させ,自ら移動経路を形成・維持しているという,成体脳の新生ニューロンの能動的な移動制御の分子機構をはじめて提示した.
脳室下帯で産生された新生ニューロンは,ニューロンの脱落するような傷害がくわわると傷害部に移動してごく少数ではあるがニューロンを再生する11,12).この過程を促進し多くのニューロンを再生することができれば,現在は不可逆性の病態と考えられているさまざまな脳疾患に対する治療的な戦略となる可能性がある.この研究で明らかになった細胞間相互作用による成体脳の内部での新生ニューロンの移動制御系は,ニューロン再生過程の理解やその促進手法の開発にかかわる再生医学的な応用性が期待される.
精神科臨床医として勤務ののち,山梨大学医学系大学院博士課程に在学中に慶應義塾大学医学部生理学教室(岡野栄之教授)に派遣され共同研究員として研究を行う.2007年 同 修了ののち,名古屋市立大学大学院医学研究科 澤本和延教授のもとで研究を開始し,2009年より同 助教.
研究テーマ:げっ歯類~霊長類におけるニューロン新生・再生機構の解析.
抱負:成体脳の内部でニューロンが高速で動いているのがとてもおもしろい.正常や傷害などさまざまな状況下での新生ニューロンの移動のようすをきれいに可視化したい.
澤本 和延(Kazunobu Sawamoto)
名古屋市立大学大学院医学研究科 教授.
研究室URL:http://k-sawamoto.com/
© 2010 金子奈穂子・澤本和延 Licensed under CC 表示 2.1 日本
(名古屋市立大学大学院医学研究科 再生医学分野)
email:澤本和延
DOI: 10.7875/first.author.2010.016
New neurons clear the path of astrocytic processes for their rapid migration in the adult brain.
Naoko Kaneko, Oscar Marín, Masato Koike, Yuki Hirota, Yasuo Uchiyama, Jane Y. Wu, Qiang Lu, Marc Tessier-Lavigne, Arturo Alvarez-Buylla, Hideyuki Okano, John L.R. Rubenstein, Kazunobu Sawamoto
Neuron, 67, 213-223 (2010)
要 約
発達期をおえた成体脳でも側脳室の周囲の“脳室下帯”では持続的にニューロンが産生されている.新生ニューロンはアストロサイトにより形成されたトンネルの内部をとおって嗅球へと高速度で移動しているが,このトンネルの形成・維持や新生ニューロンとの相互作用の分子機構については不明であった.筆者らは,この研究で,新生ニューロンが分泌するタンパク質Slitが,トンネルを形成するアストロサイトに発現している受容体Roboを介してその形態や分布を制御し,自らの移動経路を維持しているという,成体脳に独自の細胞間相互作用による新規の移動制御の分子機構を明らかにした.
はじめに
成体脳においても,側脳室の外側壁に存在する脳室下帯,および,大脳辺縁系に属する海馬歯状回では神経幹細胞がニューロンを産生しつづけていることが明らかになっている.脳室下帯で産生された新生ニューロンは吻側移動経路(rostral migratory stream,RMS)とよばれる移動経路をとおって,脳の最前端の嗅球までの長距離をわずか数日のうちに移動していく1-3)(図1,左).新生ニューロンの役割や生理的な意義についてはいまだ不明な点が多いが,発達をおえた成体脳の内部でこのようなダイナミックなニューロンの移動が行われているということには驚くべきである.
ニューロンの移動は脳の形成過程において大規模に行われる.特定の場所で産生された未熟なニューロンは,最終的にニューロンとしての機能をはたす場所へ移動し分化・成熟する.発達過程において新生ニューロンの移動を制御することが知られているタンパク質の一部は,成体脳の吻側移動経路における新生ニューロンの移動にも関与していることが近年の研究により明らかになった.しかし,成体脳は神経線維やグリア細胞の突起の発達した組織であり,この成熟した組織の内部を移動するには発達期とは異なった分子機構による制御が必要であるものと考えられる.
一般的に,細胞の移動方向は移動環境における多様な誘引性因子および忌避性因子の分布と,移動する細胞自体の受容体の発現パターンによって制御されている.Slitタンパク質は脳の発達過程において忌避性因子として移動する細胞や軸索の伸長方向を反発性に誘導することが広く知られている分泌性のガイダンス因子である4,5).脳においては機能や構造がよく似たSlit1とSlit2が発現しており,発達期をおえた脳でも一部の領域では発現が持続するが,これらのSlitの役割はほとんどわかっていない.しかし,興味深いことに,成体脳の吻側移動経路においてSlit1が移動する新生ニューロンに発現していることが報告された6).移動する細胞自体が忌避性因子Slitを発現するという典型的なガイダンス因子としての作用モデルとは明らかに異なったこの発現パターンから,筆者らは,Slit1が新生ニューロンと周囲組織との相互作用に関与しているのではないかと考えた.
成体脳の内部の吻側移動経路における新生ニューロンの移動には,胎生期のニューロンの移動とは異なった2つの大きな形態的な特徴が知られている1-3)(図1,右).ひとつは,移動する新生ニューロンが細長い鎖状の細胞塊“チェーン”を形成し,このなかで互いを足場として乗り越えながら移動する“鎖状移動”(chain-migration)という移動形式である.もうひとつは,このチェーンが移動する通路を形成するトンネル構造である.このトンネルは,脳の発達の末期から現われるグリア細胞の一種であるアストロサイトの突起によって形成され,“グリアチューブ”とよばれている.ニューロンの鎖状移動が障害されるいくつかの遺伝子変異マウスにおいて同時にアストロサイトのトンネル構造にも異常がみられるため7-10),この構造の形成・維持と新生ニューロンの正常な鎖状移動とは関連の深い事象であると推測された.吻側移動経路のアストロサイトの機能に焦点をあてた研究はごく少数しかないが,分泌性タンパク質および非分泌性タンパク質の発現や細胞外環境に供された移動調節タンパク質の量や分布の調節によって新生ニューロンの移動の制御されていることが報告されている.しかし,この特徴的なアストロサイトのトンネル構造がどのように形成・維持されているのか,また,新生ニューロンとの相互作用がどのような分子機構で調節されているのかは解明されていなかった.筆者らは,この研究で,新生ニューロンが忌避性因子Slit1の分泌によってこのトンネル構造を制御し自らの移動経路を形成・維持するという新規の分子機構を明らかにした.
1.Slit1は新生ニューロンの吻側移動経路における高速移動に必要である
Slit1ノックアウトマウスの新生ニューロンの移動経路(脳室下帯-吻側移動経路-嗅球)では,脳室下帯前方が拡大し嗅球側の経路が狭小化するという新生ニューロンの移動障害を示唆する組織像が得られた.まず,新生ニューロンの移動へのSlit1の関与を明らかにするため,野生型マウスとSlit1ノックアウトマウスの脳切片において吻側移動経路を移動する新生ニューロンを蛍光色素で標識し,実際に組織の内部を移動するようすを経時的に観察した.野生型マウスの吻側移動経路では新生ニューロンは嗅球へむかって直線的に移動し,その平均速度は時速120μm以上であったが,Slit1ノックアウトマウスの吻側移動経路では新生ニューロンの移動方向は不規則で,移動速度も40%ほど低下していた.
つぎに,Slit1の新生ニューロンの移動における機能が細胞自律的なものであるかどうかを,野生型マウス脳およびSlit1ノックアウトマウス脳の切片培養への野生型新生ニューロンおよびSlit1ノックアウト新生ニューロンの移植実験によって検討した.すると,野生型マウス脳切片の吻側移動経路を移動する野生型ニューロンの移動速度に対し,野生型マウス脳切片におけるSlit1ノックアウトニューロンの移動速度,および,Slit1ノックアウトマウス脳切片における野生型ニューロンの移動速度は有意に低下しており,新生ニューロンの発現するSlit1は,細胞自律的な面および細胞非自律的な面の両方の側面から自らの細胞移動を制御していることが明らかになった.
2.Roboはトンネルを形成しているアストロサイトに発現している
Slitはその受容体Roboに結合することで細胞内シグナルに変換される.Roboサブタイプには,Robo1,Robo2,Robo3/Rig1と,血管内皮細胞に発現するRobo4の4種類が存在する.各タンパク質に特異的な抗体(大阪大学大学院生命機能研究科 村上富士夫教授より供与)を用いた免疫染色により,脳室下帯-吻側移動経路-嗅球周辺領域におけるRobo1,Robo2,Robo3の発現パターンを調べた.すると,Robo2とRobo3はこの経路にそって強く発現していることがわかった.また,Robo2とRobo3の両者とも移動する新生ニューロンに発現していたが,意外なことに,周囲でトンネルを形成するアストロサイトの細胞体および突起により強く発現していた.つまり,吻側移動経路では,新生ニューロンにリガンドであるSlitが,周囲のアストロサイトにその受容体Roboが発現しているという,従来の忌避性ガイダンスシグナルとしての作用から推測された分布とは異なるパターンをとっていることがわかった.これらから,新生ニューロンとアストロサイトとの相互作用にSlit-Roboシグナルが関与している可能性が示唆された.
3.SlitはRoboを介してアストロサイトの分布や突起の配列を制御する
この可能性を検討するため,Slit1ノックアウトマウスの吻側移動経路におけるアストロサイトのトンネル構造を詳細に解析した.脳室下帯-吻側移動経路-嗅球を含む矢状断切片における新生ニューロンのチェーンとアストロサイトの突起の配列を二重免疫染色により解析したところ,野生型マウスの吻側移動経路では大部分のアストロサイトの突起が新生ニューロンのチェーンにそって伸展しているのに対し,Slit1ノックアウトマウスではアストロサイトの突起の伸展方向は不規則で,チェーンと交差して走行する突起も多数みられた.吻側移動経路の新生ニューロンおよびアストロサイトの形態や細胞間の相互関係および配置は,電子顕微鏡を用いた解析により詳細に記述されている.この方法を用いてSlit1ノックアウトマウスの吻側移動経路を解析したところ,野生型マウスにおいてアストロサイトの突起は新生ニューロンのチェーンの周囲を被覆するように配置されその内部にはほとんど存在していなかったが,Slit1ノックアウトマウスではチェーンの内部への突起の侵入がしばしば観察された.これらの結果から,新生ニューロンに由来するSlit1が周囲のアストロサイトの形態や突起の配列に関与していることが示唆された.
そこで,これらのアストロサイトに対するSlitの直接の作用をin vitroで検証した.Slitを安定的に産生するHEK細胞株を混ぜ込んだコラーゲンゲルの小塊を中央に固定した培養プレートの周囲に,脳室下帯および吻側移動経路から単離培養したRoboを発現するアストロサイトを共培養したところ,Slitを分泌しない対照群のHEK細胞を混和したゲル上には多数のアストロサイトが移動してきていたのに対し,Slitを含むゲル上へのアストロサイトの移動は抑制されていた.また,このSlit含有ゲルのアストロサイト反発作用は,Roboのドミナントネガティブ体や,Robo2およびRobo3のshRNAの導入により消失したことから,アストロサイトのRoboを介したものであることが示された.
4.移動する新生ニューロンはアストロサイトの形態をダイナミックに変化させる
吻側移動経路を移動する新生ニューロンのダイナミックな形態変化やその分子機構についてはこれまでに詳細に研究されてきたが,その移動経路であるトンネルを形成するアストロサイトの挙動については過去に報告はない.筆者らは,蛍光タンパク質で標識されたアストロサイトと新生ニューロンとを生体組織を模した3次元ゲル内で共培養し,タイムラプス撮影を行って両者の相互作用を3次元的に観察した.すると,新生ニューロンが接した部分のアストロサイトの細胞膜がその移動方向にそって陥入し,溝のような構造をつくっていることが見い出された.この溝は新生ニューロンが通過すると消失する一時的なもので,アストロサイトは新生ニューロンの移動にともなって非常に動的にその形態を変化させていることがわかった.
この形態変化を定量的に評価するため,アストロサイトの単層培養上を新生ニューロンの集団が移動する2次元的な培養条件をつくりだした.Roboのドミナントネガティブ体の導入によりアストロサイトのRoboシグナル伝達を抑制させたとき,あるいは,共培養する新生ニューロンのSlit1が欠損しているときのいずれも,この形態変化の出現頻度は低下した.よって,新生ニューロンとの接点におけるアストロサイトの形態変化は,移動する新生ニューロンに由来するSlit1とアストロサイトに存在する受容体Roboとを介するものであることが示唆された.
つぎに,アストロサイトの形態変化と新生ニューロンの移動速度との関係を調べた.Roboのドミナントネガティブ体の導入によってアストロサイトの形態変化を抑制すると,同時に,新生ニューロンの移動速度も低下した.また,Slit1ノックアウトマウスの新生ニューロンは,アストロサイトが存在しない培養条件における移動では野生型の新生ニューロンと比較して障害はみられないのにもかかわらず,アストロサイトとの共培養条件ではその移動は抑制されていた.つまり,新生ニューロンはアストロサイトのうえを高速で移動するため,自らの分泌するSlit1とアストロサイトの受容体Roboとの相互作用を必要とすることが明らかになった.
以上の結果から,新生ニューロンに由来するSlit1とアストロサイトにある受容体Roboとの相互作用がアストロサイトの形態および分布を制御し,新生ニューロンの移動経路であるトンネル構造を維持することによりその高速移動を可能にする,という成体脳のニューロン移動における新たな分子機構が示された(図2).
おわりに
ニューロンの移動が大規模に行われる発生期の知見を基盤とした研究により,成体脳における新生ニューロンの移動に関与するさまざまな分子機構が報告されてきたが,成体脳の細胞構築や細胞外環境は発生過程とは大きく異なっている.この研究の対象である吻側移動経路のアストロサイトのトンネルは胎生期には存在せず,ニューロンの移動が吻側移動経路のみに限定された現象となる生後に形成されるため,成体脳の内部でニューロンの長距離かつ高速の移動を可能にする重要な構造であるものと考えられている.筆者らは,この研究により,新生ニューロンが自らSlit1の分泌を介してその受容体Roboを発現している周囲のアストロサイトの形態を変化させ,自ら移動経路を形成・維持しているという,成体脳の新生ニューロンの能動的な移動制御の分子機構をはじめて提示した.
脳室下帯で産生された新生ニューロンは,ニューロンの脱落するような傷害がくわわると傷害部に移動してごく少数ではあるがニューロンを再生する11,12).この過程を促進し多くのニューロンを再生することができれば,現在は不可逆性の病態と考えられているさまざまな脳疾患に対する治療的な戦略となる可能性がある.この研究で明らかになった細胞間相互作用による成体脳の内部での新生ニューロンの移動制御系は,ニューロン再生過程の理解やその促進手法の開発にかかわる再生医学的な応用性が期待される.
文 献
- Doetsch, F. & Alvarez-Buylla, A.: Network of tangential pathways for neuronal migration in adult mammalian brain. Proc. Natl. Acad. Sci. USA, 93, 14895-14900 (1996)[PubMed]
- Jankovski, A. & Sotelo, C.: Subventricular zone-olfactory bulb migratory pathway in the adult mouse: cellular composition and specificity as determined by heterochronic and heterotopic transplantation. J. Comp. Neurol., 371, 376-396 (1996)[PubMed]
- Lois, C., Garcia-Verdugo, J. M., Alvarez-Buylla, A.: Chain migration of neuronal precursors. Science, 271, 978-981 (1996)[PubMed]
- Nguyen Ba-Charvet, K. T., Brose, K., Marillat, V. et al.: Slit2-Mediated chemorepulsion and collapse of developing forebrain axons. Neuron, 22, 463-473 (1999)[PubMed]
- Wu, W., Wong, K., Chen, J. et al.: Directional guidance of neuronal migration in the olfactory system by the protein Slit. Nature, 400, 331-336 (1999)[PubMed]
- Nguyen-Ba-Charvet, K. T., Picard-Riera, N., Tessier-Lavigne, M. et al.: Multiple roles for slits in the control of cell migration in the rostral migratory stream. J. Neurosci., 24, 1497-1506 (2004)[PubMed]
- Anton, E. S., Ghashghaei, H. T., Weber, J. L. et al.: Receptor tyrosine kinase ErbB4 modulates neuroblast migration and placement in the adult forebrain. Nat. Neurosci., 7, 1319-1328 (2004)[PubMed]
- Belvindrah, R., Hankel, S., Walker, J. et al.: β1 integrins control the formation of cell chains in the adult rostral migratory stream. J. Neurosci., 27, 2704-2717 (2007)[PubMed]
- Chazal, G., Durbec, P., Jankovski, A. et al.: Consequences of neural cell adhesion molecule deficiency on cell migration in the rostral migratory stream of the mouse. J. Neurosci., 20, 1446-1457 (2000)[PubMed]
- Ghashghaei, H. T., Weber, J., Pevny, L. et al.: The role of neuregulin-ErbB4 interactions on the proliferation and organization of cells in the subventricular zone. Proc. Natl. Acad. Sci. USA, 103, 1930-1935 (2006)[PubMed]
- Kaneko, N. & Sawamoto, K.: Adult neurogenesis and its alteration under pathological conditions. Neurosci. Res., 63, 155-164 (2009)[PubMed]
- Okano, H. & Sawamoto, K.: Neural stem cells: involvement in adult neurogenesis and CNS repair. Philos. Trans. R. Soc. Lond., B, Biol. Sci., 363, 2111-2122 (2008)[PubMed]
著者プロフィール
精神科臨床医として勤務ののち,山梨大学医学系大学院博士課程に在学中に慶應義塾大学医学部生理学教室(岡野栄之教授)に派遣され共同研究員として研究を行う.2007年 同 修了ののち,名古屋市立大学大学院医学研究科 澤本和延教授のもとで研究を開始し,2009年より同 助教.
研究テーマ:げっ歯類~霊長類におけるニューロン新生・再生機構の解析.
抱負:成体脳の内部でニューロンが高速で動いているのがとてもおもしろい.正常や傷害などさまざまな状況下での新生ニューロンの移動のようすをきれいに可視化したい.
澤本 和延(Kazunobu Sawamoto)
名古屋市立大学大学院医学研究科 教授.
研究室URL:http://k-sawamoto.com/
© 2010 金子奈穂子・澤本和延 Licensed under CC 表示 2.1 日本