花芽の形成におけるジベレリンの役割
山口暢俊・Doris Wagner
(米国Pennsylvania大学Department of Biology)
email:山口暢俊
DOI: 10.7875/first.author.2014.070
Gibberellin acts positively then negatively to control onset of flower formation in Arabidopsis.
Nobutoshi Yamaguchi, Cara M. Winter, Miin-Feng Wu, Yuri Kanno, Ayako Yamaguchi, Mitsunori Seo, Doris Wagner
Science, 344, 638-641 (2014)
胚発生の終了した段階において成体とほぼ同じかたちである動物とは異なり,固着して生活をいとなむ植物は環境の変化に応じて形態形成を行う.なかでも,栄養成長から生殖成長への相転換は,植物にとり有性生殖の成功のかかる非常に重要な決定である.この転換は多くの植物種において,葉の形成から側枝の形成への切り換えと,側枝の形成から花芽の形成へ切り換えの2段階からなる.植物ホルモンのひとつであるジベレリンは,葉の形成から側枝の形成への切り換えにむけて蓄積量が増加しその切り換えを促進する.その一方,側枝の形成から花芽の形成の切り換えにおけるジベレリンの役割は明らかにされていない.この側枝の形成から花芽の形成への切り換えは,花芽の形成におけるマスター遺伝子であるLFY遺伝子が実行する.筆者らは,LFYにより転写を促進される遺伝子として,ジベレリンの不活性化酵素をコードするELA1遺伝子を見い出した.側枝の形成から花芽の形成への切り換えに際して,LFYはELA1遺伝子の転写の促進を介してジベレリンの量を減少させ,ジベレリンのシグナル伝達を抑制するはたらきをもつRGAを蓄積させる.すると,RGA-SPL9複合体とLFYとが協調的に機能することにより,花芽分裂組織の決定遺伝子であるAP1遺伝子の転写が誘導され,側枝の形成から花芽の形成への切り換えが起こることがわかった.以上の結果から,ジベレリンは側枝の形成から花芽の形成への切り換えに対し抑制的にはたらくことが明らかになった.
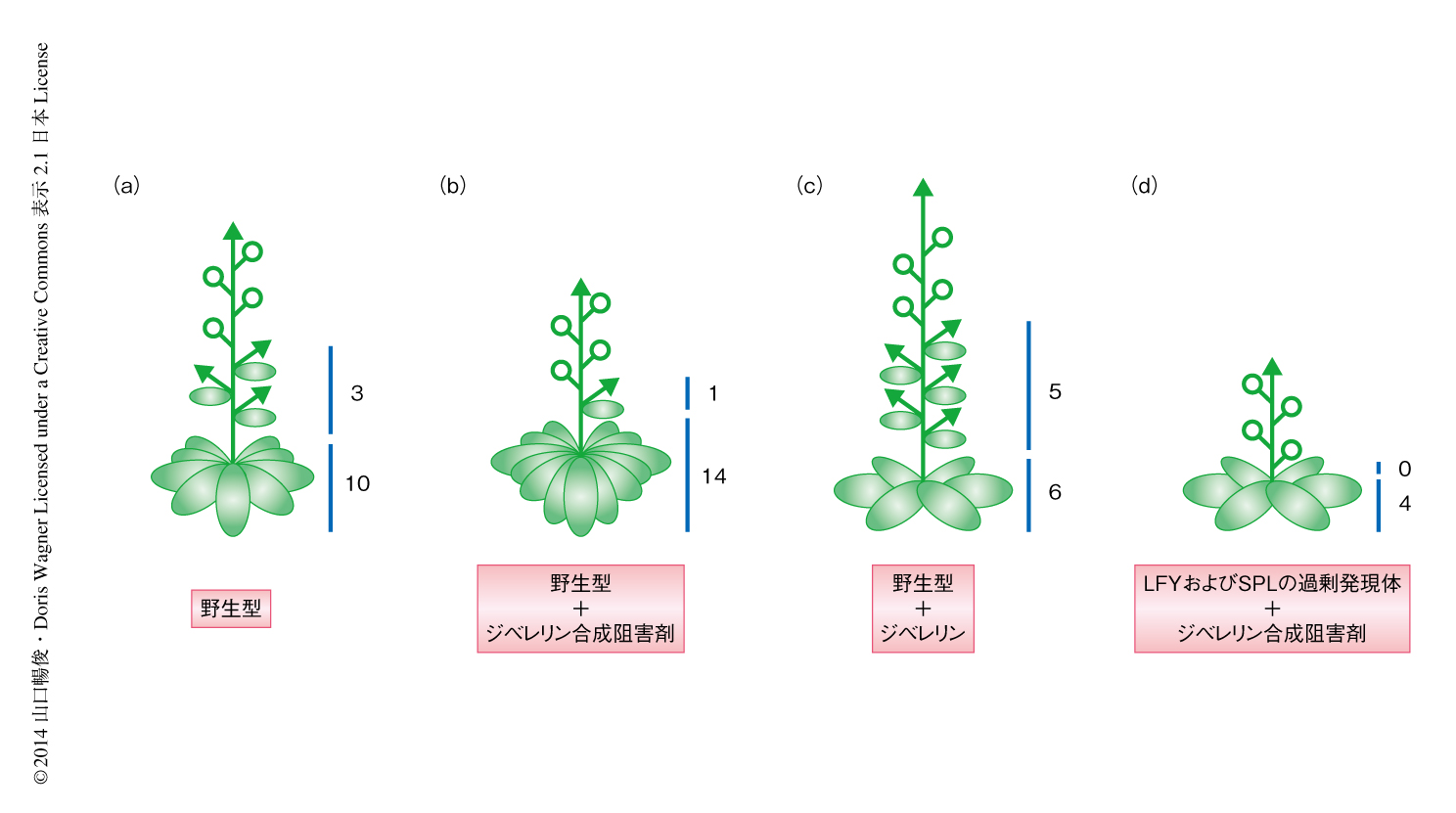
動植物の発生は胚発生からはじまる.動物の場合,胚発生のときにはほとんどの器官形成をおえており,のちに細胞の増殖と分化をくり返すことにより成体になる1).一方,植物においては胚発生のときに形成される器官はかぎられており,環境からの情報を積極的に取り入れて柔軟に器官形成を行う.茎頂分裂組織は成長相の違いにより異なる器官をつくりだす2).シロイヌナズナの場合,茎頂分裂組織は栄養成長期には葉を,生殖成長の前期には側枝を,生殖成長の後期には花を形成する2)(図1a).分裂組織のつくりだす器官が大きく変化する過程では,生理活性を示す物質は生合成あるいは代謝の制御により適切な濃度に調整される必要がある.
植物において環境の変化に対する形態的な応答のためのシグナル分子として機能する物質は,植物ホルモンである.植物ホルモンのひとつであるジベレリンは,葉の形成から側枝の形成への切り換えにむけて蓄積量が徐々に増加し,葉の形成から側枝の形成への切り換えを促進する3).しかし,のちの側枝の形成から花芽の形成への切り換えに対しどのようにはたらいているかは明らかではなかった.側枝の形成から花芽の形成への切り換えにおいては,植物に固有の転写因子をコードするLEAFY(LFY)遺伝子がマスター遺伝子として機能する.このLFYは日長や温度などの環境からの情報を読みとりはたらきはじめる4).また,側枝の形成から花芽の形成への切り換えに必要かつ十分であることがわかっており,この遺伝子がはたらかないlfy変異体では側枝の形成から花芽の形成への切り換えが大幅に遅れる5,6).興味深いことに,筆者らが同定したLFYの直接的な標的となる遺伝子には,水酸化反応を触媒するシトクロムP450をコードする遺伝子が多く含まれていた7).このシトクロムP450が触媒する反応は植物ホルモンの生合成および代謝の過程において重要であることから,花芽の形成に際して植物ホルモンの生合成および代謝が厳密に制御されている可能性が示唆された8).なかでも,ジベレリンの不活性化するシトクロムP450をコードするEUI-LIKE P450 A1(ELA1)遺伝子に着目し9),側枝の形成から花芽の形成への転換におけるジベレリンの代謝の変化とその役割について調べた.
ELA1遺伝子の発現がLFYの機能に依存しているかどうかを調べるため,lfy変異体においてELA1遺伝子の転写産物の蓄積量を調べた.野生型ではELA1遺伝子は花芽において強く発現していたが,lfy変異体ではその発現は劇的に減少していた.また,ELA1遺伝子のプロモーター領域に存在する4つのLFY結合配列の重要性について評価した.これらの配列に変異を導入するとレポーター遺伝子の発現がみられなくなったことから,LFY結合配列がELA1遺伝子の発現に必要であることがわかった.
T-DNAの挿入によりELA1遺伝子の機能を破壊したela1変異体の表現型を観察した.野生型と比べ,ela1変異体では側枝の形成から花芽の形成への切り換えが遅れるため,側枝の数が増加することがわかった.さらに,花芽分裂組織の決定遺伝子であるAPETALA1(AP1)遺伝子の発現を解析したところ,ela1変異体では発現するタイミングが遅れるだけでなく,発現量も減少していた.さらに,LFYとELA1遺伝子との遺伝学的な相互作用について解析した.その結果,ela1変異は弱いlfy変異体の表現型を亢進し,側枝の数が劇的に増加することがわかった.したがって,LFYはELA1遺伝子を制御して側枝の形成から花芽の形成への切り換えを起こしていると考えられた.
ELA1はシトクロムP450とよばれる水酸化酵素のひとつであり,ジベレリン骨格のC17位を酸化してジベレリンを不活性化すると考えられていることから9),LFYは花芽の形成に際してジベレリンの量を減少させるはたらきがあると予想された.実際,液体クロマトグラフィー-質量分析法により活性型ジベレリンであるGA4の量を測定すると,lfy変異体では増加し,LFYの過剰発現体では減少していることがわかった.
細胞がジベレリンを受容すると,ジベレリンのシグナル伝達を抑制しているREPRESSOR OF GA1-3(RGA)は分解される10).そのとき,ジベレリンの生合成遺伝子の発現は負のフィードバック制御により抑制されるようになる10).lfy変異体ではジベレリンの量の増加により,RGAの蓄積量およびジベレリンの生合成酵素をコードするGIBBERELLIN 20 OXIDASE2(GA20ox2)遺伝子の転写産物の蓄積量が減少していた.逆に,LFYの過剰発現体ではRGAの蓄積量およびGA20ox2遺伝子の転写産物の蓄積量は野生型よりも増加しており,ジベレリンの含量との強い相関がみられた.さらに,LFYの過剰発現体でみられたGA20ox2遺伝子の転写産物の蓄積量の増加は,ela1変異により部分的に抑圧された.この結果は,LFYによるジベレリンの量の制御にはELA1遺伝子を介することを示唆した.
シロイヌナズナにおいてジベレリンは葉の形成から側枝の形成への切り換えを促進する11).一方,筆者らの実験結果は,側枝の形成から花芽の形成への切り換えに対してジベレリンは抑制的にはたらくことを示唆した.そこで,ジベレリンが側枝の形成から花芽の形成への切り換えにどのように関与するのかを検討した.ジベレリンの合成あるいはシグナル伝達に欠損のある変異体,および,ジベレリン合成阻害剤により処理した植物では,葉の形成から側枝の形成への切り換えは遅くなるため葉の数は増加することがわかった.しかし,側枝の形成から花芽の形成への切り換えは野生型よりも早くなり,側枝の数は減少することがわかった(図1b).一方,ジベレリンにより処理した植物は,葉の形成から側枝の形成への切り換えは早かったが,側枝の形成から花芽の形成への切り換えは遅くなった(図1c).さらに,側枝および花芽原基において選択的にジベレリンのシグナル伝達を抑制した場合には,葉の形成から側枝の形成への切り換えに影響はなかったが,側枝の形成から花芽の形成への切り換えは早くなった.以上の解析により,ジベレリンは葉の形成から側枝の形成への切り換えに対しては促進的にはたらき,側枝の形成から花芽の形成への切り換えに対しては抑制的にはたらくという2つの役割が明らかになった.
これまでの解析の結果から,LFYはジベレリンの量を減少させて花芽の分化を進めると予想された.そこで,LFYの機能を誘導すると同時にジベレリンの合成を阻害して,AP1遺伝子の発現に変化があるかどうかを調べた.その結果,LFYの機能誘導とジベレリンの合成阻害を同時に行った場合のみ,AP1遺伝子の転写量が劇的に増加することがわかった.ジベレリンの合成を阻害するとRGAはより蓄積しやすくなる12).LFYの機能およびRGAの機能を同時に誘導した場合にも,AP1遺伝子の転写量は劇的に増加した.
RGAはDNA配列を認識する転写因子によりクロマチンにリクルートされ12),転写を抑制あるいは促進する機能をもつことが報告されている13).そこで,RGAに対してクロマチン免疫沈降法を行ったところ,RGAはAP1遺伝子のプロモーター領域にリクルートされることがわかった.RGAをAP1遺伝子のプロモーター領域にリクルートする転写因子の候補として,RGAと物理的に相互作用してAP1遺伝子のプロモーター領域に結合するSQUAMOSA PROMOTER BINDING PROTEIN-LIKE 9(SPL9)に着目した14,15).RGAによるAP1遺伝子の転写の活性化はSPL9の機能に依存するかどうかを検討した.LFYの機能誘導およびジベレリンの合成阻害によるRGAの機能誘導を行っても,MIR156遺伝子の機能誘導によりSPLファミリー遺伝子のはたらきを抑制すると,AP1遺伝子の転写量の劇的な増加は観察されなかった.また,LFYの機能およびSPL9の機能を同時に誘導するとAP1遺伝子の転写量は劇的に増加したが,ジベレリンも同時に投与してRGAの機能を抑制するとAP1遺伝子の転写量の変化はわずかであった.LFYとSPL9とが協調的にはたらくためには,RGAの機能が必要であることが示唆された.さらに,クロマチン免疫沈降法および酵母ワンハイブリッド法により,RGAはAP1遺伝子のプロモーター領域にSPL9を介して直接にリクルートされることが示された.そして,LFYとRGA-SPL9複合体が過剰に存在している植物体では,側枝を形成することなく,葉を形成したのちすみやかに花芽の形成への切り換えが起こることがわかった(図1d).以上より,ジベレリンの減少により,ジベレリンのシグナル伝達を制御するRGA-SPL9複合体がAP1遺伝子のプロモーター領域へ蓄積することで,花芽の形成は促進されていることが明らかになった.
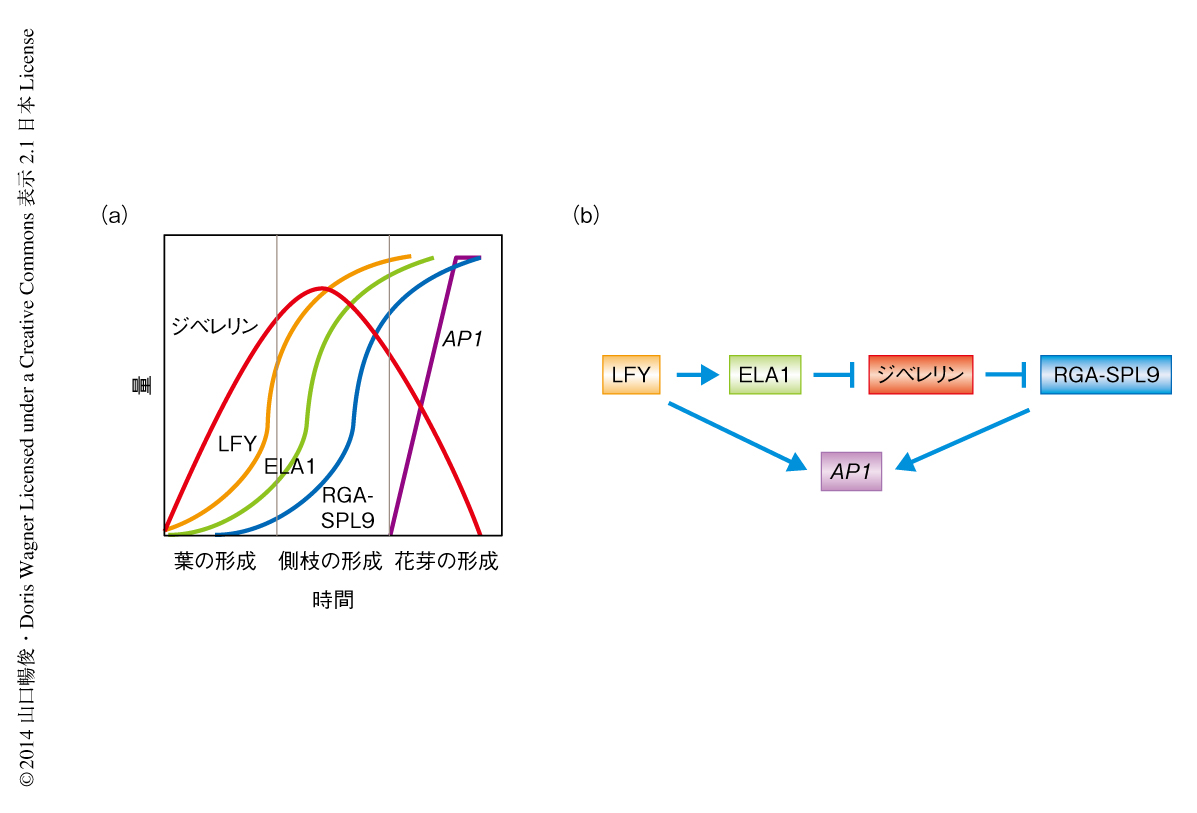
これまでに,ジベレリンは葉の形成から側枝の形成への切り換えのために蓄積量が増加することが報告されていた3).しかし,側枝の形成から花芽の形成への切り換えの過程においてジベレリンは減少することが明らかにされた(図2a).このジベレリンの減少は,花芽の形成におけるマスター遺伝子であるLFYによりひき起こされていた.この過程を制御する分子機構のひとつとして,LFYによるELA1遺伝子の転写の制御の重要性が示された.ジベレリンの量が減少に転じるとRGA-SPL9複合体が形成されるようになる.RGA-SPL9複合体はLFYと協調的に機能して花芽分裂組織の決定遺伝子であるAP1遺伝子の転写を促進し,花芽を分化させる(図2b).このように,側枝の形成から花芽の形成への切り換えの過程では,LFYによる環境情報の統合につづき4),代謝の制御によるジベレリンの濃度の調整が重要な役割をはたすことがわかった.
ジベレリンは栄養成長から生殖成長への転換を促進することが広く知られているが,ブドウなどの樹木では抑制的にはたらくことも報告されている16).今回の筆者らの発見は,いっけん矛盾ととらえられる以前の知見をうまく説明する鍵となる可能性がある.
略歴:2009年 東京大学大学院理学系研究科 修了,同年より米国Pennsylvania大学 博士研究員.
研究テーマ:花芽の形成におけるマスター遺伝子であるLFYの機能.
抱負:植物の形態形成を支配する遺伝子のはたらきを明らかにしたい.
Doris Wagner
米国Pennsylvania大学Professor.
研究室URL:https://sites.sas.upenn.edu/?q=wagner-lab/
© 2014 山口暢俊・Doris Wagner Licensed under CC 表示 2.1 日本
(米国Pennsylvania大学Department of Biology)
email:山口暢俊
DOI: 10.7875/first.author.2014.070
Gibberellin acts positively then negatively to control onset of flower formation in Arabidopsis.
Nobutoshi Yamaguchi, Cara M. Winter, Miin-Feng Wu, Yuri Kanno, Ayako Yamaguchi, Mitsunori Seo, Doris Wagner
Science, 344, 638-641 (2014)
要 約
胚発生の終了した段階において成体とほぼ同じかたちである動物とは異なり,固着して生活をいとなむ植物は環境の変化に応じて形態形成を行う.なかでも,栄養成長から生殖成長への相転換は,植物にとり有性生殖の成功のかかる非常に重要な決定である.この転換は多くの植物種において,葉の形成から側枝の形成への切り換えと,側枝の形成から花芽の形成へ切り換えの2段階からなる.植物ホルモンのひとつであるジベレリンは,葉の形成から側枝の形成への切り換えにむけて蓄積量が増加しその切り換えを促進する.その一方,側枝の形成から花芽の形成の切り換えにおけるジベレリンの役割は明らかにされていない.この側枝の形成から花芽の形成への切り換えは,花芽の形成におけるマスター遺伝子であるLFY遺伝子が実行する.筆者らは,LFYにより転写を促進される遺伝子として,ジベレリンの不活性化酵素をコードするELA1遺伝子を見い出した.側枝の形成から花芽の形成への切り換えに際して,LFYはELA1遺伝子の転写の促進を介してジベレリンの量を減少させ,ジベレリンのシグナル伝達を抑制するはたらきをもつRGAを蓄積させる.すると,RGA-SPL9複合体とLFYとが協調的に機能することにより,花芽分裂組織の決定遺伝子であるAP1遺伝子の転写が誘導され,側枝の形成から花芽の形成への切り換えが起こることがわかった.以上の結果から,ジベレリンは側枝の形成から花芽の形成への切り換えに対し抑制的にはたらくことが明らかになった.
はじめに
動植物の発生は胚発生からはじまる.動物の場合,胚発生のときにはほとんどの器官形成をおえており,のちに細胞の増殖と分化をくり返すことにより成体になる1).一方,植物においては胚発生のときに形成される器官はかぎられており,環境からの情報を積極的に取り入れて柔軟に器官形成を行う.茎頂分裂組織は成長相の違いにより異なる器官をつくりだす2).シロイヌナズナの場合,茎頂分裂組織は栄養成長期には葉を,生殖成長の前期には側枝を,生殖成長の後期には花を形成する2)(図1a).分裂組織のつくりだす器官が大きく変化する過程では,生理活性を示す物質は生合成あるいは代謝の制御により適切な濃度に調整される必要がある.
植物において環境の変化に対する形態的な応答のためのシグナル分子として機能する物質は,植物ホルモンである.植物ホルモンのひとつであるジベレリンは,葉の形成から側枝の形成への切り換えにむけて蓄積量が徐々に増加し,葉の形成から側枝の形成への切り換えを促進する3).しかし,のちの側枝の形成から花芽の形成への切り換えに対しどのようにはたらいているかは明らかではなかった.側枝の形成から花芽の形成への切り換えにおいては,植物に固有の転写因子をコードするLEAFY(LFY)遺伝子がマスター遺伝子として機能する.このLFYは日長や温度などの環境からの情報を読みとりはたらきはじめる4).また,側枝の形成から花芽の形成への切り換えに必要かつ十分であることがわかっており,この遺伝子がはたらかないlfy変異体では側枝の形成から花芽の形成への切り換えが大幅に遅れる5,6).興味深いことに,筆者らが同定したLFYの直接的な標的となる遺伝子には,水酸化反応を触媒するシトクロムP450をコードする遺伝子が多く含まれていた7).このシトクロムP450が触媒する反応は植物ホルモンの生合成および代謝の過程において重要であることから,花芽の形成に際して植物ホルモンの生合成および代謝が厳密に制御されている可能性が示唆された8).なかでも,ジベレリンの不活性化するシトクロムP450をコードするEUI-LIKE P450 A1(ELA1)遺伝子に着目し9),側枝の形成から花芽の形成への転換におけるジベレリンの代謝の変化とその役割について調べた.
1.花芽の形成におけるマスター遺伝子であるLFYはジベレリンの代謝を制御する
ELA1遺伝子の発現がLFYの機能に依存しているかどうかを調べるため,lfy変異体においてELA1遺伝子の転写産物の蓄積量を調べた.野生型ではELA1遺伝子は花芽において強く発現していたが,lfy変異体ではその発現は劇的に減少していた.また,ELA1遺伝子のプロモーター領域に存在する4つのLFY結合配列の重要性について評価した.これらの配列に変異を導入するとレポーター遺伝子の発現がみられなくなったことから,LFY結合配列がELA1遺伝子の発現に必要であることがわかった.
T-DNAの挿入によりELA1遺伝子の機能を破壊したela1変異体の表現型を観察した.野生型と比べ,ela1変異体では側枝の形成から花芽の形成への切り換えが遅れるため,側枝の数が増加することがわかった.さらに,花芽分裂組織の決定遺伝子であるAPETALA1(AP1)遺伝子の発現を解析したところ,ela1変異体では発現するタイミングが遅れるだけでなく,発現量も減少していた.さらに,LFYとELA1遺伝子との遺伝学的な相互作用について解析した.その結果,ela1変異は弱いlfy変異体の表現型を亢進し,側枝の数が劇的に増加することがわかった.したがって,LFYはELA1遺伝子を制御して側枝の形成から花芽の形成への切り換えを起こしていると考えられた.
ELA1はシトクロムP450とよばれる水酸化酵素のひとつであり,ジベレリン骨格のC17位を酸化してジベレリンを不活性化すると考えられていることから9),LFYは花芽の形成に際してジベレリンの量を減少させるはたらきがあると予想された.実際,液体クロマトグラフィー-質量分析法により活性型ジベレリンであるGA4の量を測定すると,lfy変異体では増加し,LFYの過剰発現体では減少していることがわかった.
細胞がジベレリンを受容すると,ジベレリンのシグナル伝達を抑制しているREPRESSOR OF GA1-3(RGA)は分解される10).そのとき,ジベレリンの生合成遺伝子の発現は負のフィードバック制御により抑制されるようになる10).lfy変異体ではジベレリンの量の増加により,RGAの蓄積量およびジベレリンの生合成酵素をコードするGIBBERELLIN 20 OXIDASE2(GA20ox2)遺伝子の転写産物の蓄積量が減少していた.逆に,LFYの過剰発現体ではRGAの蓄積量およびGA20ox2遺伝子の転写産物の蓄積量は野生型よりも増加しており,ジベレリンの含量との強い相関がみられた.さらに,LFYの過剰発現体でみられたGA20ox2遺伝子の転写産物の蓄積量の増加は,ela1変異により部分的に抑圧された.この結果は,LFYによるジベレリンの量の制御にはELA1遺伝子を介することを示唆した.
2.ジベレリンは側枝の形成から花芽の形成への切り換えをさまたげる
シロイヌナズナにおいてジベレリンは葉の形成から側枝の形成への切り換えを促進する11).一方,筆者らの実験結果は,側枝の形成から花芽の形成への切り換えに対してジベレリンは抑制的にはたらくことを示唆した.そこで,ジベレリンが側枝の形成から花芽の形成への切り換えにどのように関与するのかを検討した.ジベレリンの合成あるいはシグナル伝達に欠損のある変異体,および,ジベレリン合成阻害剤により処理した植物では,葉の形成から側枝の形成への切り換えは遅くなるため葉の数は増加することがわかった.しかし,側枝の形成から花芽の形成への切り換えは野生型よりも早くなり,側枝の数は減少することがわかった(図1b).一方,ジベレリンにより処理した植物は,葉の形成から側枝の形成への切り換えは早かったが,側枝の形成から花芽の形成への切り換えは遅くなった(図1c).さらに,側枝および花芽原基において選択的にジベレリンのシグナル伝達を抑制した場合には,葉の形成から側枝の形成への切り換えに影響はなかったが,側枝の形成から花芽の形成への切り換えは早くなった.以上の解析により,ジベレリンは葉の形成から側枝の形成への切り換えに対しては促進的にはたらき,側枝の形成から花芽の形成への切り換えに対しては抑制的にはたらくという2つの役割が明らかになった.
3.ジベレリンのシグナル伝達を制御するRGA-SPL9複合体とLFYとの協調的なはたらきにより花芽が分化する
これまでの解析の結果から,LFYはジベレリンの量を減少させて花芽の分化を進めると予想された.そこで,LFYの機能を誘導すると同時にジベレリンの合成を阻害して,AP1遺伝子の発現に変化があるかどうかを調べた.その結果,LFYの機能誘導とジベレリンの合成阻害を同時に行った場合のみ,AP1遺伝子の転写量が劇的に増加することがわかった.ジベレリンの合成を阻害するとRGAはより蓄積しやすくなる12).LFYの機能およびRGAの機能を同時に誘導した場合にも,AP1遺伝子の転写量は劇的に増加した.
RGAはDNA配列を認識する転写因子によりクロマチンにリクルートされ12),転写を抑制あるいは促進する機能をもつことが報告されている13).そこで,RGAに対してクロマチン免疫沈降法を行ったところ,RGAはAP1遺伝子のプロモーター領域にリクルートされることがわかった.RGAをAP1遺伝子のプロモーター領域にリクルートする転写因子の候補として,RGAと物理的に相互作用してAP1遺伝子のプロモーター領域に結合するSQUAMOSA PROMOTER BINDING PROTEIN-LIKE 9(SPL9)に着目した14,15).RGAによるAP1遺伝子の転写の活性化はSPL9の機能に依存するかどうかを検討した.LFYの機能誘導およびジベレリンの合成阻害によるRGAの機能誘導を行っても,MIR156遺伝子の機能誘導によりSPLファミリー遺伝子のはたらきを抑制すると,AP1遺伝子の転写量の劇的な増加は観察されなかった.また,LFYの機能およびSPL9の機能を同時に誘導するとAP1遺伝子の転写量は劇的に増加したが,ジベレリンも同時に投与してRGAの機能を抑制するとAP1遺伝子の転写量の変化はわずかであった.LFYとSPL9とが協調的にはたらくためには,RGAの機能が必要であることが示唆された.さらに,クロマチン免疫沈降法および酵母ワンハイブリッド法により,RGAはAP1遺伝子のプロモーター領域にSPL9を介して直接にリクルートされることが示された.そして,LFYとRGA-SPL9複合体が過剰に存在している植物体では,側枝を形成することなく,葉を形成したのちすみやかに花芽の形成への切り換えが起こることがわかった(図1d).以上より,ジベレリンの減少により,ジベレリンのシグナル伝達を制御するRGA-SPL9複合体がAP1遺伝子のプロモーター領域へ蓄積することで,花芽の形成は促進されていることが明らかになった.
おわりに
これまでに,ジベレリンは葉の形成から側枝の形成への切り換えのために蓄積量が増加することが報告されていた3).しかし,側枝の形成から花芽の形成への切り換えの過程においてジベレリンは減少することが明らかにされた(図2a).このジベレリンの減少は,花芽の形成におけるマスター遺伝子であるLFYによりひき起こされていた.この過程を制御する分子機構のひとつとして,LFYによるELA1遺伝子の転写の制御の重要性が示された.ジベレリンの量が減少に転じるとRGA-SPL9複合体が形成されるようになる.RGA-SPL9複合体はLFYと協調的に機能して花芽分裂組織の決定遺伝子であるAP1遺伝子の転写を促進し,花芽を分化させる(図2b).このように,側枝の形成から花芽の形成への切り換えの過程では,LFYによる環境情報の統合につづき4),代謝の制御によるジベレリンの濃度の調整が重要な役割をはたすことがわかった.
ジベレリンは栄養成長から生殖成長への転換を促進することが広く知られているが,ブドウなどの樹木では抑制的にはたらくことも報告されている16).今回の筆者らの発見は,いっけん矛盾ととらえられる以前の知見をうまく説明する鍵となる可能性がある.
文 献
- Raff, R. A.: The Shape of Life: Genes, Development and the Evolution of Animal form. University of Chicago Press, Chicago (1996)
- Steeves, A. & Sussex, I.: Pattern in Plant Development. Cambridge University Press, Cambridge (1989)
- Eriksson, S., Bohlenius, H., Moritz, T. et al.: GA4 is the active gibberellin in the regulation of LEAFY transcription and Arabidopsis floral initiation. Plant Cell, 18, 2172-2181 (2006)[PubMed]
- Araki, T.: Transition from vegetative to reproductive phase. Curr. Opin. Plant Biol., 4, 63-68 (2001)[PubMed]
- Weigel, D., Alvarez, J., Smyth, D. R. et al.: LEAFY controls floral meristem identity in Arabidopsis. Cell, 69, 843-859 (1992)[PubMed]
- Weigel, D. & Nilsson, O.: A developmental switch sufficient for flower initiation in diverse plants. Nature, 377, 495-500 (1995)[PubMed]
- Winter, C. M., Austin, R. S., Blanvillain-Baufume, S. et al.: LEAFY target genes reveal floral regulatory logic, cis motifs, and a link to biotic stimulus response. Dev. Cell, 20, 430-443 (2011)[PubMed]
- Mizutani, M. & Ohta, D.: Diversification of P450 genes during land plant evolution. Annu. Rev. Plant Biol., 61, 291-315 (2010)[PubMed]
- Zhang, Y., Zhang, B., Yan, D. et al.: Two Arabidopsis cytochrome P450 monooxygenases, CYP714A1 and CYP714A2, function redundantly in plant development through gibberellin deactivation. Plant J., 67, 342-353 (2011)[PubMed]
- Zentella, R., Zhang, Z.L., Park, M. et al.: Global analysis of DELLA direct targets in early gibberellin signaling in Arabidopsis. Plant Cell, 19, 3037-3057 (2007)[PubMed]
- Porri, A., Torti, S., Romera-Branchat, M. et al.: Spatially distinct regulatory roles for gibberellins in the promotion of flowering of Arabidopsis under long photoperiods. Development, 139, 2198-2209 (2012)[PubMed]
- Daviere, J. -M. & Achard, P.: Gibberellin signaling in plants. Development, 140, 1147-1151 (2013)[PubMed]
- Hirano, K., Kouketu, E., Katoh, H. et al.: The suppressive function of the rice DELLA protein SLR is dependent on its transcriptional activation activity. Plant J., 71, 443-453 (2012)[PubMed]
- Yu, S., Galvao, V. C., Zhang, Y. C. et al.: Gibberellin regulates the Arabidopsis floral transtion through miR156-targeted SQUAMOSA promoter binding-like transcription factors. Plant Cell, 24, 3320-3332 (2012)[PubMed]
- Wang, J. W., Czech, D. & Weigel, D.: miR156-regulated SPL transcription factors define an endogenous flowering pathway in Arabidopsis thaliana. Cell, 138, 738-749 (2009)[PubMed]
- Boss, P. K. & Thomas, M. R.: Association of dwarfism and floral induction with a grape ‘green revolution’ mutation. Nature, 416, 847-850 (2002)[PubMed]
著者プロフィール
略歴:2009年 東京大学大学院理学系研究科 修了,同年より米国Pennsylvania大学 博士研究員.
研究テーマ:花芽の形成におけるマスター遺伝子であるLFYの機能.
抱負:植物の形態形成を支配する遺伝子のはたらきを明らかにしたい.
Doris Wagner
米国Pennsylvania大学Professor.
研究室URL:https://sites.sas.upenn.edu/?q=wagner-lab/
© 2014 山口暢俊・Doris Wagner Licensed under CC 表示 2.1 日本