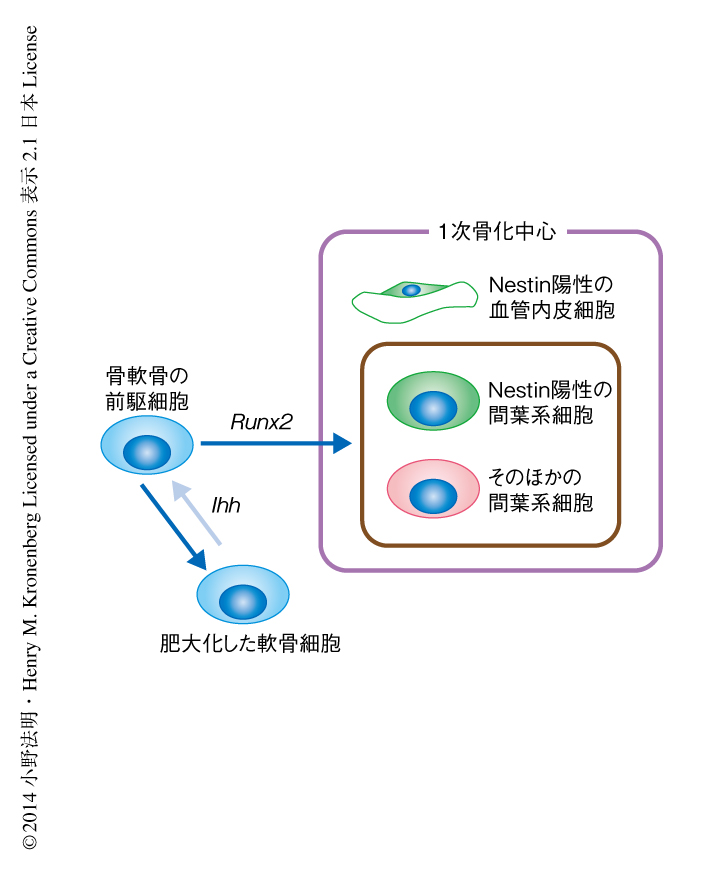
内軟骨性の骨化において血管の近傍のNestin陽性細胞は骨芽細胞および血管内皮細胞の前駆細胞を含む
小野法明・Henry M. Kronenberg
(米国Massachusetts General Hospital,Endocrine Unit)
email:小野法明
DOI: 10.7875/first.author.2014.071
Vasculature-associated cells expressing nestin in developing bones encompass early cells in the osteoblast and endothelial lineage.
Noriaki Ono, Wanida Ono, Toshihide Mizoguchi, Takashi Nagasawa, Paul S. Frenette, Henry M. Kronenberg
Developmental Cell, 29, 330-339 (2014)
Nestin陽性細胞は骨髄において造血を支持する機能をもつ重要な細胞であるが,内軟骨性の骨化におけるこれらの細胞の形成の過程は明らかにされていない.Nestinの遺伝子プロモーターに依存してGFPを発現するマウスを詳細に解析した結果,Nestin陽性細胞は軟骨原基に侵入する血管内皮細胞およびその近傍の間葉系細胞において認められ,間葉系細胞は骨軟骨系の前駆細胞からIndian hedgehogおよびRunx2の作用により形成されることが明らかになった.また,細胞系譜の解析の結果,Nestin陽性細胞に由来する細胞としては血管内皮細胞が圧倒的に多いことが明らかになった.以上の結果より,Nestin陽性細胞は内軟骨性の骨化において血管の形成と密接に関連して発生し,その結果,骨芽細胞系および血管内皮細胞系の前駆細胞を含む多様な細胞を構成することが明らかになり,骨髄において造血を支持する微小環境を構成する細胞の複雑性が示唆された.
骨は運動器としての主要な機能にくわえ,成体においては造血幹細胞から血液細胞が分化する唯一の部位である骨髄を形成する重要な器官である.大部分の骨は,発生の過程において軟骨原基が骨と骨髄により置換される内軟骨性の骨化により形成される1).その過程においては,まず軟骨細胞が形成され,つづいて骨芽前駆細胞が原基中心部の肥大軟骨細胞と近接する傍軟骨膜において形成される.この傍軟骨膜の骨芽前駆細胞は血管をともない軟骨原基に侵入し,1次骨化中心において骨芽細胞および間質細胞へと分化する2).胎生の後期において主要な造血部位は肝臓から脾臓および骨髄に移行するが,この1次骨化中心の骨髄間質細胞はCXCL12などの重要なケモカインを産生し,造血系幹細胞を支持する幹細胞ニッチの形成と密接に関連する3).また,骨髄間質細胞にくわえ,内骨膜骨芽細胞,血管内皮細胞,周皮細胞など多様な細胞が造血系幹細胞を骨髄に維持する微小環境を構成する4-7).成体の骨髄において,中間径フィラメントであるNestinを発現する細胞は間葉系幹細胞としての挙動を示し,さらに,造血系幹細胞の重要な構成要素であることが報告されている8).このように重要なはたらきを示すNestinを発現する細胞が内軟骨性の骨化の過程においてどのように形成されるかに関しては,これまで明らかにされていない.筆者らは,骨発生の過程におけるNestin発現細胞の起源,異質性,運命を明らかにするためこの研究を行った.
Nestinの遺伝子プロモーターに依存してGFPを発現するマウスを用いて,初期の骨発生を解析した.胎生10.5日齢の肢芽中央部において,Nestin陽性細胞はCD31陽性細胞と相似した網状の分布を示し,多数の共陽性細胞が認められた.胎生11.5日齢において,Nestin陽性細胞は骨軟骨原基の前駆体である間葉集合の内部には認められず,周辺部に少数のCD31との共陽性細胞が認められ,その数は胎生12.5日齢において初期の肥大化軟骨に近接する傍軟骨膜の形成にともない増加した.CD31陰性Nestin陽性細胞は,胎生13.5日齢において傍軟骨膜の内面の血管に近接した部位にはじめて出現した.胎生14.5日齢における傍軟骨膜の肥厚化および胎生15.5日齢における軟骨原基への血管の侵入による1次骨化中心の形成にともない,CD31陽性Nestin陽性細胞およびCD31陰性Nestin陽性細胞は互いに密接に関連しながらいちじるしく増加した.よって,内軟骨性の骨化の進行にともない,CD31陰性Nestin陽性細胞およびCD31陽性Nestin発現細胞が漸進的に形成されることが明らかになった.
内軟骨性の骨化の過程において,骨軟骨の前駆細胞がどのようにNestin陽性細胞に寄与するかについて検討した.Creリコンビナーゼを用いた細胞系譜の解析の結果,II型コラーゲンを発現する骨軟骨の前駆細胞はCD31陽性Nestin陽性細胞には寄与せず,胎生13.5日齢に出現するCD31陰性Nestin陽性細胞に寄与することが明らかになった.また,誘導型のCreリコンビナーゼを用いた細胞系譜の解析の結果,これらの骨軟骨の前駆細胞そのものはNestin陰性であり,発生の進行にともない漸進的にCD31陰性Nestin陽性細胞に寄与することが認められた.また,これらのCD31陰性Nestin陽性細胞はOsterix陽性の骨芽前駆細胞と多く重複し,Indian HedgehogノックアウトマウスおよびRunx2ノックアウトマウスの骨原基においてこれらの細胞は形成されなかった.これらの結果より,非血管内皮系のNestin陽性細胞は骨芽前駆細胞を含み,骨軟骨系の前駆細胞からIndian HedgehogおよびRunx2の作用により分化して形成されることが明らかになった(図1).
Nestinの遺伝子プロモーターに依存して誘導型Creリコンビナーゼを発現するマウスを用いて細胞系譜を解析した.骨髄腔が形成される胎生16.5日齢よりあとのCreリコンビナーゼの発現のみが,長期にわたり生存の可能な細胞を標識した.とくに,生後3日齢において標識をうけたNestinに由来する細胞は少なくとも6カ月以上も残存し,骨髄腔の血管洞と相似した網状に分布した.これらの細胞の大半はCD31陽性の血管内皮細胞であり,一部は一過性に骨芽細胞系に寄与したものの,その大半は時間の経過とともに消失した.また,骨髄脂肪細胞には分化せず,ごくまれに成長板の軟骨細胞への分化が認められた.さらに,一部の細胞は骨髄細動脈のCXCL12陽性の血管内皮細胞へと分化した.
生後に発生した骨髄においてNestin陽性細胞を構成する細胞を,Nestinの遺伝子プロモーターに依存してGFPを発現するマウスを用いて詳細に検討した.生後1週齢の発生骨髄においては,GFPは成長板の軟骨の直下にある1次海綿骨の傍血管細胞および骨髄細動脈の周皮細胞にとくに強く発現し,また,骨芽細胞,骨細胞,血管内皮細胞にも発現が認められた.生後2カ月齢の成体の骨髄においてはGFPを発現した細胞の数はいちじるしく減少したが,骨芽細胞および骨細胞における発現は存続した.さらに,Nestinの遺伝子プロモーターに依存して発現する誘導型Creリコンビナーゼは,Nestinの遺伝子プロモーターに依存してGFPを発現した細胞のうち,とくに血管内皮細胞に富む画分を標識した.また,Nestinの遺伝子プロモーターに依存してGFPを発現した細胞は,骨芽細胞系のOsterix発現細胞およびその子孫細胞,血管内皮細胞系のTie2発現細胞およびその子孫細胞,傍血管間質細胞系のレプチン受容体発現細胞およびその子孫細胞,さらには,成熟した骨芽細胞を含み,異質性の高い細胞の集団であることが明らかになった.
胎生期の骨髄における造血の確立には,傍軟骨膜から軟骨原基に侵入する骨芽前駆細胞および血管内皮細胞が必須であり,1次骨化中心の形成とともに,造血系幹細胞を支持する機能をもつ骨芽細胞,間質細胞,周皮細胞,血管内皮細胞など多様な細胞がほぼ同時に形成される.この研究により得られた所見は,これらの侵入した血管と密接に関連する細胞がNestinを発現することを明らかにした.成体の骨髄において,Nestin陽性細胞はコロニーを形成する画分を独占的に含み間葉系幹細胞としての挙動を示すことが報告されているが,これらの細胞は初期の骨発生においてはむしろ骨軟骨の前駆細胞からIndian hedgehogやRunx2の作用により分化する細胞であり,間葉系の細胞系譜におけるもっとも早期の細胞ではないことが示唆された.また,Nestinは成熟した骨芽細胞や骨細胞など広範な細胞に発現することから,Nestinをいわゆる間葉系幹細胞の特異的なマーカーとしてとらえることはむずかしい.また,間葉系幹細胞としての挙動を示すNestin陽性の周皮細胞のみならず,Nestin陽性の血管内皮細胞も,造血系幹細胞を維持する微小環境を構成する細胞として重要な機能をもつことが示唆された.
略歴:2007年 東京医科歯科大学大学院医歯学総合研究科 修了,東京医科歯科大学歯学部附属病院 医員,2009年 米国Massachusetts General Hospital研究員,2012年 同 講師を経て,2014年より米国Michigan大学 助教授.
研究テーマ:骨および軟骨の幹細胞とその分子制御機構.
関心事:2014年7月より米国Michigan大学に移り独立研究者として研究室をセットアップします.米国Massachusetts General Hospitalにおいてはじめた骨軟骨の未知の課題に挑む複数の未完のプロジェクトを完遂すべく,研究に取り組む意欲です.ポスドクとして力を貸してくれる人を募集しています.興味があればぜひ連絡ください.
Henry M. Kronenberg
米国Massachusetts General HospitalにてChief.
研究室URL:http://www.massgeneral.org/endocrine/
© 2014 小野法明・Henry M. Kronenberg Licensed under CC 表示 2.1 日本
(米国Massachusetts General Hospital,Endocrine Unit)
email:小野法明
DOI: 10.7875/first.author.2014.071
Vasculature-associated cells expressing nestin in developing bones encompass early cells in the osteoblast and endothelial lineage.
Noriaki Ono, Wanida Ono, Toshihide Mizoguchi, Takashi Nagasawa, Paul S. Frenette, Henry M. Kronenberg
Developmental Cell, 29, 330-339 (2014)
要 約
Nestin陽性細胞は骨髄において造血を支持する機能をもつ重要な細胞であるが,内軟骨性の骨化におけるこれらの細胞の形成の過程は明らかにされていない.Nestinの遺伝子プロモーターに依存してGFPを発現するマウスを詳細に解析した結果,Nestin陽性細胞は軟骨原基に侵入する血管内皮細胞およびその近傍の間葉系細胞において認められ,間葉系細胞は骨軟骨系の前駆細胞からIndian hedgehogおよびRunx2の作用により形成されることが明らかになった.また,細胞系譜の解析の結果,Nestin陽性細胞に由来する細胞としては血管内皮細胞が圧倒的に多いことが明らかになった.以上の結果より,Nestin陽性細胞は内軟骨性の骨化において血管の形成と密接に関連して発生し,その結果,骨芽細胞系および血管内皮細胞系の前駆細胞を含む多様な細胞を構成することが明らかになり,骨髄において造血を支持する微小環境を構成する細胞の複雑性が示唆された.
はじめに
骨は運動器としての主要な機能にくわえ,成体においては造血幹細胞から血液細胞が分化する唯一の部位である骨髄を形成する重要な器官である.大部分の骨は,発生の過程において軟骨原基が骨と骨髄により置換される内軟骨性の骨化により形成される1).その過程においては,まず軟骨細胞が形成され,つづいて骨芽前駆細胞が原基中心部の肥大軟骨細胞と近接する傍軟骨膜において形成される.この傍軟骨膜の骨芽前駆細胞は血管をともない軟骨原基に侵入し,1次骨化中心において骨芽細胞および間質細胞へと分化する2).胎生の後期において主要な造血部位は肝臓から脾臓および骨髄に移行するが,この1次骨化中心の骨髄間質細胞はCXCL12などの重要なケモカインを産生し,造血系幹細胞を支持する幹細胞ニッチの形成と密接に関連する3).また,骨髄間質細胞にくわえ,内骨膜骨芽細胞,血管内皮細胞,周皮細胞など多様な細胞が造血系幹細胞を骨髄に維持する微小環境を構成する4-7).成体の骨髄において,中間径フィラメントであるNestinを発現する細胞は間葉系幹細胞としての挙動を示し,さらに,造血系幹細胞の重要な構成要素であることが報告されている8).このように重要なはたらきを示すNestinを発現する細胞が内軟骨性の骨化の過程においてどのように形成されるかに関しては,これまで明らかにされていない.筆者らは,骨発生の過程におけるNestin発現細胞の起源,異質性,運命を明らかにするためこの研究を行った.
1.内軟骨性の骨化におけるNestin陽性の血管内皮細胞およびほかの間葉系細胞の形成
Nestinの遺伝子プロモーターに依存してGFPを発現するマウスを用いて,初期の骨発生を解析した.胎生10.5日齢の肢芽中央部において,Nestin陽性細胞はCD31陽性細胞と相似した網状の分布を示し,多数の共陽性細胞が認められた.胎生11.5日齢において,Nestin陽性細胞は骨軟骨原基の前駆体である間葉集合の内部には認められず,周辺部に少数のCD31との共陽性細胞が認められ,その数は胎生12.5日齢において初期の肥大化軟骨に近接する傍軟骨膜の形成にともない増加した.CD31陰性Nestin陽性細胞は,胎生13.5日齢において傍軟骨膜の内面の血管に近接した部位にはじめて出現した.胎生14.5日齢における傍軟骨膜の肥厚化および胎生15.5日齢における軟骨原基への血管の侵入による1次骨化中心の形成にともない,CD31陽性Nestin陽性細胞およびCD31陰性Nestin陽性細胞は互いに密接に関連しながらいちじるしく増加した.よって,内軟骨性の骨化の進行にともない,CD31陰性Nestin陽性細胞およびCD31陽性Nestin発現細胞が漸進的に形成されることが明らかになった.
2.Nestin陽性の非血管内皮細胞は骨芽細胞系の前駆細胞を含む
内軟骨性の骨化の過程において,骨軟骨の前駆細胞がどのようにNestin陽性細胞に寄与するかについて検討した.Creリコンビナーゼを用いた細胞系譜の解析の結果,II型コラーゲンを発現する骨軟骨の前駆細胞はCD31陽性Nestin陽性細胞には寄与せず,胎生13.5日齢に出現するCD31陰性Nestin陽性細胞に寄与することが明らかになった.また,誘導型のCreリコンビナーゼを用いた細胞系譜の解析の結果,これらの骨軟骨の前駆細胞そのものはNestin陰性であり,発生の進行にともない漸進的にCD31陰性Nestin陽性細胞に寄与することが認められた.また,これらのCD31陰性Nestin陽性細胞はOsterix陽性の骨芽前駆細胞と多く重複し,Indian HedgehogノックアウトマウスおよびRunx2ノックアウトマウスの骨原基においてこれらの細胞は形成されなかった.これらの結果より,非血管内皮系のNestin陽性細胞は骨芽前駆細胞を含み,骨軟骨系の前駆細胞からIndian HedgehogおよびRunx2の作用により分化して形成されることが明らかになった(図1).
3.Nestinの遺伝子プロモーターに依存して発現する誘導型CreリコンビナーゼはNestin陽性の血管内皮細胞を選択的に標識する
Nestinの遺伝子プロモーターに依存して誘導型Creリコンビナーゼを発現するマウスを用いて細胞系譜を解析した.骨髄腔が形成される胎生16.5日齢よりあとのCreリコンビナーゼの発現のみが,長期にわたり生存の可能な細胞を標識した.とくに,生後3日齢において標識をうけたNestinに由来する細胞は少なくとも6カ月以上も残存し,骨髄腔の血管洞と相似した網状に分布した.これらの細胞の大半はCD31陽性の血管内皮細胞であり,一部は一過性に骨芽細胞系に寄与したものの,その大半は時間の経過とともに消失した.また,骨髄脂肪細胞には分化せず,ごくまれに成長板の軟骨細胞への分化が認められた.さらに,一部の細胞は骨髄細動脈のCXCL12陽性の血管内皮細胞へと分化した.
4.生後に発生した骨髄のNestin陽性細胞は異質性に富む間質細胞から構成される
生後に発生した骨髄においてNestin陽性細胞を構成する細胞を,Nestinの遺伝子プロモーターに依存してGFPを発現するマウスを用いて詳細に検討した.生後1週齢の発生骨髄においては,GFPは成長板の軟骨の直下にある1次海綿骨の傍血管細胞および骨髄細動脈の周皮細胞にとくに強く発現し,また,骨芽細胞,骨細胞,血管内皮細胞にも発現が認められた.生後2カ月齢の成体の骨髄においてはGFPを発現した細胞の数はいちじるしく減少したが,骨芽細胞および骨細胞における発現は存続した.さらに,Nestinの遺伝子プロモーターに依存して発現する誘導型Creリコンビナーゼは,Nestinの遺伝子プロモーターに依存してGFPを発現した細胞のうち,とくに血管内皮細胞に富む画分を標識した.また,Nestinの遺伝子プロモーターに依存してGFPを発現した細胞は,骨芽細胞系のOsterix発現細胞およびその子孫細胞,血管内皮細胞系のTie2発現細胞およびその子孫細胞,傍血管間質細胞系のレプチン受容体発現細胞およびその子孫細胞,さらには,成熟した骨芽細胞を含み,異質性の高い細胞の集団であることが明らかになった.
おわりに
胎生期の骨髄における造血の確立には,傍軟骨膜から軟骨原基に侵入する骨芽前駆細胞および血管内皮細胞が必須であり,1次骨化中心の形成とともに,造血系幹細胞を支持する機能をもつ骨芽細胞,間質細胞,周皮細胞,血管内皮細胞など多様な細胞がほぼ同時に形成される.この研究により得られた所見は,これらの侵入した血管と密接に関連する細胞がNestinを発現することを明らかにした.成体の骨髄において,Nestin陽性細胞はコロニーを形成する画分を独占的に含み間葉系幹細胞としての挙動を示すことが報告されているが,これらの細胞は初期の骨発生においてはむしろ骨軟骨の前駆細胞からIndian hedgehogやRunx2の作用により分化する細胞であり,間葉系の細胞系譜におけるもっとも早期の細胞ではないことが示唆された.また,Nestinは成熟した骨芽細胞や骨細胞など広範な細胞に発現することから,Nestinをいわゆる間葉系幹細胞の特異的なマーカーとしてとらえることはむずかしい.また,間葉系幹細胞としての挙動を示すNestin陽性の周皮細胞のみならず,Nestin陽性の血管内皮細胞も,造血系幹細胞を維持する微小環境を構成する細胞として重要な機能をもつことが示唆された.
文 献
- Kronenberg, H. M.: Developmental regulation of the growth plate. Nature, 423, 332-336 (2003)[PubMed]
- Maes, C., Kobayashi, T., Selig, M. K. et al.: Osteoblast precursors, but not mature osteoblasts, move into developing and fractured bones along with invading blood vessels. Dev. Cell, 19, 329-344 (2010)[PubMed]
- Sugiyama, T., Kohara, H., Noda, M. et al.: Maintenance of the hematopoietic stem cell pool by CXCL12-CXCR4 chemokine signaling in bone marrow stromal cell niches. Immunity, 25, 977-988 (2006)[PubMed]
- Calvi, L. M., Adams, G. B., Weibrecht, K. W. et al.: Osteoblastic cells regulate the haematopoietic stem cell niche. Nature, 425, 841-846 (2003)[PubMed]
- Zhang, J., Niu, C., Ye, L. et al.: Identification of the haematopoietic stem cell niche and control of the niche size. Nature, 425, 836-841 (2003)[PubMed]
- Ding, L., Saunders, T. L., Enikolopov, G. et al.: Endothelial and perivascular cells maintain haematopoietic stem cells. Nature, 481, 457-462 (2012)[PubMed]
- Greenbaum, A., Hsu, Y. M., Day, R. B. et al.: CXCL12 in early mesenchymal progenitors is required for haematopoietic stem-cell maintenance. Nature, 495, 227-230 (2013)[PubMed]
- Mendez-Ferrer, S., Michurina, T. V., Ferraro, F. et al.: Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature, 466, 829-834 (2010)[PubMed]
著者プロフィール
略歴:2007年 東京医科歯科大学大学院医歯学総合研究科 修了,東京医科歯科大学歯学部附属病院 医員,2009年 米国Massachusetts General Hospital研究員,2012年 同 講師を経て,2014年より米国Michigan大学 助教授.
研究テーマ:骨および軟骨の幹細胞とその分子制御機構.
関心事:2014年7月より米国Michigan大学に移り独立研究者として研究室をセットアップします.米国Massachusetts General Hospitalにおいてはじめた骨軟骨の未知の課題に挑む複数の未完のプロジェクトを完遂すべく,研究に取り組む意欲です.ポスドクとして力を貸してくれる人を募集しています.興味があればぜひ連絡ください.
Henry M. Kronenberg
米国Massachusetts General HospitalにてChief.
研究室URL:http://www.massgeneral.org/endocrine/
© 2014 小野法明・Henry M. Kronenberg Licensed under CC 表示 2.1 日本