ヒトの卵子に1型糖尿病の患者の体細胞核を移植して2倍体の多能性幹細胞を樹立する
山田満稔・Bjarki Johannesson・Dieter Egli
(米国New York Stem Cell Foundation Research Institute)
email:山田満稔
DOI: 10.7875/first.author.2014.069
Human oocytes reprogram adult somatic nuclei of a type 1 diabetic to diploid pluripotent stem cells.
Mitsutoshi Yamada, Bjarki Johannesson, Ido Sagi, Lisa Cole Burnett, Daniel H. Kort, Robert W. Prosser, Daniel Paull, Michael W. Nestor, Matthew Freeby, Ellen Greenberg, Robin S. Goland, Rudolph L. Leibel, Susan L. Solomon, Nissim Benvenisty, Mark V. Sauer, Dieter Egli
Nature, 510, 533-536 (2014)
ヒトの卵子を用いた体細胞核の移植はES細胞と同等の能力をもつ多能性幹細胞の樹立を可能とし,将来的には免疫拒絶の起こらない細胞治療法への応用が期待される.転写因子をコードする遺伝子の導入によるiPS細胞の樹立が可能になったものの,iPS細胞とES細胞には多くの違いのあることが報告されており,臨床への応用にはいまだ問題がある.筆者らは,疾患をもつ成人の体細胞から2倍体のES細胞を作製することにより,疾患モデルの作製および細胞治療法に応用することを目標に,体細胞核の移植において胚盤胞の発生率および幹細胞の樹立の効率にかかわる因子をシステマティックに検討した.その結果,リン酸化阻害剤あるいは翻訳阻害剤を用いて卵子を活性化すること,および,ヒストン脱アセチル化酵素阻害剤を添加して胚を培養することにより,胚盤胞の発生率は改善した.胚の発生率はドナーとなる卵子のあいだで異なり,卵子が十分に成熟するまで排卵の誘発にかかった日数とは逆相関した一方,1日あたりの性腺刺激ホルモンの量および採卵された卵子の数は胚の発生率に影響しなかった.また,細胞融合の際に用いる高濃度のセンダイウイルスは細胞内Ca2+濃度の上昇にともなう卵子の早期の活性化を促進していたため,Ca2+を除去した培地のもとで希釈したセンダイウイルスを用いた.この修正したプロトコールを用いることにより,新生児の体細胞,および,成人の1型糖尿病の患者の体細胞からはじめて2倍体の多能性幹細胞を樹立することに成功した.
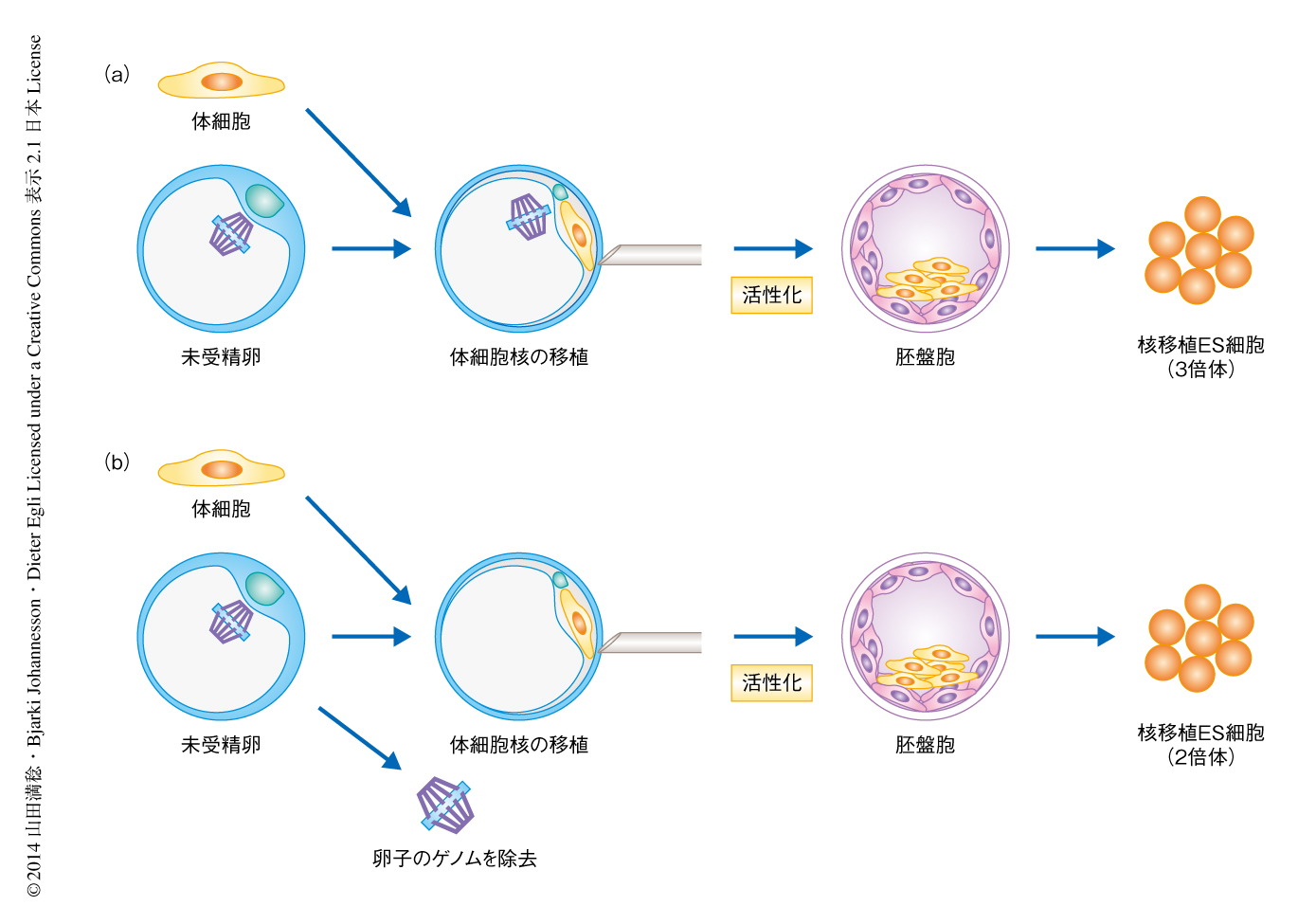
成人の体細胞核を卵子のゲノムを除去することなく卵子の細胞質へ移植すると,体細胞核はリプログラミングされて多能性幹細胞が樹立されることから(図1a),ヒトの卵子にはリプログラミング能があると報告された1).この多能性幹細胞はドナーの体細胞の2倍体ゲノムと卵母細胞の1倍体ゲノムをもつ3倍体である.卵子のゲノムを除去して体細胞核を移植すると(図1b),発生は胚盤胞期まで進行せず6~10細胞期で停止した.発生の停止した胚を網羅的な遺伝子発現解析に供したところ,体細胞核に由来する胚性ゲノムの活性化が起こっておらず,このことが発生の停止の要因のひとつと考えられた.
胚発生能の改善および2倍体の核移植胚のリプログラミングをめざして,ヒストン脱アセチル化酵素阻害薬の使用,および,卵子を活性化するプロトコールの改良を試みた.この修正は,ヒストン脱アセチル化酵素阻害薬により体細胞核を移植した胚の発生能が改善されたとのマウスにおける報告2),および,リン酸化阻害剤6-ジメチルアミノプリンと比較して翻訳阻害剤ピューロマイシンのほうが単為発生の改善に有効であったという筆者らの既報のデータ3) によるものである.検討の結果,ピューロマイシンおよび6-ジメチルアミノプリンを併用して卵子を活性化すると発生は拡張胚盤胞期まで進行した.ピューロマイシンはサイクリンBの翻訳を阻害して卵子の活性化を促進するが,6-ジメチルアミノプリンは減数分裂におけるリン酸化を抑制する.これらの併用により,減数分裂におけるリン酸化が効果的に抑制されたのかもしれない.以上の改良した卵子活性化プロトコールとヒストン脱アセチル化酵素阻害薬の使用により,たとえ卵子のゲノムを除去しても体細胞核を移植した胚を胚盤胞期まで発生させることが可能になった.
卵割期をこえて桑実胚期および胚盤胞期にまで発生が進行するには胚性ゲノムの活性化が不可欠である.以前の報告において,核移植胚は体細胞ゲノムに組み込まれたGFPを発現しなかったが1),この報告における修正プロトコールを用いることにより58%の核移植胚が体細胞ゲノムに組み込まれたGFPを発現し,体外受精胚と同様の発現パターンを示した.こうして得られた核移植胚に由来する7個の胚盤胞をES細胞の樹立において必須のステップである胚盤胞のoutgrowthに供したところ,内部細胞塊に由来する細胞は増殖したものの,ES細胞の樹立にはいたらなかった.
最近,胎児の線維芽細胞に由来する2倍体の多能性幹細胞の樹立が報告された4).ヒストン脱アセチル化酵素阻害薬の使用に関しては筆者らの報告と同様であったものの,卵子のゲノムの除去操作においてカフェインを使用することにより体細胞核の核膜の消失および染色体の凝集が促進されること,卵子の数に応じた排卵の誘発のプロトコールの選択,卵子の活性化における電気刺激の使用の重要性について論じられていた.そこで,筆者らは,胚盤胞の発生率の改善に必要な因子をシステマティックに検討するとともに,成人の1型糖尿病の患者および新生児の包皮に由来する線維芽細胞を用いて核移植ES細胞の樹立をめざすことにした.
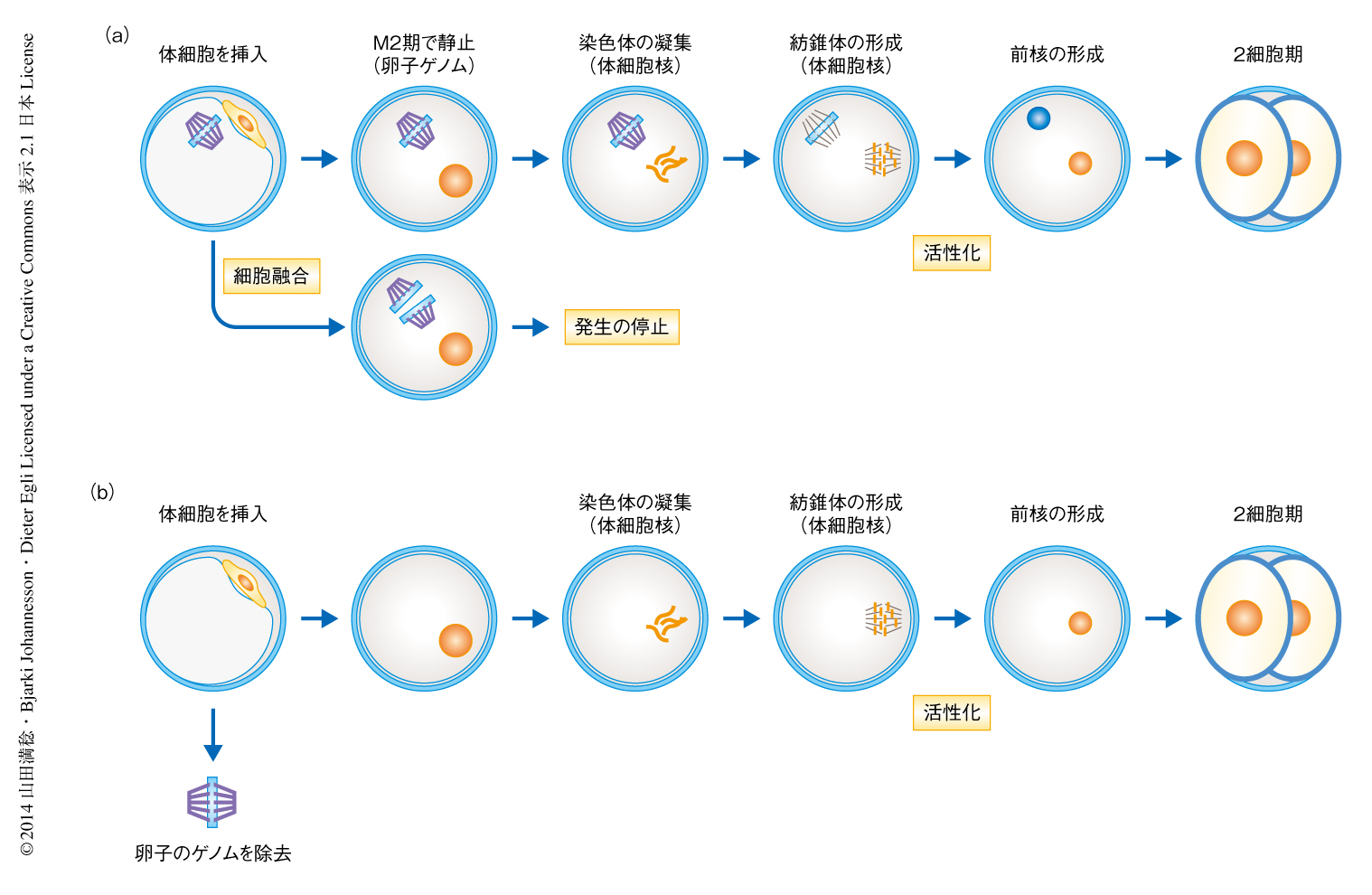
卵子のゲノムの除去が体細胞核における染色体の凝集を阻害し胚発生能の低下につながるのかどうかを検討した.G1期あるいはG0期の体細胞ゲノムをあらかじめ除核した卵子に移植したところ,74%の卵子は1~4時間で紡錘体を形成した(図2).体細胞に由来する染色体は凝集しヒストンH3のSer28はリン酸化されていたが,細胞分裂中期において染色体は整列しなかった.この原因として,複製しない染色体には微小管の二方向性の結合が起こらないことが考えられた.一方で,卵子の除核をせずに体細胞ゲノムを移植した場合でも,染色体の凝集および紡錘体の形成率は変わらなかった(図2).卵子のゲノムを除核せずに体細胞核を移植したものの,紡錘体を形成しなかった2個の卵子を免疫染色に供したところ,体細胞のヒストンはリン酸化をうけておらず,卵子のゲノムは染色体分離し,染色体パッセンジャー複合体のひとつBorealinに陽性の中心体を形成していた.以上の結果から,体細胞核における染色体の凝集は卵子のゲノムの除去操作に起因するとの仮説は否定された.
体細胞核を移植した卵子において細胞周期は進行していたことから,核移植の操作のあいだに卵子の早期の活性化がひき起こされた可能性が示唆された.細胞周期が減数分裂中期で停止している卵子を減数分裂後期へと進行させるには細胞内Ca2+濃度の上昇が必須である.そこで,卵子の早期の活性化の可能性を検討するため,卵子および紡錘体-染色体複合体をそれぞれCa2+蛍光プローブであるFluo-4と平衡化させ,細胞融合に用いるセンダイウイルスにさらした.その結果,10分後にはFluo-4の蛍光が観察された.Ca2+を含まない培地では蛍光強度は減弱したことからこの蛍光はCa2+依存性であると考えられた.この結果から,センダイウイルスを用いた細胞融合はCa2+の流入を促進し,卵子において減数第2分裂の停止機構を損なうものと考えられた.
卵子の早期の活性化をさけるため,20倍に希釈したセンダイウイルスを用いて細胞融合を行うことにした.さらに,Ca2+除去培地を用いて核移植を行った.その結果,移植された体細胞核の染色体は凝集し,胚盤胞の良好な発生率が得られた.卵子の活性化に電気刺激を組み合わせるとともに,核移植の操作の際にカフェインを用いることにより,もっとも高い胚盤胞の発生率が得られた.
核移植ES細胞の樹立において,培養液にウシ胎仔血清をくわえた結果,ウシ胎仔血清の添加は内部細胞塊の形成を促進させた.ウシ胎仔血清の非添加のもとで発生した8個の胚盤胞のうち2個は60個以上の細胞からなる栄養外胚葉を形成したが,核移植ES細胞の樹立にはいたらなかった.一方,ウシ胎仔血清の添加のもとでは栄養外胚葉を構成する細胞は20個未満と少ないにもかかわらず内部細胞塊はしっかりと形成され,得られた4個の胚盤胞のうち3個の内部細胞塊に由来する細胞が増殖した.ここから2倍体の雄の核型をもつ胎児の包皮の線維芽細胞に由来する3株の核移植ES細胞が樹立され,さらに,成人の1型糖尿病の患者の体細胞に由来する雌の核型をもつ1株の核移植ES細胞が樹立された.これら4株の核移植ES細胞はすべて多能性マーカーの発現が認められ,皮膚の線維芽細胞のマーカーは消失していた.核移植ES細胞はグローバルな遺伝子発現解析において,ほかのヒトの多能性幹細胞やiPS細胞と近い遺伝子発現パターンを示した.また,胚葉体の形成試験および免疫不全マウスへの移植実験のいずれにおいても三胚葉すべての組織への分化を認めた.さらに,分化条件において培養することにより,ニューロン,PDX-1陽性細胞,β細胞に分化し,β細胞はインスリン産生能も示した.
核移植胚の胚盤胞について10%程度の発生率が得られたものの,卵子のゲノムを除去しなくともドナーとなる卵子のあいだで核移植胚の発生能は異なっていた.そこで,核移植胚の発生能にかかわる卵子の因子を明らかにするため,ドナーの年齢,および,排卵の誘発のプロトコールが核移植ののちの胚発生能にかかわるかどうか,後方視的に検討した.その結果,ドナーの年齢が21~26歳の場合は27~32歳と比較して胚発生能が高かった.採卵された卵子の数,下垂体からのホルモン分泌の抑制の目的で用いる性腺刺激ホルモン放出ホルモンアゴニストおよび性腺刺激ホルモン放出ホルモンアンタゴニストの使用のプロトコール,排卵の誘発に用いる性腺刺激ホルモンの1日あたりの用量には,胚発生能と有意な相関が認められなかった.一方,卵胞径が18 mmに到達するまでの排卵の誘発に要する日数は,長ければ長いほど胚発生能が低下する傾向が認められた.臨床的には,卵胞の刺激に要する日数が長い場合には体外受精の成績が低下するものの,臨床的な妊娠率には寄与しないことが知られている5).このため,体細胞核の移植によるリプログラミングの機構を研究することが,生殖補助医療の現場ではいまだ明らかになっていない微妙な生物学的な違いを明らかにすることにつながるかもしれない.
さらに,この後方視的な検討により,希釈したセンダイウイルスを細胞融合に用いることが胚盤胞の発生率に,また,ウシ胎仔血清の使用が核移植ES細胞の樹立に,それぞれ有効であることが明らかになった.驚いたことに,移植する体細胞として新生児の線維芽細胞を使用した場合と比較して,成人の線維芽細胞を使用した場合でも胚盤胞の発生能に違いは認められなかった.
これらの後方視的な検討から,核移植ののちの胚盤胞の発生率を改善させる技術的な知見が得られた.しかしながら,卵子のゲノムを除去せずに体細胞核を移植したほうが,卵子のゲノムを除去した場合と比較して発生率が高かった.この解釈のひとつとして,体細胞ゲノムの不完全なリプログラミングを卵子のゲノムが代償していると考えることができる.今後のさらなる検討により,核移植の技術的な改善がどのようにリプログラミング能や発生能に影響をあたえるのかということに関する分子機構をより,いっそう理解できると期待される.
今回,筆者らは,新生児の体細胞および成人の1型糖尿病の患者の体細胞を用いて,ヒトの卵子に体細胞核を移植してリプログラミングを起こすことにより2倍体の多能性幹細胞を樹立することに成功した.この多能性幹細胞から分化させたβ細胞はインスリン分泌能をもっていた.このことから,この多能性幹細胞は将来的に細胞治療法への利用が期待される.現在は,転写因子をコードする遺伝子を導入することによりiPS細胞の樹立が可能になったものの6),iPS細胞は分化能に欠けること7),また,シトシンのメチル化のパターンの変化8-10),DNAの変異11),インプリント遺伝子の両アレル性の発現12) が報告されるなど,臨床への応用にはいまだ解決すべき問題が残っている.今後,核移植ES細胞とiPS細胞とを比較することにより,異なる方法によりリプログラミングされた多能性幹細胞の質を評価することが可能になると期待される.
略歴:2010年 慶應義塾大学大学院医学研究科博士課程 修了,同年 同 医学部 助教を経て,2013年より米国New York Stem Cell Foundation Research Instituteポストドクトラルフェロー.
研究テーマ:核移植を用いた疾患モデルおよび細胞治療モデルの作製.
関心事:リプログラミングおよび不妊症の分子機構の解明.
Bjarki Johannesson
米国New York Stem Cell Foundation Research Instituteポストドクトラルフェロー.
Dieter Egli
米国New York Stem Cell Foundation Research Instituteシニアリサーチフェロー.
© 2014 山田満稔・Bjarki Johannesson・Dieter Egli Licensed under CC 表示 2.1 日本
(米国New York Stem Cell Foundation Research Institute)
email:山田満稔
DOI: 10.7875/first.author.2014.069
Human oocytes reprogram adult somatic nuclei of a type 1 diabetic to diploid pluripotent stem cells.
Mitsutoshi Yamada, Bjarki Johannesson, Ido Sagi, Lisa Cole Burnett, Daniel H. Kort, Robert W. Prosser, Daniel Paull, Michael W. Nestor, Matthew Freeby, Ellen Greenberg, Robin S. Goland, Rudolph L. Leibel, Susan L. Solomon, Nissim Benvenisty, Mark V. Sauer, Dieter Egli
Nature, 510, 533-536 (2014)
要 約
ヒトの卵子を用いた体細胞核の移植はES細胞と同等の能力をもつ多能性幹細胞の樹立を可能とし,将来的には免疫拒絶の起こらない細胞治療法への応用が期待される.転写因子をコードする遺伝子の導入によるiPS細胞の樹立が可能になったものの,iPS細胞とES細胞には多くの違いのあることが報告されており,臨床への応用にはいまだ問題がある.筆者らは,疾患をもつ成人の体細胞から2倍体のES細胞を作製することにより,疾患モデルの作製および細胞治療法に応用することを目標に,体細胞核の移植において胚盤胞の発生率および幹細胞の樹立の効率にかかわる因子をシステマティックに検討した.その結果,リン酸化阻害剤あるいは翻訳阻害剤を用いて卵子を活性化すること,および,ヒストン脱アセチル化酵素阻害剤を添加して胚を培養することにより,胚盤胞の発生率は改善した.胚の発生率はドナーとなる卵子のあいだで異なり,卵子が十分に成熟するまで排卵の誘発にかかった日数とは逆相関した一方,1日あたりの性腺刺激ホルモンの量および採卵された卵子の数は胚の発生率に影響しなかった.また,細胞融合の際に用いる高濃度のセンダイウイルスは細胞内Ca2+濃度の上昇にともなう卵子の早期の活性化を促進していたため,Ca2+を除去した培地のもとで希釈したセンダイウイルスを用いた.この修正したプロトコールを用いることにより,新生児の体細胞,および,成人の1型糖尿病の患者の体細胞からはじめて2倍体の多能性幹細胞を樹立することに成功した.
はじめに
成人の体細胞核を卵子のゲノムを除去することなく卵子の細胞質へ移植すると,体細胞核はリプログラミングされて多能性幹細胞が樹立されることから(図1a),ヒトの卵子にはリプログラミング能があると報告された1).この多能性幹細胞はドナーの体細胞の2倍体ゲノムと卵母細胞の1倍体ゲノムをもつ3倍体である.卵子のゲノムを除去して体細胞核を移植すると(図1b),発生は胚盤胞期まで進行せず6~10細胞期で停止した.発生の停止した胚を網羅的な遺伝子発現解析に供したところ,体細胞核に由来する胚性ゲノムの活性化が起こっておらず,このことが発生の停止の要因のひとつと考えられた.
胚発生能の改善および2倍体の核移植胚のリプログラミングをめざして,ヒストン脱アセチル化酵素阻害薬の使用,および,卵子を活性化するプロトコールの改良を試みた.この修正は,ヒストン脱アセチル化酵素阻害薬により体細胞核を移植した胚の発生能が改善されたとのマウスにおける報告2),および,リン酸化阻害剤6-ジメチルアミノプリンと比較して翻訳阻害剤ピューロマイシンのほうが単為発生の改善に有効であったという筆者らの既報のデータ3) によるものである.検討の結果,ピューロマイシンおよび6-ジメチルアミノプリンを併用して卵子を活性化すると発生は拡張胚盤胞期まで進行した.ピューロマイシンはサイクリンBの翻訳を阻害して卵子の活性化を促進するが,6-ジメチルアミノプリンは減数分裂におけるリン酸化を抑制する.これらの併用により,減数分裂におけるリン酸化が効果的に抑制されたのかもしれない.以上の改良した卵子活性化プロトコールとヒストン脱アセチル化酵素阻害薬の使用により,たとえ卵子のゲノムを除去しても体細胞核を移植した胚を胚盤胞期まで発生させることが可能になった.
卵割期をこえて桑実胚期および胚盤胞期にまで発生が進行するには胚性ゲノムの活性化が不可欠である.以前の報告において,核移植胚は体細胞ゲノムに組み込まれたGFPを発現しなかったが1),この報告における修正プロトコールを用いることにより58%の核移植胚が体細胞ゲノムに組み込まれたGFPを発現し,体外受精胚と同様の発現パターンを示した.こうして得られた核移植胚に由来する7個の胚盤胞をES細胞の樹立において必須のステップである胚盤胞のoutgrowthに供したところ,内部細胞塊に由来する細胞は増殖したものの,ES細胞の樹立にはいたらなかった.
最近,胎児の線維芽細胞に由来する2倍体の多能性幹細胞の樹立が報告された4).ヒストン脱アセチル化酵素阻害薬の使用に関しては筆者らの報告と同様であったものの,卵子のゲノムの除去操作においてカフェインを使用することにより体細胞核の核膜の消失および染色体の凝集が促進されること,卵子の数に応じた排卵の誘発のプロトコールの選択,卵子の活性化における電気刺激の使用の重要性について論じられていた.そこで,筆者らは,胚盤胞の発生率の改善に必要な因子をシステマティックに検討するとともに,成人の1型糖尿病の患者および新生児の包皮に由来する線維芽細胞を用いて核移植ES細胞の樹立をめざすことにした.
1.卵子のゲノムの除去操作は卵子による体細胞核における染色体の凝集能および紡錘体の形成能を損なわない
卵子のゲノムの除去が体細胞核における染色体の凝集を阻害し胚発生能の低下につながるのかどうかを検討した.G1期あるいはG0期の体細胞ゲノムをあらかじめ除核した卵子に移植したところ,74%の卵子は1~4時間で紡錘体を形成した(図2).体細胞に由来する染色体は凝集しヒストンH3のSer28はリン酸化されていたが,細胞分裂中期において染色体は整列しなかった.この原因として,複製しない染色体には微小管の二方向性の結合が起こらないことが考えられた.一方で,卵子の除核をせずに体細胞ゲノムを移植した場合でも,染色体の凝集および紡錘体の形成率は変わらなかった(図2).卵子のゲノムを除核せずに体細胞核を移植したものの,紡錘体を形成しなかった2個の卵子を免疫染色に供したところ,体細胞のヒストンはリン酸化をうけておらず,卵子のゲノムは染色体分離し,染色体パッセンジャー複合体のひとつBorealinに陽性の中心体を形成していた.以上の結果から,体細胞核における染色体の凝集は卵子のゲノムの除去操作に起因するとの仮説は否定された.
2.センダイウイルスを用いた細胞融合は卵子の早期の活性化を促進する
体細胞核を移植した卵子において細胞周期は進行していたことから,核移植の操作のあいだに卵子の早期の活性化がひき起こされた可能性が示唆された.細胞周期が減数分裂中期で停止している卵子を減数分裂後期へと進行させるには細胞内Ca2+濃度の上昇が必須である.そこで,卵子の早期の活性化の可能性を検討するため,卵子および紡錘体-染色体複合体をそれぞれCa2+蛍光プローブであるFluo-4と平衡化させ,細胞融合に用いるセンダイウイルスにさらした.その結果,10分後にはFluo-4の蛍光が観察された.Ca2+を含まない培地では蛍光強度は減弱したことからこの蛍光はCa2+依存性であると考えられた.この結果から,センダイウイルスを用いた細胞融合はCa2+の流入を促進し,卵子において減数第2分裂の停止機構を損なうものと考えられた.
卵子の早期の活性化をさけるため,20倍に希釈したセンダイウイルスを用いて細胞融合を行うことにした.さらに,Ca2+除去培地を用いて核移植を行った.その結果,移植された体細胞核の染色体は凝集し,胚盤胞の良好な発生率が得られた.卵子の活性化に電気刺激を組み合わせるとともに,核移植の操作の際にカフェインを用いることにより,もっとも高い胚盤胞の発生率が得られた.
3.核移植ES細胞は未分化能および多分化能をもち分化したβ細胞はインスリンを分泌する
核移植ES細胞の樹立において,培養液にウシ胎仔血清をくわえた結果,ウシ胎仔血清の添加は内部細胞塊の形成を促進させた.ウシ胎仔血清の非添加のもとで発生した8個の胚盤胞のうち2個は60個以上の細胞からなる栄養外胚葉を形成したが,核移植ES細胞の樹立にはいたらなかった.一方,ウシ胎仔血清の添加のもとでは栄養外胚葉を構成する細胞は20個未満と少ないにもかかわらず内部細胞塊はしっかりと形成され,得られた4個の胚盤胞のうち3個の内部細胞塊に由来する細胞が増殖した.ここから2倍体の雄の核型をもつ胎児の包皮の線維芽細胞に由来する3株の核移植ES細胞が樹立され,さらに,成人の1型糖尿病の患者の体細胞に由来する雌の核型をもつ1株の核移植ES細胞が樹立された.これら4株の核移植ES細胞はすべて多能性マーカーの発現が認められ,皮膚の線維芽細胞のマーカーは消失していた.核移植ES細胞はグローバルな遺伝子発現解析において,ほかのヒトの多能性幹細胞やiPS細胞と近い遺伝子発現パターンを示した.また,胚葉体の形成試験および免疫不全マウスへの移植実験のいずれにおいても三胚葉すべての組織への分化を認めた.さらに,分化条件において培養することにより,ニューロン,PDX-1陽性細胞,β細胞に分化し,β細胞はインスリン産生能も示した.
4.核移植胚の発生能に関連する因子の後方視的な検討
核移植胚の胚盤胞について10%程度の発生率が得られたものの,卵子のゲノムを除去しなくともドナーとなる卵子のあいだで核移植胚の発生能は異なっていた.そこで,核移植胚の発生能にかかわる卵子の因子を明らかにするため,ドナーの年齢,および,排卵の誘発のプロトコールが核移植ののちの胚発生能にかかわるかどうか,後方視的に検討した.その結果,ドナーの年齢が21~26歳の場合は27~32歳と比較して胚発生能が高かった.採卵された卵子の数,下垂体からのホルモン分泌の抑制の目的で用いる性腺刺激ホルモン放出ホルモンアゴニストおよび性腺刺激ホルモン放出ホルモンアンタゴニストの使用のプロトコール,排卵の誘発に用いる性腺刺激ホルモンの1日あたりの用量には,胚発生能と有意な相関が認められなかった.一方,卵胞径が18 mmに到達するまでの排卵の誘発に要する日数は,長ければ長いほど胚発生能が低下する傾向が認められた.臨床的には,卵胞の刺激に要する日数が長い場合には体外受精の成績が低下するものの,臨床的な妊娠率には寄与しないことが知られている5).このため,体細胞核の移植によるリプログラミングの機構を研究することが,生殖補助医療の現場ではいまだ明らかになっていない微妙な生物学的な違いを明らかにすることにつながるかもしれない.
さらに,この後方視的な検討により,希釈したセンダイウイルスを細胞融合に用いることが胚盤胞の発生率に,また,ウシ胎仔血清の使用が核移植ES細胞の樹立に,それぞれ有効であることが明らかになった.驚いたことに,移植する体細胞として新生児の線維芽細胞を使用した場合と比較して,成人の線維芽細胞を使用した場合でも胚盤胞の発生能に違いは認められなかった.
これらの後方視的な検討から,核移植ののちの胚盤胞の発生率を改善させる技術的な知見が得られた.しかしながら,卵子のゲノムを除去せずに体細胞核を移植したほうが,卵子のゲノムを除去した場合と比較して発生率が高かった.この解釈のひとつとして,体細胞ゲノムの不完全なリプログラミングを卵子のゲノムが代償していると考えることができる.今後のさらなる検討により,核移植の技術的な改善がどのようにリプログラミング能や発生能に影響をあたえるのかということに関する分子機構をより,いっそう理解できると期待される.
おわりに
今回,筆者らは,新生児の体細胞および成人の1型糖尿病の患者の体細胞を用いて,ヒトの卵子に体細胞核を移植してリプログラミングを起こすことにより2倍体の多能性幹細胞を樹立することに成功した.この多能性幹細胞から分化させたβ細胞はインスリン分泌能をもっていた.このことから,この多能性幹細胞は将来的に細胞治療法への利用が期待される.現在は,転写因子をコードする遺伝子を導入することによりiPS細胞の樹立が可能になったものの6),iPS細胞は分化能に欠けること7),また,シトシンのメチル化のパターンの変化8-10),DNAの変異11),インプリント遺伝子の両アレル性の発現12) が報告されるなど,臨床への応用にはいまだ解決すべき問題が残っている.今後,核移植ES細胞とiPS細胞とを比較することにより,異なる方法によりリプログラミングされた多能性幹細胞の質を評価することが可能になると期待される.
文 献
- Noggle, S., Fung, H. L., Gore, A. et al.: Human oocytes reprogram somatic cells to a pluripotent state. Nature, 478, 70-75 (2011)[PubMed]
- Fan, Y., Jiang, Y., Chen, X. et al.: Derivation of cloned human blastocysts by histone deacetylase inhibitor treatment after somatic cell nuclear transfer with beta-thalassemia fibroblasts. Stem Cells Dev., 20, 1951-1959 (2011)[PubMed]
- Paull, D., Emmanuele, V., Weiss, K. A. et al.: Nuclear genome transfer in human oocytes eliminates mitochondrial DNA variants. Nature, 493, 632-637 (2013)[PubMed]
- Tachibana, M., Amato, P., Sparman, M. et al.: Human embryonic stem cells derived by somatic cell nuclear transfer. Cell, 153, 1228-1238 (2013)[PubMed]
- Bar-Hava, I., Yoeli, R., Yulzari-Roll, V. et al.: Controlled ovarian hyperstimulation: does prolonged stimulation justify cancellation of in vitro fertilization cycles? Gynecol Endocrinol., 21, 232-234 (2005)[PubMed]
- Takahashi, K., Tanabe, K., Ohnuki, M. et al.: Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell, 131, 861-872 (2007)[PubMed]
- Koyanagi-Aoi, M., Ohnuki, M., Takahashi, K. et al.: Differentiation-defective phenotypes revealed by large-scale analyses of human pluripotent stem cells. Proc. Natl. Acad. Sci. USA, 110, 20569-20574 (2013)[PubMed]
- Ohi, Y., Qin, H., Hong, C. et al.: Incomplete DNA methylation underlies a transcriptional memory of somatic cells in human iPS cells. Nat. Cell Biol., 13, 541-549 (2011)[PubMed]
- Ruiz, S., Diep, D., Gore, A. et al.: Identification of a specific reprogramming-associated epigenetic signature in human induced pluripotent stem cells. Proc. Natl. Acad. Sci. USA, 109, 16196-16201 (2012)[PubMed]
- Lister, R., Pelizzola, M., Kida, Y. S. et al.: Hotspots of aberrant epigenomic reprogramming in human induced pluripotent stem cells. Nature, 471, 68-73 (2011)[PubMed]
- Gore, A., Li, Z., Fung, H. L. et al.: Somatic coding mutations in human induced pluripotent stem cells. Nature, 471, 63-67 (2011)[PubMed]
- Pick, M., Stelzer, Y., Bar-Nur, O. et al.: Clone- and gene-specific aberrations of parental imprinting in human induced pluripotent stem cells. Stem Cells, 27, 2686-2690 (2009)[PubMed]
著者プロフィール
略歴:2010年 慶應義塾大学大学院医学研究科博士課程 修了,同年 同 医学部 助教を経て,2013年より米国New York Stem Cell Foundation Research Instituteポストドクトラルフェロー.
研究テーマ:核移植を用いた疾患モデルおよび細胞治療モデルの作製.
関心事:リプログラミングおよび不妊症の分子機構の解明.
Bjarki Johannesson
米国New York Stem Cell Foundation Research Instituteポストドクトラルフェロー.
Dieter Egli
米国New York Stem Cell Foundation Research Instituteシニアリサーチフェロー.
© 2014 山田満稔・Bjarki Johannesson・Dieter Egli Licensed under CC 表示 2.1 日本