組織に特異的に存在するシグナルはマクロファージの局在および機能を可逆的に制御する
岡部 泰賢
(米国Yale大学School of Medicine,Department of Immunobiology)
email:岡部泰賢
DOI: 10.7875/first.author.2014.064
Tissue-specific signals control reversible program of localization and functional polarization of macrophages.
Yasutaka Okabe, Ruslan Medzhitov
Cell, 157, 832-844 (2014)
生体のほぼすべての組織には恒常的にマクロファージが存在する.これらのマクロファージは組織に存在するシグナルに応答することによりさまざまな機能および形態を示し,組織における恒常性の維持に寄与する.しかし,この組織マクロファージの多様性を制御するシグナルの実体はほとんど明らかにされていなかった.今回,筆者らは,腹腔マクロファージに焦点をあて,マクロファージが組織からのシグナルにより特異的な遺伝子の発現を誘導する分子機構について解析した.その結果,腹膜の一部である大網から産生されるレチノイン酸が腹腔マクロファージにおいて転写因子をコードするGATA6遺伝子の発現を可逆的に誘導することにより組織に特異的な遺伝子の発現を活性化し,腹腔のB-1細胞を介した抗体の産生を制御していることが明らかにされた.
マクロファージはほかの細胞には類をみないさまざまな機能をもつ.これは,マクロファージが病原体認識受容体,Gタンパク質共役受容体,スカベンジャー受容体,核内ホルモン受容体などの種々の細胞外シグナルセンサーを発現することにより,周囲に存在するさまざまなシグナルを認識し応答することに起因する.一方,生体のほぼすべての組織には恒常的にマクロファージが存在し,おのおのの組織に特化した性質を示すことが知られている.すなわち,肝臓のクッパー細胞,脳のマイクログリア,骨の破骨細胞,肺胞マクロファージ,腸管マクロファージなど,異なる組織マクロファージは組織において特異的な役割を担い恒常性の維持に寄与する1).この組織マクロファージの多様性は,マクロファージが組織に存在する細胞外シグナルに応答し特異的な遺伝子の発現の活性化を誘導することにより決定されると考えられている.しかし,この組織シグナルの実体はこれまでほとんど明らかにされていなかった.
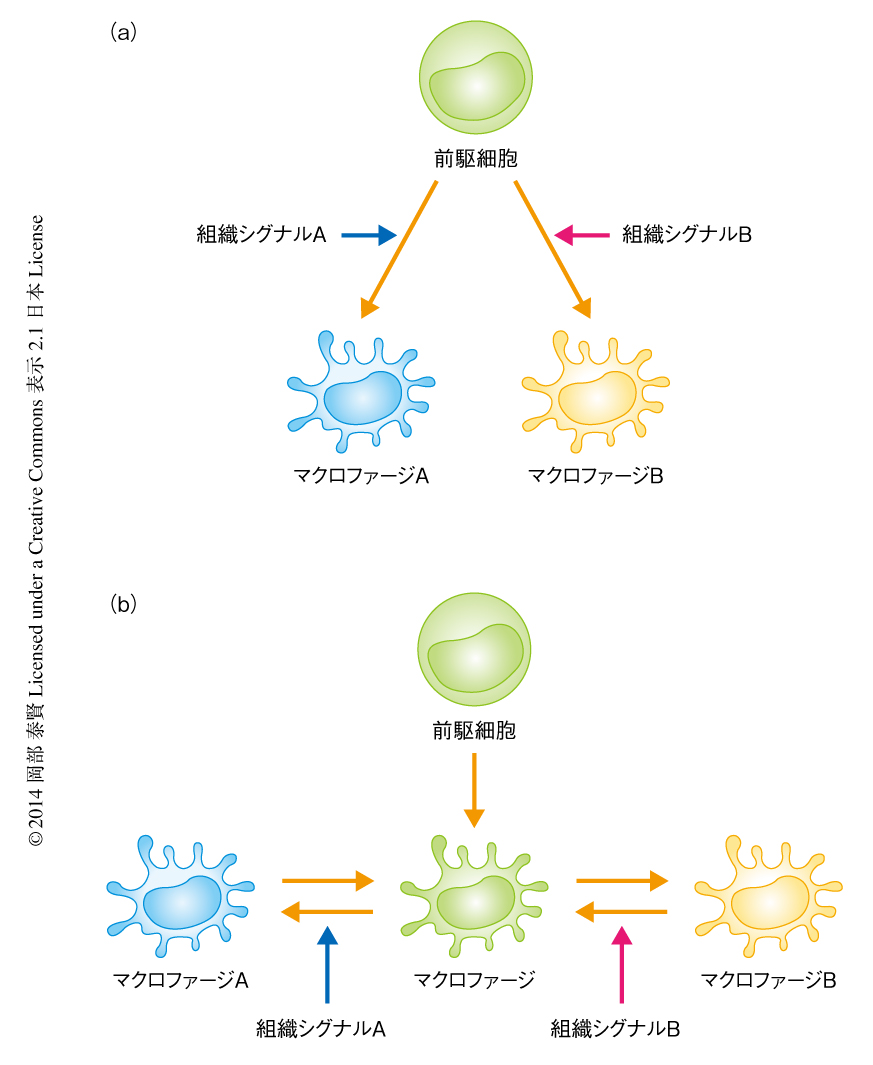
マクロファージが組織に特異的な性質を獲得する分子機構には2つの可能性が考えられる(図1).ひとつは,細胞分化にともなう非可逆的なプログラムである.すなわち,マクロファージが組織のあいだで異なる細胞分化をとげることにより異なるマクロファージのサブセットが発生するという可能性である.実際に,NFATc1,Spic,LXRαなどの転写因子を欠損するマウスは特定の組織においてのみマクロファージを欠損することから,これまで,マクロファージの組織における多様性は細胞分化にともない成立するとの考えが支配的であった2).もうひとつの可能性は,分化し成熟したマクロファージが異なる組織の環境に応答してその性質を変化させる分極化である.分極化は必ずしも細胞の性質を固定するものではなく,細胞外シグナルの有無により可逆的に発動するプログラムであると考えられる.すなわち,マクロファージは同一の組織においてもその環境の変化に対し柔軟に細胞の性質を変化させ,組織における恒常性の維持に寄与している可能性が考えられる.これまで,感染や肥満などのストレス状態においてインターフェロンγやインターロイキン4などのサイトカインがマクロファージの分極化を誘導することは報告されていたが3),恒常的なマクロファージの組織における多様性が分極化の機構により制御されているかどうかは明らかではなかった.
筆者らは,このような背景のもと,マクロファージが組織に存在するシグナルを感知し特異的な遺伝子の発現を誘導する分子機構に焦点をあて研究を行った.
腹腔,肺,肝臓,脾臓,小腸,脂肪組織の6つの組織からマクロファージを分取し,マイクロアレイ法により遺伝子の発現を比較することにより,おのおのの組織マクロファージにおいて特異的に発現する遺伝子を同定した.それら遺伝子のうち,腹腔マクロファージにおいて特異的に発現する転写因子をコードするGATA6遺伝子に着目した.マクロファージにおいて特異的にGATA6を欠損するマウスを作製したところ,腹腔マクロファージは分化したが,腹腔において特異的に発現する遺伝子のうち約40%の発現がいちじるしく減弱していた.このことは,腹腔マクロファージにおいて特異的な遺伝子の発現の多くが転写因子GATA6に依存して制御されていることを示していた.そこで,GATA6遺伝子の発現の活性化を腹腔マクロファージにおいて特異的な遺伝子の発現の指標とすることで,組織に特異的なマクロファージの遺伝子発現の分子機構を解析することにした.
GATA6遺伝子の上流の配列を解析したところ,レチノイン酸により活性化される核内受容体RARの結合配列と相同性をもつ配列が見い出された.3T3細胞を用いたレポーターアッセイでは,この配列を介してレチノイン酸がGATA6遺伝子プロモーターを活性化したことから,腹腔に存在するレチノイン酸がGATA6遺伝子の発現を活性化する可能性が考えられた.実際に,腹腔マクロファージをレチノイン酸の核内受容体RARに対するインバースアゴニストであるBMS493で処理したところ,GATA6遺伝子の発現は抑制された.レチノイン酸は食物を介して取り込まれたビタミンAから体内において変換される.ビタミンAを除去したえさで飼育したマウスでは腹腔マクロファージにおけるGATA6遺伝子の発現が顕著に低下していた.そして,この発現はレチノイン酸の処理により回復した.以上の結果から,レチノイン酸が腹腔マクロファージにおけるGATA6遺伝子の発現に必須であると結論づけた.
レチノイン酸は組織に特異的なシグナルとしてどのように作用するのだろうか.小腸から吸収されたビタミンAは転写不活性型であるレチノールとして肝臓に貯蔵される.レチノールは血流を介して全身に運ばれ,標的となる組織に到達するとレチノイン酸合成酵素の作用により転写活性化型であるレチノイン酸に変換される4).大網とよばれる脂肪に富んだ腹膜は腹腔マクロファージの分化の場であることが示唆されていたが5),最近,大網にはレチノイン酸合成酵素が豊富に発現していることが報告された6).実際に,大網にはレチノイン酸合成酵素のひとつRaldh2がほかの組織に比べ5倍以上も高く発現していたことから,大網において合成されたレチノイン酸が腹腔マクロファージにおけるGATA6遺伝子の発現を誘導している可能性が考えられた.マクロファージにおいて特異的にGATA6を欠損するマウスでは,大網に大量のマクロファージが蓄積した一方,腹腔におけるマクロファージの数は顕著に減少していた.これらのことから,レチノイン酸を介したGATA6遺伝子の発現の活性化は大網において分化したマクロファージが腹腔へと移動するために必要であると考えられた.
大網がレチノイン酸のほかにも組織に特異的な遺伝子の発現を誘導するシグナルを腹腔マクロファージに提供している可能性について検討した.その結果,in vitroで培養した骨髄に由来するマクロファージに対し,大網の培養上清がレチノイン酸に非依存的あるいはレチノイン酸と協調的に腹腔マクロファージに特異的な遺伝子の発現を誘導することを見い出した.このことは,レチノイン酸を含む複数のシグナルがマクロファージに作用し組織において特異的な遺伝子発現を誘導していることを示唆していた.
腹腔マクロファージは組織に特異的にどのような役割を担うのだろうか.B細胞サブセットのひとつであるB-1細胞は,リンパ組織にはほとんどみられずおもに腹腔に局在する7).最近,B-1細胞はレチノイン酸およびTGFβの作用により免疫グロブリンAへと高い頻度でクラススイッチを起こすことが報告されている8).興味深いことに,TGFβ2,TGFβを活性型に変換するThbs1,TGFβと結合し細胞外マトリックスへの局在を制御するLTBP1など,TGFβに関連するタンパク質の遺伝子は,組織に特異的およびGATA6に依存的に腹腔マクロファージに発現していた.そこで,腹腔マクロファージに発現するGATA6がB-1細胞による免疫グロブリンAの産生に関与する可能性について検討した.野生型の腹腔マクロファージをレチノイン酸の存在のもとでB-1細胞と共培養すると免疫グロブリンAへのクラススイッチが検出されたが,GATA6を欠損する腹腔マクロファージにはこの作用がみられなかった.しかし,培地に活性型TGFβ2をくわえることにより,クラススイッチの頻度は野生型のマクロファージとの共培養と同じ程度にまで回復した.腹腔のB-1細胞は腸管の粘膜固有層に移動し腸管関連リンパ組織に非依存的に免疫グロブリンAの産生に寄与することが報告されている9).腸管関連リンパ組織を欠損する遺伝的な背景にてマクロファージにおいて特異的にGATA6を欠損するマウスでは,糞便に含まれる免疫グロブリンAの量が有意に減少した.以上の結果から,転写因子GATA6を介した腹腔マクロファージの機能はB-1細胞による免疫グロブリンAの産生に寄与すると結論づけた.
今回,筆者らは,腹腔マクロファージをモデルとし,マクロファージが組織に存在するシグナルを感知し特異的な遺伝子の発現を誘導する分子機構を明らかにした(図2).これまで,組織マクロファージの多様な表現型は異なる細胞分化の過程で生じる非可逆的な細胞の運命決定によると考えられてきた.しかし,GATA6を欠損しても腹腔マクロファージは正常に発生したこと,GATA6遺伝子を含む腹腔に特異的な遺伝子の発現はレチノイン酸の存在量に比例して変化したことから,恒常的な組織マクロファージの多様性は可逆的な分極化によっても制御されることが明らかになった.このことは,組織マクロファージは細胞分化の過程において定められた役割だけでなく,組織の環境の変化に対しても柔軟にその性質を変化させ多様な機能を担うことにより,組織における恒常性の維持に寄与することを示唆していた.そしてこのことは,マクロファージが個体の発生,生理代謝,生体防御,がんや動脈硬化を例とする病態,など多くの生命現象に関与することを考えるうえでも重要であろう.
略歴:2006年 大阪大学大学院医学系研究科 修了,同年 同 博士研究員,2007年 京都大学大学院医学研究科 博士研究員を経て,2008年より米国Yale大学School of Medicine博士研究員
研究テーマ:組織マクロファージの細胞生物学.
関心事:マクロファージによる組織における恒常性の維持.
© 2014 岡部 泰賢 Licensed under CC 表示 2.1 日本
(米国Yale大学School of Medicine,Department of Immunobiology)
email:岡部泰賢
DOI: 10.7875/first.author.2014.064
Tissue-specific signals control reversible program of localization and functional polarization of macrophages.
Yasutaka Okabe, Ruslan Medzhitov
Cell, 157, 832-844 (2014)
この論文に出現する遺伝子・タンパク質のUniprot ID
GATA6(Q61169), 病原体認識受容体, Gタンパク質共役受容体, スカベンジャー受容体, 核内ホルモン受容体, NFATc1(O88942), Spic(Q6P3D7), LXRα(Q9Z0Y9), インターフェロンγ(P01580), インターロイキン4(P07750), サイトカイン, RAR(P22605), レチノイン酸合成酵素, Raldh2(Q62148), TGFβ, TGFβ2(P27090), Thbs1(P35441), LTBP1(Q8CG19)
要 約
生体のほぼすべての組織には恒常的にマクロファージが存在する.これらのマクロファージは組織に存在するシグナルに応答することによりさまざまな機能および形態を示し,組織における恒常性の維持に寄与する.しかし,この組織マクロファージの多様性を制御するシグナルの実体はほとんど明らかにされていなかった.今回,筆者らは,腹腔マクロファージに焦点をあて,マクロファージが組織からのシグナルにより特異的な遺伝子の発現を誘導する分子機構について解析した.その結果,腹膜の一部である大網から産生されるレチノイン酸が腹腔マクロファージにおいて転写因子をコードするGATA6遺伝子の発現を可逆的に誘導することにより組織に特異的な遺伝子の発現を活性化し,腹腔のB-1細胞を介した抗体の産生を制御していることが明らかにされた.
はじめに
マクロファージはほかの細胞には類をみないさまざまな機能をもつ.これは,マクロファージが病原体認識受容体,Gタンパク質共役受容体,スカベンジャー受容体,核内ホルモン受容体などの種々の細胞外シグナルセンサーを発現することにより,周囲に存在するさまざまなシグナルを認識し応答することに起因する.一方,生体のほぼすべての組織には恒常的にマクロファージが存在し,おのおのの組織に特化した性質を示すことが知られている.すなわち,肝臓のクッパー細胞,脳のマイクログリア,骨の破骨細胞,肺胞マクロファージ,腸管マクロファージなど,異なる組織マクロファージは組織において特異的な役割を担い恒常性の維持に寄与する1).この組織マクロファージの多様性は,マクロファージが組織に存在する細胞外シグナルに応答し特異的な遺伝子の発現の活性化を誘導することにより決定されると考えられている.しかし,この組織シグナルの実体はこれまでほとんど明らかにされていなかった.
マクロファージが組織に特異的な性質を獲得する分子機構には2つの可能性が考えられる(図1).ひとつは,細胞分化にともなう非可逆的なプログラムである.すなわち,マクロファージが組織のあいだで異なる細胞分化をとげることにより異なるマクロファージのサブセットが発生するという可能性である.実際に,NFATc1,Spic,LXRαなどの転写因子を欠損するマウスは特定の組織においてのみマクロファージを欠損することから,これまで,マクロファージの組織における多様性は細胞分化にともない成立するとの考えが支配的であった2).もうひとつの可能性は,分化し成熟したマクロファージが異なる組織の環境に応答してその性質を変化させる分極化である.分極化は必ずしも細胞の性質を固定するものではなく,細胞外シグナルの有無により可逆的に発動するプログラムであると考えられる.すなわち,マクロファージは同一の組織においてもその環境の変化に対し柔軟に細胞の性質を変化させ,組織における恒常性の維持に寄与している可能性が考えられる.これまで,感染や肥満などのストレス状態においてインターフェロンγやインターロイキン4などのサイトカインがマクロファージの分極化を誘導することは報告されていたが3),恒常的なマクロファージの組織における多様性が分極化の機構により制御されているかどうかは明らかではなかった.
筆者らは,このような背景のもと,マクロファージが組織に存在するシグナルを感知し特異的な遺伝子の発現を誘導する分子機構に焦点をあて研究を行った.
1.腹腔マクロファージに特異的な遺伝子の発現を制御する転写因子GATA6の同定
腹腔,肺,肝臓,脾臓,小腸,脂肪組織の6つの組織からマクロファージを分取し,マイクロアレイ法により遺伝子の発現を比較することにより,おのおのの組織マクロファージにおいて特異的に発現する遺伝子を同定した.それら遺伝子のうち,腹腔マクロファージにおいて特異的に発現する転写因子をコードするGATA6遺伝子に着目した.マクロファージにおいて特異的にGATA6を欠損するマウスを作製したところ,腹腔マクロファージは分化したが,腹腔において特異的に発現する遺伝子のうち約40%の発現がいちじるしく減弱していた.このことは,腹腔マクロファージにおいて特異的な遺伝子の発現の多くが転写因子GATA6に依存して制御されていることを示していた.そこで,GATA6遺伝子の発現の活性化を腹腔マクロファージにおいて特異的な遺伝子の発現の指標とすることで,組織に特異的なマクロファージの遺伝子発現の分子機構を解析することにした.
2.レチノイン酸に依存したGATA6遺伝子の発現の活性化
GATA6遺伝子の上流の配列を解析したところ,レチノイン酸により活性化される核内受容体RARの結合配列と相同性をもつ配列が見い出された.3T3細胞を用いたレポーターアッセイでは,この配列を介してレチノイン酸がGATA6遺伝子プロモーターを活性化したことから,腹腔に存在するレチノイン酸がGATA6遺伝子の発現を活性化する可能性が考えられた.実際に,腹腔マクロファージをレチノイン酸の核内受容体RARに対するインバースアゴニストであるBMS493で処理したところ,GATA6遺伝子の発現は抑制された.レチノイン酸は食物を介して取り込まれたビタミンAから体内において変換される.ビタミンAを除去したえさで飼育したマウスでは腹腔マクロファージにおけるGATA6遺伝子の発現が顕著に低下していた.そして,この発現はレチノイン酸の処理により回復した.以上の結果から,レチノイン酸が腹腔マクロファージにおけるGATA6遺伝子の発現に必須であると結論づけた.
3.レチノイン酸-GATA6経路はマクロファージの腹腔への局在を制御する
レチノイン酸は組織に特異的なシグナルとしてどのように作用するのだろうか.小腸から吸収されたビタミンAは転写不活性型であるレチノールとして肝臓に貯蔵される.レチノールは血流を介して全身に運ばれ,標的となる組織に到達するとレチノイン酸合成酵素の作用により転写活性化型であるレチノイン酸に変換される4).大網とよばれる脂肪に富んだ腹膜は腹腔マクロファージの分化の場であることが示唆されていたが5),最近,大網にはレチノイン酸合成酵素が豊富に発現していることが報告された6).実際に,大網にはレチノイン酸合成酵素のひとつRaldh2がほかの組織に比べ5倍以上も高く発現していたことから,大網において合成されたレチノイン酸が腹腔マクロファージにおけるGATA6遺伝子の発現を誘導している可能性が考えられた.マクロファージにおいて特異的にGATA6を欠損するマウスでは,大網に大量のマクロファージが蓄積した一方,腹腔におけるマクロファージの数は顕著に減少していた.これらのことから,レチノイン酸を介したGATA6遺伝子の発現の活性化は大網において分化したマクロファージが腹腔へと移動するために必要であると考えられた.
大網がレチノイン酸のほかにも組織に特異的な遺伝子の発現を誘導するシグナルを腹腔マクロファージに提供している可能性について検討した.その結果,in vitroで培養した骨髄に由来するマクロファージに対し,大網の培養上清がレチノイン酸に非依存的あるいはレチノイン酸と協調的に腹腔マクロファージに特異的な遺伝子の発現を誘導することを見い出した.このことは,レチノイン酸を含む複数のシグナルがマクロファージに作用し組織において特異的な遺伝子発現を誘導していることを示唆していた.
4.腹腔マクロファージにおけるGATA6に依存的なB-1細胞の機能制御
腹腔マクロファージは組織に特異的にどのような役割を担うのだろうか.B細胞サブセットのひとつであるB-1細胞は,リンパ組織にはほとんどみられずおもに腹腔に局在する7).最近,B-1細胞はレチノイン酸およびTGFβの作用により免疫グロブリンAへと高い頻度でクラススイッチを起こすことが報告されている8).興味深いことに,TGFβ2,TGFβを活性型に変換するThbs1,TGFβと結合し細胞外マトリックスへの局在を制御するLTBP1など,TGFβに関連するタンパク質の遺伝子は,組織に特異的およびGATA6に依存的に腹腔マクロファージに発現していた.そこで,腹腔マクロファージに発現するGATA6がB-1細胞による免疫グロブリンAの産生に関与する可能性について検討した.野生型の腹腔マクロファージをレチノイン酸の存在のもとでB-1細胞と共培養すると免疫グロブリンAへのクラススイッチが検出されたが,GATA6を欠損する腹腔マクロファージにはこの作用がみられなかった.しかし,培地に活性型TGFβ2をくわえることにより,クラススイッチの頻度は野生型のマクロファージとの共培養と同じ程度にまで回復した.腹腔のB-1細胞は腸管の粘膜固有層に移動し腸管関連リンパ組織に非依存的に免疫グロブリンAの産生に寄与することが報告されている9).腸管関連リンパ組織を欠損する遺伝的な背景にてマクロファージにおいて特異的にGATA6を欠損するマウスでは,糞便に含まれる免疫グロブリンAの量が有意に減少した.以上の結果から,転写因子GATA6を介した腹腔マクロファージの機能はB-1細胞による免疫グロブリンAの産生に寄与すると結論づけた.
おわりに
今回,筆者らは,腹腔マクロファージをモデルとし,マクロファージが組織に存在するシグナルを感知し特異的な遺伝子の発現を誘導する分子機構を明らかにした(図2).これまで,組織マクロファージの多様な表現型は異なる細胞分化の過程で生じる非可逆的な細胞の運命決定によると考えられてきた.しかし,GATA6を欠損しても腹腔マクロファージは正常に発生したこと,GATA6遺伝子を含む腹腔に特異的な遺伝子の発現はレチノイン酸の存在量に比例して変化したことから,恒常的な組織マクロファージの多様性は可逆的な分極化によっても制御されることが明らかになった.このことは,組織マクロファージは細胞分化の過程において定められた役割だけでなく,組織の環境の変化に対しても柔軟にその性質を変化させ多様な機能を担うことにより,組織における恒常性の維持に寄与することを示唆していた.そしてこのことは,マクロファージが個体の発生,生理代謝,生体防御,がんや動脈硬化を例とする病態,など多くの生命現象に関与することを考えるうえでも重要であろう.
文 献
- Gordon, S. & Taylor, P. R.: Monocyte and macrophage heterogeneity. Nat. Rev. Immunol., 5, 953-964 (2005)[PubMed]
- Wynn, T. A., Chawla, A. & Pollard, J. W.: Macrophage biology in development, homeostasis and disease. Nature, 496, 445-455 (2013)[PubMed]
- Gordon, S. & Martinez F. O.: Alternative activation of macrophages: mechanism and functions. Immunity, 32, 593-604 (2010)[PubMed]
- Duester, G.: Retinoic acid synthesis and signaling during early organogenesis. Cell, 134, 921-931 (2008)[PubMed]
- Wijffels, J. F., Hendrickx, R. J., Steenbergen, J. J. et al.: Milky spots in the mouse omentum may play an important role in the origin of peritoneal macrophages. Res. Immunol., 143, 401-409 (1992)[PubMed]
- Maruya, M., Suzuki, K., Fujimoto, H. et al.: Vitamin A-dependent transcriptional activation of the nuclear factor of activated T cell c1 (NFATc1) is critical for the development and survival of B1 cells. Proc. Nati. Acad. Sci. USA, 108, 722-777 (2011)[PubMed]
- Baumgarth, N.: The double life of a B-1 cell: self-reactivity selects for protective effector functions. Nat. Rev. Immunol., 11, 34-46 (2011)[PubMed]
- Roy, B., Brennecke, A. M., Agarwal, S. et al.: An intrinsic propensity of murine peritoneal B1b cells to switch to IgA in presence of TGF-β and retinoic acid. PLoS One, 8, e82121 (2013)[PubMed]
- Fagarasan, S., Kawamoto, S., Kanagawa, O. et al.: Adaptive immune regulation in the gut: T cell-dependent and T cell-independent IgA synthesis. Annu. Rev. Immunol., 28, 243-273 (2010)[PubMed]
著者プロフィール
略歴:2006年 大阪大学大学院医学系研究科 修了,同年 同 博士研究員,2007年 京都大学大学院医学研究科 博士研究員を経て,2008年より米国Yale大学School of Medicine博士研究員
研究テーマ:組織マクロファージの細胞生物学.
関心事:マクロファージによる組織における恒常性の維持.
© 2014 岡部 泰賢 Licensed under CC 表示 2.1 日本