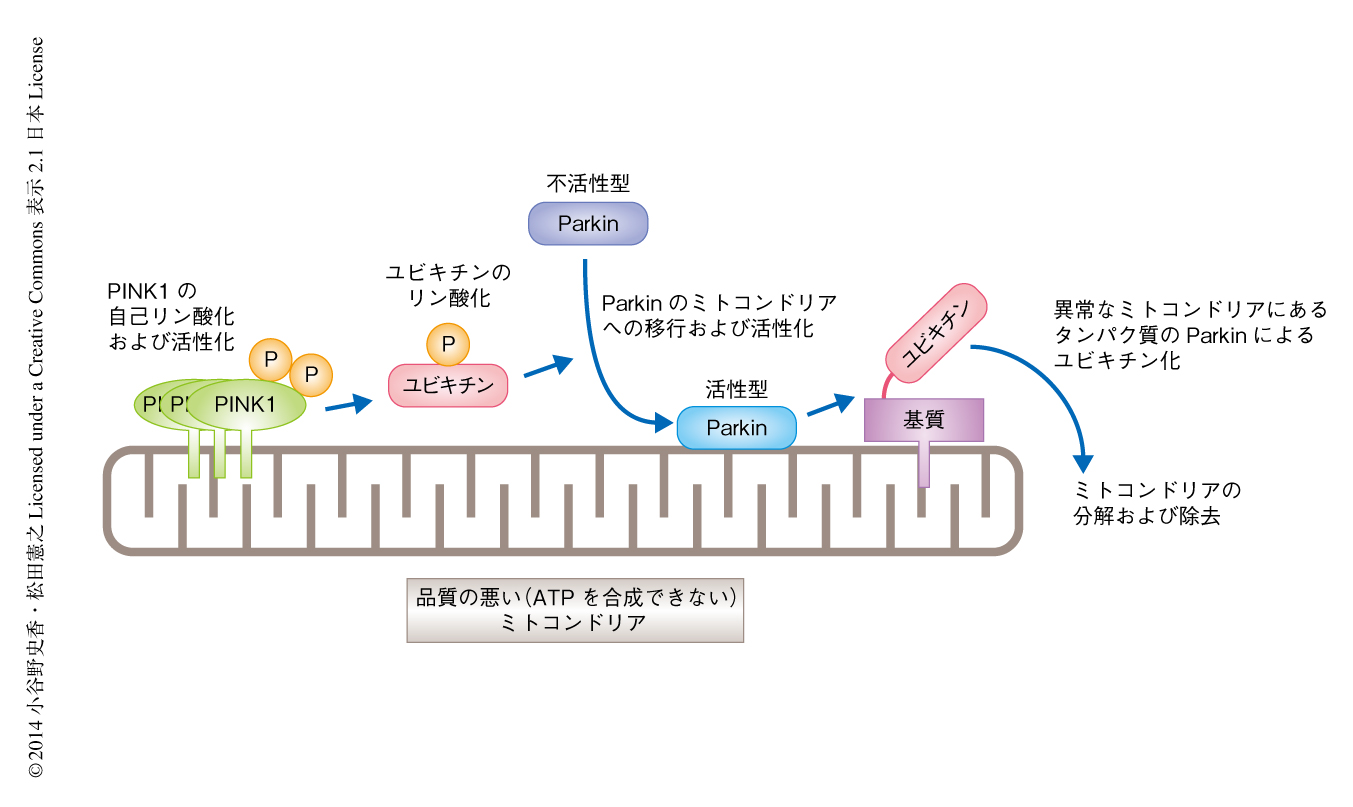
PINK1によりリン酸化されたユビキチンがユビキチン連結酵素Parkinを活性化する
小谷野史香・松田憲之
(東京都医学総合研究所 蛋白質代謝研究室)
email:小谷野史香,松田憲之
DOI: 10.7875/first.author.2014.068
Ubiquitin is phosphorylated by PINK1 to activate parkin.
Fumika Koyano, Kei Okatsu, Hidetaka Kosako, Yasushi Tamura, Etsu Go, Mayumi Kimura, Yoko Kimura, Hikaru Tsuchiya, Hidehito Yoshihara, Takatsugu Hirokawa, Toshiya Endo, Edward A. Fon, Jean-François Trempe, Yasushi Saeki, Keiji Tanaka, Noriyuki Matsuda
Nature, 510, 162-166 (2014)
PINK1およびParkinは遺伝性パーキンソン病の原因遺伝子の産物である.これまでの研究により,セリン/スレオニンキナーゼであるPINK1とユビキチンリガーゼであるParkinとが協調してミトコンドリアの品質管理を担うことが示されてきた.しかしながら,その分子機構が完全に理解されたわけではなく,とくに,PINK1とParkinとを結びつける実体は不明であり,このミッシングリンクの発見および同定がこの分野に残された最大の謎といわれていた.今回,筆者らは,細胞においてミトコンドリアの品質が低下するとPINK1がユビキチンをリン酸化し,それにより生じるリン酸化ユビキチンがParkinを活性化して,遺伝性パーキンソン病の発症を抑制していることを明らかにした.
パーキンソン病は国内だけでも14万人をこえる患者のいる難治性の神経変性疾患である.神経伝達物質であるドーパミンを産生するニューロンが失われることにより,安静時のふるえ,歩行の障害,姿勢保持の障害,動作緩慢などの運動障害が起こる.また,高齢者ほど患者の数が多く,65歳をこえると1%以上の人が罹患するといわれている.病状が進行すると自律神経の障害,記憶力の低下などの認知機能の障害,幻視やうつなどの精神症状が現われることもあり,最終的に自立した生活が困難になる危険性がある.社会の高齢化が進むにつれ患者の数は増えつづけており,疾患の発症するしくみの解明,また,早期の診断法および根本的な治療法の確立が社会的にも強く求められている.
パーキンソン病にはいくつかのタイプがあり発症の原因も単一ではないと考えられている.PINK1遺伝子あるいはPARKIN遺伝子,および,それらの産物に変異が起こると若くしてパーキンソン病の症状を示し,これは常染色体劣性若年性パーキンソン症候群あるいは遺伝性劣性若年性パーキンソン症候群ともよばれる1,2).PINK1はセリン/スレオニンキナーゼ,Parkinはユビキチンリガーゼである.遺伝子の変異や欠損によりPINK1あるいはParkinの機能が失われるとパーキンソン病が発症することから,PINK1およびParkinがふだんはパーキンソン病の発症を抑制するためにはたらいていることがわかる3,4).そこで,筆者らは,PINK1およびParkinの機能を調べればパーキンソン病の発症の機構にせまれるのではないかと考え,10年近く研究を続けてきた.
2010年,筆者は,Parkinのユビキチンリガーゼ活性は通常の細胞においては観察できず,ミトコンドリアの膜電位の低下にともない活性化されることを明らかにした4).また,2012年から2013年にかけて,筆者の所属するグループを含め国内外の複数の研究グループにより,ParkinのSer65がミトコンドリアの膜電位の低下およびPINK1の両方に依存してリン酸化されることが報告された5-7).しかしながら,ParkinのSer65のリン酸化を模倣した変異体は依然としてその活性化にPINK1への依存性を示したことなどから,PINK1によるParkinのSer65のリン酸化だけでPINK1の機能を説明するのは困難であり,Parkinの活性化に必要な別のPINK1の基質の存在することが示唆されていた.そこで,Parkinのほかにも重要なPINK1の基質の存在する可能性を考えて新しいPINK1の基質を探索したのが,この研究の出発点であった.
Parkinのリン酸化部位であるSer65はN末端側にあるユビキチン様ドメインに存在する.Parkinのユビキチン様ドメインとユビキチンはアミノ酸配列において約30%の相同性をもち,Parkinのリン酸化部位であるSer65はその両者で保存されている.そこで,ミトコンドリアの膜電位を低下させる薬剤CCCPにより処理した細胞抽出液を用いて,リン酸化タンパク質の移動度を変化させるPhos-tagウェスタンブロット解析を行ったところ,ユビキチンのリン酸化を示すバンドのシフトが観察された.また,CCCP処理した細胞から回収したミトコンドリアを用いて,in vitroにおいて精製したユビキチンをリン酸化できることも確認した.PINK1を欠損した細胞から調製したミトコンドリアは精製したユビキチンをリン酸化できないが,野生型のPINK1を入れ戻すとユビキチンに対するリン酸化能は回復し,キナーゼ活性をもたないPINK1の変異体あるいは遺伝性パーキンソン病の患者に由来するPINK1の変異体の入れ戻しではユビキチンはリン酸化されないままであった.また,CCCP処理した細胞から抗PINK1抗体を用いて回収した免疫沈降物もユビキチンを明瞭にリン酸化したことから,PINK1がユビキチンをリン酸化することが示された.
ユビキチンにおけるリン酸化部位を同定するため質量分析計により解析したところ,Parkinと同様に,ユビキチンのSer65がCCCP処理に依存してリン酸化されることがわかった.実際に,Ser65をAlaに置換したユビキチン変異体はin vitroおよびin vivoにおいてリン酸化されなかった.さらに,ミトコンドリアの膜電位が低下したとき細胞に存在するユビキチンのうちどの程度がリン酸化されているかを,AQUAペプチドと質量分析計を用いた絶対定量法により検討した.HeLa細胞では内在性のユビキチンの約0.05%がCCCP処理に依存してリン酸化されることが示され,さらに,このリン酸化は内在性のPINK1に依存していた.この0.05%という比率は非常に低いが,細胞には数百種類から千種類ほどのユビキチンリガーゼが存在するといわれていることから,Parkinに割り当てられるユビキチンの量(単純計算で,0.5%以下)を考えると十分な量ではないかと思われた.
リン酸化ユビキチンが細胞においてはたす役割について検証した.PINK1によるParkinの制御は大きく2つに分けることができる.ひとつは,膜電位の低下したミトコンドリアへの移行(細胞内局在の変化)であり,もうひとつは,さきに述べたユビキチンリガーゼ機能の活性化(ユビキチンリガーゼ活性の変化)である.そこで,蛍光タンパク質GFPとParkinとの融合タンパク質を細胞に導入して,細胞内局在の変化はGFPの蛍光を蛍光顕微鏡により観察し,ユビキチンリガーゼ活性の変化は偽基質であるGFPに対するユビキチン化を指標に測定した.野生型のユビキチンと野生型のParkin,野生型のユビキチンとリン酸化を模倣したParkin,リン酸化を模倣したユビキチン変異体と野生型のParkin,を細胞内に共発現したところ,Parkinの細胞内局在およびユビキチンリガーゼ活性は変化しなかった.一方で,リン酸化を模倣したParkin変異体とリン酸化を模倣したユビキチン変異体とを共発現したところ,Parkinの細胞内局在は変化しなかったが,驚くべきことに,ミトコンドリアの状態とは無関係にParkinが活性化された.さらに,無細胞系を確立して,ミトコンドリアの活性が正常な細胞からリン酸化を模倣したParkin変異体を含む細胞質の画分を回収し,リン酸化を模倣したユビキチン,あるいは,in vitroにおいて事前にリン酸化したユビキチンと反応させたところ,Parkinのユビキチンリガーゼ活性が検出された.これらの結果は,リン酸化ユビキチンがリン酸化ParkinをPINK1に非依存的に活性化すること,つまり,PINK1によるParkinの活性化をリン酸化ユビキチンがバイパスできることを示していた.なお,リン酸化ユビキチンがParkinを活性化する際に,ユビキチンのC末端側にありチオエステル結合の形成やイソペプチド結合の形成に必須のGlyGlyモチーフは必要なかったことから,Parkinを活性化する際にリン酸化ユビキチンはほかのタンパク質と結合している必要はないことも示された.
リン酸化ユビキチンはどのようにParkinを活性化するのだろうか? 現時点では,その分子機構は完全に解明されたわけではないが,いくつかの手がかりが得られている.
まず,Parkinとリン酸化ユビキチンとが結合するかどうかを検討した.両者の結合は非常に弱いのか,通常の免疫沈降やプルダウン実験では安定的な結合活性を検出することはできなかったが,Fluoppi系を用いることにより,リン酸化を模倣したParkin変異体とリン酸化を模倣したユビキチン変異体との細胞における結合が示された.
つぎに,in vitroにおいてParkinによるユビキチン化を再構成することにより,ユビキチン化反応のどのステップが活性化されるのかについて検討した.Parkinが基質をユビキチン化する過程では,まず,ユビキチン活性化酵素(E1)によりATPに依存してユビキチンが活性化され,E1と高エネルギーチオエステル結合した中間体が形成される.つぎに,ユビキチンはチオエステル結合を保持したまま,E1からユビキチン結合酵素(E2)に,さらに,E2からユビキチンリガーゼ(E3)であるParkinの活性中心に移行して,最終的に基質タンパク質へと受け渡される.E2とチオエステル結合を形成したE2-ユビキチン反応中間体を用いて解析した結果,Parkinの存在下においてのみ,リン酸化ユビキチンがE2-ユビキチン反応中間体からのユビキチンの遊離を促進することが示された.この活性はParkinを要求するので,リン酸化ユビキチンが単純にE2からのユビキチンの遊離を促進しているわけではなかった.
Parkinの立体構造解析から,通常の状態ではParkinの活性中心は外部からのアクセスが困難な状態になっていると考えられる8).これらの結果を考えあわせると,リン酸化ユビキチンがParkinと結合することで,チオエステル結合したユビキチンの受け手であるParkinの活性中心を露出させることにより,ユビキチン結合酵素からParkinへのユビキチンの移行を促進していると考えるのが妥当だと思われた(図1).今後は,このモデルを実験的に検証していきたいと考えている.
この研究においては,翻訳後修飾因子として細胞において幅広く使用されているユビキチン自体がリン酸化修飾をうけること,ミトコンドリアの膜電位の低下を引き金としてPINK1がユビキチンをリン酸化すること,リン酸化されたユビキチンがParkinを活性化すること,が示された(図2).正常な状態ではPINK1がユビキチンをリン酸化することでParkinを活性化することにより細胞の異常なミトコンドリアを除去する一方,この機構が破綻すると異常なミトコンドリアが徐々に脳に蓄積しパーキンソン病の発症にいたると考えられた.なお,Parkinにより基質タンパク質へと受け渡されるユビキチンは必ずしもリン酸化されている必要はないが,PINK1によるユビキチンのリン酸化→Parkinの活性化→ユビキチンのミトコンドリアへの集積→PINK1によるそのユビキチンのさらなるリン酸化→Parkinの活性化,という正のサイクルが形成され,このサイクルがシグナルを増幅させている可能性が考えられる.
ユビキチンに関しては膨大な量の論文が発表されているが,翻訳後修飾因子であるユビキチン自体がリン酸化という修飾をうけ,かつ,それが遺伝性パーキンソン病の発症を抑制するのに重要な役割を担うという知見は,誰も予想できないものであった.実際に,Parkinの研究を深化させてミトコンドリアの異常という情報を伝達するParkinの活性化因子を同定したところ,それがユビキチンであったという展開は,筆者にとっても驚きで研究の不思議を感じるものであった.
この成果は直接的には遺伝性パーキンソン病に関するものであるが,より一般的な孤発性パーキンソン病についてもその発症に同様のしくみが関与している可能性は十分にあるだろう.また,リン酸化ユビキチンに由来するペプチドを質量分析計により測定することで,放置するとパーキンソン病の発症につながるような細胞におけるミトコンドリアの異常を高感度で検知することが期待できることから,パーキンソン病の新しい病理解析ツールや診断マーカーの開発につながる可能性もある.今後は,このような応用も視野にいれつつ,さらに基礎研究を展開させたい.
なお,筆者らの論文とほぼ同じ時期に,米国の研究グループからも,非常に関連したリン酸化ユビキチンに関する論文が出版された9).細部に違いはあるが,彼らの結果と筆者らの結果は大枠において一致しており,この研究が第三者によっても再現できる信頼度の高いものであることが証明されたと考えている.
略歴:東京大学大学院新領域創成科学研究科博士課程 在学中.
研究テーマ:ミトコンドリアの品質管理とパーキンソン病.
抱負:新しいことに挑戦しつづけたい.
松田 憲之(Noriyuki Matsuda)
東京都医学総合研究所 副参事研究員.
研究室URL:http://www.igakuken.or.jp/pro-meta/studies/mastuda.html
© 2014 小谷野史香・松田憲之 Licensed under CC 表示 2.1 日本
(東京都医学総合研究所 蛋白質代謝研究室)
email:小谷野史香,松田憲之
DOI: 10.7875/first.author.2014.068
Ubiquitin is phosphorylated by PINK1 to activate parkin.
Fumika Koyano, Kei Okatsu, Hidetaka Kosako, Yasushi Tamura, Etsu Go, Mayumi Kimura, Yoko Kimura, Hikaru Tsuchiya, Hidehito Yoshihara, Takatsugu Hirokawa, Toshiya Endo, Edward A. Fon, Jean-François Trempe, Yasushi Saeki, Keiji Tanaka, Noriyuki Matsuda
Nature, 510, 162-166 (2014)
この論文に出現する遺伝子・タンパク質のUniprot ID
PINK1(Q9BXM7), ユビキチン, ユビキチン連結酵素Parkin(O60260), parkin(O60260), Parkin(O60260), セリン/スレオニンキナーゼ, ユビキチンリガーゼ, ドーパミン, PARKIN(O60260), ユビキチン活性化酵素(E1), E1, ユビキチン結合酵素(E2)(P68036), E2(P68036), ユビキチンリガーゼ(E3), ユビキチン結合酵素(P68036)
要 約
PINK1およびParkinは遺伝性パーキンソン病の原因遺伝子の産物である.これまでの研究により,セリン/スレオニンキナーゼであるPINK1とユビキチンリガーゼであるParkinとが協調してミトコンドリアの品質管理を担うことが示されてきた.しかしながら,その分子機構が完全に理解されたわけではなく,とくに,PINK1とParkinとを結びつける実体は不明であり,このミッシングリンクの発見および同定がこの分野に残された最大の謎といわれていた.今回,筆者らは,細胞においてミトコンドリアの品質が低下するとPINK1がユビキチンをリン酸化し,それにより生じるリン酸化ユビキチンがParkinを活性化して,遺伝性パーキンソン病の発症を抑制していることを明らかにした.
はじめに
パーキンソン病は国内だけでも14万人をこえる患者のいる難治性の神経変性疾患である.神経伝達物質であるドーパミンを産生するニューロンが失われることにより,安静時のふるえ,歩行の障害,姿勢保持の障害,動作緩慢などの運動障害が起こる.また,高齢者ほど患者の数が多く,65歳をこえると1%以上の人が罹患するといわれている.病状が進行すると自律神経の障害,記憶力の低下などの認知機能の障害,幻視やうつなどの精神症状が現われることもあり,最終的に自立した生活が困難になる危険性がある.社会の高齢化が進むにつれ患者の数は増えつづけており,疾患の発症するしくみの解明,また,早期の診断法および根本的な治療法の確立が社会的にも強く求められている.
パーキンソン病にはいくつかのタイプがあり発症の原因も単一ではないと考えられている.PINK1遺伝子あるいはPARKIN遺伝子,および,それらの産物に変異が起こると若くしてパーキンソン病の症状を示し,これは常染色体劣性若年性パーキンソン症候群あるいは遺伝性劣性若年性パーキンソン症候群ともよばれる1,2).PINK1はセリン/スレオニンキナーゼ,Parkinはユビキチンリガーゼである.遺伝子の変異や欠損によりPINK1あるいはParkinの機能が失われるとパーキンソン病が発症することから,PINK1およびParkinがふだんはパーキンソン病の発症を抑制するためにはたらいていることがわかる3,4).そこで,筆者らは,PINK1およびParkinの機能を調べればパーキンソン病の発症の機構にせまれるのではないかと考え,10年近く研究を続けてきた.
2010年,筆者は,Parkinのユビキチンリガーゼ活性は通常の細胞においては観察できず,ミトコンドリアの膜電位の低下にともない活性化されることを明らかにした4).また,2012年から2013年にかけて,筆者の所属するグループを含め国内外の複数の研究グループにより,ParkinのSer65がミトコンドリアの膜電位の低下およびPINK1の両方に依存してリン酸化されることが報告された5-7).しかしながら,ParkinのSer65のリン酸化を模倣した変異体は依然としてその活性化にPINK1への依存性を示したことなどから,PINK1によるParkinのSer65のリン酸化だけでPINK1の機能を説明するのは困難であり,Parkinの活性化に必要な別のPINK1の基質の存在することが示唆されていた.そこで,Parkinのほかにも重要なPINK1の基質の存在する可能性を考えて新しいPINK1の基質を探索したのが,この研究の出発点であった.
1.PINK1はユビキチンをリン酸化する
Parkinのリン酸化部位であるSer65はN末端側にあるユビキチン様ドメインに存在する.Parkinのユビキチン様ドメインとユビキチンはアミノ酸配列において約30%の相同性をもち,Parkinのリン酸化部位であるSer65はその両者で保存されている.そこで,ミトコンドリアの膜電位を低下させる薬剤CCCPにより処理した細胞抽出液を用いて,リン酸化タンパク質の移動度を変化させるPhos-tagウェスタンブロット解析を行ったところ,ユビキチンのリン酸化を示すバンドのシフトが観察された.また,CCCP処理した細胞から回収したミトコンドリアを用いて,in vitroにおいて精製したユビキチンをリン酸化できることも確認した.PINK1を欠損した細胞から調製したミトコンドリアは精製したユビキチンをリン酸化できないが,野生型のPINK1を入れ戻すとユビキチンに対するリン酸化能は回復し,キナーゼ活性をもたないPINK1の変異体あるいは遺伝性パーキンソン病の患者に由来するPINK1の変異体の入れ戻しではユビキチンはリン酸化されないままであった.また,CCCP処理した細胞から抗PINK1抗体を用いて回収した免疫沈降物もユビキチンを明瞭にリン酸化したことから,PINK1がユビキチンをリン酸化することが示された.
ユビキチンにおけるリン酸化部位を同定するため質量分析計により解析したところ,Parkinと同様に,ユビキチンのSer65がCCCP処理に依存してリン酸化されることがわかった.実際に,Ser65をAlaに置換したユビキチン変異体はin vitroおよびin vivoにおいてリン酸化されなかった.さらに,ミトコンドリアの膜電位が低下したとき細胞に存在するユビキチンのうちどの程度がリン酸化されているかを,AQUAペプチドと質量分析計を用いた絶対定量法により検討した.HeLa細胞では内在性のユビキチンの約0.05%がCCCP処理に依存してリン酸化されることが示され,さらに,このリン酸化は内在性のPINK1に依存していた.この0.05%という比率は非常に低いが,細胞には数百種類から千種類ほどのユビキチンリガーゼが存在するといわれていることから,Parkinに割り当てられるユビキチンの量(単純計算で,0.5%以下)を考えると十分な量ではないかと思われた.
2.リン酸化ユビキチンはParkinを活性化する
リン酸化ユビキチンが細胞においてはたす役割について検証した.PINK1によるParkinの制御は大きく2つに分けることができる.ひとつは,膜電位の低下したミトコンドリアへの移行(細胞内局在の変化)であり,もうひとつは,さきに述べたユビキチンリガーゼ機能の活性化(ユビキチンリガーゼ活性の変化)である.そこで,蛍光タンパク質GFPとParkinとの融合タンパク質を細胞に導入して,細胞内局在の変化はGFPの蛍光を蛍光顕微鏡により観察し,ユビキチンリガーゼ活性の変化は偽基質であるGFPに対するユビキチン化を指標に測定した.野生型のユビキチンと野生型のParkin,野生型のユビキチンとリン酸化を模倣したParkin,リン酸化を模倣したユビキチン変異体と野生型のParkin,を細胞内に共発現したところ,Parkinの細胞内局在およびユビキチンリガーゼ活性は変化しなかった.一方で,リン酸化を模倣したParkin変異体とリン酸化を模倣したユビキチン変異体とを共発現したところ,Parkinの細胞内局在は変化しなかったが,驚くべきことに,ミトコンドリアの状態とは無関係にParkinが活性化された.さらに,無細胞系を確立して,ミトコンドリアの活性が正常な細胞からリン酸化を模倣したParkin変異体を含む細胞質の画分を回収し,リン酸化を模倣したユビキチン,あるいは,in vitroにおいて事前にリン酸化したユビキチンと反応させたところ,Parkinのユビキチンリガーゼ活性が検出された.これらの結果は,リン酸化ユビキチンがリン酸化ParkinをPINK1に非依存的に活性化すること,つまり,PINK1によるParkinの活性化をリン酸化ユビキチンがバイパスできることを示していた.なお,リン酸化ユビキチンがParkinを活性化する際に,ユビキチンのC末端側にありチオエステル結合の形成やイソペプチド結合の形成に必須のGlyGlyモチーフは必要なかったことから,Parkinを活性化する際にリン酸化ユビキチンはほかのタンパク質と結合している必要はないことも示された.
3.Parkinが活性化される分子機構
リン酸化ユビキチンはどのようにParkinを活性化するのだろうか? 現時点では,その分子機構は完全に解明されたわけではないが,いくつかの手がかりが得られている.
まず,Parkinとリン酸化ユビキチンとが結合するかどうかを検討した.両者の結合は非常に弱いのか,通常の免疫沈降やプルダウン実験では安定的な結合活性を検出することはできなかったが,Fluoppi系を用いることにより,リン酸化を模倣したParkin変異体とリン酸化を模倣したユビキチン変異体との細胞における結合が示された.
つぎに,in vitroにおいてParkinによるユビキチン化を再構成することにより,ユビキチン化反応のどのステップが活性化されるのかについて検討した.Parkinが基質をユビキチン化する過程では,まず,ユビキチン活性化酵素(E1)によりATPに依存してユビキチンが活性化され,E1と高エネルギーチオエステル結合した中間体が形成される.つぎに,ユビキチンはチオエステル結合を保持したまま,E1からユビキチン結合酵素(E2)に,さらに,E2からユビキチンリガーゼ(E3)であるParkinの活性中心に移行して,最終的に基質タンパク質へと受け渡される.E2とチオエステル結合を形成したE2-ユビキチン反応中間体を用いて解析した結果,Parkinの存在下においてのみ,リン酸化ユビキチンがE2-ユビキチン反応中間体からのユビキチンの遊離を促進することが示された.この活性はParkinを要求するので,リン酸化ユビキチンが単純にE2からのユビキチンの遊離を促進しているわけではなかった.
Parkinの立体構造解析から,通常の状態ではParkinの活性中心は外部からのアクセスが困難な状態になっていると考えられる8).これらの結果を考えあわせると,リン酸化ユビキチンがParkinと結合することで,チオエステル結合したユビキチンの受け手であるParkinの活性中心を露出させることにより,ユビキチン結合酵素からParkinへのユビキチンの移行を促進していると考えるのが妥当だと思われた(図1).今後は,このモデルを実験的に検証していきたいと考えている.
おわりに
この研究においては,翻訳後修飾因子として細胞において幅広く使用されているユビキチン自体がリン酸化修飾をうけること,ミトコンドリアの膜電位の低下を引き金としてPINK1がユビキチンをリン酸化すること,リン酸化されたユビキチンがParkinを活性化すること,が示された(図2).正常な状態ではPINK1がユビキチンをリン酸化することでParkinを活性化することにより細胞の異常なミトコンドリアを除去する一方,この機構が破綻すると異常なミトコンドリアが徐々に脳に蓄積しパーキンソン病の発症にいたると考えられた.なお,Parkinにより基質タンパク質へと受け渡されるユビキチンは必ずしもリン酸化されている必要はないが,PINK1によるユビキチンのリン酸化→Parkinの活性化→ユビキチンのミトコンドリアへの集積→PINK1によるそのユビキチンのさらなるリン酸化→Parkinの活性化,という正のサイクルが形成され,このサイクルがシグナルを増幅させている可能性が考えられる.
ユビキチンに関しては膨大な量の論文が発表されているが,翻訳後修飾因子であるユビキチン自体がリン酸化という修飾をうけ,かつ,それが遺伝性パーキンソン病の発症を抑制するのに重要な役割を担うという知見は,誰も予想できないものであった.実際に,Parkinの研究を深化させてミトコンドリアの異常という情報を伝達するParkinの活性化因子を同定したところ,それがユビキチンであったという展開は,筆者にとっても驚きで研究の不思議を感じるものであった.
この成果は直接的には遺伝性パーキンソン病に関するものであるが,より一般的な孤発性パーキンソン病についてもその発症に同様のしくみが関与している可能性は十分にあるだろう.また,リン酸化ユビキチンに由来するペプチドを質量分析計により測定することで,放置するとパーキンソン病の発症につながるような細胞におけるミトコンドリアの異常を高感度で検知することが期待できることから,パーキンソン病の新しい病理解析ツールや診断マーカーの開発につながる可能性もある.今後は,このような応用も視野にいれつつ,さらに基礎研究を展開させたい.
なお,筆者らの論文とほぼ同じ時期に,米国の研究グループからも,非常に関連したリン酸化ユビキチンに関する論文が出版された9).細部に違いはあるが,彼らの結果と筆者らの結果は大枠において一致しており,この研究が第三者によっても再現できる信頼度の高いものであることが証明されたと考えている.
文 献
- Kitada, T., Asakawa, S., Hattori, N. et al.: Mutations in the parkin gene cause autosomal recessive juvenile parkinsonism. Nature, 392, 605-608 (1998)[PubMed]
- Valente, E. M., Abou-Sleiman, P. M., Caputo, V. et al.: Hereditary early-onset Parkinson's disease caused by mutations in PINK1. Science, 304, 1158-1160 (2004)[PubMed]
- Narendra, D. P., Jin, S. M., Tanaka, A. et al.: PINK1 is selectively stabilized on impaired mitochondria to activate Parkin. PLoS Biol., 8, e1000298 (2010)[PubMed]
- Matsuda, N., Sato, S., Shiba, K. et al.: PINK1 stabilized by mitochondrial depolarization recruits Parkin to damaged mitochondria and activates latent Parkin for mitophagy. J. Cell Biol., 189, 211-221 (2010)[PubMed]
- Kondapalli, C., Kazlauskaite, A., Zhang, N. et al.: PINK1 is activated by mitochondrial membrane potential depolarization and stimulates Parkin E3 ligase activity by phosphorylating Serine 65. Open Biol., 2, 120080 (2012)[PubMed]
- Shiba-Fukushima, K., Imai, Y., Yoshida, S. et al.: PINK1-mediated phosphorylation of the Parkin ubiquitin-like domain primes mitochondrial translocation of Parkin and regulates mitophagy. Sci. Rep., 2, 1002 (2012)[PubMed]
- Iguchi, M., Kujuro, Y., Okatsu, K. et al.: Parkin-catalyzed ubiquitin-ester transfer is triggered by PINK1-dependent phosphorylation. J. Biol. Chem., 288, 22019-22032 (2013)[PubMed]
- Trempe, J. F., Sauve, V., Grenier, K. et al.: Structure of parkin reveals mechanisms for ubiquitin ligase activation. Science, 340, 1451-1455 (2013)[PubMed]
- Kane, L. A., Lazarou, M., Fogel, A. I. et al.: PINK1 phosphorylates ubiquitin to activate Parkin E3 ubiquitin ligase activity. J. Cell Biol., 205, 143-153 (2014)[PubMed]
著者プロフィール
略歴:東京大学大学院新領域創成科学研究科博士課程 在学中.
研究テーマ:ミトコンドリアの品質管理とパーキンソン病.
抱負:新しいことに挑戦しつづけたい.
松田 憲之(Noriyuki Matsuda)
東京都医学総合研究所 副参事研究員.
研究室URL:http://www.igakuken.or.jp/pro-meta/studies/mastuda.html
© 2014 小谷野史香・松田憲之 Licensed under CC 表示 2.1 日本