線維芽細胞によるレチノイン酸の代謝酵素を介したマスト細胞の鎮静化は皮膚の恒常性の維持において必須である
倉島洋介1・國澤 純2・清野 宏1
(1東京大学医科学研究所 炎症免疫学分野,2医薬基盤研究所 創薬基盤研究部ワクチンマテリアルプロジェクト)
email:倉島洋介,國澤 純,清野 宏
DOI: 10.7875/first.author.2014.060
The enzyme Cyp26b1 mediates inhibition of mast-cell activation by fibroblasts to maintain skin-barrier homeostasis.
Yosuke Kurashima, Takeaki Amiya, Kumiko Fujisawa, Naoko Shibata, Yuji Suzuki, Yuta Kogure, Eri Hashimoto, Atsushi Otsuka, Kenji Kabashima, Shintaro Sato, Takeshi Sato, Masato Kubo, Shizuo Akira, Kensuke Miyake, Jun Kunisawa, Hiroshi Kiyono
Immunity, 40, 530-541 (2014)
マスト細胞は全身に広く分布しており,脱顆粒反応や活性化により即時型アレルギー反応や炎症反応をひき起こす.マスト細胞のもつ顆粒は皮膚などの結合組織と肺や腸管などの粘膜面とで異なっており,それぞれ結合組織型マスト細胞および粘膜型マスト細胞とよばれている.しかし,マスト細胞が組織ごとに異なる特性を示すことの意義や,ほかの遺伝子の発現および制御の分子機構については不明である.筆者らは,粘膜型マスト細胞に対する抗体を作製するとともに,腸管,皮膚,腹腔といった組織からマスト細胞を単離し遺伝子の発現を比較した.その結果,ATPに対する細胞外受容体であるP2X7受容体の発現のレベルが,組織のあいだで異なることを発見した.マスト細胞におけるP2X7受容体の発現制御をひもとくことにより,マスト細胞の組織特異性の獲得が組織ごとの恒常性の維持において重要であることがわかった.
マスト細胞は皮膚や粘膜といった外界にさらされている部位にとくに多く存在している.これら体表は病原性微生物の感染に高い頻度でおびやかされていることから,マスト細胞は微生物に由来する分子などを認識しすみやかな感染防御を誘導する自然免疫系の細胞と考えられる.腸に存在するマスト細胞のもつプロテアーゼであるマスト細胞プロテアーゼ1を欠損するマウスでは,寄生虫のひとつTrichinella spiralisに対する感染防御がうまく行われないことが報告されている.また,マスト細胞の腸管の粘膜面における役割としては,インターロイキン6の産生を介した免疫グロブリンA産生細胞の分化および増殖の促進や,上皮細胞のターンオーバーの正常化などが報告されている1).このように,マスト細胞は体表において病原性微生物からの脅威にたちむかうとともに,恒常性の維持においても重要な細胞のひとつであると考えられる.
マスト細胞は宿主防御細胞として重要な役割をはたす一方,ときとして,生体にとり好ましくないアレルギー疾患や炎症性疾患の発症にも関与している.食物アレルギーにおいては腸管の粘膜面にマスト細胞の集積像が観察され,アレルゲンに特異的な免疫グロブリンEとアレルゲンとの架橋反応によりマスト細胞が活性化することにより下痢などの消化器の症状をひき起こしている1).また,炎症性疾患におけるマスト細胞の関与については,接触性皮膚炎や炎症性腸疾患において炎症の増悪に寄与していることが報告されている.関節炎については,最近,マスト細胞を欠損したマウスでも炎症は軽減されないことが示されている.これらのことから,炎症反応におけるマスト細胞の役割は疾患や発症部位により異なると考えられる.
マスト細胞には粘膜型マスト細胞と結合組織型マスト細胞という2つのサブセットのあることが古くから知られている.これは,キマーゼやトリプターゼといったマスト細胞プロテアーゼをはじめ,ヘパリンやコンドロイチン硫酸など,マスト細胞が細胞質にもつ顆粒の成分により規定されている.歴史的には,アルシアンブルーやサフラニンなどの色素を用いてヘパリンやコンドロイチン硫酸を染色することにより,マスト細胞は粘膜型マスト細胞と結合組織型マスト細胞とに分別されてきた2).マスト細胞は好酸球や好中球などの顆粒球とは異なり,未熟な細胞のまま骨髄から血液へと放出され,おのおのの組織にたどりついたのち成熟するという特徴をもつため,それぞれの組織の微小環境に適応した形質に成熟すると推察される.しかし,このようなマスト細胞の組織特異性の意義やその制御機構については不明な部分が多く残されている.
からだのさまざまな組織に存在するマスト細胞の遺伝子発現パターンを比較したところ,マスト細胞プロテアーゼの発現レベルが異なっていることが確認された.そして興味深いことに,以前から報告されている粘膜型マスト細胞と結合組織型マスト細胞との指標であるマスト細胞プロテアーゼの発現のほかにも,いくつかのタンパク質の発現のレベルが組織のあいだで異なることが示された.なかでも,P2X7受容体とよばれるATPに対する細胞外受容体の発現が特徴的であった.これまで筆者らは,粘膜型マスト細胞を認識する抗体の作製を試みており3),この先行研究において作製した抗マスト細胞抗体のひとつがP2X7受容体を認識する抗体であった.この抗P2X7抗体を用いた解析から,P2X7受容体の発現は大腸や小腸においては高レベルであり,肺においては中レベルの発現が認められたが,皮膚に存在するマスト細胞のみ発現のレベルがきわめて低いことが見い出された3).このP2X7受容体の発現の違いを解析することにより,マスト細胞の組織特異性の獲得機序の解明につながることが期待された.
ATPは細胞内に存在し代謝などのエネルギー源としてはたらくことが知られているが,100年ほどまえ,イヌに投与すると血圧が降下することから血管など細胞外においてもなんらかの機能をはたす可能性が報告された.そして,神経伝達物質としてもはたらく独自の受容体のあることも示された.さらに,感染や組織損傷をともなう炎症が起こるとATPは細胞外へと多量に遊離して免疫細胞に危険を伝達するシグナルとしてはたらくことが明らかになった4,5).多くのATP受容体のなかでも,P2X7受容体はATPの刺激により活性酸素の産生とK+流出経路を介したNLRP3インフラマソームの活性化を介してインターロイキン1βの産生をひき起こす4,5).筆者らによる先行研究から,炎症性腸疾患において大腸組織にしみ出たATPがP2X7受容体を介してマスト細胞を活性化させ,炎症性サイトカイン,ケモカイン,脂質メディエーターが産生されることにより炎症の増悪をひき起こしていることが明らかになっている.それに対して,皮膚のマスト細胞を単離してATPにより刺激しても,このようなサイトカインあるいはケモカインの産生はみられなかった.
皮膚のマスト細胞は腹腔のマスト細胞とともに結合組織型マスト細胞に分類される.しかしながら,腹腔のマスト細胞は皮膚のマスト細胞とは異なり,P2X7受容体が高レベルで発現していることが示された.すなわち,粘膜型マスト細胞と結合組織型マスト細胞との分類とは異なる,P2X7受容体の発現を制御する制御機序の存在する可能性が示唆された.また,P2X7受容体を発現するマスト細胞をマウスの皮膚に移植したところ,移植ののち数日でP2X7受容体の発現レベルは低下することが示された.このことから,皮膚の特殊な環境もしくは皮膚に選択的に存在する因子がP2X7受容体の発現に影響を及ぼすことが示唆された.そこで,皮膚に特有の免疫細胞や常在細菌の関与について検討するため,ランゲルハンス細胞欠損マウス,γδT細胞欠損マウス,無菌マウスなどを解析した.しかしながら,これらマウスにおいては野生型マウスと比べP2X7受容体の発現に変動はみられなかった.また,皮膚における免疫制御因子として知られているビタミンD3,プロスタグランジン,インターロイキン10などの関与についても検証したが,これらはP2X7を制御しないことも示された6).
マスト細胞の成熟および分化には幹細胞因子をはじめとした間質細胞に由来する因子が必須であることが報告されている7).実際に,皮膚組織において線維芽細胞とマスト細胞とは密に接触して存在することが確認されている.そこで,おのおのの組織から線維芽細胞を含む間質細胞を単離し,造血幹細胞からex vivoにおいて分化させたマスト細胞と共培養した.その結果,大腸,小腸,肺といった粘膜組織に存在する間質細胞との共培養により粘膜型マスト細胞に強く発現するマスト細胞プロテアーゼの発現が亢進したのに対し,皮膚線維芽細胞との共培養により結合組織型マスト細胞に強く発現するマスト細胞プロテアーゼの発現の亢進が確認された.そして,皮膚線維芽細胞と共培養したときのみ,P2X7受容体の発現は減弱することが明らかになった.すなわち,皮膚線維芽細胞に由来する因子がP2X7受容体の発現の制御において必須であることが示唆された.皮膚線維芽細胞との共培養系からマスト細胞を単離し,非共培養系あるいは大腸に由来する間質細胞との共培養系に移行すると,P2X7受容体,および,粘膜型マスト細胞と結合組織型マスト細胞とを規定するマスト細胞プロテアーゼの発現が変動した.つまり,P2X7受容体,および,マスト細胞の分類に用いられてきたマスト細胞プロテアーゼは組織適応性の高いことが明らかになり,同時に,マスト細胞が線維芽細胞の作用をうけて可塑性を示すことが見い出された.
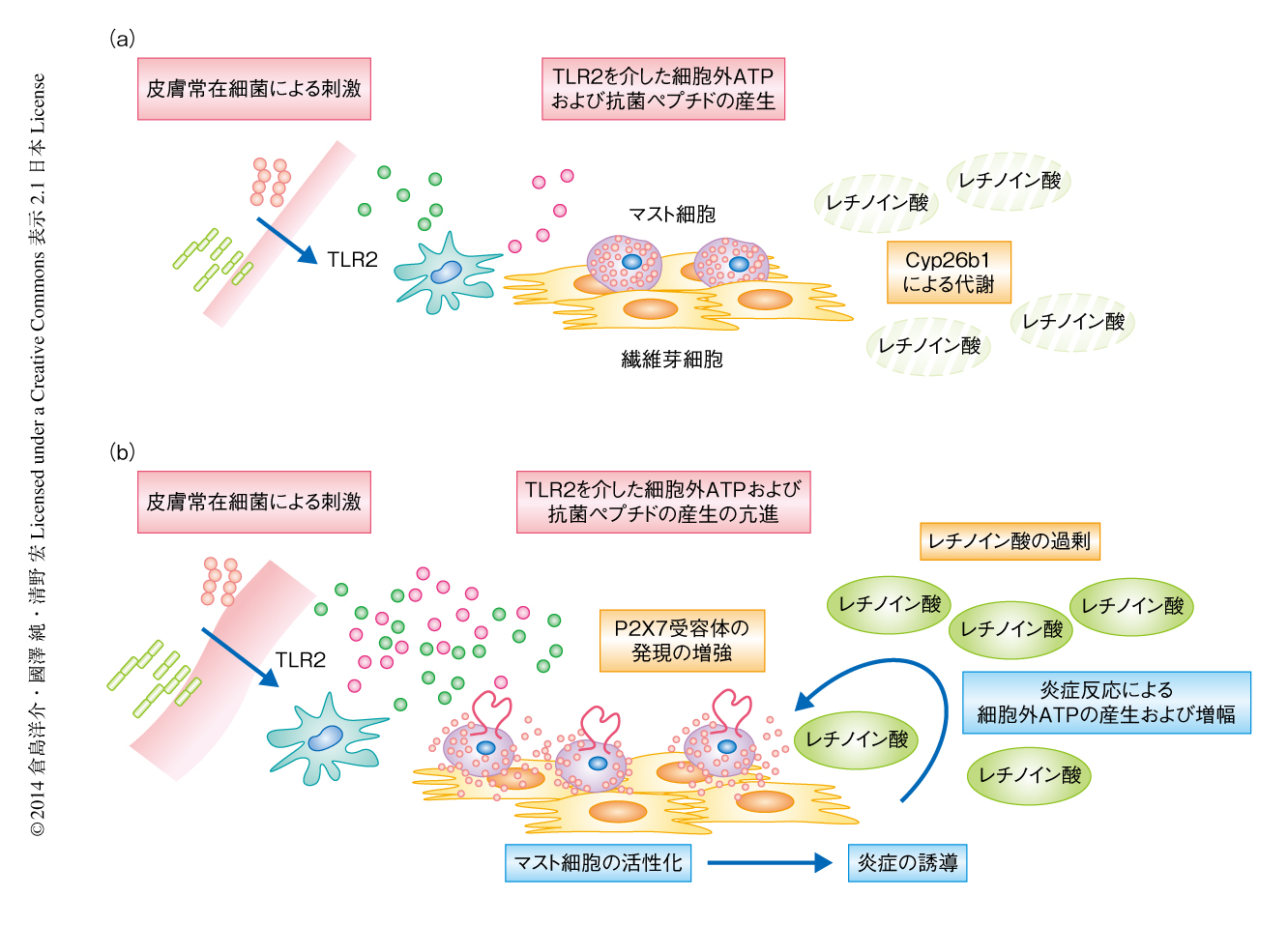
皮膚線維芽細胞との共培養によるP2X7受容体の発現の低下は,直接的な細胞間相互作用に依存しないことがTranswellを用いた解析から示された.そこで,間質細胞の発現するタンパク質の比較解析により,P2X7受容体の発現を制御する因子を探索した.分泌因子,あるいは,それを制御するタンパク質および酵素などに着目した結果,Cyp26がほかの組織の間質細胞に比べ皮膚線維芽細胞において非常に高く発現していることがわかった.なかでもとくにCyp26b1の発現が非常に高いことが示された.このCyp26b1はビタミンAの代謝産物であるレチノイン酸を代謝する酵素のひとつである.皮膚線維芽細胞とマスト細胞との共培養系にレチノイン酸あるいはCyp26b1の阻害剤であるLiarozoleを添加すると,P2X7受容体の発現は亢進することが確認された.この条件ではマスト細胞プロテアーゼの発現に変化はみられなかったことから,レチノイン酸-Cyp26b1経路はP2X7受容体の制御に選択的に関与していることが示された.
レチノイン酸は皮膚の恒常性の維持において重要であり8),ニキビをはじめとした皮膚疾患の治療薬としてレチノイン酸を含んだ外用薬が用いられている.しかしながら,ビタミンAの過剰な摂取による慢性的な中毒症状として,嘔吐や下痢とともに皮膚障害を呈することも古くから知られている.ホッキョクグマやアザラシといった北極圏にいる動物には,ヒトや家畜に比べ100倍以上ものビタミンAが肝臓に蓄えられていることが知られているが,イヌイットや北極探検隊がこれらの動物を摂取した際に皮膚に炎症を呈したことは有名な話である.実際に,過剰なレチノイン酸をマウスに経口投与することにより,レチノイン酸過剰症による皮膚炎を呈することが報告されている.
そこで,過剰量のレチノイン酸を継続的にマウスに経口投与したところ,3週間後に顕著な皮膚炎が観察された.さらにこの状況では,P2X7受容体の発現の亢進した皮膚のマスト細胞が増加し活性化しているようすが観察された.一方で,P2X7受容体あるいはマスト細胞を欠損したマウスではレチノイン酸の過剰な摂取による皮膚炎は起こらないことが示された.つまり,皮膚におけるレチノイン酸の増加によりマスト細胞においてP2X7受容体の発現が増強された結果,マスト細胞が活性化し,ヒスタミン,ケモカイン,炎症性サイトカイン,脂質メディエーターなどが産生され慢性的な炎症が導かれると説明できた.P2X7受容体は物理的なストレス,傷害,炎症により細胞の外に放出されるATP,および,皮膚に豊富に存在する抗菌ペプチドを認識するという報告から9),P2X7受容体のリガンドが豊富に存在する皮膚の特殊な環境に応じて,線維芽細胞によりマスト細胞の性質が制御されている可能性が示唆された.
レチノイン酸過剰症による皮膚バリアの破綻にともない,炎症性単球,マクロファージ,好中球の顕著な浸潤が観察された.炎症性単球やマクロファージには細菌の成分に対する受容体のひとつであるTLR2(TLR:Toll-like receptor,Toll様受容体)が高発現していることが示されたことから,TLR2ノックアウトマウスにおいてレチノイン酸過剰症を誘導したところ,皮膚炎を発症しないことが示された.さらなる解析により,TLR4ノックアウトマウスでは皮膚炎を発症したのに対して,MyD88ノックアウトマウスではTLR2ノックアウトマウスと同様に皮膚炎は観察されなかったことから,この皮膚炎はTLR2-MyD88経路に依存的であることが示された.とくにTLR2は,リポタイコ酸やペプチドグリカンといった細菌の成分のほか,ヒアルロン酸などの自己成分をも認識することが報告されている.このことから,皮膚常在細菌の関与について無菌飼育マウスを用いて解析した結果,無菌マウスでは皮膚炎が軽減された.詳細な解析から,TLR2の刺激により抗菌ペプチドのひとつカテリシジンおよびATPが炎症性単球やマクロファージから産生されることが示された.また,炎症性単球あるいはマクロファージとマスト細胞との共存下においてTLR2の刺激をあたえると,マスト細胞から好中球誘導因子であるCXCL1およびCXCL2の発現が誘導されたのに対し,P2X7を欠損するマスト細胞ではCXCL1およびCXCL2の発現は低レベルであったことから,炎症性単球やマクロファージに発現するTLR2を介してP2X7受容体のリガンドが産生され,ついで,マスト細胞がP2X7受容体を介して活性化するという図式が示唆された.
この研究から,組織の環境に適応して成熟をとげるマスト細胞が可塑性を示すことが明らかになった(図1).さらに,組織特異性の制御の破綻が慢性炎症を導くひとつの例が新たに見い出された.マスト細胞にとり線維芽細胞は分化および成熟に必須であり,かつ,組織に適応した機能をあたえる,あたかも“教育者”のような存在である.今回,皮膚組織の恒常性の維持に必要なマスト細胞に存在するP2X7受容体の発現の低下が,線維芽細胞による環境の整備によりなされていることが明らかになった.最近,レチノイン酸合成酵素やレチノイン酸分解酵素などの発現が,アトピー性皮膚炎や円形脱毛症といった皮膚疾患において変化していることが報告されている.このような疾患の背景に,今回,筆者らが見い出したマスト細胞と線維芽細胞との相互作用による恒常性の破綻が関与しているのかもしれない.また,皮膚のみならず慢性炎症性疾患などの発症部位において,炎症という環境の変化にともないマスト細胞をはじめとする免疫細胞の組織特異性が損なわれているのかもしれない.今後は,このような視点から疾患の発症機構を解析することにより,新たな治療法の確立につながることが期待される.
略歴:2011年 東京大学大学院医学系研究科博士課程 修了,2013年より東京大学医科学研究所 助教.
研究テーマ:粘膜免疫と皮膚免疫とのクロストーク.マスト細胞.
抱負:初志貫徹.
國澤 純(Jun Kunisawa)
医薬基盤研究所 プロジェクトリーダー.
清野 宏(Hiroshi Kiyono)
東京大学医科学研究所 教授.
研究室URL:http://www.ims.u-tokyo.ac.jp/EnMen/index_j.html
© 2014 倉島洋介・國澤 純・清野 宏 Licensed under CC 表示 2.1 日本
(1東京大学医科学研究所 炎症免疫学分野,2医薬基盤研究所 創薬基盤研究部ワクチンマテリアルプロジェクト)
email:倉島洋介,國澤 純,清野 宏
DOI: 10.7875/first.author.2014.060
The enzyme Cyp26b1 mediates inhibition of mast-cell activation by fibroblasts to maintain skin-barrier homeostasis.
Yosuke Kurashima, Takeaki Amiya, Kumiko Fujisawa, Naoko Shibata, Yuji Suzuki, Yuta Kogure, Eri Hashimoto, Atsushi Otsuka, Kenji Kabashima, Shintaro Sato, Takeshi Sato, Masato Kubo, Shizuo Akira, Kensuke Miyake, Jun Kunisawa, Hiroshi Kiyono
Immunity, 40, 530-541 (2014)
要 約
マスト細胞は全身に広く分布しており,脱顆粒反応や活性化により即時型アレルギー反応や炎症反応をひき起こす.マスト細胞のもつ顆粒は皮膚などの結合組織と肺や腸管などの粘膜面とで異なっており,それぞれ結合組織型マスト細胞および粘膜型マスト細胞とよばれている.しかし,マスト細胞が組織ごとに異なる特性を示すことの意義や,ほかの遺伝子の発現および制御の分子機構については不明である.筆者らは,粘膜型マスト細胞に対する抗体を作製するとともに,腸管,皮膚,腹腔といった組織からマスト細胞を単離し遺伝子の発現を比較した.その結果,ATPに対する細胞外受容体であるP2X7受容体の発現のレベルが,組織のあいだで異なることを発見した.マスト細胞におけるP2X7受容体の発現制御をひもとくことにより,マスト細胞の組織特異性の獲得が組織ごとの恒常性の維持において重要であることがわかった.
はじめに
マスト細胞は皮膚や粘膜といった外界にさらされている部位にとくに多く存在している.これら体表は病原性微生物の感染に高い頻度でおびやかされていることから,マスト細胞は微生物に由来する分子などを認識しすみやかな感染防御を誘導する自然免疫系の細胞と考えられる.腸に存在するマスト細胞のもつプロテアーゼであるマスト細胞プロテアーゼ1を欠損するマウスでは,寄生虫のひとつTrichinella spiralisに対する感染防御がうまく行われないことが報告されている.また,マスト細胞の腸管の粘膜面における役割としては,インターロイキン6の産生を介した免疫グロブリンA産生細胞の分化および増殖の促進や,上皮細胞のターンオーバーの正常化などが報告されている1).このように,マスト細胞は体表において病原性微生物からの脅威にたちむかうとともに,恒常性の維持においても重要な細胞のひとつであると考えられる.
マスト細胞は宿主防御細胞として重要な役割をはたす一方,ときとして,生体にとり好ましくないアレルギー疾患や炎症性疾患の発症にも関与している.食物アレルギーにおいては腸管の粘膜面にマスト細胞の集積像が観察され,アレルゲンに特異的な免疫グロブリンEとアレルゲンとの架橋反応によりマスト細胞が活性化することにより下痢などの消化器の症状をひき起こしている1).また,炎症性疾患におけるマスト細胞の関与については,接触性皮膚炎や炎症性腸疾患において炎症の増悪に寄与していることが報告されている.関節炎については,最近,マスト細胞を欠損したマウスでも炎症は軽減されないことが示されている.これらのことから,炎症反応におけるマスト細胞の役割は疾患や発症部位により異なると考えられる.
マスト細胞には粘膜型マスト細胞と結合組織型マスト細胞という2つのサブセットのあることが古くから知られている.これは,キマーゼやトリプターゼといったマスト細胞プロテアーゼをはじめ,ヘパリンやコンドロイチン硫酸など,マスト細胞が細胞質にもつ顆粒の成分により規定されている.歴史的には,アルシアンブルーやサフラニンなどの色素を用いてヘパリンやコンドロイチン硫酸を染色することにより,マスト細胞は粘膜型マスト細胞と結合組織型マスト細胞とに分別されてきた2).マスト細胞は好酸球や好中球などの顆粒球とは異なり,未熟な細胞のまま骨髄から血液へと放出され,おのおのの組織にたどりついたのち成熟するという特徴をもつため,それぞれの組織の微小環境に適応した形質に成熟すると推察される.しかし,このようなマスト細胞の組織特異性の意義やその制御機構については不明な部分が多く残されている.
1.皮膚,肺,腸管などの組織におけるP2X7受容体の発現
からだのさまざまな組織に存在するマスト細胞の遺伝子発現パターンを比較したところ,マスト細胞プロテアーゼの発現レベルが異なっていることが確認された.そして興味深いことに,以前から報告されている粘膜型マスト細胞と結合組織型マスト細胞との指標であるマスト細胞プロテアーゼの発現のほかにも,いくつかのタンパク質の発現のレベルが組織のあいだで異なることが示された.なかでも,P2X7受容体とよばれるATPに対する細胞外受容体の発現が特徴的であった.これまで筆者らは,粘膜型マスト細胞を認識する抗体の作製を試みており3),この先行研究において作製した抗マスト細胞抗体のひとつがP2X7受容体を認識する抗体であった.この抗P2X7抗体を用いた解析から,P2X7受容体の発現は大腸や小腸においては高レベルであり,肺においては中レベルの発現が認められたが,皮膚に存在するマスト細胞のみ発現のレベルがきわめて低いことが見い出された3).このP2X7受容体の発現の違いを解析することにより,マスト細胞の組織特異性の獲得機序の解明につながることが期待された.
ATPは細胞内に存在し代謝などのエネルギー源としてはたらくことが知られているが,100年ほどまえ,イヌに投与すると血圧が降下することから血管など細胞外においてもなんらかの機能をはたす可能性が報告された.そして,神経伝達物質としてもはたらく独自の受容体のあることも示された.さらに,感染や組織損傷をともなう炎症が起こるとATPは細胞外へと多量に遊離して免疫細胞に危険を伝達するシグナルとしてはたらくことが明らかになった4,5).多くのATP受容体のなかでも,P2X7受容体はATPの刺激により活性酸素の産生とK+流出経路を介したNLRP3インフラマソームの活性化を介してインターロイキン1βの産生をひき起こす4,5).筆者らによる先行研究から,炎症性腸疾患において大腸組織にしみ出たATPがP2X7受容体を介してマスト細胞を活性化させ,炎症性サイトカイン,ケモカイン,脂質メディエーターが産生されることにより炎症の増悪をひき起こしていることが明らかになっている.それに対して,皮膚のマスト細胞を単離してATPにより刺激しても,このようなサイトカインあるいはケモカインの産生はみられなかった.
2.線維芽細胞との共培養によりみえてきたマスト細胞の組織特異性
皮膚のマスト細胞は腹腔のマスト細胞とともに結合組織型マスト細胞に分類される.しかしながら,腹腔のマスト細胞は皮膚のマスト細胞とは異なり,P2X7受容体が高レベルで発現していることが示された.すなわち,粘膜型マスト細胞と結合組織型マスト細胞との分類とは異なる,P2X7受容体の発現を制御する制御機序の存在する可能性が示唆された.また,P2X7受容体を発現するマスト細胞をマウスの皮膚に移植したところ,移植ののち数日でP2X7受容体の発現レベルは低下することが示された.このことから,皮膚の特殊な環境もしくは皮膚に選択的に存在する因子がP2X7受容体の発現に影響を及ぼすことが示唆された.そこで,皮膚に特有の免疫細胞や常在細菌の関与について検討するため,ランゲルハンス細胞欠損マウス,γδT細胞欠損マウス,無菌マウスなどを解析した.しかしながら,これらマウスにおいては野生型マウスと比べP2X7受容体の発現に変動はみられなかった.また,皮膚における免疫制御因子として知られているビタミンD3,プロスタグランジン,インターロイキン10などの関与についても検証したが,これらはP2X7を制御しないことも示された6).
マスト細胞の成熟および分化には幹細胞因子をはじめとした間質細胞に由来する因子が必須であることが報告されている7).実際に,皮膚組織において線維芽細胞とマスト細胞とは密に接触して存在することが確認されている.そこで,おのおのの組織から線維芽細胞を含む間質細胞を単離し,造血幹細胞からex vivoにおいて分化させたマスト細胞と共培養した.その結果,大腸,小腸,肺といった粘膜組織に存在する間質細胞との共培養により粘膜型マスト細胞に強く発現するマスト細胞プロテアーゼの発現が亢進したのに対し,皮膚線維芽細胞との共培養により結合組織型マスト細胞に強く発現するマスト細胞プロテアーゼの発現の亢進が確認された.そして,皮膚線維芽細胞と共培養したときのみ,P2X7受容体の発現は減弱することが明らかになった.すなわち,皮膚線維芽細胞に由来する因子がP2X7受容体の発現の制御において必須であることが示唆された.皮膚線維芽細胞との共培養系からマスト細胞を単離し,非共培養系あるいは大腸に由来する間質細胞との共培養系に移行すると,P2X7受容体,および,粘膜型マスト細胞と結合組織型マスト細胞とを規定するマスト細胞プロテアーゼの発現が変動した.つまり,P2X7受容体,および,マスト細胞の分類に用いられてきたマスト細胞プロテアーゼは組織適応性の高いことが明らかになり,同時に,マスト細胞が線維芽細胞の作用をうけて可塑性を示すことが見い出された.
3.皮膚マスト細胞のもつP2X7受容体を制御する因子の探索
皮膚線維芽細胞との共培養によるP2X7受容体の発現の低下は,直接的な細胞間相互作用に依存しないことがTranswellを用いた解析から示された.そこで,間質細胞の発現するタンパク質の比較解析により,P2X7受容体の発現を制御する因子を探索した.分泌因子,あるいは,それを制御するタンパク質および酵素などに着目した結果,Cyp26がほかの組織の間質細胞に比べ皮膚線維芽細胞において非常に高く発現していることがわかった.なかでもとくにCyp26b1の発現が非常に高いことが示された.このCyp26b1はビタミンAの代謝産物であるレチノイン酸を代謝する酵素のひとつである.皮膚線維芽細胞とマスト細胞との共培養系にレチノイン酸あるいはCyp26b1の阻害剤であるLiarozoleを添加すると,P2X7受容体の発現は亢進することが確認された.この条件ではマスト細胞プロテアーゼの発現に変化はみられなかったことから,レチノイン酸-Cyp26b1経路はP2X7受容体の制御に選択的に関与していることが示された.
4.レチノイン酸過剰症からみえてきたマスト細胞における組織特異性の破綻
レチノイン酸は皮膚の恒常性の維持において重要であり8),ニキビをはじめとした皮膚疾患の治療薬としてレチノイン酸を含んだ外用薬が用いられている.しかしながら,ビタミンAの過剰な摂取による慢性的な中毒症状として,嘔吐や下痢とともに皮膚障害を呈することも古くから知られている.ホッキョクグマやアザラシといった北極圏にいる動物には,ヒトや家畜に比べ100倍以上ものビタミンAが肝臓に蓄えられていることが知られているが,イヌイットや北極探検隊がこれらの動物を摂取した際に皮膚に炎症を呈したことは有名な話である.実際に,過剰なレチノイン酸をマウスに経口投与することにより,レチノイン酸過剰症による皮膚炎を呈することが報告されている.
そこで,過剰量のレチノイン酸を継続的にマウスに経口投与したところ,3週間後に顕著な皮膚炎が観察された.さらにこの状況では,P2X7受容体の発現の亢進した皮膚のマスト細胞が増加し活性化しているようすが観察された.一方で,P2X7受容体あるいはマスト細胞を欠損したマウスではレチノイン酸の過剰な摂取による皮膚炎は起こらないことが示された.つまり,皮膚におけるレチノイン酸の増加によりマスト細胞においてP2X7受容体の発現が増強された結果,マスト細胞が活性化し,ヒスタミン,ケモカイン,炎症性サイトカイン,脂質メディエーターなどが産生され慢性的な炎症が導かれると説明できた.P2X7受容体は物理的なストレス,傷害,炎症により細胞の外に放出されるATP,および,皮膚に豊富に存在する抗菌ペプチドを認識するという報告から9),P2X7受容体のリガンドが豊富に存在する皮膚の特殊な環境に応じて,線維芽細胞によりマスト細胞の性質が制御されている可能性が示唆された.
5.皮膚常在細菌,Toll様受容体,マスト細胞のクロストーク
レチノイン酸過剰症による皮膚バリアの破綻にともない,炎症性単球,マクロファージ,好中球の顕著な浸潤が観察された.炎症性単球やマクロファージには細菌の成分に対する受容体のひとつであるTLR2(TLR:Toll-like receptor,Toll様受容体)が高発現していることが示されたことから,TLR2ノックアウトマウスにおいてレチノイン酸過剰症を誘導したところ,皮膚炎を発症しないことが示された.さらなる解析により,TLR4ノックアウトマウスでは皮膚炎を発症したのに対して,MyD88ノックアウトマウスではTLR2ノックアウトマウスと同様に皮膚炎は観察されなかったことから,この皮膚炎はTLR2-MyD88経路に依存的であることが示された.とくにTLR2は,リポタイコ酸やペプチドグリカンといった細菌の成分のほか,ヒアルロン酸などの自己成分をも認識することが報告されている.このことから,皮膚常在細菌の関与について無菌飼育マウスを用いて解析した結果,無菌マウスでは皮膚炎が軽減された.詳細な解析から,TLR2の刺激により抗菌ペプチドのひとつカテリシジンおよびATPが炎症性単球やマクロファージから産生されることが示された.また,炎症性単球あるいはマクロファージとマスト細胞との共存下においてTLR2の刺激をあたえると,マスト細胞から好中球誘導因子であるCXCL1およびCXCL2の発現が誘導されたのに対し,P2X7を欠損するマスト細胞ではCXCL1およびCXCL2の発現は低レベルであったことから,炎症性単球やマクロファージに発現するTLR2を介してP2X7受容体のリガンドが産生され,ついで,マスト細胞がP2X7受容体を介して活性化するという図式が示唆された.
おわりに
この研究から,組織の環境に適応して成熟をとげるマスト細胞が可塑性を示すことが明らかになった(図1).さらに,組織特異性の制御の破綻が慢性炎症を導くひとつの例が新たに見い出された.マスト細胞にとり線維芽細胞は分化および成熟に必須であり,かつ,組織に適応した機能をあたえる,あたかも“教育者”のような存在である.今回,皮膚組織の恒常性の維持に必要なマスト細胞に存在するP2X7受容体の発現の低下が,線維芽細胞による環境の整備によりなされていることが明らかになった.最近,レチノイン酸合成酵素やレチノイン酸分解酵素などの発現が,アトピー性皮膚炎や円形脱毛症といった皮膚疾患において変化していることが報告されている.このような疾患の背景に,今回,筆者らが見い出したマスト細胞と線維芽細胞との相互作用による恒常性の破綻が関与しているのかもしれない.また,皮膚のみならず慢性炎症性疾患などの発症部位において,炎症という環境の変化にともないマスト細胞をはじめとする免疫細胞の組織特異性が損なわれているのかもしれない.今後は,このような視点から疾患の発症機構を解析することにより,新たな治療法の確立につながることが期待される.
文 献
- Kurashima, Y. & Kiyono, H.: New era for mucosal mast cells: their roles in inflammation, allergic immune responses and adjuvant development. Exp. Mol. Med., 46, e83 (2014)[PubMed]
- Gurish, M. F. & Austen, K. F.: Developmental origin and functional specialization of mast cell subsets. Immunity, 37, 25-33 (2012)[PubMed]
- Kurashima, Y., Amiya, T., Nochi, T. et al.: Extracellular ATP mediates mast cell-dependent intestinal inflammation through P2X7 purinoceptors. Nat. Commun., 3, 1034 (2012)[PubMed]
- Di Virgilio, F.: Liaisons dangereuses: P2X7 and the inflammasome. Trends Pharmacol. Sci., 28, 465-472 (2007)[PubMed]
- Junger, W. G.: Immune cell regulation by autocrine purinergic signaling. Nat. Rev. Immunol., 11, 201-212 (2011)[PubMed]
- Biggs, L., Yu, C., Fedoric, B. et al.: Evidence that vitamin D3 promotes mast cell-dependent reduction of chronic UVB-induced skin pathology in mice. J. Exp. Med., 207, 455-463 (2010)[PubMed]
- Takano, H., Nakazawa, S., Okuno, Y. et al.: Establishment of the culture model system that reflects the process of terminal differentiation of connective tissue-type mast cells. FEBS Lett., 582, 1444-1450 (2008)[PubMed]
- Fisher, G. J. & Voorhees, J. J.: Molecular mechanisms of retinoid actions in skin. FASEB J., 10, 1002-1013 (1996)[PubMed]
- Elssner, A., Duncan, M., Gavrilin, M. et al.: A novel P2X7 receptor activator, the human cathelicidin-derived peptide LL37, induces IL-1β processing and release. J. Immunol., 172, 4987-4994 (2004)[PubMed]
著者プロフィール
略歴:2011年 東京大学大学院医学系研究科博士課程 修了,2013年より東京大学医科学研究所 助教.
研究テーマ:粘膜免疫と皮膚免疫とのクロストーク.マスト細胞.
抱負:初志貫徹.
國澤 純(Jun Kunisawa)
医薬基盤研究所 プロジェクトリーダー.
清野 宏(Hiroshi Kiyono)
東京大学医科学研究所 教授.
研究室URL:http://www.ims.u-tokyo.ac.jp/EnMen/index_j.html
© 2014 倉島洋介・國澤 純・清野 宏 Licensed under CC 表示 2.1 日本