出生ののちの酸素に富む環境は酸化ストレス応答を介して新生児の心筋細胞において細胞周期の停止を誘導する
木村 航・Hesham A. Sadek
(米国Texas大学Southwestern Medical Center,Department of Internal Medicine)
email:木村 航
DOI: 10.7875/first.author.2014.059
The oxygen-rich postnatal environment induces cardiomyocyte cell-cycle arrest through DNA damage response.
Bao N. Puente, Wataru Kimura, Shalini A. Muralidhar, Jesung Moon, James F. Amatruda, Kate L. Phelps, David Grinsfelder, Beverly A. Rothermel, Rui Chen, Joseph A. Garcia, Celio X. Santos, SuWannee Thet, Eiichiro Mori, Michael T. Kinter, Paul M. Rindler, Serena Zacchigna, Shibani Mukherjee, David J. Chen, Ahmed I. Mahmoud, Mauro Giacca, Peter S. Rabinovitch, Asaithamby Aroumougame, Ajay M. Shah, Luke I. Szweda, Hesham A. Sadek
Cell, 157, 565-579 (2014)
胎児期にさかんに細胞分裂をくり返す哺乳類の心筋細胞は,出生ののちすぐにほとんどが細胞周期を停止し,そののち,二度と分裂することはない.出生ののちの心筋細胞において細胞周期の停止をひき起こす機構はこれまで知られていなかった.この論文において,筆者らは,低酸素の状態にある胎児の環境から酸素に富む出生ののちの環境への移行が,酸化ストレス応答を介して心筋細胞において細胞周期を停止させていることを明らかにした.まず,マウスの新生仔の心筋細胞において,好気呼吸,活性酸素種,核DNAの酸化損傷,DNA損傷応答が生後7日目までのあいだに顕著に増加していることを見い出した.心臓の再生能をもつ成体のゼブラフィッシュの心臓においては,好気呼吸および核DNAの酸化損傷は低いまま保たれていた.さらに,マウスの新生仔を高酸素の環境におくこと,あるいは,活性酸素種の産生剤で処理することにより,出生ののちの心筋細胞の増殖の期間は短縮されることが示された.また逆に,新生仔を低酸素の環境におくこと,N-アセチルシステインの投与あるいはミトコンドリアに特異的なカタラーゼの発現により活性酸素種を除去すること,あるいは,DNA損傷応答経路の下流タンパク質であるWee1の阻害剤を投与することにより,出生ののちの心筋細胞の増殖の期間は延長されることも明らかにされた.これらの結果より,出生ののちの心筋細胞において細胞周期の停止を誘導する環境要因は大気中の酸素の濃度であり,活性酸素種の増加とDNA損傷応答経路を介して細胞周期を停止させていることが明らかになった.
心疾患は“肥満大国”米国における死因の第1位であり,また,近い将来には,全世界をつうじて死因の第1位になると予測されている.心疾患の高い死亡率の原因として,われわれ哺乳類の心臓には再生能がないという事実があげられる.最近,筆者らのグループは,出生まもないマウスの新生仔は心筋梗塞などの障害ののち,心筋細胞の増殖を介して完全な心臓を再生できることを報告した1,2).しかし残念なことに,マウスでは生後7日目までに心臓の再生能は失われる1,2).この時期は,心臓の成長が心筋細胞の増殖による成長から心筋細胞の大きさが肥大することによる成長に移行する時期と対応しており,ほとんどの心筋細胞はこの時期に2核化あるいは多核化し細胞周期を不可逆的に停止すると考えられている3-5).一方,ゼブラフィッシュなど一部の魚類6-8) や有尾両生類9-11) などでは,この細胞の増殖による成長から細胞の肥大による成長への変換は存在せず,心筋細胞の増殖を介した心臓の再生能は成体においても維持されている.なぜ哺乳類の心筋細胞においては,出生の直後に細胞周期の停止,細胞の増殖による成長から細胞の肥大による成長への変換,2核化あるいは多核化が起こるのかについては,これまで明らかにされていなかった.
心臓の再生能をもつ脊椎動物に共通すると考えられる特徴のひとつが酸素環境である.ゼブラフィッシュは低酸素の環境への耐性が高いうえ,生息する淡水は大気と比較し1/30程度の酸素容量しかもたない.それに対し,哺乳類は大気中の酸素を利用できることにくわえ,肺循環と体循環とが完全に分離しているため心臓を含むおのおのの臓器には多くの酸素が供給されている.しかし,哺乳類において2心房2心室の心臓が完成するのは出生ののちであり,胎児においては両生類などと同様に動脈血と静脈血とが混ざりあっている.したがって,ゼブラフィッシュや両生類,および,哺乳類の胎児は,哺乳類の成体と比較して酸素の供給量が低い状態におかれているといえる.
哺乳類において,出生のまえの胎児循環から出生ののちの成体循環への移行は,心筋細胞のエネルギー代謝において大きな転換をもたらす.動脈血の酸素分圧は3倍以上に上昇し,心筋細胞のおもなエネルギー源は胎児期には嫌気的解糖系であったものが出生ののちには好気呼吸へと変わる.好気呼吸は解糖系と比較し18倍ものATPを産生することが可能である一方,ミトコンドリア電子伝達系の副産物として生じる活性酸素種(reactive oxygen species:ROS)が細胞に酸化ストレスをあたえるという負の影響も及ぼす.酸化ストレスは脂肪酸,核酸,タンパク質などの酸化による損傷が原因になるもので,とくにDNAの酸化損傷は細胞周期チェックポイントを活性化させ細胞周期を停止させることが知られている.筆者らは,これらの事実から,哺乳類の心筋細胞における出生ののちの細胞周期の停止は,急激に増加した好気呼吸の副産物として生じる活性酸素種と酸化ストレスが原因になっているのではないかと考え,これを実証するため実験を行った.
好気呼吸と脊椎動物の種間における心臓の再生能の違いとの関連を明らかにするため,出生ののち2週間までのマウス,および,成体のゼブラフィッシュの心室におけるミトコンドリアDNAのコピー量を定量RT-PCR法により測定した.その結果,ミトコンドリアDNAのコピー量はマウスにおいては出生ののちの2週間で直線的に増加し,成体のゼブラフィッシュにおいては出生の直後のマウスよりもさらに少ないことがわかった.電子伝達系を担う呼吸鎖複合体が局在するミトコンドリア内膜の性状を透過型電子顕微鏡により精査したところ,成体のゼブラフィッシュおよび生後1日目のマウスの心筋細胞では,生後7日目のマウスよりもミトコンドリア内膜の密度が低く構造的にも未発達であった.さらに,マウスの心筋細胞において嫌気的代謝あるいは好気的代謝にかかわる酵素のタンパク質量を生後1日目から生後7日目にかけて質量分析計により包括的に測定したところ,嫌気的解糖系に必要な酵素は大多数が減少していたのに対し,クエン酸回路および脂肪酸β酸化にかかわる酵素のほとんどは増加していた.これらの結果は,ゼブラフィッシュおよびマウスにおいて,心臓の再生能とミトコンドリアによる好気呼吸とのあいだに相関があることを示した.とくに,マウスの新生仔においては嫌気的解糖系から好気呼吸への転換の起こる時期が,細胞の増殖による成長から細胞の肥大による成長への変換,および,心臓の再生能の喪失の起こる時期と正確に対応していたことは興味深く思われた.
出生ののちのマウスの心筋細胞において,好気呼吸の増加にともない活性酸素種および酸化ストレスが増加しているかどうかを検討した.ジヒドロエチジウム,ジヒドロローダミン123,ジクロロジヒドロフルオレセインを用いたアッセイは,いずれも生後1日目から生後7日目にかけて心筋細胞における活性酸素種の増加を示した.また,心筋細胞における核DNAの酸化損傷およびDNA損傷応答を,それぞれ,抗8-oxoG抗体および抗リン酸化ATM抗体を用いた定量的な解析により検討したところ,いずれも生後1日目から生後7日目にかけて増加していることが明らかになった.興味深いことに,成体のゼブラフィッシュの心臓では抗8-oxoG抗体によるシグナルは検出されなかった.これらの結果は,マウスの新生仔の心臓において,好気呼吸の増加にともなう活性酸素種の蓄積が核DNAの酸化損傷およびDNA損傷応答を活性化していることを示唆した.
大気中の酸素の濃度(21%)が出生ののちのマウスの心筋細胞における細胞周期の停止に影響をあたえているのかどうか検討するため,マウスの胎仔を出生の直前から高酸素(100%)の環境あるいは低酸素(15%)の環境においた.通常の環境におかれた対照と比較し,出生の直前から生後4日目まで高酸素の環境におかれた新生仔は核DNAの酸化損傷およびDNA損傷応答が増加し,逆に,出生の直前から生後7日目まで低酸素の環境におかれた新生仔はいずれも減少していた.驚くべきことに,高酸素の環境におかれた生後4日目の新生仔は心筋細胞が肥大すると同時に細胞分裂が減少しており,低酸素の環境におかれた生後7日目の新生仔は心筋細胞の大きさが小さくなり細胞分裂が増加していた.これらの結果は,大気中の酸素の濃度が心筋細胞における酸化ストレス,心筋細胞の増殖,細胞の増殖による成長から細胞の肥大による成長への変換に影響をあたえていることを強く示唆した.
出生ののちの好気呼吸の増加により産生された活性酸素種は酸化ストレス応答を介して細胞周期を停止させているのかどうかを検討するため,出生の直後から生後2日目まで活性酸素種の産生剤であるジクワットあるいはパラコートの皮下投与,および,出生の直後に過酸化水素を心室に直接に注入する実験を行った.いずれも,生後3日目の時点では心筋細胞の細胞死についてめだった増加はみられず,心筋細胞における核DNAの酸化損傷の増加およびDNA損傷応答の活性化がみられた.そして,心筋細胞の大きさは肥大し増殖は顕著に低下していた.これらの結果は,出生ののち増加した活性酸素種が核DNAの酸化損傷を誘導し,DNA損傷応答の活性化をへて,細胞の増殖による成長から細胞の肥大による成長への変換,および,心筋細胞における細胞周期の停止を誘導している可能性を示唆した.
逆の実験として,活性酸素種を除去することによりマウスの新生仔の心筋細胞において細胞周期の停止を抑制できるかどうか検討した.出生の直後から2週間にわたり抗酸化剤であるN-アセチルシステインを皮下投与したところ,心筋細胞における活性酸素種,核DNAの酸化損傷,DNA損傷応答はいずれも減少した.また,心筋細胞の大きさは減少し細胞分裂は増加した.くわえて,単核の心筋細胞の数の増加,2核化あるいは多核化した心筋細胞の数の減少が観察された.これらの結果は,活性酸素種の除去により心筋細胞における細胞周期の停止,および,細胞の増殖による成長から細胞の肥大による成長への変換を抑制する(少なくとも,遅延させる)ことのできることを示唆した.さらに,N-アセチルシステインによる処理をつづけたマウスにおいて,心臓の再生能をすでに失っているはずの生後21日目に虚血再灌流による障害をあたえたところ,対照と比較して,繊維性の瘢痕の減少,心筋細胞の増殖および収縮機能の改善が観察された.これらの結果は,活性酸素種の除去により新生児において心臓の再生能をもつ期間を延長できることを示した.
ミトコンドリア電子伝達系の副産物として生じる活性酸素種が心筋細胞における細胞周期の停止を誘導しているのかどうかを検討するため,ミトコンドリア局在シグナルを融合したカタラーゼを心筋細胞において特異的に発現するトランスジェニックマウスを作製した.このトランスジェニックマウスでは,生後14日目において心筋細胞における活性酸素種,核DNAの酸化損傷,DNA損傷応答の減少が確認された.さらに,このトランスジェニックマウスではN-アセチルシステインによる処理と同様に,心筋細胞の大きさの減少および細胞分裂の増加,単核の心筋細胞の数の増加(2核化あるいは多核化した心筋細胞の数の減少)がみられた.したがって,新生児の心筋細胞においては,好気呼吸に由来する活性酸素種がDNA損傷応答を介した細胞周期の停止に重要な役割をはたしていると考えられた.
活性酸素種によるDNA損傷応答経路の活性化が心筋細胞における細胞周期の停止をひき起こしているのかどうか検討した.DNAの損傷によるATM/ATRの活性化は,キナーゼであるWee1の活性化を介してCDK1に依存性のG2期からM期への細胞周期の移行を抑制することが知られている.マウスの新生仔においてWee1のタンパク質量を測定したところ,生後1日目から生後7日目にかけて心筋細胞において増加しており,N-アセチルシステインにより処理した生後7日目のマウス,および,心筋細胞のミトコンドリアにおいてカタラーゼを特異的に発現するトランスジェニックマウスでは,それぞれの対照と比較して減少していることが確認された.また,出生の直後から2週間にわたりWee1の特異的な阻害剤であるMK-1775を皮下投与したところ,活性酸素種の除去と同様に,心筋細胞の大きさの減少および細胞分裂の増加,さらに,心筋細胞の数の増加および単核の心筋細胞の数の増加(2核化あるいは多核化した心筋細胞の数の減少)が観察された.したがって,Wee1の阻害は出生ののちの心筋細胞の増殖の期間を延長するのに十分であることが示された.以上の結果は,出生ののちの心筋細胞において,好気呼吸の増加にともなう活性酸素種の増加がDNA損傷応答経路を介して細胞周期の停止を誘導するという仮説を強く支持した.
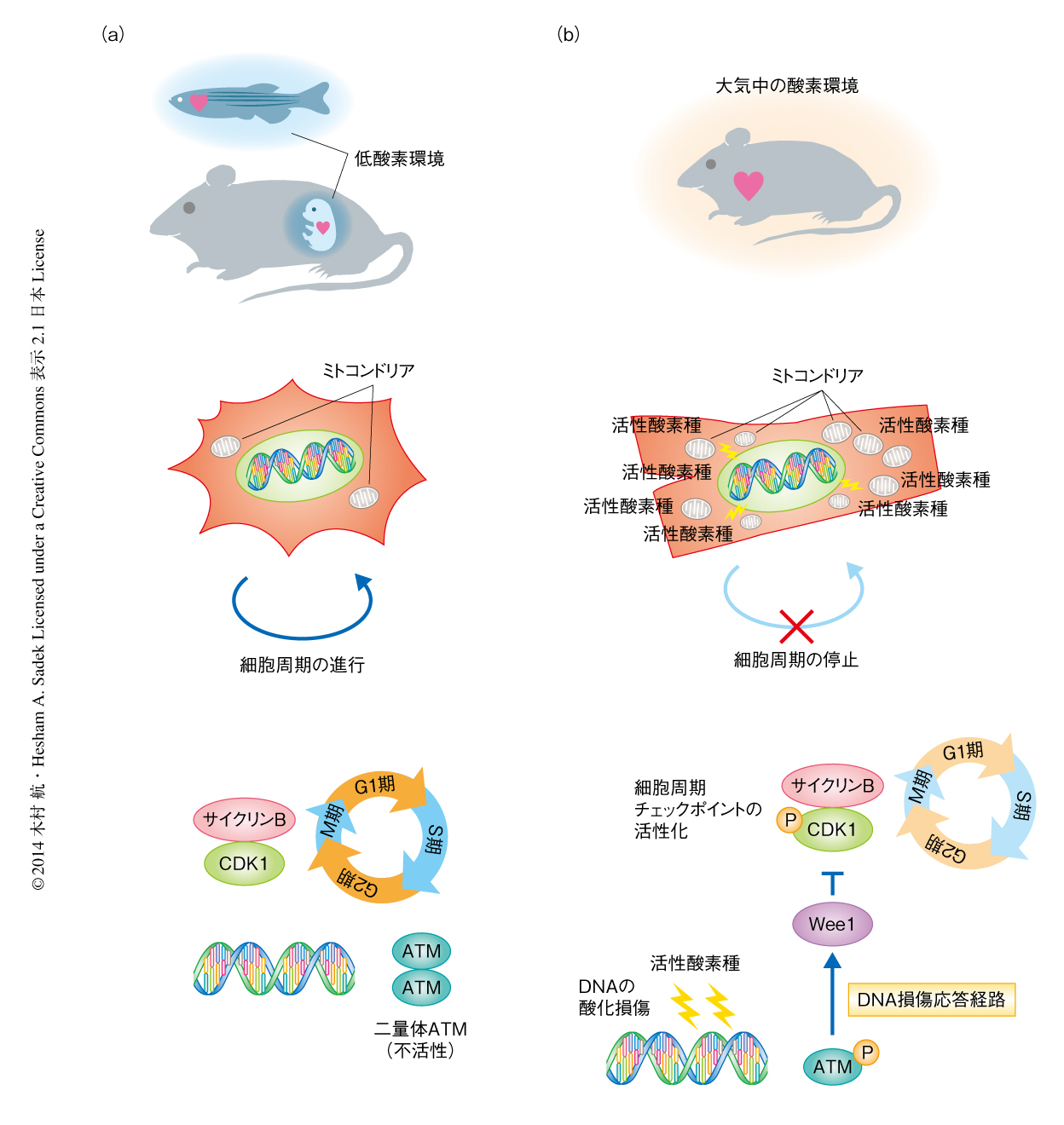
この研究により,マウスの新生仔の心筋細胞における細胞周期の停止,細胞の増殖による成長から細胞の肥大による成長への変換,心臓の再生能の喪失には,胎児期の低酸素な環境から出生ののちの酸素に富む環境にさらされることによる好気呼吸の増加,それにともなう活性酸素種の蓄積とDNA損傷応答経路の活性化が重要な役割をはたしていることが明らかになった(図1).酸化ストレスの低下,とくに,ミトコンドリアに由来する活性酸素種の低下は,心筋細胞の細胞死をふせぐだけでなく,心筋細胞の増殖をもとにした心疾患の治療法の開発においても重要になると期待される.
好気呼吸による効率的なATPの合成は活性酸素種の産生をともなう諸刃の剣であり,つねに多量の酸素を消費しつづける心筋細胞では酸化ストレスが恒常的に生じている.それゆえ,出生ののちの心筋細胞において細胞周期が永続的に停止することは,DNA変異の蓄積による細胞のがん化などに対する防御機構のひとつなのではないかと考えられる.心臓にかぎらず,一般に魚類や有尾両生類,そして,哺乳類の胎児および新生児は,哺乳類の成体と比較してさまざまな組織の再生能が高く,かつ,低酸素の環境におかれているという共通点をもつ.好気呼吸および酸化ストレスと組織の再生能との関係が,異なる器官や動物種をこえてどこまで保存されているか解明することは,今後の研究課題として魅力的であると考えている.
略歴:2007年 東京都立大学大学院理学研究科博士課程 修了,同年 浜松医科大学 特任研究員,2012年 米国Texas大学Southwestern Medical CenterにてVisiting Senior Fellowを経て,2014年より同Assistant Instructor.
研究テーマ:心臓の再生.
抱負:個別の器官の再生にかぎらず,器官の再生の一般的な機構や原理を明らかにしていきたい.
Hesham A. Sadek
米国Texas大学Southwestern Medical CenterにてAssistant Professor.
研究室URL:http://www.utsouthwestern.edu/labs/sadek/
© 2014 木村 航・Hesham A. Sadek Licensed under CC 表示 2.1 日本
(米国Texas大学Southwestern Medical Center,Department of Internal Medicine)
email:木村 航
DOI: 10.7875/first.author.2014.059
The oxygen-rich postnatal environment induces cardiomyocyte cell-cycle arrest through DNA damage response.
Bao N. Puente, Wataru Kimura, Shalini A. Muralidhar, Jesung Moon, James F. Amatruda, Kate L. Phelps, David Grinsfelder, Beverly A. Rothermel, Rui Chen, Joseph A. Garcia, Celio X. Santos, SuWannee Thet, Eiichiro Mori, Michael T. Kinter, Paul M. Rindler, Serena Zacchigna, Shibani Mukherjee, David J. Chen, Ahmed I. Mahmoud, Mauro Giacca, Peter S. Rabinovitch, Asaithamby Aroumougame, Ajay M. Shah, Luke I. Szweda, Hesham A. Sadek
Cell, 157, 565-579 (2014)
要 約
胎児期にさかんに細胞分裂をくり返す哺乳類の心筋細胞は,出生ののちすぐにほとんどが細胞周期を停止し,そののち,二度と分裂することはない.出生ののちの心筋細胞において細胞周期の停止をひき起こす機構はこれまで知られていなかった.この論文において,筆者らは,低酸素の状態にある胎児の環境から酸素に富む出生ののちの環境への移行が,酸化ストレス応答を介して心筋細胞において細胞周期を停止させていることを明らかにした.まず,マウスの新生仔の心筋細胞において,好気呼吸,活性酸素種,核DNAの酸化損傷,DNA損傷応答が生後7日目までのあいだに顕著に増加していることを見い出した.心臓の再生能をもつ成体のゼブラフィッシュの心臓においては,好気呼吸および核DNAの酸化損傷は低いまま保たれていた.さらに,マウスの新生仔を高酸素の環境におくこと,あるいは,活性酸素種の産生剤で処理することにより,出生ののちの心筋細胞の増殖の期間は短縮されることが示された.また逆に,新生仔を低酸素の環境におくこと,N-アセチルシステインの投与あるいはミトコンドリアに特異的なカタラーゼの発現により活性酸素種を除去すること,あるいは,DNA損傷応答経路の下流タンパク質であるWee1の阻害剤を投与することにより,出生ののちの心筋細胞の増殖の期間は延長されることも明らかにされた.これらの結果より,出生ののちの心筋細胞において細胞周期の停止を誘導する環境要因は大気中の酸素の濃度であり,活性酸素種の増加とDNA損傷応答経路を介して細胞周期を停止させていることが明らかになった.
はじめに
心疾患は“肥満大国”米国における死因の第1位であり,また,近い将来には,全世界をつうじて死因の第1位になると予測されている.心疾患の高い死亡率の原因として,われわれ哺乳類の心臓には再生能がないという事実があげられる.最近,筆者らのグループは,出生まもないマウスの新生仔は心筋梗塞などの障害ののち,心筋細胞の増殖を介して完全な心臓を再生できることを報告した1,2).しかし残念なことに,マウスでは生後7日目までに心臓の再生能は失われる1,2).この時期は,心臓の成長が心筋細胞の増殖による成長から心筋細胞の大きさが肥大することによる成長に移行する時期と対応しており,ほとんどの心筋細胞はこの時期に2核化あるいは多核化し細胞周期を不可逆的に停止すると考えられている3-5).一方,ゼブラフィッシュなど一部の魚類6-8) や有尾両生類9-11) などでは,この細胞の増殖による成長から細胞の肥大による成長への変換は存在せず,心筋細胞の増殖を介した心臓の再生能は成体においても維持されている.なぜ哺乳類の心筋細胞においては,出生の直後に細胞周期の停止,細胞の増殖による成長から細胞の肥大による成長への変換,2核化あるいは多核化が起こるのかについては,これまで明らかにされていなかった.
心臓の再生能をもつ脊椎動物に共通すると考えられる特徴のひとつが酸素環境である.ゼブラフィッシュは低酸素の環境への耐性が高いうえ,生息する淡水は大気と比較し1/30程度の酸素容量しかもたない.それに対し,哺乳類は大気中の酸素を利用できることにくわえ,肺循環と体循環とが完全に分離しているため心臓を含むおのおのの臓器には多くの酸素が供給されている.しかし,哺乳類において2心房2心室の心臓が完成するのは出生ののちであり,胎児においては両生類などと同様に動脈血と静脈血とが混ざりあっている.したがって,ゼブラフィッシュや両生類,および,哺乳類の胎児は,哺乳類の成体と比較して酸素の供給量が低い状態におかれているといえる.
哺乳類において,出生のまえの胎児循環から出生ののちの成体循環への移行は,心筋細胞のエネルギー代謝において大きな転換をもたらす.動脈血の酸素分圧は3倍以上に上昇し,心筋細胞のおもなエネルギー源は胎児期には嫌気的解糖系であったものが出生ののちには好気呼吸へと変わる.好気呼吸は解糖系と比較し18倍ものATPを産生することが可能である一方,ミトコンドリア電子伝達系の副産物として生じる活性酸素種(reactive oxygen species:ROS)が細胞に酸化ストレスをあたえるという負の影響も及ぼす.酸化ストレスは脂肪酸,核酸,タンパク質などの酸化による損傷が原因になるもので,とくにDNAの酸化損傷は細胞周期チェックポイントを活性化させ細胞周期を停止させることが知られている.筆者らは,これらの事実から,哺乳類の心筋細胞における出生ののちの細胞周期の停止は,急激に増加した好気呼吸の副産物として生じる活性酸素種と酸化ストレスが原因になっているのではないかと考え,これを実証するため実験を行った.
1.好気呼吸と心臓の再生能
好気呼吸と脊椎動物の種間における心臓の再生能の違いとの関連を明らかにするため,出生ののち2週間までのマウス,および,成体のゼブラフィッシュの心室におけるミトコンドリアDNAのコピー量を定量RT-PCR法により測定した.その結果,ミトコンドリアDNAのコピー量はマウスにおいては出生ののちの2週間で直線的に増加し,成体のゼブラフィッシュにおいては出生の直後のマウスよりもさらに少ないことがわかった.電子伝達系を担う呼吸鎖複合体が局在するミトコンドリア内膜の性状を透過型電子顕微鏡により精査したところ,成体のゼブラフィッシュおよび生後1日目のマウスの心筋細胞では,生後7日目のマウスよりもミトコンドリア内膜の密度が低く構造的にも未発達であった.さらに,マウスの心筋細胞において嫌気的代謝あるいは好気的代謝にかかわる酵素のタンパク質量を生後1日目から生後7日目にかけて質量分析計により包括的に測定したところ,嫌気的解糖系に必要な酵素は大多数が減少していたのに対し,クエン酸回路および脂肪酸β酸化にかかわる酵素のほとんどは増加していた.これらの結果は,ゼブラフィッシュおよびマウスにおいて,心臓の再生能とミトコンドリアによる好気呼吸とのあいだに相関があることを示した.とくに,マウスの新生仔においては嫌気的解糖系から好気呼吸への転換の起こる時期が,細胞の増殖による成長から細胞の肥大による成長への変換,および,心臓の再生能の喪失の起こる時期と正確に対応していたことは興味深く思われた.
2.出生ののちのマウスの心筋細胞におけるDNA損傷応答経路の活性化
出生ののちのマウスの心筋細胞において,好気呼吸の増加にともない活性酸素種および酸化ストレスが増加しているかどうかを検討した.ジヒドロエチジウム,ジヒドロローダミン123,ジクロロジヒドロフルオレセインを用いたアッセイは,いずれも生後1日目から生後7日目にかけて心筋細胞における活性酸素種の増加を示した.また,心筋細胞における核DNAの酸化損傷およびDNA損傷応答を,それぞれ,抗8-oxoG抗体および抗リン酸化ATM抗体を用いた定量的な解析により検討したところ,いずれも生後1日目から生後7日目にかけて増加していることが明らかになった.興味深いことに,成体のゼブラフィッシュの心臓では抗8-oxoG抗体によるシグナルは検出されなかった.これらの結果は,マウスの新生仔の心臓において,好気呼吸の増加にともなう活性酸素種の蓄積が核DNAの酸化損傷およびDNA損傷応答を活性化していることを示唆した.
3.大気中の酸素はマウスの新生仔の心臓において細胞周期の停止を制御している
大気中の酸素の濃度(21%)が出生ののちのマウスの心筋細胞における細胞周期の停止に影響をあたえているのかどうか検討するため,マウスの胎仔を出生の直前から高酸素(100%)の環境あるいは低酸素(15%)の環境においた.通常の環境におかれた対照と比較し,出生の直前から生後4日目まで高酸素の環境におかれた新生仔は核DNAの酸化損傷およびDNA損傷応答が増加し,逆に,出生の直前から生後7日目まで低酸素の環境におかれた新生仔はいずれも減少していた.驚くべきことに,高酸素の環境におかれた生後4日目の新生仔は心筋細胞が肥大すると同時に細胞分裂が減少しており,低酸素の環境におかれた生後7日目の新生仔は心筋細胞の大きさが小さくなり細胞分裂が増加していた.これらの結果は,大気中の酸素の濃度が心筋細胞における酸化ストレス,心筋細胞の増殖,細胞の増殖による成長から細胞の肥大による成長への変換に影響をあたえていることを強く示唆した.
4.活性酸素種はマウスの新生仔の心筋細胞において細胞周期の停止を促進する
出生ののちの好気呼吸の増加により産生された活性酸素種は酸化ストレス応答を介して細胞周期を停止させているのかどうかを検討するため,出生の直後から生後2日目まで活性酸素種の産生剤であるジクワットあるいはパラコートの皮下投与,および,出生の直後に過酸化水素を心室に直接に注入する実験を行った.いずれも,生後3日目の時点では心筋細胞の細胞死についてめだった増加はみられず,心筋細胞における核DNAの酸化損傷の増加およびDNA損傷応答の活性化がみられた.そして,心筋細胞の大きさは肥大し増殖は顕著に低下していた.これらの結果は,出生ののち増加した活性酸素種が核DNAの酸化損傷を誘導し,DNA損傷応答の活性化をへて,細胞の増殖による成長から細胞の肥大による成長への変換,および,心筋細胞における細胞周期の停止を誘導している可能性を示唆した.
5.活性酸素種の除去により出生ののちの心筋細胞の増殖の期間を延長することができる
逆の実験として,活性酸素種を除去することによりマウスの新生仔の心筋細胞において細胞周期の停止を抑制できるかどうか検討した.出生の直後から2週間にわたり抗酸化剤であるN-アセチルシステインを皮下投与したところ,心筋細胞における活性酸素種,核DNAの酸化損傷,DNA損傷応答はいずれも減少した.また,心筋細胞の大きさは減少し細胞分裂は増加した.くわえて,単核の心筋細胞の数の増加,2核化あるいは多核化した心筋細胞の数の減少が観察された.これらの結果は,活性酸素種の除去により心筋細胞における細胞周期の停止,および,細胞の増殖による成長から細胞の肥大による成長への変換を抑制する(少なくとも,遅延させる)ことのできることを示唆した.さらに,N-アセチルシステインによる処理をつづけたマウスにおいて,心臓の再生能をすでに失っているはずの生後21日目に虚血再灌流による障害をあたえたところ,対照と比較して,繊維性の瘢痕の減少,心筋細胞の増殖および収縮機能の改善が観察された.これらの結果は,活性酸素種の除去により新生児において心臓の再生能をもつ期間を延長できることを示した.
6.ミトコンドリアに由来する活性酸素種が心筋細胞における細胞周期の停止を制御する
ミトコンドリア電子伝達系の副産物として生じる活性酸素種が心筋細胞における細胞周期の停止を誘導しているのかどうかを検討するため,ミトコンドリア局在シグナルを融合したカタラーゼを心筋細胞において特異的に発現するトランスジェニックマウスを作製した.このトランスジェニックマウスでは,生後14日目において心筋細胞における活性酸素種,核DNAの酸化損傷,DNA損傷応答の減少が確認された.さらに,このトランスジェニックマウスではN-アセチルシステインによる処理と同様に,心筋細胞の大きさの減少および細胞分裂の増加,単核の心筋細胞の数の増加(2核化あるいは多核化した心筋細胞の数の減少)がみられた.したがって,新生児の心筋細胞においては,好気呼吸に由来する活性酸素種がDNA損傷応答を介した細胞周期の停止に重要な役割をはたしていると考えられた.
7.DNA損傷応答経路の抑制により心筋細胞の増殖の期間を延長することができる
活性酸素種によるDNA損傷応答経路の活性化が心筋細胞における細胞周期の停止をひき起こしているのかどうか検討した.DNAの損傷によるATM/ATRの活性化は,キナーゼであるWee1の活性化を介してCDK1に依存性のG2期からM期への細胞周期の移行を抑制することが知られている.マウスの新生仔においてWee1のタンパク質量を測定したところ,生後1日目から生後7日目にかけて心筋細胞において増加しており,N-アセチルシステインにより処理した生後7日目のマウス,および,心筋細胞のミトコンドリアにおいてカタラーゼを特異的に発現するトランスジェニックマウスでは,それぞれの対照と比較して減少していることが確認された.また,出生の直後から2週間にわたりWee1の特異的な阻害剤であるMK-1775を皮下投与したところ,活性酸素種の除去と同様に,心筋細胞の大きさの減少および細胞分裂の増加,さらに,心筋細胞の数の増加および単核の心筋細胞の数の増加(2核化あるいは多核化した心筋細胞の数の減少)が観察された.したがって,Wee1の阻害は出生ののちの心筋細胞の増殖の期間を延長するのに十分であることが示された.以上の結果は,出生ののちの心筋細胞において,好気呼吸の増加にともなう活性酸素種の増加がDNA損傷応答経路を介して細胞周期の停止を誘導するという仮説を強く支持した.
おわりに
この研究により,マウスの新生仔の心筋細胞における細胞周期の停止,細胞の増殖による成長から細胞の肥大による成長への変換,心臓の再生能の喪失には,胎児期の低酸素な環境から出生ののちの酸素に富む環境にさらされることによる好気呼吸の増加,それにともなう活性酸素種の蓄積とDNA損傷応答経路の活性化が重要な役割をはたしていることが明らかになった(図1).酸化ストレスの低下,とくに,ミトコンドリアに由来する活性酸素種の低下は,心筋細胞の細胞死をふせぐだけでなく,心筋細胞の増殖をもとにした心疾患の治療法の開発においても重要になると期待される.
好気呼吸による効率的なATPの合成は活性酸素種の産生をともなう諸刃の剣であり,つねに多量の酸素を消費しつづける心筋細胞では酸化ストレスが恒常的に生じている.それゆえ,出生ののちの心筋細胞において細胞周期が永続的に停止することは,DNA変異の蓄積による細胞のがん化などに対する防御機構のひとつなのではないかと考えられる.心臓にかぎらず,一般に魚類や有尾両生類,そして,哺乳類の胎児および新生児は,哺乳類の成体と比較してさまざまな組織の再生能が高く,かつ,低酸素の環境におかれているという共通点をもつ.好気呼吸および酸化ストレスと組織の再生能との関係が,異なる器官や動物種をこえてどこまで保存されているか解明することは,今後の研究課題として魅力的であると考えている.
文 献
- Porrello, E. R., Mahmoud, A. I., Simpson, E. et al.: Transient regenerative potential of the neonatal mouse heart. Science, 331, 1078-1080 (2011)[PubMed]
- Porrello, E. R., Mahmoud, A. I., Simpson, E. et al.: Regulation of neonatal and adult mammalian heart regeneration by the miR-15 family. Proc. Natl. Acad. Sci. USA, 110, 187-192 (2013)[PubMed]
- Clubb, F. J. Jr. & Bishop, S. P.: Formation of binucleated myocardial cells in the neonatal rat. An index for growth hypertrophy. Lab. Invest., 50, 571-577 (1984)[PubMed]
- Li, F., Wang, X., Capasso, J. M. et al.: Rapid transition of cardiac myocytes from hyperplasia to hypertrophy during postnatal development. J. Mol. Cell. Cardiol., 28, 1737-1746 (1996)[PubMed]
- Soonpaa, M. H., Kim, K. K., Pajak, L. et al.: Cardiomyocyte DNA synthesis and binucleation during murine development. Am. J. Physiol., 271, H2183- H2189 (1996)[PubMed]
- Jopling, C., Sleep, E., Raya, M. et al.: Zebrafish heart regeneration occurs by cardiomyocyte dedifferentiation and proliferation. Nature, 464, 606-609 (2010)[PubMed]
- Kikuchi, K., Holdway, J. E., Werdich, A. A. et al.: Primary contribution to zebrafish heart regeneration by gata4+ cardiomyocytes. Nature, 464, 601-605 (2010)[PubMed]
- Poss, K. D., Wilson, L. G. & Keating, M. T.: Heart regeneration in zebrafish. Science, 298, 2188-2190 (2002)[PubMed]
- Flink, I. L.: Cell cycle reentry of ventricular and atrial cardiomyocytes and cells within the epicardium following amputation of the ventricular apex in the axolotl, Amblystoma mexicanum: confocal microscopic immunofluorescent image analysis of bromodeoxyuridine-labeled nuclei. Anat. Embryol., 205, 235-244 (2002)[PubMed]
- Oberpriller, J. O. & Oberpriller, J. C.: Response of the adult newt ventricle to injury. J. Exp. Zool., 187, 249-253 (1974)[PubMed]
- Witman, N., Murtuza, B., Davis, B. et al.: Recapitulation of developmental cardiogenesis governs the morphological and functional regeneration of adult newt hearts following injury. Dev. Biol., 354, 67-76 (2011)[PubMed]
著者プロフィール
略歴:2007年 東京都立大学大学院理学研究科博士課程 修了,同年 浜松医科大学 特任研究員,2012年 米国Texas大学Southwestern Medical CenterにてVisiting Senior Fellowを経て,2014年より同Assistant Instructor.
研究テーマ:心臓の再生.
抱負:個別の器官の再生にかぎらず,器官の再生の一般的な機構や原理を明らかにしていきたい.
Hesham A. Sadek
米国Texas大学Southwestern Medical CenterにてAssistant Professor.
研究室URL:http://www.utsouthwestern.edu/labs/sadek/
© 2014 木村 航・Hesham A. Sadek Licensed under CC 表示 2.1 日本