胎生期における環境ストレスは熱ショックシグナル伝達経路を介して精神神経疾患に関与する
鳥居 (橋本) 和枝
(米国Yale大学School of Medicine,Department of Neurobiology)
email:鳥居 (橋本) 和枝
DOI: 10.7875/first.author.2014.055
Roles of Heat Shock Factor 1 in neuronal response to fetal environmental risks and its relevance to brain disorders.
Kazue Hashimoto-Torii, Masaaki Torii, Mitsuaki Fujimoto, Akira Nakai, Rachid El Fatimy, Valerie Mezger, Min J. Ju, Seiji Ishii, Shih-hui Chao, Kristen J. Brennand, Fred H. Gage, Pasko Rakic
Neuron, 82, 560-572 (2014)
妊娠中のウイルスへの感染,虚血,飲酒,喫煙などにより,胎児は子宮内においてさまざまな環境ストレスにさらされる.これらの環境ストレスにより出生ののちの精神神経疾患への罹患率の上昇することが知られているが,その機構についてはほとんどわかっていない.この論文では,アルコール,メチル水銀,母体のてんかん発作をモデルストレスとし,マウスを用いた実験結果をもとに,胎生期における種々の環境ストレスが出生ののちの精神神経疾患への罹患率を上昇させる機構について新しいモデルを提唱した.まず,異なるモデルストレスがいずれも胎生期の大脳皮質において熱ショックシグナル伝達経路を活性化することを見い出した.つぎに,この活性化の生理学的な役割を明らかにするため,熱ショックシグナル伝達経路を不活性化したマウスの胎仔を低いレベルのモデルストレスにさらし大脳皮質の発生への影響について調べた.その結果,これらのマウスでは大脳皮質の発生の異常が高い頻度で起こり,これに相関して出生ののちに,てんかんの誘引されやすいことを発見した.さらに,統合失調症の患者に由来する神経前駆細胞では,環境ストレスによる熱ショックシグナル伝達経路の活性化に細胞のあいだで異常なばらつきの生じることも発見した.以上の結果から,熱ショックシグナル伝達経路は子宮内において環境ストレスにさらされた胎児の脳の発生の異常を抑制しており,その機能不全が統合失調症をはじめとする精神神経疾患の引き金になる可能性が示唆された.
遺伝的な因子と子宮内および生後の環境因子の両者が精神神経疾患の発症に関与することが知られている1).また,社会および産業の成熟にともない,新しく環境ストレスとなりうる因子の増加が予想されることから,環境ストレスによる精神神経疾患の罹患率の上昇について,その機構の解明が望まれている.脳のなかでも大脳皮質は主たる精神神経疾患の原因となる病巣が高い頻度でみられる領域であり,多くの研究から,大脳皮質の原基における細胞の増殖あるいは細胞の移動などへの胎生期における環境ストレスの影響が,精神神経疾患の罹患率の上昇に関与することが示唆されている.一般に,げっ歯類モデルにおいてヒトの患者に類似する表現型を示す個体を検証に十分な数だけ確保するためには,臨床データから得られるレベルよりはるかに高いレベルの環境ストレスを必要とするが,一方で,非常に低いレベルの環境ストレスによってもごく一部の個体は精神遅延に相当する行動異常などの強い表現型を示すことがわかっている.また,さまざまな環境ストレスが同様の表現型をもたらすことも知られている.これらの現象は,種々の環境ストレスに共通して応答し精神神経疾患の罹患を左右する機構の存在を示している.
熱ショックシグナル伝達経路はさまざまな環境ストレスに応答して活性化される.この機構はほとんどすべての生物種において保存されており,分子シャペロンとよばれる熱ショックタンパク質の産生を促進しストレスにさらされた細胞の恒常性を維持すると考えられている.以前に筆者らの行った,胎生期にアルコールにさらされた大脳皮質の網羅的な転写プロファイリングから,この熱ショックシグナル伝達経路が胎生期における環境ストレスにより強く活性化される可能性が示唆された2).この研究では,この知見にもとづき,これまでほとんどわかっていなかった熱ショックシグナル伝達経路の大脳皮質の発生における役割,および,精神神経疾患との関連について検討した.
以前に筆者らの行った,胎生期にアルコールにさらされた大脳皮質の網羅的な転写プロファイリングから,熱ショックシグナル伝達経路が胎生期における環境ストレスにより強く活性化されることが示唆された2).一方で,成体の成熟したニューロンでは熱ショックシグナル伝達経路は環境ストレスによりほとんど活性化されない3).そこで,熱ショックシグナル伝達経路が精神神経疾患のリスクを上昇させる胎生期における環境ストレスとして報告されているさまざまな環境因子により共通して活性化されるか,また,大脳皮質のどの細胞種において活性化されるか,という疑問に答えるため,熱ショックシグナル伝達経路の活性を測定した.まず,細胞ストレスに応答して熱ショックタンパク質の発現を誘導する転写因子HSF1の標的であるHsp70遺伝子プロモーター領域への結合を,マウスおよびヒトの胎児の大脳皮質の培養系を用いてクロマチン-免疫沈降法により検討した.試験を行ったアルコール,メチル水銀,母体のてんかん発作の3つの環境ストレスのいずれによってもHSF1の結合の上昇のみられたことから,熱ショックシグナル伝達経路はさまざまな環境ストレスに共通して応答することがわかった.さらに,HSF1の免疫組織染色により活性化のもうひとつの指標である核への移行のようすを観察した結果,熱ショックシグナル伝達経路の活性化はとくに神経前駆細胞において強いことが判明した.
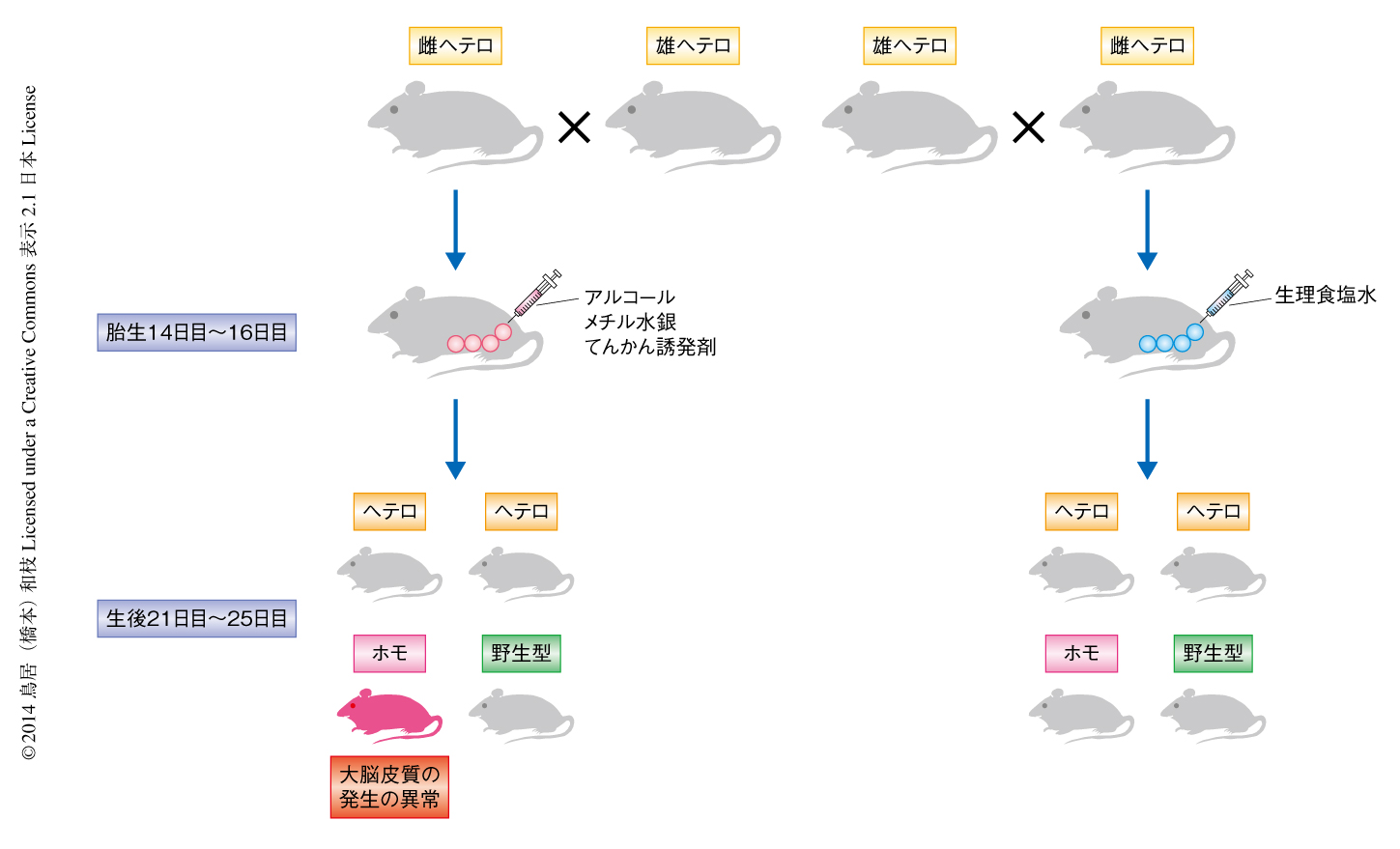
HSF1ノックアウトマウスを用いて,胎生期において環境ストレスにさらされた大脳皮質における熱ショックシグナル伝達経路の役割を検討した.大脳皮質を組織学的に比較したところ,HSF1ノックアウトマウスにおいては低いレベルの環境ストレスへの曝露により対照となる野生型のマウスではほとんどみられない大脳皮質の発生の異常が高い頻度で起こることがわかった(図1).顕著にみられた形態の異常は,髄膜下の灰白質の異所形成と大脳皮質の低形成であった.また,胎生期において環境ストレスをうけたHSF1ノックアウトマウスはてんかんのリスクの上昇することが示された.統計的な解析から,てんかんのリスクの上昇は髄膜下の灰白質の異所形成と強い相関のあることが示された.さらに,環境ストレスに曝露した直後の解析から,観察された大脳皮質の形態の異常はおもに神経前駆細胞の細胞死の増加,および,細胞の増殖の抑制によることが明らかになった.
一方,子宮内エレクトロポレーション法を用いて胎生期の大脳皮質においてHSF1をノックダウンしたのち胎仔を環境ストレスに曝露する実験から,HSF1による神経前駆細胞の細胞死の抑制および細胞の増殖の維持は細胞自立的であることが示された.また,HSF1ノックアウトマウスの胎仔の大脳皮質に熱ショックタンパク質Hsp70を強制発現したのち環境ストレスに曝露した場合には,細胞死の抑制はみられたが細胞の増殖は再開しなかったことから,Hsp70はHSF1の機能の一部のみを担っていることがわかった.
胎生期における環境ストレスとの相関の知られている精神神経疾患における熱ショックシグナル伝達経路の関与を検討するため,ヒトの統合失調症の患者に由来するiPS細胞および健常なヒトから得たiPS細胞を神経前駆細胞に分化させ4,5),環境ストレスに曝露したときの熱ショックシグナル伝達経路の活性を測定した.その結果,統合失調症の患者に由来する細胞および対照となる細胞において平均的な活性のレベルに違いはみられなかったが,1細胞解析を行ったところ,個々の細胞のあいだの活性のレベルのばらつきが,統合失調症の患者に由来する細胞では対照に比べ有意に大きいことが明らかになった.
さまざまな胎生期における環境ストレスが神経精神疾患の罹患率を上昇させることが知られているが,どのようにして環境ストレスが遺伝的な因子と相互作用し罹患率を上昇させるのかについてはいまだ解明されていない.この研究の結果は,熱ショックシグナル伝達経路がこの機構に関与する重要な経路のひとつであることを示した.とくに,胎生期における環境ストレスによる熱ショックシグナル伝達経路の活性化に関して,遺伝的な背景の異なる複数の統合失調症の患者に由来する細胞が,いずれも対照と比べ有意に大きな細胞のあいだの不均一性を示したことから,このような1細胞レベルでの異常ならびにその機構がさまざまな遺伝的な因子と環境因子との相互作用を解き明かす重要な鍵ではないかと期待される.統合失調症の患者に由来する細胞において熱ショックシグナル伝達経路の活性化の細胞のあいだでのばらつきが大きくなる原因として,酸化ストレスによるDNAの損傷6) やL1レトロトランスポゾンの挿入率の上昇7) などが考えられるが,現時点では,このばらつきの拡大がどのように統合失調症の発症に関与するのかは不明である.また,このばらつきの異常が熱ショックシグナル伝達経路に特異的であるのかどうかについても網羅的な1細胞解析など8,9) により検討する必要がある.さらに,自閉症など胎生期における環境ストレスとの相関が報告されているほかの精神神経疾患において同様に細胞のあいだのばらつきに異常が存在するのかどうかも,今後の重要な検討課題である.
略歴:米国Children's National Medical CenterにてPrincipal Investigator.
関心事:気合の入ったポスドク,学生さんを募集中.
研究室URL:http://www.childrensresearchinstitute.org/centers/kazue-hashimoto-torii-phd-laboratory
© 2014 鳥居 (橋本) 和枝 Licensed under CC 表示 2.1 日本
(米国Yale大学School of Medicine,Department of Neurobiology)
email:鳥居 (橋本) 和枝
DOI: 10.7875/first.author.2014.055
Roles of Heat Shock Factor 1 in neuronal response to fetal environmental risks and its relevance to brain disorders.
Kazue Hashimoto-Torii, Masaaki Torii, Mitsuaki Fujimoto, Akira Nakai, Rachid El Fatimy, Valerie Mezger, Min J. Ju, Seiji Ishii, Shih-hui Chao, Kristen J. Brennand, Fred H. Gage, Pasko Rakic
Neuron, 82, 560-572 (2014)
要 約
妊娠中のウイルスへの感染,虚血,飲酒,喫煙などにより,胎児は子宮内においてさまざまな環境ストレスにさらされる.これらの環境ストレスにより出生ののちの精神神経疾患への罹患率の上昇することが知られているが,その機構についてはほとんどわかっていない.この論文では,アルコール,メチル水銀,母体のてんかん発作をモデルストレスとし,マウスを用いた実験結果をもとに,胎生期における種々の環境ストレスが出生ののちの精神神経疾患への罹患率を上昇させる機構について新しいモデルを提唱した.まず,異なるモデルストレスがいずれも胎生期の大脳皮質において熱ショックシグナル伝達経路を活性化することを見い出した.つぎに,この活性化の生理学的な役割を明らかにするため,熱ショックシグナル伝達経路を不活性化したマウスの胎仔を低いレベルのモデルストレスにさらし大脳皮質の発生への影響について調べた.その結果,これらのマウスでは大脳皮質の発生の異常が高い頻度で起こり,これに相関して出生ののちに,てんかんの誘引されやすいことを発見した.さらに,統合失調症の患者に由来する神経前駆細胞では,環境ストレスによる熱ショックシグナル伝達経路の活性化に細胞のあいだで異常なばらつきの生じることも発見した.以上の結果から,熱ショックシグナル伝達経路は子宮内において環境ストレスにさらされた胎児の脳の発生の異常を抑制しており,その機能不全が統合失調症をはじめとする精神神経疾患の引き金になる可能性が示唆された.
はじめに
遺伝的な因子と子宮内および生後の環境因子の両者が精神神経疾患の発症に関与することが知られている1).また,社会および産業の成熟にともない,新しく環境ストレスとなりうる因子の増加が予想されることから,環境ストレスによる精神神経疾患の罹患率の上昇について,その機構の解明が望まれている.脳のなかでも大脳皮質は主たる精神神経疾患の原因となる病巣が高い頻度でみられる領域であり,多くの研究から,大脳皮質の原基における細胞の増殖あるいは細胞の移動などへの胎生期における環境ストレスの影響が,精神神経疾患の罹患率の上昇に関与することが示唆されている.一般に,げっ歯類モデルにおいてヒトの患者に類似する表現型を示す個体を検証に十分な数だけ確保するためには,臨床データから得られるレベルよりはるかに高いレベルの環境ストレスを必要とするが,一方で,非常に低いレベルの環境ストレスによってもごく一部の個体は精神遅延に相当する行動異常などの強い表現型を示すことがわかっている.また,さまざまな環境ストレスが同様の表現型をもたらすことも知られている.これらの現象は,種々の環境ストレスに共通して応答し精神神経疾患の罹患を左右する機構の存在を示している.
熱ショックシグナル伝達経路はさまざまな環境ストレスに応答して活性化される.この機構はほとんどすべての生物種において保存されており,分子シャペロンとよばれる熱ショックタンパク質の産生を促進しストレスにさらされた細胞の恒常性を維持すると考えられている.以前に筆者らの行った,胎生期にアルコールにさらされた大脳皮質の網羅的な転写プロファイリングから,この熱ショックシグナル伝達経路が胎生期における環境ストレスにより強く活性化される可能性が示唆された2).この研究では,この知見にもとづき,これまでほとんどわかっていなかった熱ショックシグナル伝達経路の大脳皮質の発生における役割,および,精神神経疾患との関連について検討した.
1.胎生期の大脳皮質においてさまざまな環境ストレスが熱ショックシグナル伝達経路を活性化する
以前に筆者らの行った,胎生期にアルコールにさらされた大脳皮質の網羅的な転写プロファイリングから,熱ショックシグナル伝達経路が胎生期における環境ストレスにより強く活性化されることが示唆された2).一方で,成体の成熟したニューロンでは熱ショックシグナル伝達経路は環境ストレスによりほとんど活性化されない3).そこで,熱ショックシグナル伝達経路が精神神経疾患のリスクを上昇させる胎生期における環境ストレスとして報告されているさまざまな環境因子により共通して活性化されるか,また,大脳皮質のどの細胞種において活性化されるか,という疑問に答えるため,熱ショックシグナル伝達経路の活性を測定した.まず,細胞ストレスに応答して熱ショックタンパク質の発現を誘導する転写因子HSF1の標的であるHsp70遺伝子プロモーター領域への結合を,マウスおよびヒトの胎児の大脳皮質の培養系を用いてクロマチン-免疫沈降法により検討した.試験を行ったアルコール,メチル水銀,母体のてんかん発作の3つの環境ストレスのいずれによってもHSF1の結合の上昇のみられたことから,熱ショックシグナル伝達経路はさまざまな環境ストレスに共通して応答することがわかった.さらに,HSF1の免疫組織染色により活性化のもうひとつの指標である核への移行のようすを観察した結果,熱ショックシグナル伝達経路の活性化はとくに神経前駆細胞において強いことが判明した.
2.胎生期において環境ストレスにさらされたHSF1ノックアウトマウスはてんかんの発症率が上昇する
HSF1ノックアウトマウスを用いて,胎生期において環境ストレスにさらされた大脳皮質における熱ショックシグナル伝達経路の役割を検討した.大脳皮質を組織学的に比較したところ,HSF1ノックアウトマウスにおいては低いレベルの環境ストレスへの曝露により対照となる野生型のマウスではほとんどみられない大脳皮質の発生の異常が高い頻度で起こることがわかった(図1).顕著にみられた形態の異常は,髄膜下の灰白質の異所形成と大脳皮質の低形成であった.また,胎生期において環境ストレスをうけたHSF1ノックアウトマウスはてんかんのリスクの上昇することが示された.統計的な解析から,てんかんのリスクの上昇は髄膜下の灰白質の異所形成と強い相関のあることが示された.さらに,環境ストレスに曝露した直後の解析から,観察された大脳皮質の形態の異常はおもに神経前駆細胞の細胞死の増加,および,細胞の増殖の抑制によることが明らかになった.
一方,子宮内エレクトロポレーション法を用いて胎生期の大脳皮質においてHSF1をノックダウンしたのち胎仔を環境ストレスに曝露する実験から,HSF1による神経前駆細胞の細胞死の抑制および細胞の増殖の維持は細胞自立的であることが示された.また,HSF1ノックアウトマウスの胎仔の大脳皮質に熱ショックタンパク質Hsp70を強制発現したのち環境ストレスに曝露した場合には,細胞死の抑制はみられたが細胞の増殖は再開しなかったことから,Hsp70はHSF1の機能の一部のみを担っていることがわかった.
3.統合失調症の患者に由来する神経前駆細胞では環境ストレスによる熱ショックシグナル伝達経路の活性化に異常がある
胎生期における環境ストレスとの相関の知られている精神神経疾患における熱ショックシグナル伝達経路の関与を検討するため,ヒトの統合失調症の患者に由来するiPS細胞および健常なヒトから得たiPS細胞を神経前駆細胞に分化させ4,5),環境ストレスに曝露したときの熱ショックシグナル伝達経路の活性を測定した.その結果,統合失調症の患者に由来する細胞および対照となる細胞において平均的な活性のレベルに違いはみられなかったが,1細胞解析を行ったところ,個々の細胞のあいだの活性のレベルのばらつきが,統合失調症の患者に由来する細胞では対照に比べ有意に大きいことが明らかになった.
おわりに
さまざまな胎生期における環境ストレスが神経精神疾患の罹患率を上昇させることが知られているが,どのようにして環境ストレスが遺伝的な因子と相互作用し罹患率を上昇させるのかについてはいまだ解明されていない.この研究の結果は,熱ショックシグナル伝達経路がこの機構に関与する重要な経路のひとつであることを示した.とくに,胎生期における環境ストレスによる熱ショックシグナル伝達経路の活性化に関して,遺伝的な背景の異なる複数の統合失調症の患者に由来する細胞が,いずれも対照と比べ有意に大きな細胞のあいだの不均一性を示したことから,このような1細胞レベルでの異常ならびにその機構がさまざまな遺伝的な因子と環境因子との相互作用を解き明かす重要な鍵ではないかと期待される.統合失調症の患者に由来する細胞において熱ショックシグナル伝達経路の活性化の細胞のあいだでのばらつきが大きくなる原因として,酸化ストレスによるDNAの損傷6) やL1レトロトランスポゾンの挿入率の上昇7) などが考えられるが,現時点では,このばらつきの拡大がどのように統合失調症の発症に関与するのかは不明である.また,このばらつきの異常が熱ショックシグナル伝達経路に特異的であるのかどうかについても網羅的な1細胞解析など8,9) により検討する必要がある.さらに,自閉症など胎生期における環境ストレスとの相関が報告されているほかの精神神経疾患において同様に細胞のあいだのばらつきに異常が存在するのかどうかも,今後の重要な検討課題である.
文 献
- Thompson, B. L., Levitt, P. & Stanwood, G. D.: Prenatal exposure to drugs: effects on brain development and implications for policy and education. Nat. Rev. Neurosci., 10, 303-312 (2009)[PubMed]
- Hashimoto-Torii, K., Kawasawa, Y. I., Kuhn, A. et al.: Combined transcriptome analysis of fetal human and mouse cerebral cortex exposed to alcohol. Proc. Natl. Acad. Sci. USA, 108, 4212-4217 (2011)[PubMed]
- Morimoto, R. I.: Proteotoxic stress and inducible chaperone networks in neurodegenerative disease and aging. Genes Dev., 22, 1427-1438 (2008)[PubMed]
- Brennand, K. J., Simone, A., Jou, J. et al.: Modelling schizophrenia using human induced pluripotent stem cells. Nature, 479, 221-225 (2011)[PubMed]
- Brennand, K. J., Savas, J. N., Kim, Y. et al.: Phenotypic differences in hiPSC NPCs derived from patients with schizophrenia. Mol. Psychiatry, 20, 361-368 (2015)[PubMed]
- Clay, H. B., Sillivan, S. & Konradi, C.: Mitochondrial dysfunction and pathology in bipolar disorder and schizophrenia. Int. J. Dev. Neurosci., 29, 311-324 (2011)[PubMed]
- Bundo, M., Toyoshima, M., Okada, Y. et al.: Increased L1 retrotransposition in the neuronal genome in schizophrenia. Neuron, 22, 306-313 (2014)[PubMed]
- Sasagawa, Y., Nikaido, I., Hayashi, T. et al.: Quartz-Seq: a highly reproducible and sensitive single-cell RNA sequencing method, reveals non-genetic gene-expression heterogeneity. Genome Biol., 14, R31 (2013)[PubMed]
- Islam, S., Zeisel, A., Joost, S. et al.: Quantitative single-cell RNA-seq with unique molecular identifiers. Nat. Methods, 11, 163-166 (2014)[PubMed]
著者プロフィール
略歴:米国Children's National Medical CenterにてPrincipal Investigator.
関心事:気合の入ったポスドク,学生さんを募集中.
研究室URL:http://www.childrensresearchinstitute.org/centers/kazue-hashimoto-torii-phd-laboratory
© 2014 鳥居 (橋本) 和枝 Licensed under CC 表示 2.1 日本