腸管において樹状細胞により提示されるセグメント細菌の抗原はTh17細胞の分化を誘導する
後藤 義幸
(米国Columbia大学Medical Center,Department of Microbiology and Immunology)
email:後藤義幸
DOI: 10.7875/first.author.2014.058
Segmented filamentous bacteria antigens presented by intestinal dendritic cells drive mucosal Th17 cell differentiation.
Yoshiyuki Goto, Casandra Panea, Gaku Nakato, Anna Cebula, Carolyn Lee, Marta Galan Diez, Terri M. Laufer, Leszek Ignatowicz, Ivaylo I. Ivanov
Immunity, 40, 594-607 (2014)
腸管は腸内細菌を含む多種多様な抗原につねにさらされている特殊な器官である.腸内細菌は宿主の粘膜免疫系の構築に寄与しており,とくに,ヘルパーT細胞であるTh17細胞や制御性T細胞の分化を誘導することが知られている.このうち,Th17細胞は代表的な腸内細菌の一種であるセグメント細菌により分化が誘導されることが報告されているものの,その詳細な機構は明らかになっていない.この研究では,腸管において樹状細胞がMHCタイプII分子を介してT細胞にセグメント細菌に由来する抗原を提示することにより,Th17細胞の分化の誘導に重要な役割を担っていることを示した.
腸管は腸内細菌や食餌性の抗原に恒常的にさらされている特殊な器官である.ヒトの小腸では十二指腸から回腸へ進むにしたがい腸内細菌の数も増加し,大腸では内容物1 gあたり約1011~1012個もの細菌の生息することが知られている1).腸内細菌は宿主から,食餌に由来する栄養源,適切な温度,酸素など生息に適した環境を提供される一方,宿主に対しビタミンKなどの栄養源を供給するのみならず,バクテリオシンなどの抗菌物質を産生することにより病原性細菌の感染に対する防御機能も付与している2).さらに,腸内細菌のもつ重要な機能として,宿主の腸管における免疫機構の構築があげられる.無菌マウスではパイエル板や孤立リンパ小節などの2次リンパ組織が未発達であることにくわえ,腸管におけるT細胞の分化および増殖,免疫グロブリンAの産生が低下している1).腸管にはT細胞やB細胞を含む多数の免疫細胞が存在しており,外来の抗原に対し第一線のバリア機構を形成している.なかでもTh17細胞はインターロイキン17を産生するヘルパーT細胞の一種であり,インターロイキン17A,インターロイキン17F,インターロイキン22を産生し,真菌や病原細菌の感染を防御する機能をもつ3).一方,Th17細胞は炎症性腸炎や自己免疫性関節炎,実験的自己免疫性脳脊髄炎の発症に関与することも報告されている3-6)(腸内細菌と腸管免疫については,本田 賢也, 領域融合レビュー, 2, e011, 2013 も参照されたい).
腸内細菌の一種であるセグメント細菌はグラム陽性の嫌気性細菌であり,腸管の上皮細胞層に恒常的に生息することが報告されている1).セグメント細菌はマウスやラットのみならず,無脊椎動物であるシロアリ,さらに,脊椎動物である魚類,ニワトリ,ウサギ,サルなどの哺乳類でも観察される7).これまでに報告されているセグメント細菌のおもな機能として,宿主の上皮間リンパ球の増殖,および,腸管において免疫グロブリンA陽性細胞の増加を促進することがあげられる8).さらに,セグメント細菌は腸管においてTh17細胞の分化を誘導し,病原性細菌であるCitrobactor rodentiumに対する感染防御に寄与している9).一方,セグメント細菌は自己免疫性関節炎や実験的自己免疫性脳脊髄炎の発症を促進することも報告されている5,6).
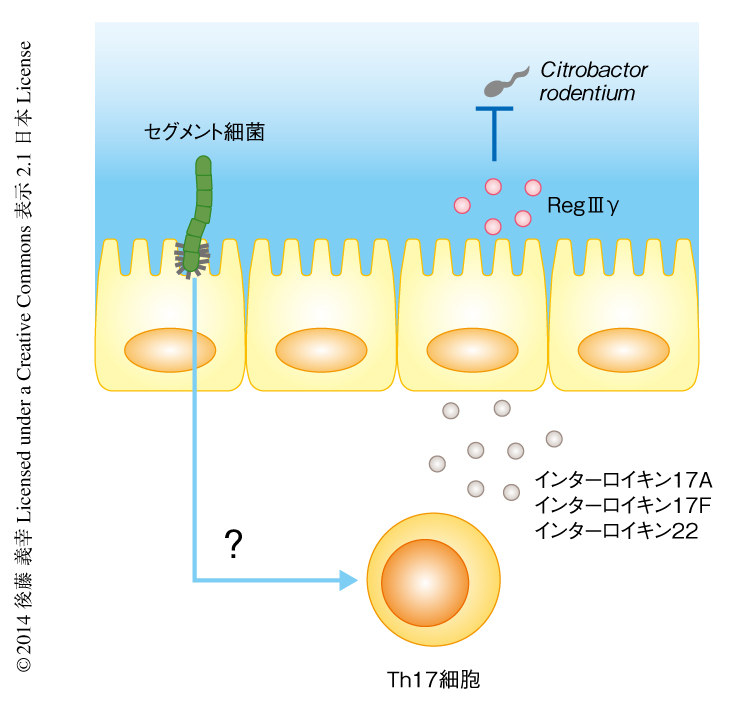
セグメント細菌による腸管におけるTh17細胞の分化の誘導の機構については,これまでに,セグメント細菌が回腸の上皮細胞に対し血清アミロイドAの発現を誘導することにより,腸管において樹状細胞によるインターロイキン23などのサイトカインの産生を促進し,Th17細胞の分化を誘導する可能性が示唆されているものの,その詳細は明らかになっていない9)(図1).また,セグメント細菌により誘導されたTh17細胞がどのような抗原を認識するのか,そのT細胞受容体の特異性も明らかではない.この研究では,1)セグメント細菌によるTh17細胞の分化の誘導には樹状細胞に発現するMHCタイプII分子が必要であること,2)セグメント細菌により分化が誘導されるTh17細胞はセグメント細菌に由来する抗原を認識すること,3)自然リンパ球に発現するMHCタイプII分子は腸管においてTh17細胞を抑制するもののセグメント細菌により分化が誘導されるTh17細胞は抑制しないこと,4)セグメント細菌によるTh17細胞の分化の誘導はおもに腸管の粘膜固有層において起こること,を示した.
種々のヘルパーT細胞は抗原提示細胞から抗原の提示をうけ分化することから,抗原提示細胞の発現するMHCタイプII分子がセグメント細菌によるTh17細胞の分化の誘導に関与する可能性を考え,その検証を試みた.MHCタイプII分子ノックアウトマウスを作製し,その腸管におけるTh17細胞の分化の誘導について観察した.その結果,セグメント細菌の存在下において,野生型のマウスでは腸管に存在するCD4陽性T細胞のうち10~15%がTh17細胞であったのに対し,MHCタイプII分子ノックアウトマウスではTh17細胞はほとんど観察されなかった.しかしながら,MHCタイプII分子ノックアウトマウスではもともとCD4陽性T細胞の数が減少しており,T細胞の分化の異常によりTh17細胞の分化が阻害されている可能性が考えられた.そこで,野生型マウスからナイーブCD4陽性T細胞を単離し,セグメント細菌をもつ野生型マウスおよびMHCタイプII分子ノックアウトマウスに移入してTh17細胞の分化の誘導について観察した.その結果,野生型マウスでは移入されたT細胞のうち約30%がTh17細胞に分化したのに対し,MHCタイプII分子ノックアウトマウスではTh17細胞の分化は観察されなかった.以上の結果から,MHCタイプII分子がセグメント細菌によるTh17細胞の分化の誘導に関与していることが示された.
セグメント細菌により分化が誘導されるTh17細胞のT細胞受容体のもつ抗原特異性について解析を試みた.セグメント細菌をもつインターロイキン17-GFPノックインマウスの腸管からGFP陽性CD4陽性T細胞(すなわち,Th17細胞)を単離し,脾臓に由来する樹状細胞,さらに,セグメント細菌,大腸菌,Clostridium perfingen,野生型マウスの糞便から分離した細菌のそれぞれに由来する抗原と共培養し,Th17細胞の増殖を観察したところ,セグメント細菌に由来する抗原をくわえた場合のみTh17細胞の増殖が観察された.さらに,MHCタイプII分子ノックアウトマウスから単離した樹状細胞を用いて同様の実験を行ったところ,Th17細胞の増殖は観察されなかった.これらの結果から,セグメント細菌により分化が誘導されるTh17細胞はセグメント細菌に由来する抗原を認識し,樹状細胞に発現するMHCタイプII分子がその増殖に関与することが示された.一方,GFP陰性CD4陽性T細胞,および,セグメント細菌をもたないマウスから単離したTh17細胞は,セグメント細菌に由来する抗原には反応しなかったことから,この増殖反応はセグメント細菌により誘導されたTh17細胞に対し特異的であることが示唆された.
セグメント細菌により分化が誘導されたTh17細胞のうち,セグメント細菌を認識するTh17細胞の割合を同定する目的で,セグメント細菌をもつインターロイキン17-GFPノックインマウスから単離したTh17細胞を胸腺腫細胞と融合させることによりT細胞のハイブリドーマを樹立した.ハイブリドーマとセグメント細菌に由来する抗原を共培養し,ハイブリドーマの産生するインターロイキン2を測定したところ,46%のハイブリドーマがセグメント細菌に由来する抗原に反応した.一方,GFP陰性CD4陽性T細胞のうちセグメント細菌に由来する抗原に反応したのは3%であった.
T細胞はMHCタイプIIを介して抗原提示細胞から抗原の提示をうける.これまで,MHCタイプII分子を発現する細胞として,樹状細胞,B細胞,マクロファージ,上皮細胞,自然リンパ球が知られている.B細胞ノックアウトマウスではセグメント細菌の存在下において野生型のマウスと同等にTh17細胞の分化が誘導されることから,このうちB細胞はTh17細胞の誘導に関与しないと考えられた.セグメント細菌によるTh17細胞の分化の誘導に関与するMHCタイプII分子を発現する細胞を同定するため,上皮細胞において特異的,および,樹状細胞において特異的にMHCタイプII分子を欠損するマウスを作製した.上皮細胞に特異的なMHCタイプII分子ノックアウトマウスではセグメント細菌の存在下において野生型マウスと同等のTh17細胞が観察された.一方,樹状細胞に特異的なMHCタイプII分子ノックアウトマウスではセグメント細菌の存在下においてもTh17細胞の分化は誘導されなかった.一方,樹状細胞において特異的にMHCタイプII分子を発現するトランスジェニックマウスを作製したところ,セグメント細菌の存在下において野生型マウスと同等のTh17細胞が観察された.以上の結果より,樹状細胞に発現するMHCタイプII分子がセグメント細菌によるTh17細胞の分化の誘導に関与していることが示された.
以前の報告から,自然リンパ球(innate lymphoid cell:ILC)もMHCタイプII分子を発現することが知られている10).このうち,小腸の粘膜固有層に存在する自然リンパ球では,Rorγt陽性ILC3画分のうちc-kit陽性NKp46陰性の細胞が恒常的にMHCタイプII分子を発現する.このILC3画分において特異的にMHCタイプII分子を欠損したマウスを作製した.驚いたことに,ILC3画分に特異的なMHCタイプII分子ノックアウトマウスでは,セグメント細菌の非存在下においてもセグメント細菌の存在下の野生型マウスと同等のTh17細胞が観察され,さらに,セグメント細菌の存在下では非存在下よりもさらに多くのTh17細胞が観察された.以上の結果から,MHCタイプII分子を発現する自然リンパ球はセグメント細菌に非依存的な腸管におけるTh17細胞の分化を負に制御し,セグメント細菌によるTh17細胞の分化の誘導にはとくに関与しないことが示された.
セグメント細菌により分化が誘導されるTh17細胞の動態を解析した.インターロイキン17-GFPノックインマウスからナイーブCD4陽性細胞を単離しセグメント細菌をもつ野生型マウスに移入したところ,移入後5日目から腸管の粘膜固有層においてTh17細胞が確認され,移入後7日目には多数のTh17細胞が観察された.一方,このあいだ,パイエル板や腸管膜リンパ節といった2次リンパ組織ではTh17細胞はほとんど観察されなかった.
腸管膜リンパ節をはじめとする2次リンパ組織がTh17細胞の分化の誘導に必要かどうかを明らかにするため,2次リンパ組織を欠損したリンホトキシンαノックアウトマウスにおいてTh17細胞の動態を解析した.その結果,セグメント細菌の存在下においてはリンホトキシンαノックアウトマウスの腸管に野生型マウスと同等のTh17細胞が観察された.以上の結果から,セグメント細菌により誘導されるTh17細胞は2次リンパ組織を必要としない可能性が示唆された.いまだ詳細は明らかでないものの,おそらく,粘膜固有層の局所において樹状細胞によりセグメント細菌に由来する抗原がCD4陽性T細胞に対し直接的に提示されているものと考えられる.
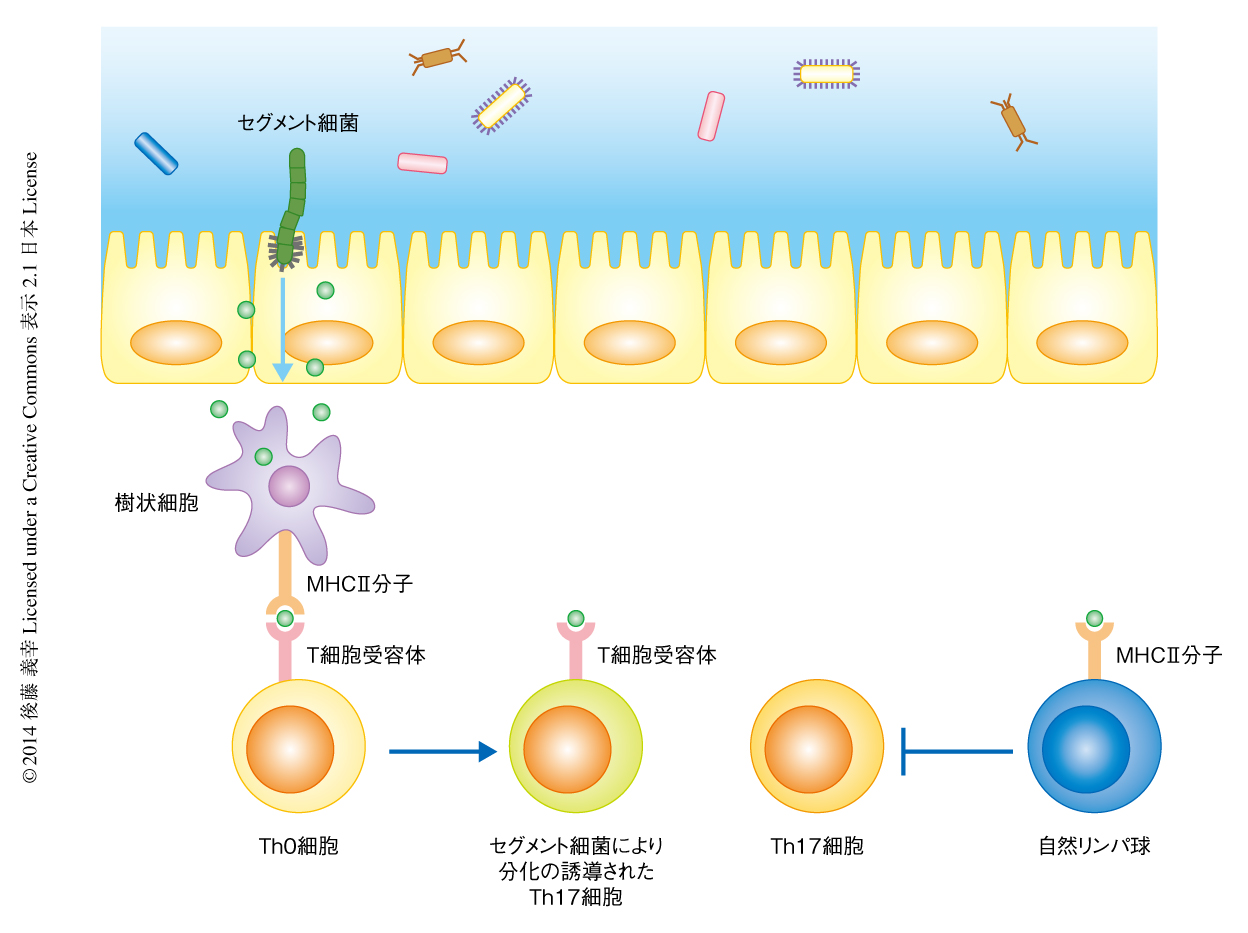
この研究により,腸管において樹状細胞に発現するMHCタイプII分子がセグメント細菌によるTh17細胞の分化の誘導に関与していることが明らかになった(図2).腸管においてTh17細胞は種々の病原体の感染防御に寄与するのみならず,腸炎の誘導や全身性自己免疫疾患の発症にも関与していることから,病態の形成という観点からもその分化の誘導の機構を解明することは重要と考えられる.とくに,セグメント細菌により分化が誘導されるTh17細胞は自己免疫性関節炎や実験的自己免疫性脳脊髄炎の発症を促進することが報告されているが5,6),腸管において分化が誘導されたTh17細胞のもつT細胞受容体が自己抗原を認識するかどうかは,いまだ明らかになっていない.今後は,セグメント細菌に由来する抗原を同定することにより,腸管におけるTh17細胞の分化を人為的に制御する方法の開発が期待される.
略歴:2009年 東京大学大学院医学系研究科博士課程 修了,同年 東京大学医科学研究所 博士研究員を経て,2012年より米国Columbia大学Medical Center博士研究員.
研究テーマ:腸内細菌による宿主の粘膜における免疫機構の構築.
関心事:宿主の免疫細胞による腸内細菌叢の恒常性の維持および腸内細菌による宿主の免疫の構築の機構.腸内細菌と宿主とのあいだで共生関係が成立するシステム.
© 2014 後藤 義幸 Licensed under CC 表示 2.1 日本
(米国Columbia大学Medical Center,Department of Microbiology and Immunology)
email:後藤義幸
DOI: 10.7875/first.author.2014.058
Segmented filamentous bacteria antigens presented by intestinal dendritic cells drive mucosal Th17 cell differentiation.
Yoshiyuki Goto, Casandra Panea, Gaku Nakato, Anna Cebula, Carolyn Lee, Marta Galan Diez, Terri M. Laufer, Leszek Ignatowicz, Ivaylo I. Ivanov
Immunity, 40, 594-607 (2014)
要 約
腸管は腸内細菌を含む多種多様な抗原につねにさらされている特殊な器官である.腸内細菌は宿主の粘膜免疫系の構築に寄与しており,とくに,ヘルパーT細胞であるTh17細胞や制御性T細胞の分化を誘導することが知られている.このうち,Th17細胞は代表的な腸内細菌の一種であるセグメント細菌により分化が誘導されることが報告されているものの,その詳細な機構は明らかになっていない.この研究では,腸管において樹状細胞がMHCタイプII分子を介してT細胞にセグメント細菌に由来する抗原を提示することにより,Th17細胞の分化の誘導に重要な役割を担っていることを示した.
はじめに
腸管は腸内細菌や食餌性の抗原に恒常的にさらされている特殊な器官である.ヒトの小腸では十二指腸から回腸へ進むにしたがい腸内細菌の数も増加し,大腸では内容物1 gあたり約1011~1012個もの細菌の生息することが知られている1).腸内細菌は宿主から,食餌に由来する栄養源,適切な温度,酸素など生息に適した環境を提供される一方,宿主に対しビタミンKなどの栄養源を供給するのみならず,バクテリオシンなどの抗菌物質を産生することにより病原性細菌の感染に対する防御機能も付与している2).さらに,腸内細菌のもつ重要な機能として,宿主の腸管における免疫機構の構築があげられる.無菌マウスではパイエル板や孤立リンパ小節などの2次リンパ組織が未発達であることにくわえ,腸管におけるT細胞の分化および増殖,免疫グロブリンAの産生が低下している1).腸管にはT細胞やB細胞を含む多数の免疫細胞が存在しており,外来の抗原に対し第一線のバリア機構を形成している.なかでもTh17細胞はインターロイキン17を産生するヘルパーT細胞の一種であり,インターロイキン17A,インターロイキン17F,インターロイキン22を産生し,真菌や病原細菌の感染を防御する機能をもつ3).一方,Th17細胞は炎症性腸炎や自己免疫性関節炎,実験的自己免疫性脳脊髄炎の発症に関与することも報告されている3-6)(腸内細菌と腸管免疫については,本田 賢也, 領域融合レビュー, 2, e011, 2013 も参照されたい).
腸内細菌の一種であるセグメント細菌はグラム陽性の嫌気性細菌であり,腸管の上皮細胞層に恒常的に生息することが報告されている1).セグメント細菌はマウスやラットのみならず,無脊椎動物であるシロアリ,さらに,脊椎動物である魚類,ニワトリ,ウサギ,サルなどの哺乳類でも観察される7).これまでに報告されているセグメント細菌のおもな機能として,宿主の上皮間リンパ球の増殖,および,腸管において免疫グロブリンA陽性細胞の増加を促進することがあげられる8).さらに,セグメント細菌は腸管においてTh17細胞の分化を誘導し,病原性細菌であるCitrobactor rodentiumに対する感染防御に寄与している9).一方,セグメント細菌は自己免疫性関節炎や実験的自己免疫性脳脊髄炎の発症を促進することも報告されている5,6).
セグメント細菌による腸管におけるTh17細胞の分化の誘導の機構については,これまでに,セグメント細菌が回腸の上皮細胞に対し血清アミロイドAの発現を誘導することにより,腸管において樹状細胞によるインターロイキン23などのサイトカインの産生を促進し,Th17細胞の分化を誘導する可能性が示唆されているものの,その詳細は明らかになっていない9)(図1).また,セグメント細菌により誘導されたTh17細胞がどのような抗原を認識するのか,そのT細胞受容体の特異性も明らかではない.この研究では,1)セグメント細菌によるTh17細胞の分化の誘導には樹状細胞に発現するMHCタイプII分子が必要であること,2)セグメント細菌により分化が誘導されるTh17細胞はセグメント細菌に由来する抗原を認識すること,3)自然リンパ球に発現するMHCタイプII分子は腸管においてTh17細胞を抑制するもののセグメント細菌により分化が誘導されるTh17細胞は抑制しないこと,4)セグメント細菌によるTh17細胞の分化の誘導はおもに腸管の粘膜固有層において起こること,を示した.
1.セグメント細菌によるTh17細胞の分化の誘導にはMHCタイプII分子が必要である
種々のヘルパーT細胞は抗原提示細胞から抗原の提示をうけ分化することから,抗原提示細胞の発現するMHCタイプII分子がセグメント細菌によるTh17細胞の分化の誘導に関与する可能性を考え,その検証を試みた.MHCタイプII分子ノックアウトマウスを作製し,その腸管におけるTh17細胞の分化の誘導について観察した.その結果,セグメント細菌の存在下において,野生型のマウスでは腸管に存在するCD4陽性T細胞のうち10~15%がTh17細胞であったのに対し,MHCタイプII分子ノックアウトマウスではTh17細胞はほとんど観察されなかった.しかしながら,MHCタイプII分子ノックアウトマウスではもともとCD4陽性T細胞の数が減少しており,T細胞の分化の異常によりTh17細胞の分化が阻害されている可能性が考えられた.そこで,野生型マウスからナイーブCD4陽性T細胞を単離し,セグメント細菌をもつ野生型マウスおよびMHCタイプII分子ノックアウトマウスに移入してTh17細胞の分化の誘導について観察した.その結果,野生型マウスでは移入されたT細胞のうち約30%がTh17細胞に分化したのに対し,MHCタイプII分子ノックアウトマウスではTh17細胞の分化は観察されなかった.以上の結果から,MHCタイプII分子がセグメント細菌によるTh17細胞の分化の誘導に関与していることが示された.
2.セグメント細菌により誘導されるTh17細胞はセグメント細菌に由来する抗原を認識する
セグメント細菌により分化が誘導されるTh17細胞のT細胞受容体のもつ抗原特異性について解析を試みた.セグメント細菌をもつインターロイキン17-GFPノックインマウスの腸管からGFP陽性CD4陽性T細胞(すなわち,Th17細胞)を単離し,脾臓に由来する樹状細胞,さらに,セグメント細菌,大腸菌,Clostridium perfingen,野生型マウスの糞便から分離した細菌のそれぞれに由来する抗原と共培養し,Th17細胞の増殖を観察したところ,セグメント細菌に由来する抗原をくわえた場合のみTh17細胞の増殖が観察された.さらに,MHCタイプII分子ノックアウトマウスから単離した樹状細胞を用いて同様の実験を行ったところ,Th17細胞の増殖は観察されなかった.これらの結果から,セグメント細菌により分化が誘導されるTh17細胞はセグメント細菌に由来する抗原を認識し,樹状細胞に発現するMHCタイプII分子がその増殖に関与することが示された.一方,GFP陰性CD4陽性T細胞,および,セグメント細菌をもたないマウスから単離したTh17細胞は,セグメント細菌に由来する抗原には反応しなかったことから,この増殖反応はセグメント細菌により誘導されたTh17細胞に対し特異的であることが示唆された.
セグメント細菌により分化が誘導されたTh17細胞のうち,セグメント細菌を認識するTh17細胞の割合を同定する目的で,セグメント細菌をもつインターロイキン17-GFPノックインマウスから単離したTh17細胞を胸腺腫細胞と融合させることによりT細胞のハイブリドーマを樹立した.ハイブリドーマとセグメント細菌に由来する抗原を共培養し,ハイブリドーマの産生するインターロイキン2を測定したところ,46%のハイブリドーマがセグメント細菌に由来する抗原に反応した.一方,GFP陰性CD4陽性T細胞のうちセグメント細菌に由来する抗原に反応したのは3%であった.
3.樹状細胞に発現するMHCタイプII分子がセグメント細菌によるTh17細胞の分化の誘導に関与する
T細胞はMHCタイプIIを介して抗原提示細胞から抗原の提示をうける.これまで,MHCタイプII分子を発現する細胞として,樹状細胞,B細胞,マクロファージ,上皮細胞,自然リンパ球が知られている.B細胞ノックアウトマウスではセグメント細菌の存在下において野生型のマウスと同等にTh17細胞の分化が誘導されることから,このうちB細胞はTh17細胞の誘導に関与しないと考えられた.セグメント細菌によるTh17細胞の分化の誘導に関与するMHCタイプII分子を発現する細胞を同定するため,上皮細胞において特異的,および,樹状細胞において特異的にMHCタイプII分子を欠損するマウスを作製した.上皮細胞に特異的なMHCタイプII分子ノックアウトマウスではセグメント細菌の存在下において野生型マウスと同等のTh17細胞が観察された.一方,樹状細胞に特異的なMHCタイプII分子ノックアウトマウスではセグメント細菌の存在下においてもTh17細胞の分化は誘導されなかった.一方,樹状細胞において特異的にMHCタイプII分子を発現するトランスジェニックマウスを作製したところ,セグメント細菌の存在下において野生型マウスと同等のTh17細胞が観察された.以上の結果より,樹状細胞に発現するMHCタイプII分子がセグメント細菌によるTh17細胞の分化の誘導に関与していることが示された.
4.自然リンパ球はセグメント細菌に非依存的なTh17細胞の増殖を抑制するがセグメント細菌により分化が誘導されるTh17細胞の増殖は抑制しない
以前の報告から,自然リンパ球(innate lymphoid cell:ILC)もMHCタイプII分子を発現することが知られている10).このうち,小腸の粘膜固有層に存在する自然リンパ球では,Rorγt陽性ILC3画分のうちc-kit陽性NKp46陰性の細胞が恒常的にMHCタイプII分子を発現する.このILC3画分において特異的にMHCタイプII分子を欠損したマウスを作製した.驚いたことに,ILC3画分に特異的なMHCタイプII分子ノックアウトマウスでは,セグメント細菌の非存在下においてもセグメント細菌の存在下の野生型マウスと同等のTh17細胞が観察され,さらに,セグメント細菌の存在下では非存在下よりもさらに多くのTh17細胞が観察された.以上の結果から,MHCタイプII分子を発現する自然リンパ球はセグメント細菌に非依存的な腸管におけるTh17細胞の分化を負に制御し,セグメント細菌によるTh17細胞の分化の誘導にはとくに関与しないことが示された.
5.セグメント細菌により分化が誘導されるTh17細胞は2次リンパ組織を必要としない
セグメント細菌により分化が誘導されるTh17細胞の動態を解析した.インターロイキン17-GFPノックインマウスからナイーブCD4陽性細胞を単離しセグメント細菌をもつ野生型マウスに移入したところ,移入後5日目から腸管の粘膜固有層においてTh17細胞が確認され,移入後7日目には多数のTh17細胞が観察された.一方,このあいだ,パイエル板や腸管膜リンパ節といった2次リンパ組織ではTh17細胞はほとんど観察されなかった.
腸管膜リンパ節をはじめとする2次リンパ組織がTh17細胞の分化の誘導に必要かどうかを明らかにするため,2次リンパ組織を欠損したリンホトキシンαノックアウトマウスにおいてTh17細胞の動態を解析した.その結果,セグメント細菌の存在下においてはリンホトキシンαノックアウトマウスの腸管に野生型マウスと同等のTh17細胞が観察された.以上の結果から,セグメント細菌により誘導されるTh17細胞は2次リンパ組織を必要としない可能性が示唆された.いまだ詳細は明らかでないものの,おそらく,粘膜固有層の局所において樹状細胞によりセグメント細菌に由来する抗原がCD4陽性T細胞に対し直接的に提示されているものと考えられる.
おわりに
この研究により,腸管において樹状細胞に発現するMHCタイプII分子がセグメント細菌によるTh17細胞の分化の誘導に関与していることが明らかになった(図2).腸管においてTh17細胞は種々の病原体の感染防御に寄与するのみならず,腸炎の誘導や全身性自己免疫疾患の発症にも関与していることから,病態の形成という観点からもその分化の誘導の機構を解明することは重要と考えられる.とくに,セグメント細菌により分化が誘導されるTh17細胞は自己免疫性関節炎や実験的自己免疫性脳脊髄炎の発症を促進することが報告されているが5,6),腸管において分化が誘導されたTh17細胞のもつT細胞受容体が自己抗原を認識するかどうかは,いまだ明らかになっていない.今後は,セグメント細菌に由来する抗原を同定することにより,腸管におけるTh17細胞の分化を人為的に制御する方法の開発が期待される.
文 献
- Honda, K. & Littman, D. R.: The microbiome in infectious disease and inflammation. Annu. Rev. Immunol., 30, 759-795 (2012)[PubMed]
- O'Hara, A. M. & Shanahan, F.: The gut flora as a forgotten organ. EMBO Rep., 7, 688-693 (2006)[PubMed]
- Korn, T., Bettelli, E., Oukka, M. et al.: IL-17 and Th17 cells. Annu. Rev. Immunol., 27, 485-517 (2009)[PubMed]
- Leppkes, M., Becker, C., Ivanov, I. I. et al.: RORγ-expressing Th17 cells induce murine chronic intestinal inflammation via redundant effects of IL-17A and IL-17F. Gastroenterology, 136, 257-267 (2009)[PubMed]
- Lee, Y. K., Menezes, J. S., Umesaki, Y. et al.: Proinflammatory T-cell responses to gut microbiota promote experimental autoimmune encephalomyelitis. Proc. Natl. Acad. Sci. USA, 108(Suppl.1), 4615-4622 (2011)[PubMed]
- Wu, H. J., Ivanov, I. I., Darce, J. et al.: Gut-residing segmented filamentous bacteria drive autoimmune arthritis via T helper 17 cells. Immunity, 32, 815-827 (2010)[PubMed]
- Ivanov, I. I. & Honda, K.: Intestinal commensal microbes as immune modulators. Cell Host Microbe, 12, 496-508 (2012)[PubMed]
- Umesaki, Y., Setoyama, H., Matsumoto, S. et al.: Differential roles of segmented filamentous bacteria and clostridia in development of the intestinal immune system. Infect. Immun., 67, 3504-3511 (1999)[PubMed]
- Ivanov, I. I., Atarashi, K., Manel, N. et al.: Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell, 139, 485-198 (2009)[PubMed]
- Hepworth, M. R., Monticelli, L. A., Fung, T. C. et al.: Innate lymphoid cells regulate CD4+ T-cell responses to intestinal commensal bacteria. Nature, 498, 113-117 (2013)[PubMed]
著者プロフィール
略歴:2009年 東京大学大学院医学系研究科博士課程 修了,同年 東京大学医科学研究所 博士研究員を経て,2012年より米国Columbia大学Medical Center博士研究員.
研究テーマ:腸内細菌による宿主の粘膜における免疫機構の構築.
関心事:宿主の免疫細胞による腸内細菌叢の恒常性の維持および腸内細菌による宿主の免疫の構築の機構.腸内細菌と宿主とのあいだで共生関係が成立するシステム.
© 2014 後藤 義幸 Licensed under CC 表示 2.1 日本