好熱性光合成細菌に由来するコアアンテナタンパク質-反応中心複合体の結晶構造
竹田一旗・三木邦夫
(京都大学大学院理学研究科 化学専攻生物構造化学研究室)
email:竹田一旗,三木邦夫
DOI: 10.7875/first.author.2014.054
Structure of the LH1-RC complex from Thermochromatium tepidum at 3.0Å.
Satomi Niwa, Long-Jiang Yu, Kazuki Takeda, Yu Hirano, Tomoaki Kawakami, Zheng-Yu Wang-Otomo, Kunio Miki
Nature, 508, 228-232 (2014)
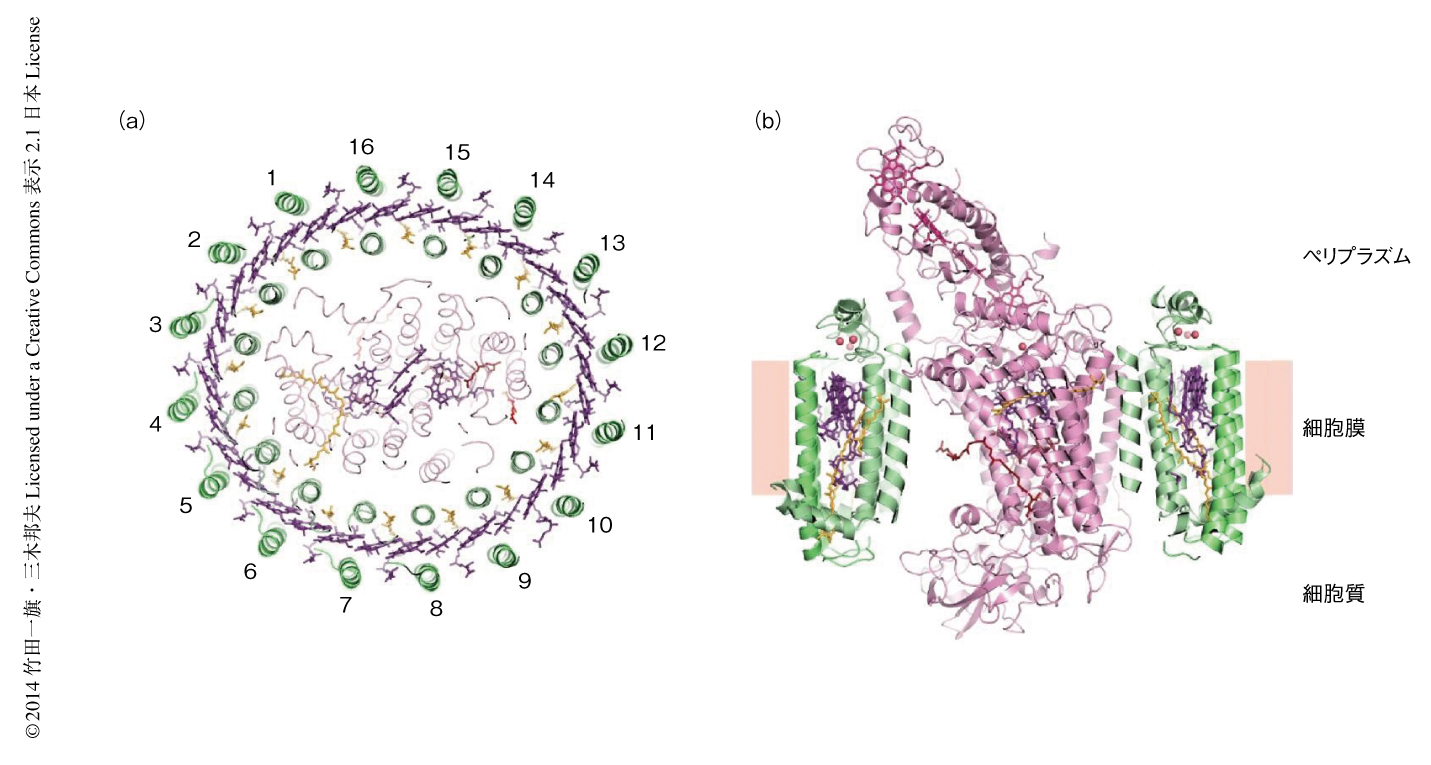
紅色光合成細菌において光の捕集を担うコアアンテナタンパク質と反応中心は,超分子複合体を形成して太陽光を効率的に利用する.好熱性光合成細菌Thermochromatium tepidumに由来するコアアンテナタンパク質-反応中心複合体の結晶構造を解析し,サブユニットと補因子の詳細な配置および相互作用を決定した.その結果,それぞれ16本のα鎖とβ鎖から構成されるコアアンテナタンパク質のリングに,反応中心が完全にとりかこまれていることが判明した.コアアンテナタンパク質のペリスラズム側には16カ所のCa2+の結合部位が確認された.コアアンテナタンパク質のリングにおいては32個のバクテリオクロロフィルと16個のスピリロキサンチンが楕円状の分子集合体を形成していた.バクテリオクロロフィル32量体の分子配置からは吸収波長や励起エネルギー移動について考察することができた.また,化学エネルギーを伝達するユビキノンがコアアンテナタンパク質のリングを通り抜ける経路が確認された.
太陽光のエネルギーを利用して二酸化炭素と水からデンプンなどの糖類を合成する光合成反応の初期過程においては,光の捕集を担うアンテナタンパク質や反応中心などの光合成装置により光エネルギーが化学エネルギーへと変換される.このしくみは非酸素発生型光合成を行う細菌から酸素発生型光合成を行う高等植物にいたるまで共通である.光合成細菌のもつアンテナタンパク質や反応中心は高等植物より構造や構成が単純で,これまで,理論的な研究や分光学的な研究によく用いられてきた.はじめて結晶構造の解明された反応中心も光合成細菌に由来するものである1).しかしながら,反応中心をとりまくかたちで存在し光の捕集を担うコアアンテナタンパク質の結合した状態での構造は,これまで,分解能の低いものしか得られていなかったため2),効率的な集光や光エネルギー移動の機構を解明するために必要なコアアンテナタンパク質と反応中心との相互作用や色素などの補因子の配置については,その詳細が不明であった.
米国Yellowstone国立公園の温泉から単離された紅色光合成細菌Thermochromatium tepidumの生育温度は約50℃であり,熱安定性の高い光合成装置をもつ.この細菌に由来する反応中心の結晶構造については,以前に筆者らが,2.2Å分解能で報告している3).今回,コアアンテナタンパク質-反応中心複合体についてもこの細菌から精製して良質の結晶を得ることに成功し,3.0Å分解能のX線回折データを測定することができた.まず,反応中心の構造をサーチモデルとした分子置換法から最初の位相を得て,重原子誘導体データの重原子位置を決定した.この重原子位置をもとにあらためて重原子同型置換法を行うことにより,モデルバイアスのない位相情報を得ることができた.なお,回折データ強度の分布には強い異方性が存在しており,等方的になるよう補正をした.また,6個のデータセットを使用して結晶のあいだの電子密度の平均化を行った.これらのデータ処理の結果,ポリペプチド部分の側鎖をはじめ,バクテリオクロロフィル,バクテリオフェオフィチン,スピリロキサンチンなどの補因子を,実験的に決定した電子密度にもとづいて確認することが可能になった(PDB ID:3WMM,3WMN,3WMO).
T. tepidumに由来のするコアアンテナタンパク質-反応中心複合体は,反応中心の部分がシトクロム,H,L,Mの4種類のサブユニット,コアアンテナタンパク質の部分がそれぞれ16個のαサブユニットとβサブユニットから構成されていた.また,合計で80個の補因子が確認された.反応中心はそれぞれ16個のαサブユニットとβのサブユニットから構成されるコアアンテナタンパク質のリングに完全にとりかこまれていた(図1a).このリングは楕円状の二重構造をとっていた.反応中心の部分の構造は以前に報告されている反応中心の単独の構造と非常によく一致していたが,シトクロムサブユニットのループのひとつに大きな差がみられた.また,非ヘム鉄の近傍にはユビキノンの結合が確認された.コアアンテナタンパク質のリングは,内側にαサブユニットの膜貫通ヘリックス,外側にβサブユニットの膜貫通ヘリックスが位置し,どちらのサブユニットについてもN末端は細胞質側,C末端はペリプラズム側をむいていた.αサブユニットの膜貫通ヘリックスのN末端側およびC末端側には,細胞膜の外に突き出たかたちでヘリックスが存在していた(図1b).αサブユニットとβサブユニットはヘテロ二量体を形成し,おのおののαβヘテロ二量体には,2個のバクテリオクロロフィル,1個のスピリロキサンチン,1個のCa2+が結合していた.
αβヘテロ二量体の膜貫通領域の構造は,Rhodopseudomonas acidophilaに由来する周辺アンテナタンパク質4),Rhodospirillum molischianumに由来する周辺アンテナタンパク質5),Rhodop. acidophilaに由来する弱光型周辺アンテナタンパク質6) の構造と類似していた.とりわけ,Rhodosp. molischianumに由来する周辺アンテナタンパク質は,T. tepidumに由来するコアアンテナタンパク質と,細胞膜外領域も含め類似していた.以前に4.8Å分解能で報告されているRhodops. Palustrisに由来するコアアンテナタンパク質-反応中心複合体の構造2) においては,コアアンテナタンパク質は15組のαβヘテロ二量体から構成されており,タンパク質Wという1回膜貫通型のサブユニットによりリングに切れ目が生じている.T. tepidumに由来するコアアンテナタンパク質は,ほぼ同じかたちおよび大きさであるにもかかわらず,16組のαβヘテロ二量体から構成されており,完全に閉じたリングを形成していた.タンパク質Wに対応する位置には16個目のαβヘテロ二量体が存在していた.
互いに隣接する2つのαβヘテロ二量体のあいだの膜貫通領域における相互作用は,おもにバクテリオクロロフィルとスピリロキサンチンを介していた.コアアンテナタンパク質のリングにおける膜貫通ヘリックスのあいだの直接的な相互作用は,となりあうαサブユニットのPhe27とIle29とのあいだにのみ観察された.細胞膜外領域については,細胞質側に位置するN末端側にはサブユニットのあいだの相互作用はあまりみられない一方,ペリプラズム側にはいくつもの相互作用が確認できた.n番目のαサブユニットとn + 1番目のβサブユニットは金属イオンを介して相互作用していた.この金属イオンについては,Ca2+のK吸収端の近傍のX線を使用して回折データを測定し異常散乱差フーリエ図を計算することにより,実際にCa2+であることが確認された.コアアンテナタンパク質のペリプラズム側には16カ所のCa2+結合部位を同定することができた.それぞれのCa2+には,αサブユニットのAsp49およびAsn50の側鎖,αサブユニットTrp46の主鎖のカルボニル基,隣接したαβヘテロ二量体のβサブユニットLeu46のC末端のカルボキシル基に含まれる酸素原子が配位していた.もっともよくみられるCa2+の配位形式は7配位であるのに対し,T. tepidumに由来するコアアンテナタンパク質では合計で5個の配位原子しか同定できなかったが,残り2つの配位子としては水分子が考えられた.αサブユニットのAsp49およびAsn50はほかの紅色光合成細菌では保存されておらず,Ca2+結合部位はT. tepidumに特有であった.このCa2+を介した相互作用は,T. tepidumに由来するコアアンテナタンパク質-反応中心複合体の高い耐熱性にかかわるものと考えられた.
T. tepidumに由来するコアアンテナタンパク質に結合しているバクテリオクロロフィルは915 nmに吸収波長があり,880 nmに吸収波長をもつほかの種のコアアンテナタンパク質よりも35 nmも長波長側にあった.EDTAを使用してCa2+を除去すると吸収波長は880 nmに変化し,ふたたびCa2+を添加すると吸収波長は915 nmにもどる7).αサブユニットのTrp46の側鎖は,コアアンテナタンパク質のαサブユニットに結合しているバクテリオクロロフィルのC3位のアセチル基と水素結合を形成していた.βサブユニットのLeu46のとなりの残基であるTrp45も,βサブユニットに結合しているバクテリオクロロフィルと同様の水素結合を形成していた.2つのバクテリオクロロフィルのあいだの距離はMg2+のあいだで測定して平均8.75Åであった.この値は,これまでに報告されている光合成細菌のアンテナタンパク質(コアアンテナタンパク質および周辺アンテナタンパク質)のなかでは最短であった.Ca2+によりバクテリオクロロフィルどうしの密な重なり合いが可能になり,吸収波長のシフトをもたらしていると考えられた.
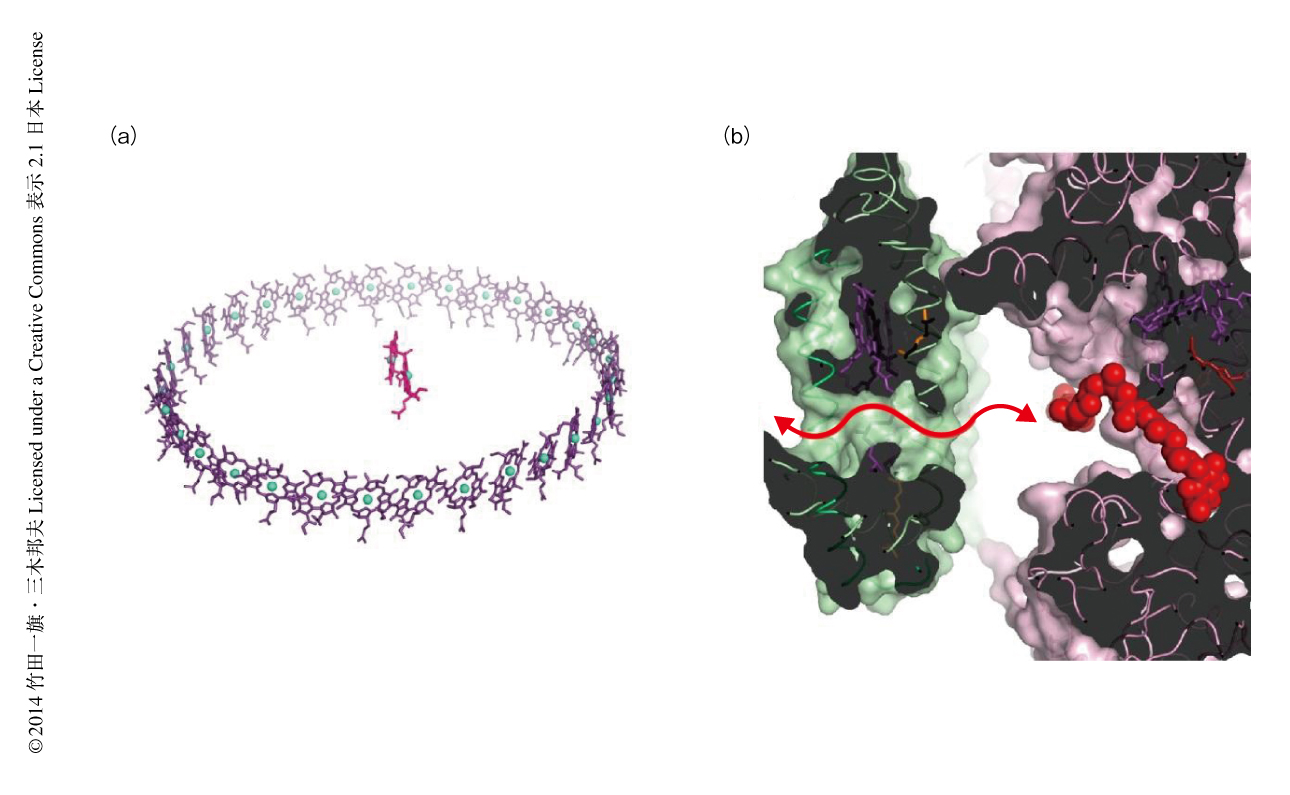
コアアンテナタンパク質のリングでは,32個のバクテリオクロロフィルは16個のスピリロキサンチンとともに楕円状の分子集合体を形成していた(図2a).コアアンテナタンパク質のバクテリオクロロフィルは,反応中心のスペシャルペアのバクテリオクロロフィルと膜貫通ヘリックスに対し同じ高さに位置していた.また,α1,β1,α9,β9と結合しているバクテリオクロロフィルは,スペシャルペアのバクテリオクロロフィルと平行に位置していた.これらの平行なバクテリオクロロフィルは,分子集合体の楕円状リングの短軸からは約30度はずれていた.平行なバクテリオクロロフィルとスペシャルペアのバクテリオクロロフィルのあいだの距離は39.4~43.5Åであった.励起エネルギー移動には,色素のあいだの距離だけではなく,遷移モーメントどうしの角度も重要であり,これらの平行なバクテリオクロロフィルがコアアンテナタンパク質から反応中心への励起エネルギーの移動に重要な役割をはたしている可能性が指摘された.
光のエネルギーにより反応中心のスペシャルペアのバクテリオクロロフィルから飛び出した電子は,最終的に還元型ユビキノンとして化学エネルギーのかたちに変換され,コアアンテナタンパク質-反応中心複合体の外へと運び出される.T. tepidumに由来するコアアンテナタンパク質-反応中心複合体の構造からは,完全に閉じたコアアンテナタンパク質のリングにおけるユビキノンの移動の機構も考察することができた(図2b).コアアンテナタンパク質のリングの隣接したαβヘテロ二量体のおのおののあいだには,ユビキノンの通り抜ける経路となりうるすきまがひとつずつ存在することが観察された.この16個のすきまは膜貫通ヘリックスの細胞質側に位置していた.周辺アンテナタンパク質のこの部分に対応する位置にはバクテリオクロロフィルが結合している.このすきまの位置は,反応中心のユビキノン結合部位と膜貫通ヘリックスに対する高さが同じであった.ユビキノン結合部位ともっとも近いすきまは約30Åの距離に位置していた.このすきまの大きさはユビキノンのベンゾキノン基とほぼ同じであった.すきまのもっとも狭い部分はバクテリオクロロフィル,スピリロキサンチン,αサブユニットの疎水性の残基の側鎖により形成されていて,柔軟性が高く非常に疎水的であった.コアアンテナタンパク質の膜貫通ヘリックスどうしの間隔について調べると,もっとも広いところと狭いところとでは2Åの差のあることが判明した.このことは,膜貫通ヘリックスがゆらぎやすい性質をもち,コアアンテナタンパク質の全体が呼吸をするような運動をすることを示唆していた.コアアンテナタンパク質のリングにおいてはペリプラズム側に比べ細胞質側にはサブユニット間の相互作用があまりみられなかった.このため,ユビキノンの通り抜ける経路のある膜貫通ヘリックスの細胞質側がより柔軟になっていた.このようなコアアンテナタンパク質の動きがユビキノンの移動に重要であることは,以前に報告されている分光学による研究や分子動力学による研究の結果からも予想されていた8-10).
コアアンテナタンパク質-反応中心複合体において,アンテナで吸収された光エネルギーを高い効率で反応中心に伝達するしくみは理論的には未解明のままである.今後,今回の構造解析により得られた分子構造をもとにして,光合成のエネルギー伝達に関する理論的な解明が期待される.
略歴:2000年 名古屋大学大学院理学研究科博士後期課程 単位取得退学,2005年 名古屋大学大学院理学研究科にて博士号取得,同年 理化学研究所播磨研究所 連携研究員を経て,2006年より京都大学大学院理学研究科 講師.
研究テーマ:生物物理学,タンパク質結晶学.
関心事:明日の天気.
三木 邦夫(Kunio Miki)
京都大学大学院理学研究科 教授.
研究室URL:http://kuchem.kyoto-u.ac.jp/kozo/miki_lab.html
© 2014 竹田一旗・三木邦夫 Licensed under CC 表示 2.1 日本
(京都大学大学院理学研究科 化学専攻生物構造化学研究室)
email:竹田一旗,三木邦夫
DOI: 10.7875/first.author.2014.054
Structure of the LH1-RC complex from Thermochromatium tepidum at 3.0Å.
Satomi Niwa, Long-Jiang Yu, Kazuki Takeda, Yu Hirano, Tomoaki Kawakami, Zheng-Yu Wang-Otomo, Kunio Miki
Nature, 508, 228-232 (2014)
要 約
紅色光合成細菌において光の捕集を担うコアアンテナタンパク質と反応中心は,超分子複合体を形成して太陽光を効率的に利用する.好熱性光合成細菌Thermochromatium tepidumに由来するコアアンテナタンパク質-反応中心複合体の結晶構造を解析し,サブユニットと補因子の詳細な配置および相互作用を決定した.その結果,それぞれ16本のα鎖とβ鎖から構成されるコアアンテナタンパク質のリングに,反応中心が完全にとりかこまれていることが判明した.コアアンテナタンパク質のペリスラズム側には16カ所のCa2+の結合部位が確認された.コアアンテナタンパク質のリングにおいては32個のバクテリオクロロフィルと16個のスピリロキサンチンが楕円状の分子集合体を形成していた.バクテリオクロロフィル32量体の分子配置からは吸収波長や励起エネルギー移動について考察することができた.また,化学エネルギーを伝達するユビキノンがコアアンテナタンパク質のリングを通り抜ける経路が確認された.
はじめに
太陽光のエネルギーを利用して二酸化炭素と水からデンプンなどの糖類を合成する光合成反応の初期過程においては,光の捕集を担うアンテナタンパク質や反応中心などの光合成装置により光エネルギーが化学エネルギーへと変換される.このしくみは非酸素発生型光合成を行う細菌から酸素発生型光合成を行う高等植物にいたるまで共通である.光合成細菌のもつアンテナタンパク質や反応中心は高等植物より構造や構成が単純で,これまで,理論的な研究や分光学的な研究によく用いられてきた.はじめて結晶構造の解明された反応中心も光合成細菌に由来するものである1).しかしながら,反応中心をとりまくかたちで存在し光の捕集を担うコアアンテナタンパク質の結合した状態での構造は,これまで,分解能の低いものしか得られていなかったため2),効率的な集光や光エネルギー移動の機構を解明するために必要なコアアンテナタンパク質と反応中心との相互作用や色素などの補因子の配置については,その詳細が不明であった.
1.X線結晶構造解析
米国Yellowstone国立公園の温泉から単離された紅色光合成細菌Thermochromatium tepidumの生育温度は約50℃であり,熱安定性の高い光合成装置をもつ.この細菌に由来する反応中心の結晶構造については,以前に筆者らが,2.2Å分解能で報告している3).今回,コアアンテナタンパク質-反応中心複合体についてもこの細菌から精製して良質の結晶を得ることに成功し,3.0Å分解能のX線回折データを測定することができた.まず,反応中心の構造をサーチモデルとした分子置換法から最初の位相を得て,重原子誘導体データの重原子位置を決定した.この重原子位置をもとにあらためて重原子同型置換法を行うことにより,モデルバイアスのない位相情報を得ることができた.なお,回折データ強度の分布には強い異方性が存在しており,等方的になるよう補正をした.また,6個のデータセットを使用して結晶のあいだの電子密度の平均化を行った.これらのデータ処理の結果,ポリペプチド部分の側鎖をはじめ,バクテリオクロロフィル,バクテリオフェオフィチン,スピリロキサンチンなどの補因子を,実験的に決定した電子密度にもとづいて確認することが可能になった(PDB ID:3WMM,3WMN,3WMO).
2.全体の構造
T. tepidumに由来のするコアアンテナタンパク質-反応中心複合体は,反応中心の部分がシトクロム,H,L,Mの4種類のサブユニット,コアアンテナタンパク質の部分がそれぞれ16個のαサブユニットとβサブユニットから構成されていた.また,合計で80個の補因子が確認された.反応中心はそれぞれ16個のαサブユニットとβのサブユニットから構成されるコアアンテナタンパク質のリングに完全にとりかこまれていた(図1a).このリングは楕円状の二重構造をとっていた.反応中心の部分の構造は以前に報告されている反応中心の単独の構造と非常によく一致していたが,シトクロムサブユニットのループのひとつに大きな差がみられた.また,非ヘム鉄の近傍にはユビキノンの結合が確認された.コアアンテナタンパク質のリングは,内側にαサブユニットの膜貫通ヘリックス,外側にβサブユニットの膜貫通ヘリックスが位置し,どちらのサブユニットについてもN末端は細胞質側,C末端はペリプラズム側をむいていた.αサブユニットの膜貫通ヘリックスのN末端側およびC末端側には,細胞膜の外に突き出たかたちでヘリックスが存在していた(図1b).αサブユニットとβサブユニットはヘテロ二量体を形成し,おのおののαβヘテロ二量体には,2個のバクテリオクロロフィル,1個のスピリロキサンチン,1個のCa2+が結合していた.
3.ほかのアンテナタンパク質との比較
αβヘテロ二量体の膜貫通領域の構造は,Rhodopseudomonas acidophilaに由来する周辺アンテナタンパク質4),Rhodospirillum molischianumに由来する周辺アンテナタンパク質5),Rhodop. acidophilaに由来する弱光型周辺アンテナタンパク質6) の構造と類似していた.とりわけ,Rhodosp. molischianumに由来する周辺アンテナタンパク質は,T. tepidumに由来するコアアンテナタンパク質と,細胞膜外領域も含め類似していた.以前に4.8Å分解能で報告されているRhodops. Palustrisに由来するコアアンテナタンパク質-反応中心複合体の構造2) においては,コアアンテナタンパク質は15組のαβヘテロ二量体から構成されており,タンパク質Wという1回膜貫通型のサブユニットによりリングに切れ目が生じている.T. tepidumに由来するコアアンテナタンパク質は,ほぼ同じかたちおよび大きさであるにもかかわらず,16組のαβヘテロ二量体から構成されており,完全に閉じたリングを形成していた.タンパク質Wに対応する位置には16個目のαβヘテロ二量体が存在していた.
4.Ca2+の結合
互いに隣接する2つのαβヘテロ二量体のあいだの膜貫通領域における相互作用は,おもにバクテリオクロロフィルとスピリロキサンチンを介していた.コアアンテナタンパク質のリングにおける膜貫通ヘリックスのあいだの直接的な相互作用は,となりあうαサブユニットのPhe27とIle29とのあいだにのみ観察された.細胞膜外領域については,細胞質側に位置するN末端側にはサブユニットのあいだの相互作用はあまりみられない一方,ペリプラズム側にはいくつもの相互作用が確認できた.n番目のαサブユニットとn + 1番目のβサブユニットは金属イオンを介して相互作用していた.この金属イオンについては,Ca2+のK吸収端の近傍のX線を使用して回折データを測定し異常散乱差フーリエ図を計算することにより,実際にCa2+であることが確認された.コアアンテナタンパク質のペリプラズム側には16カ所のCa2+結合部位を同定することができた.それぞれのCa2+には,αサブユニットのAsp49およびAsn50の側鎖,αサブユニットTrp46の主鎖のカルボニル基,隣接したαβヘテロ二量体のβサブユニットLeu46のC末端のカルボキシル基に含まれる酸素原子が配位していた.もっともよくみられるCa2+の配位形式は7配位であるのに対し,T. tepidumに由来するコアアンテナタンパク質では合計で5個の配位原子しか同定できなかったが,残り2つの配位子としては水分子が考えられた.αサブユニットのAsp49およびAsn50はほかの紅色光合成細菌では保存されておらず,Ca2+結合部位はT. tepidumに特有であった.このCa2+を介した相互作用は,T. tepidumに由来するコアアンテナタンパク質-反応中心複合体の高い耐熱性にかかわるものと考えられた.
T. tepidumに由来するコアアンテナタンパク質に結合しているバクテリオクロロフィルは915 nmに吸収波長があり,880 nmに吸収波長をもつほかの種のコアアンテナタンパク質よりも35 nmも長波長側にあった.EDTAを使用してCa2+を除去すると吸収波長は880 nmに変化し,ふたたびCa2+を添加すると吸収波長は915 nmにもどる7).αサブユニットのTrp46の側鎖は,コアアンテナタンパク質のαサブユニットに結合しているバクテリオクロロフィルのC3位のアセチル基と水素結合を形成していた.βサブユニットのLeu46のとなりの残基であるTrp45も,βサブユニットに結合しているバクテリオクロロフィルと同様の水素結合を形成していた.2つのバクテリオクロロフィルのあいだの距離はMg2+のあいだで測定して平均8.75Åであった.この値は,これまでに報告されている光合成細菌のアンテナタンパク質(コアアンテナタンパク質および周辺アンテナタンパク質)のなかでは最短であった.Ca2+によりバクテリオクロロフィルどうしの密な重なり合いが可能になり,吸収波長のシフトをもたらしていると考えられた.
5.バクテリオクロロフィル32量体の構造
コアアンテナタンパク質のリングでは,32個のバクテリオクロロフィルは16個のスピリロキサンチンとともに楕円状の分子集合体を形成していた(図2a).コアアンテナタンパク質のバクテリオクロロフィルは,反応中心のスペシャルペアのバクテリオクロロフィルと膜貫通ヘリックスに対し同じ高さに位置していた.また,α1,β1,α9,β9と結合しているバクテリオクロロフィルは,スペシャルペアのバクテリオクロロフィルと平行に位置していた.これらの平行なバクテリオクロロフィルは,分子集合体の楕円状リングの短軸からは約30度はずれていた.平行なバクテリオクロロフィルとスペシャルペアのバクテリオクロロフィルのあいだの距離は39.4~43.5Åであった.励起エネルギー移動には,色素のあいだの距離だけではなく,遷移モーメントどうしの角度も重要であり,これらの平行なバクテリオクロロフィルがコアアンテナタンパク質から反応中心への励起エネルギーの移動に重要な役割をはたしている可能性が指摘された.
6.ユビキノンの移動経路
光のエネルギーにより反応中心のスペシャルペアのバクテリオクロロフィルから飛び出した電子は,最終的に還元型ユビキノンとして化学エネルギーのかたちに変換され,コアアンテナタンパク質-反応中心複合体の外へと運び出される.T. tepidumに由来するコアアンテナタンパク質-反応中心複合体の構造からは,完全に閉じたコアアンテナタンパク質のリングにおけるユビキノンの移動の機構も考察することができた(図2b).コアアンテナタンパク質のリングの隣接したαβヘテロ二量体のおのおののあいだには,ユビキノンの通り抜ける経路となりうるすきまがひとつずつ存在することが観察された.この16個のすきまは膜貫通ヘリックスの細胞質側に位置していた.周辺アンテナタンパク質のこの部分に対応する位置にはバクテリオクロロフィルが結合している.このすきまの位置は,反応中心のユビキノン結合部位と膜貫通ヘリックスに対する高さが同じであった.ユビキノン結合部位ともっとも近いすきまは約30Åの距離に位置していた.このすきまの大きさはユビキノンのベンゾキノン基とほぼ同じであった.すきまのもっとも狭い部分はバクテリオクロロフィル,スピリロキサンチン,αサブユニットの疎水性の残基の側鎖により形成されていて,柔軟性が高く非常に疎水的であった.コアアンテナタンパク質の膜貫通ヘリックスどうしの間隔について調べると,もっとも広いところと狭いところとでは2Åの差のあることが判明した.このことは,膜貫通ヘリックスがゆらぎやすい性質をもち,コアアンテナタンパク質の全体が呼吸をするような運動をすることを示唆していた.コアアンテナタンパク質のリングにおいてはペリプラズム側に比べ細胞質側にはサブユニット間の相互作用があまりみられなかった.このため,ユビキノンの通り抜ける経路のある膜貫通ヘリックスの細胞質側がより柔軟になっていた.このようなコアアンテナタンパク質の動きがユビキノンの移動に重要であることは,以前に報告されている分光学による研究や分子動力学による研究の結果からも予想されていた8-10).
おわりに
コアアンテナタンパク質-反応中心複合体において,アンテナで吸収された光エネルギーを高い効率で反応中心に伝達するしくみは理論的には未解明のままである.今後,今回の構造解析により得られた分子構造をもとにして,光合成のエネルギー伝達に関する理論的な解明が期待される.
文 献
- Deisenhofer, J., Epp, O., Miki, K. et al.: Structure of the protein subunits in the photosynthetic reaction centre of Rhodopseudomonas viridis at 3Å resolution. Nature, 318, 618-624 (1985)[PubMed]
- Roszak, A. W., Howard, T. D., Southall, J. et al.: Crystal structure of the RC-LH1 core complex from Rhodopseudomonas palustris. Science, 302, 1969-1972 (2003)[PubMed]
- Nogi, T., Fathir, I., Kobayashi, M. et al.: Crystal structures of photosynthetic reaction center and high-potential iron-sulfur protein from Thermochromatium tepidum: thermostability and electron transfer. Proc. Natl. Acad. Sci. USA, 97, 13561-13566 (2000)[PubMed]
- McDermott, G., Prince, S. M., Freer, A. A. et al.: Crystal structure of an integral membrane light-harvesting complex from photosynthetic bacteria. Nature, 374, 517-521 (1995)
- Koepke, J., Hu, X., Muenke, C. et al.: The crystal structure of the light-harvesting complex II (B800-850) from Rhodospirillum molischianum. Structure, 4, 581-597 (1996)[PubMed]
- McLuskey, K., Prince, S. M., Cogdell, R. J. et al.: The crystallographic structure of the B800-820 LH3 light-harvesting complex from the purple bacteria Rhodopseudomonas acidophila strain 7050. Biochemistry, 40, 8783-8789 (2001)[PubMed]
- Kimura, Y., Hirano, Y., Yu, L. J. et al.: Calcium ions are involved in the unusual red shift of the light-harvesting 1 Qy transition of the core complex in thermophilic purple sulfur bacterium Thermochromatium tepidum. J. Biol. Chem., 283, 13867-13873 (2008)[PubMed]
- Comayras, R., Jungas, C. & Lavergne, J.: Functional consequences of the organization of the photosynthetic apparatus in Rhodobacter sphaeroides: II. A study of PufX- membranes. J. Biol. Chem., 280, 11214-11223 (2005)[PubMed]
- Mascle-Allemand, C., Lavergne, J., Bernadac, A. et al.: Organisation and function of the Phaeospirillum molischianum photosynthetic apparatus. Biochim. Biophys. Acta, 1777, 1552-1559 (2008)[PubMed]
- Aird, A., Wrachtrup, J., Schulten, K. et al.: Possible pathway for ubiquinone shuttling in Rhodospirillum rubrum revealed by molecular dynamics simulation. Biophys. J., 92, 23-33 (2007)[PubMed]
著者プロフィール
略歴:2000年 名古屋大学大学院理学研究科博士後期課程 単位取得退学,2005年 名古屋大学大学院理学研究科にて博士号取得,同年 理化学研究所播磨研究所 連携研究員を経て,2006年より京都大学大学院理学研究科 講師.
研究テーマ:生物物理学,タンパク質結晶学.
関心事:明日の天気.
三木 邦夫(Kunio Miki)
京都大学大学院理学研究科 教授.
研究室URL:http://kuchem.kyoto-u.ac.jp/kozo/miki_lab.html
© 2014 竹田一旗・三木邦夫 Licensed under CC 表示 2.1 日本