メチオニンの代謝はヒトのES細胞およびiPS細胞の未分化な状態の維持および分化を制御している
白木伸明・粂 昭苑
(熊本大学発生医学研究所 多能性幹細胞分野)
email:粂 昭苑
DOI: 10.7875/first.author.2014.053
Methionine metabolism regulates maintenance and differentiation of human pluripotent stem cells.
Nobuaki Shiraki, Yasuko Shiraki, Tomonori Tsuyama, Fumiaki Obata, Masayuki Miura, Genta Nagae, Hiroyuki Aburatani, Kazuhiko Kume, Fumio Endo, Shoen Kume
Cell Metabolism, 19, 780-794 (2014)
マウスのES細胞およびiPS細胞においてはスレオニンの代謝がさかんであり,スレオニンを除去した培地では生育できないことがわかっていたが,ヒトのES細胞およびiPS細胞におけるアミノ酸の代謝に関しては報告がなかった.筆者らは,遺伝子発現の解析および代謝産物の定量により,ヒトのES細胞およびiPS細胞においてはメチオニンの代謝が非常にさかんであることを見い出した.ヒトのES細胞およびiPS細胞をメチオニン除去培地で5時間培養すると,メチオニンの代謝産物であり生体におけるさまざまなメチル化反応において利用されているS-アデノシルメチオニンの濃度が顕著に低下し,p53シグナルの活性化,NANOGの発現の低下がひき起こされた.未分化な状態を維持する過程においてメチオニン除去培地で短時間培養することにより,細胞の増殖は抑制され,のちの三胚葉への分化は促進された.さらに,未分化な細胞と比べ分化した内胚葉細胞はメチオニンの要求性が低いという性質を利用して,分化を誘導する過程においてメチオニン除去培地を用いることにより未分化な細胞を選択的に除去することに成功した.この研究では,これまで不明であったヒトのES細胞およびiPS細胞における未分化な状態の維持および分化の機構におけるメチオニン代謝の重要性を明らかにし,S-アデノシルメチオニンがその制御にはたらくことをはじめて報告した.
これまで,筆者らの研究室では,ES細胞(embryonic stem cell,胚性幹細胞)およびiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)を用いて内胚葉の発生および分化の機構を解明してきた.その過程で,細胞外マトリックスや低分子化合物を利用して細胞外の環境を変化させることにより,ES細胞およびiPS細胞から肝臓1),膵臓2,3),小腸細胞4) への選択的な分化を誘導することにも成功した.ES細胞およびiPS細胞といった多能性をもつ幹細胞は,分化した細胞とは異なる代謝プログラムを保持していることがわかっており,その代謝プログラムが幹細胞における未分化な状態の維持や自己複製能などに関与することが明らかになってきている5-7).ES細胞およびiPS細胞におけるアミノ酸代謝については,マウスのES細胞の生存にはスレオニンが必須であることが明らかにされており,未分化なES細胞ではスレオニンからグリシンおよびアセチルCoAを合成する際の律速酵素であるスレオニン脱水素酵素が高く発現していることがわかっていた8).また,マウスのES細胞およびiPS細胞においては,スレオニンから複数のステップをへて合成されるS-アデノシルメチオニンがエピゲノムの状態を維持するために重要であることも報告されていた9).しかし,ヒトのES細胞およびiPS細胞においてはこのスレオニン脱水素酵素は発現していないことがわかっており,ヒトのES細胞およびiPS細胞におけるアミノ酸代謝の役割は不明であった.この研究では,ヒトのES細胞およびiPS細胞は未分化な状態では高いメチオニン要求性を示し,このメチオニン要求性は分化にともない減少することを見い出した.
未分化なヒトのES細胞およびiPS細胞におけるアミノ酸の要求性について,2つのヒトES細胞株および2つのヒトiPS細胞株を用いて検討した.9種類の必須アミノ酸をそれぞれ1つずつ除去した未分化維持培地を調製し,それぞれの培地で48時間培養したのち細胞数を評価した.ロイシン,リジン,トリプトファン,メチオニンの除去により細胞数の減少が確認でき,なかでも,メチオニンの除去による減少がもっとも大きく,完全培地で培養した場合の5%以下にまで細胞数は顕著に減少した.さらに,メチオニンの要求性について評価したところ,未分化なヒトのES細胞およびiPS細胞の良好な生育には25μM以上のメチオニンが必要であることがわかった(完全培地は,約120μMのメチオニンを含む).つづいて,メチオニンを除去したのちの細胞死,細胞の増殖,細胞周期について継時的に評価した.その結果,未分化なヒトのES細胞およびiPS細胞はメチオニンの除去から5時間後には顕著な増殖の抑制を示し,24時間後にはG0期あるいはG1期において細胞周期が停止しアポトーシスの起こることがわかった.
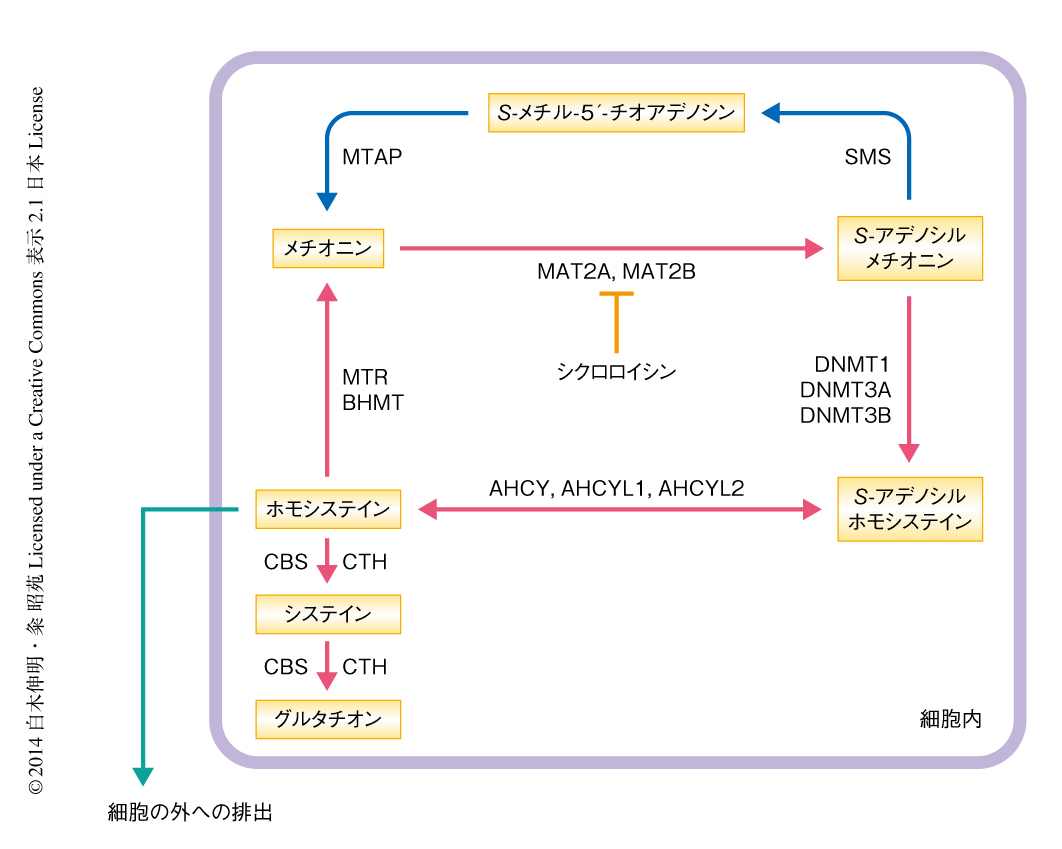
ヒトのES細胞およびiPS細胞の生存にはメチオニンが非常に重要であることがわかったことから,メチオニンの代謝の変化について遺伝子発現の解析および代謝産物の定量により評価した(図1).遺伝子発現はマイクロアレイ法により解析し,代謝産物については細胞内のメチオニン,S-アデノシルメチオニン,S-メチル-5’-チオアデノシン,S-アデノシルホモシステイン,および,培養液中のホモシステインをUPLC-MS/MS法により定量した.その結果,メチオニンの除去から5時間後にはDNMT3B遺伝子およびMAT2B遺伝子の顕著な発現の低下が確認され,細胞内のメチオニン,S-メチル-5’-チオアデノシン,S-アデノシルメチオニンの濃度が顕著に低下した.興味深いことに,完全培地での培養では確認できるホモシステインの細胞外への排出が,メチオニン除去培地での培養ではまったく起こらなくなった.さらに,S-アデノシルメチオニンからメチオニンへのサルベージ回路の中間代謝産物であるS-メチル-5’-チオアデノシンを添加することにより,メチオニンの除去により停止したホモシステインの細胞外への排出が完全に回復することも確認された.以上のことから,ヒトのES細胞およびiPS細胞はメチオニン除去培地での培養を開始すると,すみやかにメチオニン代謝回路が停止することが明らかになった.また,ヒトのES細胞およびiPS細胞においてメチオニンへのサルベージ回路がはたらいていることも確認された.
メチオニン代謝回路において,メチオニンあるいはその代謝産物であるS-アデノシルメチオニンのどちらがヒトのES細胞およびiPS細胞の生存により重要な役割をはたしているのかについて評価した.S-アデノシルメチオニンはメチオニンを除去したのちの細胞死を抑制したが,メチオニンへのサルベージ回路における律速酵素であるSMSをノックダウンした場合にもS-アデノシルメチオニンの添加により細胞死が抑制された.このことは,S-アデノシルメチオニンがサルベージ回路によりメチオニンとなってはたらいているのではなく,S-アデノシルメチオニンそれ自体が細胞死に関与していることを意味した.さらに,MAT2AおよびMAT2Bの阻害剤であるシクロロイシンはメチオニンの除去と同様にヒトのES細胞およびiPS細胞に細胞死を誘導したが,シクロロイシンの添加から5時間後の細胞内のS-アデノシルメチオニンの濃度は対照の半分にまで低下した一方,メチオニンの濃度は対照の2倍に増加することが確認された.この結果からも,細胞内におけるS-アデノシルメチオニンの低下が細胞死をひき起こすことが示唆された.以上の結果から,ヒトのES細胞およびiPS細胞の生存にはメチオニン代謝回路,とりわけ,細胞内のS-アデノシルメチオニンが重要な役割をはたしていることがわかった.
メチオニンを除去したのちにはメチオニンの代謝が停止しS-アデノシルメチオニンの濃度が低下したことから,ほかのシグナル分子の変化についても,マイクロアレイ解析,ウェスタンブロット解析,および,免疫細胞化学的な解析により評価した.その結果,メチオニンの除去から5時間後にはすでに細胞周期および細胞死に関連する多くの遺伝子の発現が上昇していることがわかった.細胞死に関与する重要なシグナル分子であるp53に関しては,mRNAの量に変化はなかったがタンパク質の量が顕著に増加し,その増加はS-アデノシルメチオニンの添加により阻害されることが確認された.さらに,このp53の発現の上昇は培地のメチオニン濃度が6μM以下の場合に起こり,ほかのアミノ酸の除去では起こらないことも確認された.メチオニンを除去したのちの細胞死にp53の関与することが示唆されたため,p53をノックダウンした細胞においてメチオニンを除去したところ細胞死が抑制された.以上の結果から,ヒトのES細胞およびiPS細胞をメチオニン除去培地で培養するとp53のタンパク質レベルの発現が上昇し,その結果として,細胞周期の停止および細胞死の起こることがわかった.
メチオニンを除去したのちに起こる細胞内のS-アデノシルメチオニンの低下がヒストンメチル化およびDNAメチル化にあたえる影響について検討した.マウスのES細胞においても,スレオニンの除去により結果的にS-アデノシルメチオニンの減少の起こることが報告されており,その際に,ヒストンH3の4番目のLysのトリメチル化の低下することがわかっていた.そこで,ヒストンH3における各種のメチル化への影響をウェスタンブロット法により評価したところ,メチオニンの除去あるいはシクロロイシンの処理から5時間後に,ヒストンH3の4番目のLysのトリメチル化の顕著に低下することが確認された.一方,ヒストンH3の9番目のLysのトリメチル化,27番目のLysのトリメチル化,36番目のLysのトリメチル化については,メチオニンの除去から24時間後においても変化は確認されなかった.このおのおののLysメチル化に対するメチオニン除去の効果の違いの原因については不明であり,さらなる検討が必要である.さらに,DNAメチル化に対する影響についてマイクロアレイ法を用いて網羅的に評価した.解析の結果,メチオニンの除去から5時間後には広い範囲でDNAメチル化の低下がみられたが,特定の遺伝子にかたよるものではなく,その低下の程度も遺伝子の発現に影響をあたえるほど強いものではなかった.
ヒトのES細胞およびiPS細胞はメチオニン除去培地で培養すると一時的に増殖の停止することがわかったので,その状態における未分化マーカーの発現について調べた.その結果,メチオニンの除去から5時間後にNANOGのmRNAレベルおよびタンパク質レベルでの発現の低下が確認された.ほかの未分化マーカーであるOct3/4については発現に変化はみられなかった.このNANOGの発現低下はS-アデノシルメチオニンの添加により抑制され,さらに,ほかのアミノ酸の除去では起こらないこともわかった.メチオニンの短時間の除去ののちの増殖の停止に関しては,のちに完全培地に置き換えることにより回復が可能であることがわかっていたため,この短時間のメチオニン除去ののちのNANOGの発現低下を分化の促進に利用できるのではないかと考えた.そこで,ヒトiPS細胞株を未分化な状態においてメチオニン除去培地で10時間培養したのち,内胚葉,中胚葉,外胚葉への分化培地にそれぞれ置換して分化の誘導効率を評価した.その結果,それぞれの胚葉への分化の効率は約3倍も上昇した.内胚葉への分化の促進効果については,ほかのヒトiPS細胞株およびヒトES細胞株においても確認した.以上のことから,ヒトのES細胞およびiPS細胞においては,メチオニンの代謝阻害によりヒストンH3の4番目のLysのトリメチル化の低下およびNANOGの発現の低下がひき起こされ,のちの胚葉への分化の起こりやすい状態へと移行していることがわかった.
未分化な細胞および分化した細胞におけるメチオニン代謝の違いについて,遺伝子発現の解析および代謝産物の定量により比較した.分化した細胞としては,ヒトES細胞株から分化を誘導した内胚葉を用いた.遺伝子発現の解析の結果,MAT遺伝子やDNMT遺伝子といったメチオニン代謝にかかわる酵素をコードする遺伝子の多くが未分化な細胞において高く発現していた.また,培地中のメチオニン濃度を経時的に定量した結果,未分化な細胞は分化した細胞に比べ単位時間あたり約5倍のメチオニンを消費していることもわかった.さらに,細胞外へのホモシステインの排出について評価した結果,分化した細胞では未分化な細胞の約半分であった.さきに述べたように,未分化な細胞はメチオニン除去培地で培養するとホモシステインの細胞外への排出が停止するが,分化した細胞ではホモシステインの排出量に変化はなかった.以上のことから,未分化な細胞は分化した細胞に比べメチオニン代謝が非常にさかんであり,その生育により多くのメチオニンが必要であることがわかった.
ヒトのES細胞およびiPS細胞は細胞株のあいだで分化能に差のあることがよく知られている10).そこで,すでに構築されている支持細胞を用いた分化の誘導系を用いて,細胞株のあいだの分化能の違いについて評価した.その結果,同じ培養条件で内胚葉へ分化させた場合に,ヒトES細胞株khES3およびヒトiPS細胞株253G1株は非常によく分化したものの,ヒトES細胞株khES1およびヒトiPS細胞株201B7株は10日間にわたり分化を誘導しても未分化な細胞の残存することがわかった.未分化な細胞と分化した内胚葉細胞にはメチオニンの要求性に違いのあることがわかっていたため,分化の途中からメチオニン除去培地で培養することにより未分化な細胞のみを選択的に除去できるのではないかと考えた.ヒトES細胞株khES1およびヒトiPS細胞株201B7株を用いて培養8日目から10日目までの2日間にわたりメチオニン除去培地で培養した結果,内胚葉に影響をあたえることなく未分化な細胞に対し選択的に細胞死が誘導され,相対的に内胚葉への分化の効率が上昇することがわかった.ヒトiPS細胞株201B7株について,のちに肝臓への分化を誘導したところ,最終的なアルブミンの発現量および分泌量が約3倍にも増加することがわかった.このことから,分化の過程においてメチオニン除去培地で培養することにより残存する未分化な細胞を除去することが可能であり,分化の効率の悪い細胞株を利用する場合は非常に有効な手段となりうることがわかった.
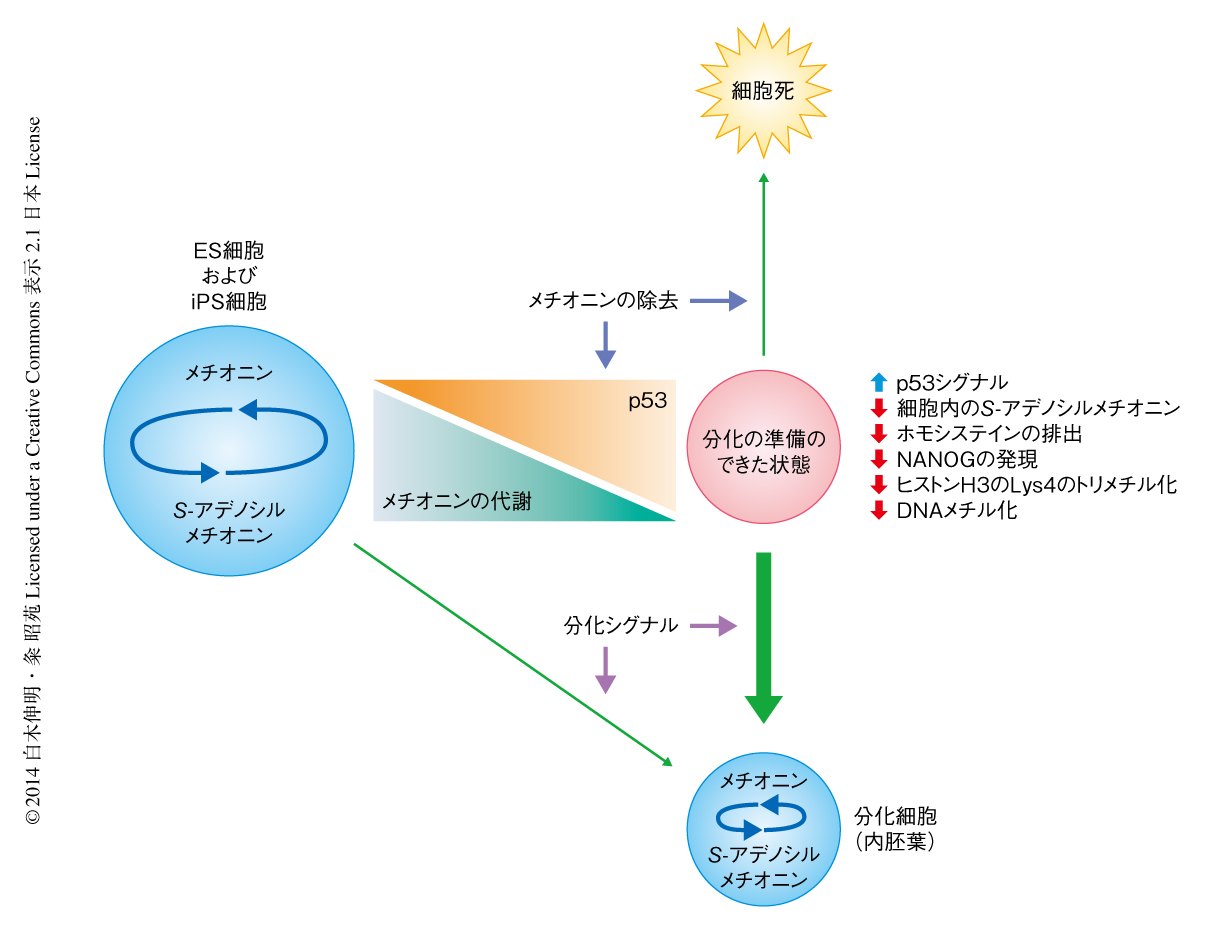
今回の研究において,ヒトのES細胞およびiPS細胞の生存にはメチオニンが必須であり,その代謝産物であるS-アデノシルメチオニンを介してヒトのES細胞およびiPS細胞の未分化な状態の維持および分化が制御されていることを見い出した(図2).マウスの場合はS-アデノシルメチオニンの供給源としてスレオニンが積極的に利用されているが,ヒトの場合はメチオニンがおもに利用されていることが明らかになった.さらに,ヒトのES細胞およびiPS細胞のもつメチオニン代謝の特性を分化の誘導に応用した結果,未分化な状態においてメチオニンを除去したのち,内胚葉,中胚葉,外胚葉へとそれぞれ分化を誘導すると,顕著な分化の促進効果がみられることを確認した.さらに,内胚葉への分化の誘導の過程においてメチオニン除去培地で培養することにより,残存する未分化な細胞に対し特異的に細胞死を誘導することができ,のちに肝臓へと効率的に分化させることに成功した.未分化な過程におけるメチオニン除去培地の処理によるおのおのの胚葉への分化の促進は,各種の細胞を作製する期間の短縮および分化の効率化につながり,ヒトのES細胞およびiPS細胞を利用した創薬研究および再生医療に寄与できる.また,残存した未分化な細胞を除去することは,効率的な分化の誘導への利用のみならず,移植医療において,残存した未分化な幹細胞に由来するテラトーマの発生するリスクの低減に大きく寄与することが期待できる.今後は,ヒトのES細胞およびiPS細胞におけるメチオニン代謝と遺伝子の発現制御との関係性の解明が課題である.
略歴:2006年 熊本大学大学院医学研究科博士課程 修了,2009年より熊本大学発生医学研究所 助教.
研究テーマ:内胚葉の発生および分化.
粂 昭苑(Shoen Kume)
熊本大学発生医学研究所 教授.
研究室URL:http://www.imeg.kumamoto-u.ac.jp/divisions/stem_cell_biology/
© 2014 白木伸明・粂 昭苑 Licensed under CC 表示 2.1 日本
(熊本大学発生医学研究所 多能性幹細胞分野)
email:粂 昭苑
DOI: 10.7875/first.author.2014.053
Methionine metabolism regulates maintenance and differentiation of human pluripotent stem cells.
Nobuaki Shiraki, Yasuko Shiraki, Tomonori Tsuyama, Fumiaki Obata, Masayuki Miura, Genta Nagae, Hiroyuki Aburatani, Kazuhiko Kume, Fumio Endo, Shoen Kume
Cell Metabolism, 19, 780-794 (2014)
この論文に出現する遺伝子・タンパク質のUniprot ID
p53(P04637), NANOG(Q9H9S0), スレオニン脱水素酵素(Q8IZJ6), DNMT3B(Q9UBC3), MAT2B(Q9NZL9), SMS(P52788), MAT2A(P31153), ヒストンH3, Oct3/4(Q9H9S0), MAT(MAT2), DNMT
要 約
マウスのES細胞およびiPS細胞においてはスレオニンの代謝がさかんであり,スレオニンを除去した培地では生育できないことがわかっていたが,ヒトのES細胞およびiPS細胞におけるアミノ酸の代謝に関しては報告がなかった.筆者らは,遺伝子発現の解析および代謝産物の定量により,ヒトのES細胞およびiPS細胞においてはメチオニンの代謝が非常にさかんであることを見い出した.ヒトのES細胞およびiPS細胞をメチオニン除去培地で5時間培養すると,メチオニンの代謝産物であり生体におけるさまざまなメチル化反応において利用されているS-アデノシルメチオニンの濃度が顕著に低下し,p53シグナルの活性化,NANOGの発現の低下がひき起こされた.未分化な状態を維持する過程においてメチオニン除去培地で短時間培養することにより,細胞の増殖は抑制され,のちの三胚葉への分化は促進された.さらに,未分化な細胞と比べ分化した内胚葉細胞はメチオニンの要求性が低いという性質を利用して,分化を誘導する過程においてメチオニン除去培地を用いることにより未分化な細胞を選択的に除去することに成功した.この研究では,これまで不明であったヒトのES細胞およびiPS細胞における未分化な状態の維持および分化の機構におけるメチオニン代謝の重要性を明らかにし,S-アデノシルメチオニンがその制御にはたらくことをはじめて報告した.
はじめに
これまで,筆者らの研究室では,ES細胞(embryonic stem cell,胚性幹細胞)およびiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)を用いて内胚葉の発生および分化の機構を解明してきた.その過程で,細胞外マトリックスや低分子化合物を利用して細胞外の環境を変化させることにより,ES細胞およびiPS細胞から肝臓1),膵臓2,3),小腸細胞4) への選択的な分化を誘導することにも成功した.ES細胞およびiPS細胞といった多能性をもつ幹細胞は,分化した細胞とは異なる代謝プログラムを保持していることがわかっており,その代謝プログラムが幹細胞における未分化な状態の維持や自己複製能などに関与することが明らかになってきている5-7).ES細胞およびiPS細胞におけるアミノ酸代謝については,マウスのES細胞の生存にはスレオニンが必須であることが明らかにされており,未分化なES細胞ではスレオニンからグリシンおよびアセチルCoAを合成する際の律速酵素であるスレオニン脱水素酵素が高く発現していることがわかっていた8).また,マウスのES細胞およびiPS細胞においては,スレオニンから複数のステップをへて合成されるS-アデノシルメチオニンがエピゲノムの状態を維持するために重要であることも報告されていた9).しかし,ヒトのES細胞およびiPS細胞においてはこのスレオニン脱水素酵素は発現していないことがわかっており,ヒトのES細胞およびiPS細胞におけるアミノ酸代謝の役割は不明であった.この研究では,ヒトのES細胞およびiPS細胞は未分化な状態では高いメチオニン要求性を示し,このメチオニン要求性は分化にともない減少することを見い出した.
1.メチオニンの除去によりヒトのES細胞およびiPS細胞は細胞周期が停止し細胞死が起こる
未分化なヒトのES細胞およびiPS細胞におけるアミノ酸の要求性について,2つのヒトES細胞株および2つのヒトiPS細胞株を用いて検討した.9種類の必須アミノ酸をそれぞれ1つずつ除去した未分化維持培地を調製し,それぞれの培地で48時間培養したのち細胞数を評価した.ロイシン,リジン,トリプトファン,メチオニンの除去により細胞数の減少が確認でき,なかでも,メチオニンの除去による減少がもっとも大きく,完全培地で培養した場合の5%以下にまで細胞数は顕著に減少した.さらに,メチオニンの要求性について評価したところ,未分化なヒトのES細胞およびiPS細胞の良好な生育には25μM以上のメチオニンが必要であることがわかった(完全培地は,約120μMのメチオニンを含む).つづいて,メチオニンを除去したのちの細胞死,細胞の増殖,細胞周期について継時的に評価した.その結果,未分化なヒトのES細胞およびiPS細胞はメチオニンの除去から5時間後には顕著な増殖の抑制を示し,24時間後にはG0期あるいはG1期において細胞周期が停止しアポトーシスの起こることがわかった.
2.S-アデノシルメチオニンはヒトのES細胞およびiPS細胞の生存において重要である
ヒトのES細胞およびiPS細胞の生存にはメチオニンが非常に重要であることがわかったことから,メチオニンの代謝の変化について遺伝子発現の解析および代謝産物の定量により評価した(図1).遺伝子発現はマイクロアレイ法により解析し,代謝産物については細胞内のメチオニン,S-アデノシルメチオニン,S-メチル-5’-チオアデノシン,S-アデノシルホモシステイン,および,培養液中のホモシステインをUPLC-MS/MS法により定量した.その結果,メチオニンの除去から5時間後にはDNMT3B遺伝子およびMAT2B遺伝子の顕著な発現の低下が確認され,細胞内のメチオニン,S-メチル-5’-チオアデノシン,S-アデノシルメチオニンの濃度が顕著に低下した.興味深いことに,完全培地での培養では確認できるホモシステインの細胞外への排出が,メチオニン除去培地での培養ではまったく起こらなくなった.さらに,S-アデノシルメチオニンからメチオニンへのサルベージ回路の中間代謝産物であるS-メチル-5’-チオアデノシンを添加することにより,メチオニンの除去により停止したホモシステインの細胞外への排出が完全に回復することも確認された.以上のことから,ヒトのES細胞およびiPS細胞はメチオニン除去培地での培養を開始すると,すみやかにメチオニン代謝回路が停止することが明らかになった.また,ヒトのES細胞およびiPS細胞においてメチオニンへのサルベージ回路がはたらいていることも確認された.
メチオニン代謝回路において,メチオニンあるいはその代謝産物であるS-アデノシルメチオニンのどちらがヒトのES細胞およびiPS細胞の生存により重要な役割をはたしているのかについて評価した.S-アデノシルメチオニンはメチオニンを除去したのちの細胞死を抑制したが,メチオニンへのサルベージ回路における律速酵素であるSMSをノックダウンした場合にもS-アデノシルメチオニンの添加により細胞死が抑制された.このことは,S-アデノシルメチオニンがサルベージ回路によりメチオニンとなってはたらいているのではなく,S-アデノシルメチオニンそれ自体が細胞死に関与していることを意味した.さらに,MAT2AおよびMAT2Bの阻害剤であるシクロロイシンはメチオニンの除去と同様にヒトのES細胞およびiPS細胞に細胞死を誘導したが,シクロロイシンの添加から5時間後の細胞内のS-アデノシルメチオニンの濃度は対照の半分にまで低下した一方,メチオニンの濃度は対照の2倍に増加することが確認された.この結果からも,細胞内におけるS-アデノシルメチオニンの低下が細胞死をひき起こすことが示唆された.以上の結果から,ヒトのES細胞およびiPS細胞の生存にはメチオニン代謝回路,とりわけ,細胞内のS-アデノシルメチオニンが重要な役割をはたしていることがわかった.
3.メチオニンの除去によりp53シグナルが活性化される
メチオニンを除去したのちにはメチオニンの代謝が停止しS-アデノシルメチオニンの濃度が低下したことから,ほかのシグナル分子の変化についても,マイクロアレイ解析,ウェスタンブロット解析,および,免疫細胞化学的な解析により評価した.その結果,メチオニンの除去から5時間後にはすでに細胞周期および細胞死に関連する多くの遺伝子の発現が上昇していることがわかった.細胞死に関与する重要なシグナル分子であるp53に関しては,mRNAの量に変化はなかったがタンパク質の量が顕著に増加し,その増加はS-アデノシルメチオニンの添加により阻害されることが確認された.さらに,このp53の発現の上昇は培地のメチオニン濃度が6μM以下の場合に起こり,ほかのアミノ酸の除去では起こらないことも確認された.メチオニンを除去したのちの細胞死にp53の関与することが示唆されたため,p53をノックダウンした細胞においてメチオニンを除去したところ細胞死が抑制された.以上の結果から,ヒトのES細胞およびiPS細胞をメチオニン除去培地で培養するとp53のタンパク質レベルの発現が上昇し,その結果として,細胞周期の停止および細胞死の起こることがわかった.
4.未分化な状態におけるメチオニンの除去によりのちの分化は促進される
メチオニンを除去したのちに起こる細胞内のS-アデノシルメチオニンの低下がヒストンメチル化およびDNAメチル化にあたえる影響について検討した.マウスのES細胞においても,スレオニンの除去により結果的にS-アデノシルメチオニンの減少の起こることが報告されており,その際に,ヒストンH3の4番目のLysのトリメチル化の低下することがわかっていた.そこで,ヒストンH3における各種のメチル化への影響をウェスタンブロット法により評価したところ,メチオニンの除去あるいはシクロロイシンの処理から5時間後に,ヒストンH3の4番目のLysのトリメチル化の顕著に低下することが確認された.一方,ヒストンH3の9番目のLysのトリメチル化,27番目のLysのトリメチル化,36番目のLysのトリメチル化については,メチオニンの除去から24時間後においても変化は確認されなかった.このおのおののLysメチル化に対するメチオニン除去の効果の違いの原因については不明であり,さらなる検討が必要である.さらに,DNAメチル化に対する影響についてマイクロアレイ法を用いて網羅的に評価した.解析の結果,メチオニンの除去から5時間後には広い範囲でDNAメチル化の低下がみられたが,特定の遺伝子にかたよるものではなく,その低下の程度も遺伝子の発現に影響をあたえるほど強いものではなかった.
ヒトのES細胞およびiPS細胞はメチオニン除去培地で培養すると一時的に増殖の停止することがわかったので,その状態における未分化マーカーの発現について調べた.その結果,メチオニンの除去から5時間後にNANOGのmRNAレベルおよびタンパク質レベルでの発現の低下が確認された.ほかの未分化マーカーであるOct3/4については発現に変化はみられなかった.このNANOGの発現低下はS-アデノシルメチオニンの添加により抑制され,さらに,ほかのアミノ酸の除去では起こらないこともわかった.メチオニンの短時間の除去ののちの増殖の停止に関しては,のちに完全培地に置き換えることにより回復が可能であることがわかっていたため,この短時間のメチオニン除去ののちのNANOGの発現低下を分化の促進に利用できるのではないかと考えた.そこで,ヒトiPS細胞株を未分化な状態においてメチオニン除去培地で10時間培養したのち,内胚葉,中胚葉,外胚葉への分化培地にそれぞれ置換して分化の誘導効率を評価した.その結果,それぞれの胚葉への分化の効率は約3倍も上昇した.内胚葉への分化の促進効果については,ほかのヒトiPS細胞株およびヒトES細胞株においても確認した.以上のことから,ヒトのES細胞およびiPS細胞においては,メチオニンの代謝阻害によりヒストンH3の4番目のLysのトリメチル化の低下およびNANOGの発現の低下がひき起こされ,のちの胚葉への分化の起こりやすい状態へと移行していることがわかった.
5.分化の過程におけるメチオニンの除去により未分化な細胞において選択的に細胞死が誘導される
未分化な細胞および分化した細胞におけるメチオニン代謝の違いについて,遺伝子発現の解析および代謝産物の定量により比較した.分化した細胞としては,ヒトES細胞株から分化を誘導した内胚葉を用いた.遺伝子発現の解析の結果,MAT遺伝子やDNMT遺伝子といったメチオニン代謝にかかわる酵素をコードする遺伝子の多くが未分化な細胞において高く発現していた.また,培地中のメチオニン濃度を経時的に定量した結果,未分化な細胞は分化した細胞に比べ単位時間あたり約5倍のメチオニンを消費していることもわかった.さらに,細胞外へのホモシステインの排出について評価した結果,分化した細胞では未分化な細胞の約半分であった.さきに述べたように,未分化な細胞はメチオニン除去培地で培養するとホモシステインの細胞外への排出が停止するが,分化した細胞ではホモシステインの排出量に変化はなかった.以上のことから,未分化な細胞は分化した細胞に比べメチオニン代謝が非常にさかんであり,その生育により多くのメチオニンが必要であることがわかった.
ヒトのES細胞およびiPS細胞は細胞株のあいだで分化能に差のあることがよく知られている10).そこで,すでに構築されている支持細胞を用いた分化の誘導系を用いて,細胞株のあいだの分化能の違いについて評価した.その結果,同じ培養条件で内胚葉へ分化させた場合に,ヒトES細胞株khES3およびヒトiPS細胞株253G1株は非常によく分化したものの,ヒトES細胞株khES1およびヒトiPS細胞株201B7株は10日間にわたり分化を誘導しても未分化な細胞の残存することがわかった.未分化な細胞と分化した内胚葉細胞にはメチオニンの要求性に違いのあることがわかっていたため,分化の途中からメチオニン除去培地で培養することにより未分化な細胞のみを選択的に除去できるのではないかと考えた.ヒトES細胞株khES1およびヒトiPS細胞株201B7株を用いて培養8日目から10日目までの2日間にわたりメチオニン除去培地で培養した結果,内胚葉に影響をあたえることなく未分化な細胞に対し選択的に細胞死が誘導され,相対的に内胚葉への分化の効率が上昇することがわかった.ヒトiPS細胞株201B7株について,のちに肝臓への分化を誘導したところ,最終的なアルブミンの発現量および分泌量が約3倍にも増加することがわかった.このことから,分化の過程においてメチオニン除去培地で培養することにより残存する未分化な細胞を除去することが可能であり,分化の効率の悪い細胞株を利用する場合は非常に有効な手段となりうることがわかった.
おわりに
今回の研究において,ヒトのES細胞およびiPS細胞の生存にはメチオニンが必須であり,その代謝産物であるS-アデノシルメチオニンを介してヒトのES細胞およびiPS細胞の未分化な状態の維持および分化が制御されていることを見い出した(図2).マウスの場合はS-アデノシルメチオニンの供給源としてスレオニンが積極的に利用されているが,ヒトの場合はメチオニンがおもに利用されていることが明らかになった.さらに,ヒトのES細胞およびiPS細胞のもつメチオニン代謝の特性を分化の誘導に応用した結果,未分化な状態においてメチオニンを除去したのち,内胚葉,中胚葉,外胚葉へとそれぞれ分化を誘導すると,顕著な分化の促進効果がみられることを確認した.さらに,内胚葉への分化の誘導の過程においてメチオニン除去培地で培養することにより,残存する未分化な細胞に対し特異的に細胞死を誘導することができ,のちに肝臓へと効率的に分化させることに成功した.未分化な過程におけるメチオニン除去培地の処理によるおのおのの胚葉への分化の促進は,各種の細胞を作製する期間の短縮および分化の効率化につながり,ヒトのES細胞およびiPS細胞を利用した創薬研究および再生医療に寄与できる.また,残存した未分化な細胞を除去することは,効率的な分化の誘導への利用のみならず,移植医療において,残存した未分化な幹細胞に由来するテラトーマの発生するリスクの低減に大きく寄与することが期待できる.今後は,ヒトのES細胞およびiPS細胞におけるメチオニン代謝と遺伝子の発現制御との関係性の解明が課題である.
文 献
- Shiraki, N., Umeda, K., Sakashita, N. et al.: Differentiation of mouse and human embryonic stem cells into hepatic lineages. Genes Cells, 13, 731-746 (2008)[PubMed]
- Shiraki, N., Yoshida, T., Araki, K. et al.: Guided differentiation of embryonic stem cells into Pdx1-expressing regional-specific definitive endoderm. Stem Cells, 26, 874-885 (2008)[PubMed]
- Sakano, D., Shiraki, N., Kikawa, K. et al.: VMAT2 identified as a regulator of late-stage β-cell differentiation. Nat. Chem. Biol., 10, 141-148 (2014)[PubMed] [新着論文レビュー]
- Ogaki, S., Shiraki, N., Kume, K. et al.: Wnt and Notch signals guide embryonic stem cell differentiation into the intestinal lineages. Stem Cells, 31, 1086-1096 (2013)[PubMed]
- Facucho-Oliveira, J. M. & St. John, J. C.: The relationship between pluripotency and mitochondrial DNA proliferation during early embryo development and embryonic stem cell differentiation. Stem Cell Rev., 5, 140-158 (2009)[PubMed]
- Wellen, K. E. & Thompson, C. B.: A two-way street: reciprocal regulation of metabolism and signalling. Nat. Rev. Mol. Cell Biol., 13, 270-276 (2012)[PubMed]
- Takubo, K., Nagamatsu, G., Kobayashi, C. I. et al.: Regulation of glycolysis by Pdk functions as a metabolic checkpoint for cell cycle quiescence in hematopoietic stem cells. Cell Stem Cell, 12, 49-61 (2013)[PubMed]
- Wang, J., Alexander, P., Wu, L. et al.: Dependence of mouse embryonic stem cells on threonine catabolism. Science, 325, 435-439 (2009)[PubMed]
- Shyh-Chang, N., Locasale, J. W., Lyssiotis, C. A. et al.: Influence of threonine metabolism on S-adenosylmethionine and histone methylation. Science, 339, 222-226 (2013)[PubMed]
- Osafune, K., Caron, L., Borowiak, M. et al.: Marked differences in differentiation propensity among human embryonic stem cell lines. Nat. Biotechnol., 26, 313-315 (2008)[PubMed]
著者プロフィール
略歴:2006年 熊本大学大学院医学研究科博士課程 修了,2009年より熊本大学発生医学研究所 助教.
研究テーマ:内胚葉の発生および分化.
粂 昭苑(Shoen Kume)
熊本大学発生医学研究所 教授.
研究室URL:http://www.imeg.kumamoto-u.ac.jp/divisions/stem_cell_biology/
© 2014 白木伸明・粂 昭苑 Licensed under CC 表示 2.1 日本