ホスホリパーゼD2に依存的なPPARγの活性化阻害にはサイクリックリゾホスファチジン酸が関与する
塚原 完
(信州大学医学部 統合生理学講座)
email:塚原 完
DOI: 10.7875/first.author.2010.015
Phospholipase D2-dependent inhibition of the nuclear hormone receptor PPARγ by cyclic phosphatidic acid.
Tamotsu Tsukahara, Ryoko Tsukahara, Yuko Fujiwara, Junming Yue, Yunhui Cheng, Huazhang Guo, Alyssa Bolen, Chunxiang Zhang, Louisa Balazs, Fabio Re, Guangwei Du, Michael A. Frohman, Daniel L. Baker, Abby L. Parrill, Ayako Uchiyama, Tetsuyuki Kobayashi, Kimiko Murakami-Murofushi, Gabor Tigyi
Molecular Cell, 39, 421-432 (2010)
サイクリックホスファチジン酸はリゾホスファチジン酸の環状アナログ体であり,ヒトから粘菌まで広く存在するリゾリン脂質のひとつである.しかし,その生合成経路および生理的な機能に関しては不明の部分が多かった.今回,筆者らは,ホスホリパーゼD2の活性化に依存して細胞内でサイクリックホスファチジン酸が産生され,核内受容体のひとつであるPPARγに対し強いアンタゴニスト活性を示すことを明らかにした.産生されたサイクリックホスファチジン酸は3T3-L1細胞やマクロファージにおける脂肪の蓄積を阻害するとともに,ラット頸動脈内皮モデルにおいて新生内膜の形成を抑制した.この研究は,PPARγが内在性のアゴニストだけでなく,アンタゴニストによっても制御されることをはじめて示したものである.リゾリン脂質は,近年,第2世代の生理活性脂質であると考えられるようになり,脂質メディエーターとして生体内で重要な生理作用を担うことが明らかになってきており,セカンドメッセンジャーとしてのサイクリックホスファチジン酸の生体内での役割はきわめて興味深い.
近年,リゾリン脂質のひとつであるリゾホスファチジン酸が,生体内での脂質メディエーターとして重要な役割をはたしていることが明らかにされてきた1).筆者らは,リゾホスファチジン酸の細胞内受容体のひとつであるペルオキシソーム増殖因子活性化受容体(peroxisome proliferator-activated receptor:PPAR)のうちPPARγに焦点をしぼり研究を続けてきた.核内受容体は,標的遺伝子のプロモーターに結合することでリガンド依存的に遺伝子発現を正負に調節する転写制御因子であり,ヒトではゲノム解読の結果から48種類の受容体が明らかにされている.これら核内受容体のうち,PPARγは脂質代謝物,ステロイドなどをリガンドとして下流遺伝子の転写を活性化する.ここでは,リゾホスファチジン酸とその環状アナログ体であるサイクリックホスファチジン酸を中心に,リゾリン脂質とPPARγの生理的な役割に関する最近の知見を概説する.
核内受容体は基本構造が共通している.転写活性領域としてAF-1とAF-2をもち,そのあいだにDNA結合ドメインが存在する.リガンド結合領域はAF-2に存在し,転写活性はリガンド依存的である.リガンド結合領域は細胞外からのシグナルを受容・調節する重要な領域である.PPARは核内受容体型転写因子であるレチノイン酸X受容体(RXR)とヘテロ2量体をつくり,標的遺伝子のプロモーター領域に存在するPPAR応答配列(PPAR response element:PPRE)に結合し,コリプレッサーの解離やコアクチベーターの結合を介して標的遺伝子の転写活性を調節している.すなわち,リガンドと結合することにより立体構造の変化および転写共役因子との結合を生じ,転写の活性化あるいは抑制を制御する受容体である.
PPARには3種類のサブタイプが存在する2).PPARαは心臓や肝臓など脂肪を消費する臓器に高発現しており,PPARβ/δは筋肉や脳に高発現している.PPARγは脂肪細胞など脂肪を蓄積する臓器に高発現していることが特徴である.さらに,PPARγには,転写開始点が違うために分子量の異なる2つのサブタイプ,PPARγ1とPPARγ2が存在しており,脂肪細胞にはPPARγ2が強く発現している3).これらのサブタイプはいずれも脂質代謝や糖代謝に関連する疾病に深くかかわっており,それらの創薬および治療に対する重要な標的である.
PPARサブタイプのなかでもっとも精力的に機能解析がなされてきたのがPPARγである.なぜなら,その選択的な合成リガンドであるチアゾリジンジオン誘導体がPPARγの活性化を介して小型脂肪細胞を増加させることにより,インスリン感受性を増強し血糖値を低下させることが明らかになったためである4).たとえば,チアゾリジンジオン誘導体のひとつであるピオグリタゾンやロシグリタゾンは,PPARγに強い親和性で結合し,脂質の貯蔵,輸送などにかかわる遺伝子の発現レベルを調節している.近年,ライフスタイルの変化とともにわが国での糖尿病患者は増加し,生活習慣病のひとつとして注目される疾患となっている.最近では,PPARγは糖尿病や高脂血症などの代謝異常症に関与するほか,がん細胞の増殖に関与することが報告されている.PPARγを介した疾病治療薬の開発はきわめて有望な研究分野である.
生体内には脂肪酸を1本しかもたないリン脂質が存在しており,これをリゾリン脂質とよぶ.通常は2本あるリン脂質の片方のアシル基が酵素反応により切断された脂肪酸で,多様な生理活性をもつことが報告されている1).そのなかでも,リゾホスファチジン酸はスフィンゴシン1-リン酸とならび,もっともよく研究されてきたリゾリン脂質である.ここで述べる研究の行われた米国Tennessee大学Tigyi研究室では,リゾリン脂質とPPARγとを介した循環器系疾患の研究を生化学的および分子生物学的な手法を取り入れて行っている.当時,Tigyi研究室を含め,ほかの研究グループにより,細胞表面の7回膜貫通型受容体の同定や解析は活発に行われていたが,一方で,細胞内受容体の存在は明らかにされていなかった.ところが,2003年に入り,リゾホスファチジン酸がPPARγの内在性アゴニストであることが報告されてから5),さまざまな脂質性リガンドの報告が増加した.Tigyiらは,酸化LDL低密度リポタンパク質に多様なリゾホスファチジン酸およびリゾホスファチジン酸アナログが存在することを明らかにし,これらがPPARγの活性化を介して動脈硬化症の前段階である新生内膜の形成に寄与することを報告した6).そののち,リゾホスファチジン酸のアルキル体アナログであるアルキルグリセロールリン酸がPPARγの高親和性アゴニストであることが発見され7),リゾリン脂質がPPARγのリガンドとして生体内で重要な役割をはたしていることがしだいに明らかになってきた.
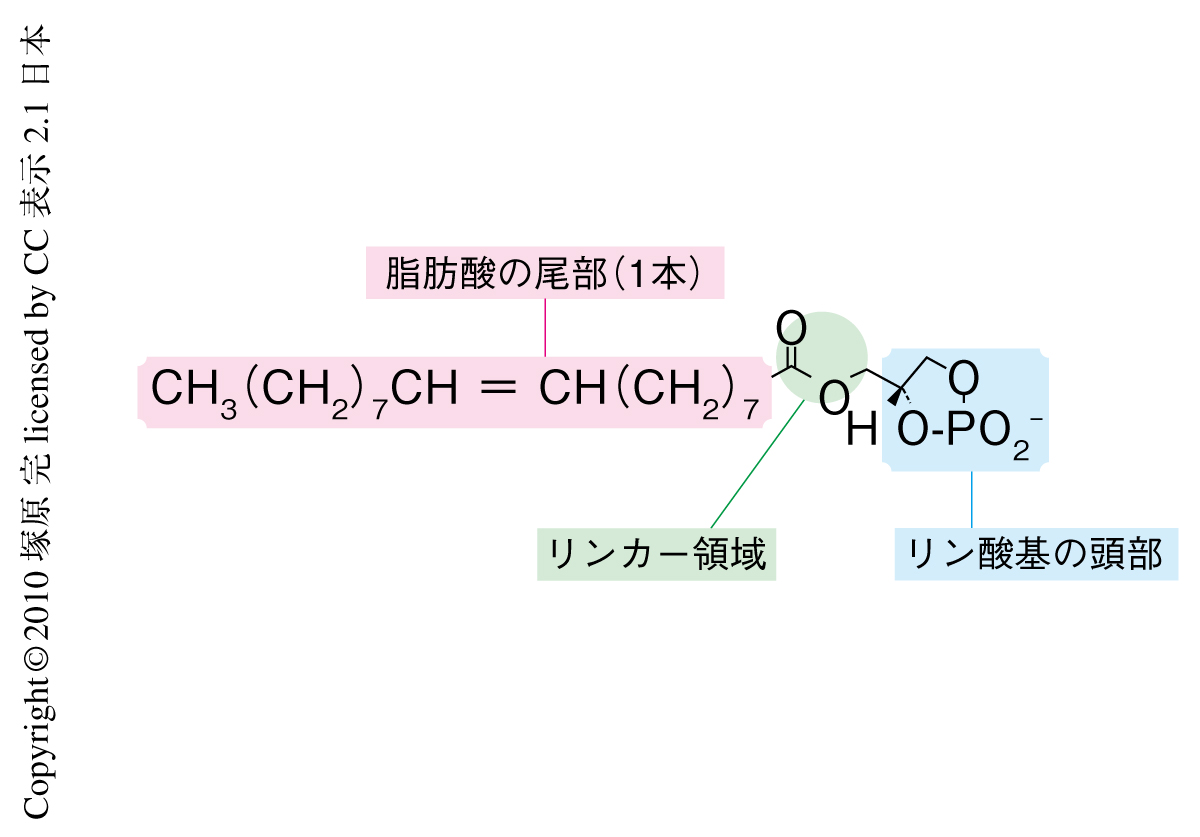
これらの網羅的な研究を進めていくうち,構造が類似していてもPPARγの活性化には関与しないリゾリン脂質の存在することも明らかになってきた.そのひとつがサイクリックホスファチジン酸である(図1).サイクリックホスファチジン酸はリゾホスファチジン酸の環状アナログ体であり,リゾホスファチジン酸とは逆の生理活性を示すという報告がされていた8).そこで,サイクリックホスファチジン酸の生理活性をくわしく解析することにした.手はじめに,PPARγのレポーター遺伝子アッセイを行ったところ,ロシグリタゾンによるPPARγの活性化がサイクリックホスファチジン酸依存的に阻害されることが観察された.さらに,ロシグリタゾンおよびアルキルグリセロールリン酸の放射性標識体を利用してPPARγのリガンド結合ドメインを用いたリガンド結合実験を行ったところ,サイクリックホスファチジン酸はロシグリタゾンおよびアルキルグリセロールリン酸を効果的に追い出すことが明らかになり,また,転写共役制御因子のひとつであるSMRTがサイクリックホスファチジン酸の濃度依存的に安定化され,ロシグリタゾンによる解離を拮抗阻害することも証明された.以上のことから,サイクリックホスファチジン酸はPPARγに対してアンタゴニスト活性をもつものと結論づけた.
つぎに,サイクリックホスファチジン酸が細胞内で合成されるしくみを明らかにしたいと考えた.サイクリックホスファチジン酸がStreptomyces chromofuscus由来のホスホリパーゼDによりつくられることが報告されていたことを参考に,動物細胞においてもホスホリパーゼDにより合成されているのではないかと考え,ホスホリパーゼD1およびホスホリパーゼD2の2つのアイソフォームが発現しているMDA-MB-231細胞を利用して32Pによる細胞標識実験を行った.標識された細胞から脂質を抽出し2次元薄層クロマトグラフィーにより分離したところ,ホルボールエステルによりホスホリパーゼDを活性化させた場合のみ,サイクリックホスファチジン酸の標準物質と同じ場所に放射性標識されたスポットが観察された.さらに,このスポットはホスホリパーゼDの阻害剤である1-ブタノールにより消失したがt-ブタノールでは消失しなかったことから,ホスホリパーゼD依存的に合成されたスポットであることが明らかになった.そこでつぎに,2つのアイソフォームのうち,どちらがサイクリックホスファチジン酸の合成に寄与しているのかを明らかにするため,酵素活性を阻害したホスホリパーゼD1およびホスホリパーゼD2をドキシサイクリン誘導下でCHO細胞に過剰に発現させ,ホルボールエステルによりホスホリパーゼDを活性化させた.その結果,野生型と比較して,ホスホリパーゼD2を過剰に発現させたCHO細胞ではサイクリックホスファチジン酸が約10倍も増加したが,ホスホリパーゼD1を過剰に発現させたCHO細胞では野生型と同程度であった.さらに,野生型ホスホリパーゼD2および酵素活性を阻害したホスホリパーゼD2の組換え体を作製しリゾホスファチジルコリンを基質として反応させたところ,野生型ホスホリパーゼD2のみでサイクリックホスファチジン酸の産生が確認された.以上から,ホスホリパーゼD2がサイクリックホスファチジン酸の産生に寄与する酵素であることが明らかになった.
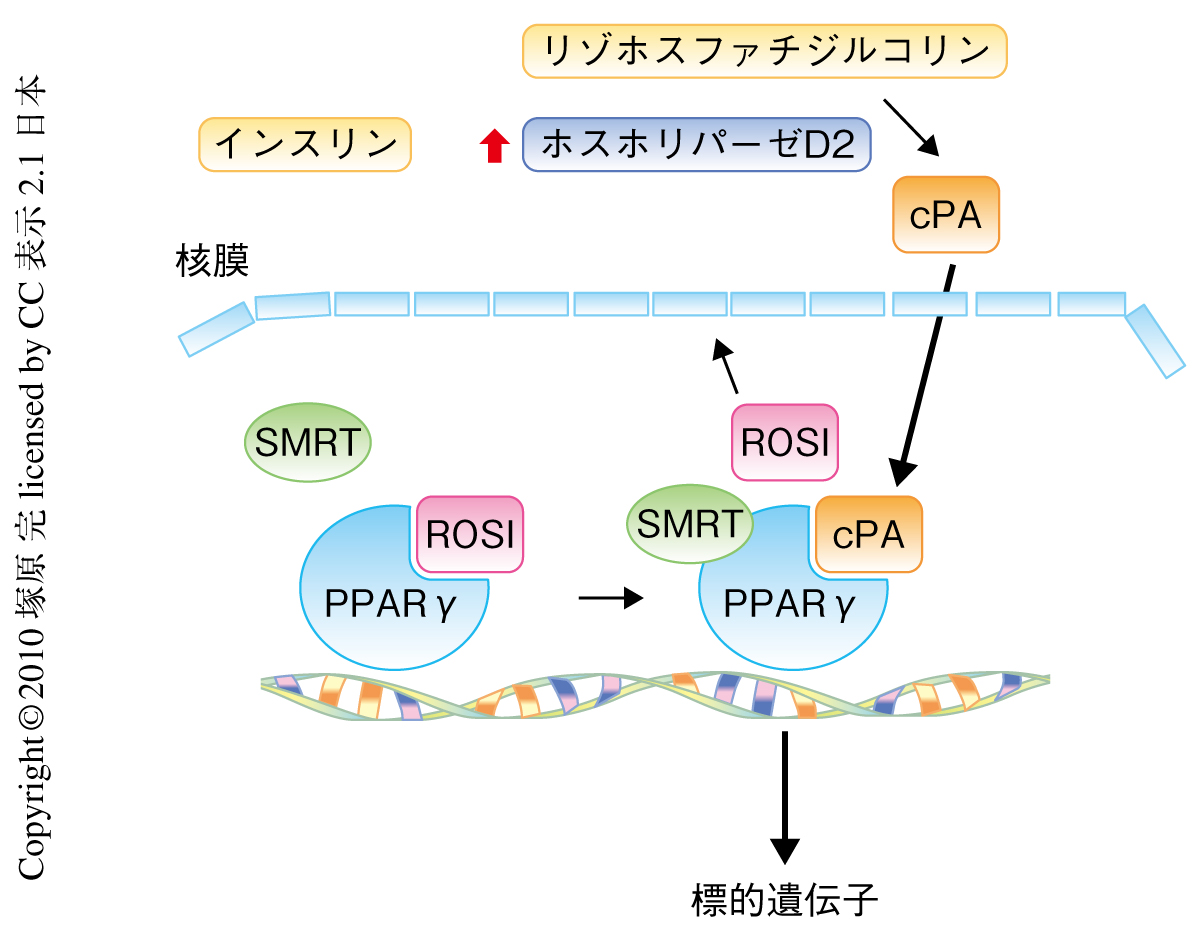
つづいて,in vivoにおけるサイクリックホスファチジン酸のしくみをさらに明らかにするため,ヒトより採取した末梢血単球細胞に,インスリン,ホルボールエステルさらに,リポ多糖を利用して刺激をくわえ,産生するサイクリックホスファチジン酸の濃度を液体クロマトグラフィー-質量分析器により測定した.その結果,無刺激の状態ではきわめて低い濃度のままであったが,刺激によりサイクリックホスファチジン酸の濃度は急激に上昇した.たとえば,100 nMのホルボールエステルで刺激した場合,無刺激のときと比較して,オレイルサイクリックホスファチジン酸およびパルミトイルサイクリックホスファチジン酸とも,産生は1000倍以上に劇的に増加した.さらに,100 nMのインスリンにて生理的な刺激をあたえた場合,オレイルサイクリックホスファチジン酸は約300倍増加したにもかかわらず,パルミトイルサイクリックホスファチジン酸は変化しなかった.さらに,この現象はホスホリパーゼDの阻害剤により抑制された.以上から,サイクリックホスファチジン酸の細胞内における合成はホスホリパーゼD2に依存しており,かつ,きわめて一過的な反応であることがわかった(図2).
サイクリックホスファチジン酸は,ホスホリパーゼD2によりインスリンなどの刺激に対して依存的に生合成されることが明らかになった.すなわち,サイクリックホスファチジン酸はセカンドメッセンジャーとしてのはたらきをもつことが予想された.Tigyiらは,アルキルグリセロールリン酸が新生内膜の形成をPPARγの活性化に依存的に促進させることを報告していた6).そこで,サイクリックホスファチジン酸が新生内膜の形成を抑制するのではないかと考え,ラット頸動脈内皮モデルを利用した実験を試みた.頸動脈内皮をロシグリタゾンまたはアルキルグリセロールリン酸で処理すると強い新生内膜の形成が認められたが,サイクリックホスファチジン酸で共処理することにより新生内膜の形成は顕著に抑制された.さらに,頸動脈内皮に対して低濃度のインスリン(3 nM)にて処理すると,アルキルグリセロールリン酸による新生内膜形成の促進が有意に抑制された.Breenらは,低濃度インスリン処理により新生内膜の形成が抑制されることを報告しており9),その分子機構にサイクリックホスファチジン酸が関与している可能も予想される.以上の結果から,インスリン刺激によるホスホリパーゼD2の活性化とそれにつづくサイクリックホスファチジン酸の合成によりPPARγの活性化が抑制されたことにより,新生内膜の形成も抑制されたものと考えられた.
脂質は最後に取り残されたもっとも困難でかつもっとも興味深い物質であるといわれている.今後も,その興味深い脂質の生理活性を最新の技術と古き良き伝統ある技術を駆使して明らかにしてきたい.
略歴:2002年 北海道大学大学院薬学研究科博士後期課程 修了(五十嵐靖之教授),同 研究員,2003年 米国Tennessee大学Health Science Centerポスドクフェロー(Dr. Gabor Tigyi)を経て,2008年より信州大学医学部 助教.
研究テーマ:リゾリン脂質と核内受容体.
抱負:リゾリン脂質の新規生理活性を明らかにしたい.
© 2010 塚原 完 Licensed under CC 表示 2.1 日本
(信州大学医学部 統合生理学講座)
email:塚原 完
DOI: 10.7875/first.author.2010.015
Phospholipase D2-dependent inhibition of the nuclear hormone receptor PPARγ by cyclic phosphatidic acid.
Tamotsu Tsukahara, Ryoko Tsukahara, Yuko Fujiwara, Junming Yue, Yunhui Cheng, Huazhang Guo, Alyssa Bolen, Chunxiang Zhang, Louisa Balazs, Fabio Re, Guangwei Du, Michael A. Frohman, Daniel L. Baker, Abby L. Parrill, Ayako Uchiyama, Tetsuyuki Kobayashi, Kimiko Murakami-Murofushi, Gabor Tigyi
Molecular Cell, 39, 421-432 (2010)
要 約
サイクリックホスファチジン酸はリゾホスファチジン酸の環状アナログ体であり,ヒトから粘菌まで広く存在するリゾリン脂質のひとつである.しかし,その生合成経路および生理的な機能に関しては不明の部分が多かった.今回,筆者らは,ホスホリパーゼD2の活性化に依存して細胞内でサイクリックホスファチジン酸が産生され,核内受容体のひとつであるPPARγに対し強いアンタゴニスト活性を示すことを明らかにした.産生されたサイクリックホスファチジン酸は3T3-L1細胞やマクロファージにおける脂肪の蓄積を阻害するとともに,ラット頸動脈内皮モデルにおいて新生内膜の形成を抑制した.この研究は,PPARγが内在性のアゴニストだけでなく,アンタゴニストによっても制御されることをはじめて示したものである.リゾリン脂質は,近年,第2世代の生理活性脂質であると考えられるようになり,脂質メディエーターとして生体内で重要な生理作用を担うことが明らかになってきており,セカンドメッセンジャーとしてのサイクリックホスファチジン酸の生体内での役割はきわめて興味深い.
はじめに
近年,リゾリン脂質のひとつであるリゾホスファチジン酸が,生体内での脂質メディエーターとして重要な役割をはたしていることが明らかにされてきた1).筆者らは,リゾホスファチジン酸の細胞内受容体のひとつであるペルオキシソーム増殖因子活性化受容体(peroxisome proliferator-activated receptor:PPAR)のうちPPARγに焦点をしぼり研究を続けてきた.核内受容体は,標的遺伝子のプロモーターに結合することでリガンド依存的に遺伝子発現を正負に調節する転写制御因子であり,ヒトではゲノム解読の結果から48種類の受容体が明らかにされている.これら核内受容体のうち,PPARγは脂質代謝物,ステロイドなどをリガンドとして下流遺伝子の転写を活性化する.ここでは,リゾホスファチジン酸とその環状アナログ体であるサイクリックホスファチジン酸を中心に,リゾリン脂質とPPARγの生理的な役割に関する最近の知見を概説する.
1.核内受容体の作用機構
核内受容体は基本構造が共通している.転写活性領域としてAF-1とAF-2をもち,そのあいだにDNA結合ドメインが存在する.リガンド結合領域はAF-2に存在し,転写活性はリガンド依存的である.リガンド結合領域は細胞外からのシグナルを受容・調節する重要な領域である.PPARは核内受容体型転写因子であるレチノイン酸X受容体(RXR)とヘテロ2量体をつくり,標的遺伝子のプロモーター領域に存在するPPAR応答配列(PPAR response element:PPRE)に結合し,コリプレッサーの解離やコアクチベーターの結合を介して標的遺伝子の転写活性を調節している.すなわち,リガンドと結合することにより立体構造の変化および転写共役因子との結合を生じ,転写の活性化あるいは抑制を制御する受容体である.
PPARには3種類のサブタイプが存在する2).PPARαは心臓や肝臓など脂肪を消費する臓器に高発現しており,PPARβ/δは筋肉や脳に高発現している.PPARγは脂肪細胞など脂肪を蓄積する臓器に高発現していることが特徴である.さらに,PPARγには,転写開始点が違うために分子量の異なる2つのサブタイプ,PPARγ1とPPARγ2が存在しており,脂肪細胞にはPPARγ2が強く発現している3).これらのサブタイプはいずれも脂質代謝や糖代謝に関連する疾病に深くかかわっており,それらの創薬および治療に対する重要な標的である.
PPARサブタイプのなかでもっとも精力的に機能解析がなされてきたのがPPARγである.なぜなら,その選択的な合成リガンドであるチアゾリジンジオン誘導体がPPARγの活性化を介して小型脂肪細胞を増加させることにより,インスリン感受性を増強し血糖値を低下させることが明らかになったためである4).たとえば,チアゾリジンジオン誘導体のひとつであるピオグリタゾンやロシグリタゾンは,PPARγに強い親和性で結合し,脂質の貯蔵,輸送などにかかわる遺伝子の発現レベルを調節している.近年,ライフスタイルの変化とともにわが国での糖尿病患者は増加し,生活習慣病のひとつとして注目される疾患となっている.最近では,PPARγは糖尿病や高脂血症などの代謝異常症に関与するほか,がん細胞の増殖に関与することが報告されている.PPARγを介した疾病治療薬の開発はきわめて有望な研究分野である.
2.サイクリックホスファチジン酸はPPARγのアンタゴニストである
生体内には脂肪酸を1本しかもたないリン脂質が存在しており,これをリゾリン脂質とよぶ.通常は2本あるリン脂質の片方のアシル基が酵素反応により切断された脂肪酸で,多様な生理活性をもつことが報告されている1).そのなかでも,リゾホスファチジン酸はスフィンゴシン1-リン酸とならび,もっともよく研究されてきたリゾリン脂質である.ここで述べる研究の行われた米国Tennessee大学Tigyi研究室では,リゾリン脂質とPPARγとを介した循環器系疾患の研究を生化学的および分子生物学的な手法を取り入れて行っている.当時,Tigyi研究室を含め,ほかの研究グループにより,細胞表面の7回膜貫通型受容体の同定や解析は活発に行われていたが,一方で,細胞内受容体の存在は明らかにされていなかった.ところが,2003年に入り,リゾホスファチジン酸がPPARγの内在性アゴニストであることが報告されてから5),さまざまな脂質性リガンドの報告が増加した.Tigyiらは,酸化LDL低密度リポタンパク質に多様なリゾホスファチジン酸およびリゾホスファチジン酸アナログが存在することを明らかにし,これらがPPARγの活性化を介して動脈硬化症の前段階である新生内膜の形成に寄与することを報告した6).そののち,リゾホスファチジン酸のアルキル体アナログであるアルキルグリセロールリン酸がPPARγの高親和性アゴニストであることが発見され7),リゾリン脂質がPPARγのリガンドとして生体内で重要な役割をはたしていることがしだいに明らかになってきた.
これらの網羅的な研究を進めていくうち,構造が類似していてもPPARγの活性化には関与しないリゾリン脂質の存在することも明らかになってきた.そのひとつがサイクリックホスファチジン酸である(図1).サイクリックホスファチジン酸はリゾホスファチジン酸の環状アナログ体であり,リゾホスファチジン酸とは逆の生理活性を示すという報告がされていた8).そこで,サイクリックホスファチジン酸の生理活性をくわしく解析することにした.手はじめに,PPARγのレポーター遺伝子アッセイを行ったところ,ロシグリタゾンによるPPARγの活性化がサイクリックホスファチジン酸依存的に阻害されることが観察された.さらに,ロシグリタゾンおよびアルキルグリセロールリン酸の放射性標識体を利用してPPARγのリガンド結合ドメインを用いたリガンド結合実験を行ったところ,サイクリックホスファチジン酸はロシグリタゾンおよびアルキルグリセロールリン酸を効果的に追い出すことが明らかになり,また,転写共役制御因子のひとつであるSMRTがサイクリックホスファチジン酸の濃度依存的に安定化され,ロシグリタゾンによる解離を拮抗阻害することも証明された.以上のことから,サイクリックホスファチジン酸はPPARγに対してアンタゴニスト活性をもつものと結論づけた.
3.ホスホリパーゼD2の活性化がサイクリックホスファチジン酸を産生する
つぎに,サイクリックホスファチジン酸が細胞内で合成されるしくみを明らかにしたいと考えた.サイクリックホスファチジン酸がStreptomyces chromofuscus由来のホスホリパーゼDによりつくられることが報告されていたことを参考に,動物細胞においてもホスホリパーゼDにより合成されているのではないかと考え,ホスホリパーゼD1およびホスホリパーゼD2の2つのアイソフォームが発現しているMDA-MB-231細胞を利用して32Pによる細胞標識実験を行った.標識された細胞から脂質を抽出し2次元薄層クロマトグラフィーにより分離したところ,ホルボールエステルによりホスホリパーゼDを活性化させた場合のみ,サイクリックホスファチジン酸の標準物質と同じ場所に放射性標識されたスポットが観察された.さらに,このスポットはホスホリパーゼDの阻害剤である1-ブタノールにより消失したがt-ブタノールでは消失しなかったことから,ホスホリパーゼD依存的に合成されたスポットであることが明らかになった.そこでつぎに,2つのアイソフォームのうち,どちらがサイクリックホスファチジン酸の合成に寄与しているのかを明らかにするため,酵素活性を阻害したホスホリパーゼD1およびホスホリパーゼD2をドキシサイクリン誘導下でCHO細胞に過剰に発現させ,ホルボールエステルによりホスホリパーゼDを活性化させた.その結果,野生型と比較して,ホスホリパーゼD2を過剰に発現させたCHO細胞ではサイクリックホスファチジン酸が約10倍も増加したが,ホスホリパーゼD1を過剰に発現させたCHO細胞では野生型と同程度であった.さらに,野生型ホスホリパーゼD2および酵素活性を阻害したホスホリパーゼD2の組換え体を作製しリゾホスファチジルコリンを基質として反応させたところ,野生型ホスホリパーゼD2のみでサイクリックホスファチジン酸の産生が確認された.以上から,ホスホリパーゼD2がサイクリックホスファチジン酸の産生に寄与する酵素であることが明らかになった.
つづいて,in vivoにおけるサイクリックホスファチジン酸のしくみをさらに明らかにするため,ヒトより採取した末梢血単球細胞に,インスリン,ホルボールエステルさらに,リポ多糖を利用して刺激をくわえ,産生するサイクリックホスファチジン酸の濃度を液体クロマトグラフィー-質量分析器により測定した.その結果,無刺激の状態ではきわめて低い濃度のままであったが,刺激によりサイクリックホスファチジン酸の濃度は急激に上昇した.たとえば,100 nMのホルボールエステルで刺激した場合,無刺激のときと比較して,オレイルサイクリックホスファチジン酸およびパルミトイルサイクリックホスファチジン酸とも,産生は1000倍以上に劇的に増加した.さらに,100 nMのインスリンにて生理的な刺激をあたえた場合,オレイルサイクリックホスファチジン酸は約300倍増加したにもかかわらず,パルミトイルサイクリックホスファチジン酸は変化しなかった.さらに,この現象はホスホリパーゼDの阻害剤により抑制された.以上から,サイクリックホスファチジン酸の細胞内における合成はホスホリパーゼD2に依存しており,かつ,きわめて一過的な反応であることがわかった(図2).
4.サイクリックホスファチジン酸は新生内膜の形成を抑制する
サイクリックホスファチジン酸は,ホスホリパーゼD2によりインスリンなどの刺激に対して依存的に生合成されることが明らかになった.すなわち,サイクリックホスファチジン酸はセカンドメッセンジャーとしてのはたらきをもつことが予想された.Tigyiらは,アルキルグリセロールリン酸が新生内膜の形成をPPARγの活性化に依存的に促進させることを報告していた6).そこで,サイクリックホスファチジン酸が新生内膜の形成を抑制するのではないかと考え,ラット頸動脈内皮モデルを利用した実験を試みた.頸動脈内皮をロシグリタゾンまたはアルキルグリセロールリン酸で処理すると強い新生内膜の形成が認められたが,サイクリックホスファチジン酸で共処理することにより新生内膜の形成は顕著に抑制された.さらに,頸動脈内皮に対して低濃度のインスリン(3 nM)にて処理すると,アルキルグリセロールリン酸による新生内膜形成の促進が有意に抑制された.Breenらは,低濃度インスリン処理により新生内膜の形成が抑制されることを報告しており9),その分子機構にサイクリックホスファチジン酸が関与している可能も予想される.以上の結果から,インスリン刺激によるホスホリパーゼD2の活性化とそれにつづくサイクリックホスファチジン酸の合成によりPPARγの活性化が抑制されたことにより,新生内膜の形成も抑制されたものと考えられた.
おわりに
脂質は最後に取り残されたもっとも困難でかつもっとも興味深い物質であるといわれている.今後も,その興味深い脂質の生理活性を最新の技術と古き良き伝統ある技術を駆使して明らかにしてきたい.
文 献
- Tigyi, G.: Aiming drug discovery at lysophosphatidic acid targets. Br. J. Pharmacol., 161, 241-270 (2010)[PubMed]
- Kliewer, S. A., Forman, B. M., Blumberg, B. et al.: Differential expression and activation of a family of murine peroxisome proliferator-activated receptors. Proc. Natl. Acad. Sci. USA, 91, 7355-7359 (1994)[PubMed]
- Tontonoz, P., Hu, E., Graves, R. A. et al. .: mPPAR gamma 2: tissue-specific regulator of an adipocyte enhancer. Genes Dev., 8, 1224-1234 (1994)[PubMed]
- Lehmann, J. M., Moore, L. B., Smith-Oliver, T. A. et al.: An antidiabetic thiazolidinedione is a high affinity ligand for peroxisome proliferator-activated receptorγ (PPARγ). J. Biol. Chem., 270, 12953-12956 (1995)[PubMed]
- McIntyre, T. M., Pontsler, A. V., Silva, A. R. et al.: Identification of an intracellular receptor for lysophosphatidic acid (LPA): LPA is a transcellular PPARγ agonist. Proc. Natl. Acad. Sci. USA, 100, 131-136 (2003)[PubMed]
- Zhang, C., Baker, D. L., Yasuda, S. et al.: Lysophosphatidic acid induces neointima formation through PPARγ activation. J. Exp. Med., 199, 763-774 (2004)[PubMed]
- Tsukahara, T., Tsukahara, R., Yasuda, S. et al.: Different residues mediate recognition of 1-O-oleyllysophosphatidic acid and rosiglitazone in the ligand binding domain of peroxisome proliferator-activated receptor γ. J. Biol. Chem., 281, 3398-3407 (2006)[PubMed]
- Murakami-Murofushi, K., Kaji, K., Kano, K. et al.: Inhibition of cell proliferation by a unique lysophosphatidic acid, PHYLPA, isolated from Physarum polycephalum: signaling events of antiproliferative action by PHYLPA. Cell Struct. Funct., 18, 363-370 (1993)[PubMed]
- Breen, D. M., Chan, K. K., Dhaliwall, J. K. et al.: Insulin increases reendothelialization and inhibits cell migration and neointimal growth after arterial injury. Arterioscler. Thromb. Vasc. Biol., 29, 1060-1066 (2009)[PubMed]
著者プロフィール
略歴:2002年 北海道大学大学院薬学研究科博士後期課程 修了(五十嵐靖之教授),同 研究員,2003年 米国Tennessee大学Health Science Centerポスドクフェロー(Dr. Gabor Tigyi)を経て,2008年より信州大学医学部 助教.
研究テーマ:リゾリン脂質と核内受容体.
抱負:リゾリン脂質の新規生理活性を明らかにしたい.
© 2010 塚原 完 Licensed under CC 表示 2.1 日本