発生期におけるエピジェネティックな修飾はクラスター型プロトカドヘリン遺伝子の確率的な発現を制御し個々のニューロンを多様化する
豊田峻輔・八木 健
(大阪大学大学院生命機能研究科 心生物学研究室)
email:豊田峻輔,八木 健
DOI: 10.7875/first.author.2014.052
Developmental epigenetic modification regulates stochastic expression of clustered Protocadherin genes, generating single neuron diversity.
Shunsuke Toyoda, Masahumi Kawaguchi, Toshihiro Kobayashi, Etsuko Tarusawa, Tomoko Toyama, Masaki Okano, Masaaki Oda, Hiromitsu Nakauchi, Yumiko Yoshimura, Makoto Sanbo, Masumi Hirabayashi, Teruyoshi Hirayama, Takahiro Hirabayashi, Takeshi Yagi
Neuron, 82, 94-108 (2014)
脳は多数のニューロンから構成されているが,個々のニューロンには機能的な個性があり,異なる回路特性をもっている.クラスター型プロトカドヘリン(cPcdh)は脳神経系において強く発現している多様化した細胞表面タンパク質であり,遺伝子プロモーターの選択により個々のニューロンごとに異なるcPcdh遺伝子が確率的に発現している.今回,筆者らは,de novo型のDNAメチル基転移酵素であるDnmt3bが胚発生の初期にcPcdh遺伝子のプロモーター領域を差次的にDNAメチル化することを発見した.そこで,ニューロンにおけるDnmt3bの役割を明らかにするため,胎生致死であるDnmt3bノックアウトマウスからiPS細胞を樹立してキメラマウスを作製した.単一のニューロンのレベルでの解析により,個々のDnmt3bを欠損したプルキンエ細胞は確率的に発現するcPcdh遺伝子の数が増加し,また,樹状突起の異常な分枝が認められた.これらのことから,発生の初期においてDnmt3bによるDNAメチル化が個々のニューロンにおけるcPcdh遺伝子の確率的な発現の頻度を制御しており,樹状突起のパターン形成にも必要であることが明らかになった.この成果は,ニューロンの個性化における新規のエピジェネティックな制御機構を示唆するものであり,Dnmt3bの変異が原因で起こるヒトの遺伝病ICF症候群や精神疾患の原因の解明にも貢献することが期待される.
脳は多数のニューロンから構成されているが,個々のニューロンには機能的な個性があり,異なる回路特性をもっている.マウスの嗅覚受容体やショウジョウバエのDscamの研究により,多様化した細胞表面タンパク質の確率的な発現は個々のニューロンの個性化とそれにともなう特異的な回路の形成に重要であることが明らかになっている.
クラスター型プロトカドヘリン(cPcdh)はカドヘリンスーパーファミリーのなかで最大のサブファミリーを構成しており,脳神経系において強く発現している多様化した細胞表面タンパク質である1,2).cPcdh遺伝子は同一の染色体にPcdh-α,Pcdh-β,Pcdh-γの3つの遺伝子クラスターを形成しており,58種類の遺伝子が縦列したゲノム構造をとっている(図1a).おのおののcPcdh遺伝子は独自のプロモーター領域をもち,Pcdh-αクラスターおよびPcdh-γクラスターにおいては多様化した可変領域エキソンのなかから1つが選択されて定常領域エキソンとのあいだでスプライシングされることにより発現している3,4).クラスター型プロトカドヘリンの細胞外領域にはカドヘリンモチーフがあり,ホモフィリックな細胞接着活性をもっている5).また,同一の細胞に由来する樹状突起どうしが接着に依存して反発する自己忌避性という性質を制御している6).
単一のニューロンのレベルでの解析により,Pcdh-αC1遺伝子,Pcdh-αC2遺伝子,Pcdh-γC3遺伝子~Pcdh-γC5遺伝子は,両側の対立遺伝子からほぼすべてのニューロンにおいて恒常的に発現しているのに対し,Pcdh-α1遺伝子~Pcdh-α12遺伝子,Pcdh-β遺伝子,Pcdh-γA遺伝子,Pcdh-γB遺伝子は,対立遺伝子ごとに独立して制御されており個々のニューロンごとに異なる発現をしている7-9)(図1b).これらのことから,クラスター型プロトカドヘリンがニューロンの個性化や回路の特異化にかかわる可能性が示唆されている.
エピジェネティクスはDNAの塩基配列の変化をともなわない遺伝子の制御機構であり,発生の過程における細胞の個性の獲得や維持において必須である.個々のニューロンにおける発現パターンと同様に,一部のPcdh-α遺伝子のみが発現している神経芽細胞腫においては,転写活性の認められる遺伝子プロモーター領域はほぼDNAメチル化されていないのに対し,転写の抑制されている遺伝子プロモーター領域は高度にDNAメチル化されている3,10).このように,in vitroにおいてはPcdh-α遺伝子のプロモーター領域におけるDNAメチル化の状態と遺伝子発現とが関連していることが明らかになっている.一方で,in vivoにおけるDNAメチル化の制御機構およびその役割については謎のままであった.
脳の個々のニューロンにおいて確率的に発現しているPcdh-α1遺伝子~Pcdh-α12遺伝子のプロモーター領域はモザイク状のDNAメチル化のパターンを示すのに対し,ほぼすべてのニューロンにおいて恒常的に発現しているPcdh-αC1遺伝子およびPcdh-αC2遺伝子のプロモーター領域はDNAメチル化の低い状態を示す10).一方で,Pcdh-α11遺伝子からPcdh-αC2遺伝子に及ぶ可変領域エキソンを欠損させたマウスでは,ほぼすべてのプルキンエ細胞においてPcdh-α10遺伝子が発現するようになる11).そこで,Pcdh-α10遺伝子のプロモーター領域を調べたところ,DNAメチル化はほとんど起こっておらず,遺伝子発現のパターンに相関してDNAメチル化のパターンが変化していることが明らかになった.
Pcdh-α遺伝子は脳神経系において排他的に発現していることから1),脳および肝臓においてPcdh-α遺伝子のプロモーター領域におけるDNAメチル化のパターンを比較した.その結果,肝臓においても脳と同様のDNAメチル化のパターンを示すことがわかった.そこで,発生の過程において解析したところ,胎生3.5日目の胚盤胞ではほとんどDNAメチル化されていなかったのに対し,発生が進むにつれ,Pcdh-α1遺伝子~Pcdh-α12遺伝子のプロモーター領域は胎生9.5日目にかけてDNAメチル化が亢進していく一方で,Pcdh-αC1遺伝子およびPcdh-αC2遺伝子のプロモーター領域はDNAメチル化の低い状態が維持されていた.
発生の過程におけるゲノム全体のグローバルなDNAメチル化は,受精ののち減少し,着床ののち,de novo型のDNAメチル基転移酵素であるDnmt3aおよびDnmt3bにより新たなDNAメチル化のパターンが形成される12).そこで,Dnmt3aを欠損した胚およびDnmt3bを欠損した胚のcPcdh遺伝子のプロモーター領域を胎生9日目において解析したところ,Dnmt3aを欠損した胚においては野生型の胚と比べ顕著な違いは認められなかったのに対し,Dnmt3bを欠損した胚ではほとんどDNAメチル化されていなかった.
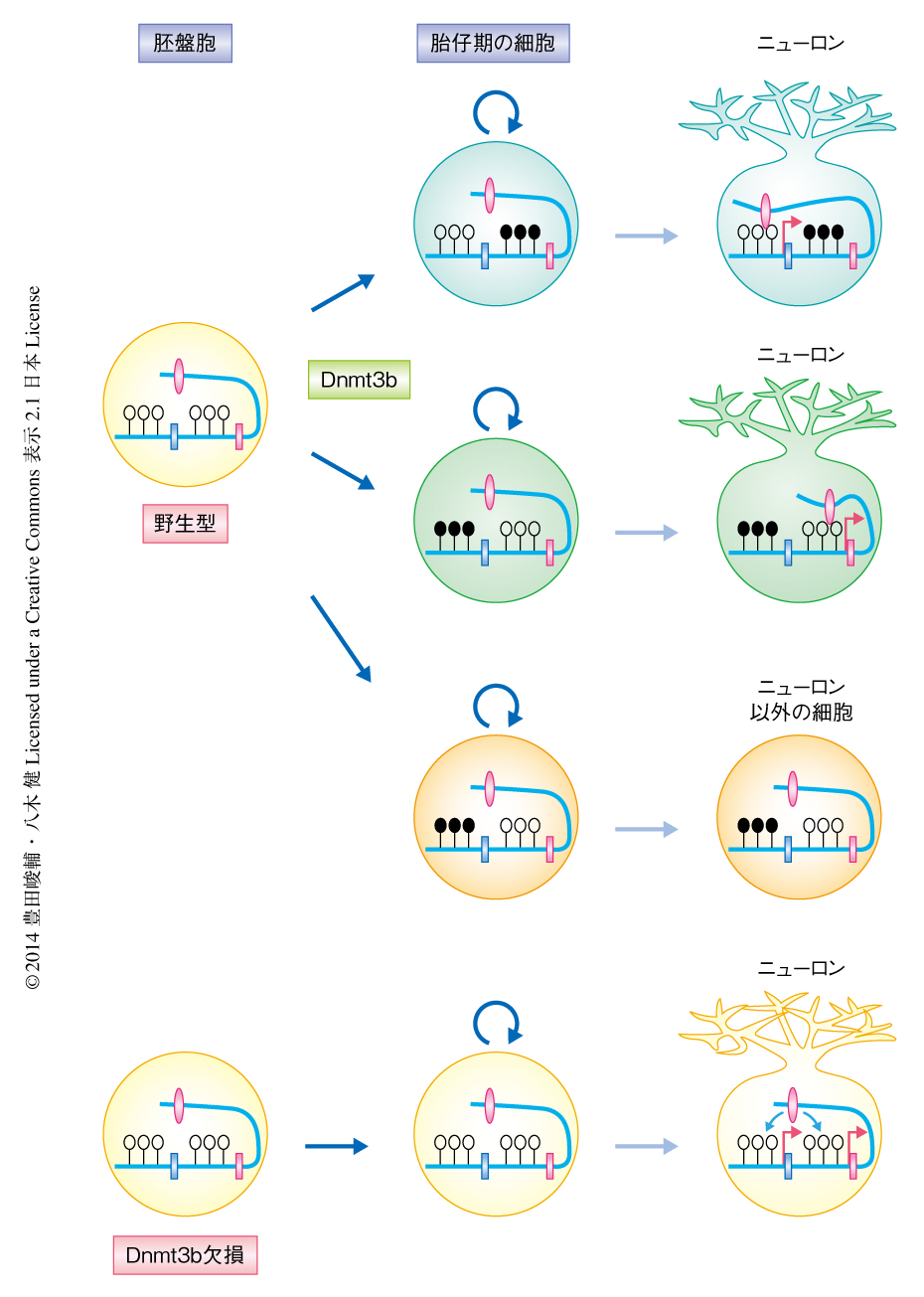
Dnmt3bは発生の初期において強く発現しており,また,Dnmt3bノックアウトマウスは胎生15日目のあたりで致死となる12).そこで,出生したのちのニューロンにおける解析のためモザイク実験を試みた.Dnmt3bを欠損したES細胞においてcPcdh遺伝子のプロモーター領域はすでに高度にDNAメチル化されていたため,グリーンマウスとの交配により全身においてEGFPを発現するDnmt3bノックアウトマウスを作製し,そこからiPS細胞を樹立した.そののち,野生型の胚にiPS細胞を導入することによりキメラマウスを作製した.得られたマウスは出生ののちにも生きており,脳においてDnmt3bを欠損したEGFP陽性の細胞が観察された.このキメラマウスにおいて平面状に分枝した複雑な樹状突起を伸ばしている小脳プルキンエ細胞の形態を詳細に解析したところ,Dnmt3bを欠損した細胞では野生型の細胞に比べ樹状突起の重なりや束が多く認められ,Dnmt3bが樹状突起のパターン形成に必須であることが明らかになった.
個々のプルキンエ細胞におけるcPcdh遺伝子の発現を解析するため,さきに述べたキメラマウスの小脳の細胞を分散し,細胞の形態を指標としてプルキンエ細胞をピックアップして,マイクロデバイスを応用した微小流路系を用いて遺伝子発現を解析した.その結果,野生型のプルキンエ細胞では細胞ごとに異なるcPcdh遺伝子が確率的に発現していたのに対し,Dnmt3bを欠損したプルキンエ細胞ではcPcdh遺伝子の発現の頻度が上昇しており,すべてのcPcdh遺伝子を発現している細胞も観察された.
cPcdh遺伝子は特異的なエンハンサーにより選択されて発現することが知られている.この研究により,発生の初期におけるDnmt3bに依存的なDNAメチル化は,個々のニューロンにおけるエンハンサーに依存的なcPcdh遺伝子の確率的な発現を制御しており,また,プルキンエ細胞における樹状突起のパターン形成に重要であることが明らかになった(図2).
Dnmt3bはヒトの遺伝病であるICF症候群(ICF:immunodeficiency, centromeric instability, facial anomaly:免疫不全,セントロメア不安定性,顔貌異常)の原因遺伝子産物であり,精神疾患との関連性も報告されているが,脳神経系における役割の多くは謎のままである.最近,興味深いことに,Pcdh-γを欠損したプルキンエ細胞において樹状突起の自己忌避性が異常になっていることが報告されている6).これらのことから,cPcdh遺伝子のエピジェネティックな制御の異常が,Dnmt3bを欠損したプルキンエ細胞において認められた樹状突起の異常やヒトのICF症候群に関与している可能性が示唆される.しかしながら,Dnmt3bにはcPcdh遺伝子のほかにも多数の標的となる遺伝子が想定されるため,さらなる研究が必要であるといえる.さらに,発生の初期に起こるcPcdh遺伝子のエピジェネティックな修飾は細胞分裂をへても維持される可能性のあることから,細胞系譜に依存したニューロンの個性化や局所における回路の形成に関与している可能性も期待される.
略歴:2013年 大阪大学大学院生命機能研究科 修了,同年より同 博士研究員.
研究テーマ:ニューロンにおける個性化の機構.
関心事:同一の遺伝情報からいかにして類似性や差異が生じているのか.
八木 健(Takeshi Yagi)
大阪大学大学院生命機能研究科 教授.
研究室URL:http://www.fbs.osaka-u.ac.jp/labs/yagi/index.htm
© 2014 豊田峻輔・八木 健 Licensed under CC 表示 2.1 日本
(大阪大学大学院生命機能研究科 心生物学研究室)
email:豊田峻輔,八木 健
DOI: 10.7875/first.author.2014.052
Developmental epigenetic modification regulates stochastic expression of clustered Protocadherin genes, generating single neuron diversity.
Shunsuke Toyoda, Masahumi Kawaguchi, Toshihiro Kobayashi, Etsuko Tarusawa, Tomoko Toyama, Masaki Okano, Masaaki Oda, Hiromitsu Nakauchi, Yumiko Yoshimura, Makoto Sanbo, Masumi Hirabayashi, Teruyoshi Hirayama, Takahiro Hirabayashi, Takeshi Yagi
Neuron, 82, 94-108 (2014)
要 約
脳は多数のニューロンから構成されているが,個々のニューロンには機能的な個性があり,異なる回路特性をもっている.クラスター型プロトカドヘリン(cPcdh)は脳神経系において強く発現している多様化した細胞表面タンパク質であり,遺伝子プロモーターの選択により個々のニューロンごとに異なるcPcdh遺伝子が確率的に発現している.今回,筆者らは,de novo型のDNAメチル基転移酵素であるDnmt3bが胚発生の初期にcPcdh遺伝子のプロモーター領域を差次的にDNAメチル化することを発見した.そこで,ニューロンにおけるDnmt3bの役割を明らかにするため,胎生致死であるDnmt3bノックアウトマウスからiPS細胞を樹立してキメラマウスを作製した.単一のニューロンのレベルでの解析により,個々のDnmt3bを欠損したプルキンエ細胞は確率的に発現するcPcdh遺伝子の数が増加し,また,樹状突起の異常な分枝が認められた.これらのことから,発生の初期においてDnmt3bによるDNAメチル化が個々のニューロンにおけるcPcdh遺伝子の確率的な発現の頻度を制御しており,樹状突起のパターン形成にも必要であることが明らかになった.この成果は,ニューロンの個性化における新規のエピジェネティックな制御機構を示唆するものであり,Dnmt3bの変異が原因で起こるヒトの遺伝病ICF症候群や精神疾患の原因の解明にも貢献することが期待される.
はじめに
脳は多数のニューロンから構成されているが,個々のニューロンには機能的な個性があり,異なる回路特性をもっている.マウスの嗅覚受容体やショウジョウバエのDscamの研究により,多様化した細胞表面タンパク質の確率的な発現は個々のニューロンの個性化とそれにともなう特異的な回路の形成に重要であることが明らかになっている.
クラスター型プロトカドヘリン(cPcdh)はカドヘリンスーパーファミリーのなかで最大のサブファミリーを構成しており,脳神経系において強く発現している多様化した細胞表面タンパク質である1,2).cPcdh遺伝子は同一の染色体にPcdh-α,Pcdh-β,Pcdh-γの3つの遺伝子クラスターを形成しており,58種類の遺伝子が縦列したゲノム構造をとっている(図1a).おのおののcPcdh遺伝子は独自のプロモーター領域をもち,Pcdh-αクラスターおよびPcdh-γクラスターにおいては多様化した可変領域エキソンのなかから1つが選択されて定常領域エキソンとのあいだでスプライシングされることにより発現している3,4).クラスター型プロトカドヘリンの細胞外領域にはカドヘリンモチーフがあり,ホモフィリックな細胞接着活性をもっている5).また,同一の細胞に由来する樹状突起どうしが接着に依存して反発する自己忌避性という性質を制御している6).
単一のニューロンのレベルでの解析により,Pcdh-αC1遺伝子,Pcdh-αC2遺伝子,Pcdh-γC3遺伝子~Pcdh-γC5遺伝子は,両側の対立遺伝子からほぼすべてのニューロンにおいて恒常的に発現しているのに対し,Pcdh-α1遺伝子~Pcdh-α12遺伝子,Pcdh-β遺伝子,Pcdh-γA遺伝子,Pcdh-γB遺伝子は,対立遺伝子ごとに独立して制御されており個々のニューロンごとに異なる発現をしている7-9)(図1b).これらのことから,クラスター型プロトカドヘリンがニューロンの個性化や回路の特異化にかかわる可能性が示唆されている.
エピジェネティクスはDNAの塩基配列の変化をともなわない遺伝子の制御機構であり,発生の過程における細胞の個性の獲得や維持において必須である.個々のニューロンにおける発現パターンと同様に,一部のPcdh-α遺伝子のみが発現している神経芽細胞腫においては,転写活性の認められる遺伝子プロモーター領域はほぼDNAメチル化されていないのに対し,転写の抑制されている遺伝子プロモーター領域は高度にDNAメチル化されている3,10).このように,in vitroにおいてはPcdh-α遺伝子のプロモーター領域におけるDNAメチル化の状態と遺伝子発現とが関連していることが明らかになっている.一方で,in vivoにおけるDNAメチル化の制御機構およびその役割については謎のままであった.
1.脳においてPcdh-α遺伝子のプロモーター領域におけるDNAメチル化のパターンはcPcdh遺伝子の発現と相関している
脳の個々のニューロンにおいて確率的に発現しているPcdh-α1遺伝子~Pcdh-α12遺伝子のプロモーター領域はモザイク状のDNAメチル化のパターンを示すのに対し,ほぼすべてのニューロンにおいて恒常的に発現しているPcdh-αC1遺伝子およびPcdh-αC2遺伝子のプロモーター領域はDNAメチル化の低い状態を示す10).一方で,Pcdh-α11遺伝子からPcdh-αC2遺伝子に及ぶ可変領域エキソンを欠損させたマウスでは,ほぼすべてのプルキンエ細胞においてPcdh-α10遺伝子が発現するようになる11).そこで,Pcdh-α10遺伝子のプロモーター領域を調べたところ,DNAメチル化はほとんど起こっておらず,遺伝子発現のパターンに相関してDNAメチル化のパターンが変化していることが明らかになった.
2.Pcdh-α遺伝子のプロモーター領域は発生の初期にde novoにDNAメチル化される
Pcdh-α遺伝子は脳神経系において排他的に発現していることから1),脳および肝臓においてPcdh-α遺伝子のプロモーター領域におけるDNAメチル化のパターンを比較した.その結果,肝臓においても脳と同様のDNAメチル化のパターンを示すことがわかった.そこで,発生の過程において解析したところ,胎生3.5日目の胚盤胞ではほとんどDNAメチル化されていなかったのに対し,発生が進むにつれ,Pcdh-α1遺伝子~Pcdh-α12遺伝子のプロモーター領域は胎生9.5日目にかけてDNAメチル化が亢進していく一方で,Pcdh-αC1遺伝子およびPcdh-αC2遺伝子のプロモーター領域はDNAメチル化の低い状態が維持されていた.
3.Dnmt3bはcPcdh遺伝子のプロモーター領域のde novoのDNAメチル化に必須である
発生の過程におけるゲノム全体のグローバルなDNAメチル化は,受精ののち減少し,着床ののち,de novo型のDNAメチル基転移酵素であるDnmt3aおよびDnmt3bにより新たなDNAメチル化のパターンが形成される12).そこで,Dnmt3aを欠損した胚およびDnmt3bを欠損した胚のcPcdh遺伝子のプロモーター領域を胎生9日目において解析したところ,Dnmt3aを欠損した胚においては野生型の胚と比べ顕著な違いは認められなかったのに対し,Dnmt3bを欠損した胚ではほとんどDNAメチル化されていなかった.
4.Dnmt3bに依存的なDNAメチル化はプルキンエ細胞における樹状突起のパターン形成に必須である
Dnmt3bは発生の初期において強く発現しており,また,Dnmt3bノックアウトマウスは胎生15日目のあたりで致死となる12).そこで,出生したのちのニューロンにおける解析のためモザイク実験を試みた.Dnmt3bを欠損したES細胞においてcPcdh遺伝子のプロモーター領域はすでに高度にDNAメチル化されていたため,グリーンマウスとの交配により全身においてEGFPを発現するDnmt3bノックアウトマウスを作製し,そこからiPS細胞を樹立した.そののち,野生型の胚にiPS細胞を導入することによりキメラマウスを作製した.得られたマウスは出生ののちにも生きており,脳においてDnmt3bを欠損したEGFP陽性の細胞が観察された.このキメラマウスにおいて平面状に分枝した複雑な樹状突起を伸ばしている小脳プルキンエ細胞の形態を詳細に解析したところ,Dnmt3bを欠損した細胞では野生型の細胞に比べ樹状突起の重なりや束が多く認められ,Dnmt3bが樹状突起のパターン形成に必須であることが明らかになった.
5.Dnmt3bに依存的なDNAメチル化は個々のニューロンにおけるcPcdh遺伝子の確率的な発現を制御する
個々のプルキンエ細胞におけるcPcdh遺伝子の発現を解析するため,さきに述べたキメラマウスの小脳の細胞を分散し,細胞の形態を指標としてプルキンエ細胞をピックアップして,マイクロデバイスを応用した微小流路系を用いて遺伝子発現を解析した.その結果,野生型のプルキンエ細胞では細胞ごとに異なるcPcdh遺伝子が確率的に発現していたのに対し,Dnmt3bを欠損したプルキンエ細胞ではcPcdh遺伝子の発現の頻度が上昇しており,すべてのcPcdh遺伝子を発現している細胞も観察された.
おわりに
cPcdh遺伝子は特異的なエンハンサーにより選択されて発現することが知られている.この研究により,発生の初期におけるDnmt3bに依存的なDNAメチル化は,個々のニューロンにおけるエンハンサーに依存的なcPcdh遺伝子の確率的な発現を制御しており,また,プルキンエ細胞における樹状突起のパターン形成に重要であることが明らかになった(図2).
Dnmt3bはヒトの遺伝病であるICF症候群(ICF:immunodeficiency, centromeric instability, facial anomaly:免疫不全,セントロメア不安定性,顔貌異常)の原因遺伝子産物であり,精神疾患との関連性も報告されているが,脳神経系における役割の多くは謎のままである.最近,興味深いことに,Pcdh-γを欠損したプルキンエ細胞において樹状突起の自己忌避性が異常になっていることが報告されている6).これらのことから,cPcdh遺伝子のエピジェネティックな制御の異常が,Dnmt3bを欠損したプルキンエ細胞において認められた樹状突起の異常やヒトのICF症候群に関与している可能性が示唆される.しかしながら,Dnmt3bにはcPcdh遺伝子のほかにも多数の標的となる遺伝子が想定されるため,さらなる研究が必要であるといえる.さらに,発生の初期に起こるcPcdh遺伝子のエピジェネティックな修飾は細胞分裂をへても維持される可能性のあることから,細胞系譜に依存したニューロンの個性化や局所における回路の形成に関与している可能性も期待される.
文 献
- Kohmura, N., Senzaki, K., Hamada, S. et al.: Diversity revealed by a novel family of cadherins expressed in neurons at a synaptic complex. Neuron, 20, 1137-1151 (1998)[PubMed]
- Wu, Q. & Maniatis, T.: A striking organization of a large family of human neural cadherin-like cell adhesion genes. Cell, 97, 779-790 (1999)[PubMed]
- Tasic, B., Nabholz, C. E., Baldwin, K. K. et al.: Promoter choice determines splice site selection in protocadherin α and γ pre-mRNA splicing. Mol. Cell, 10, 21-33 (2002)[PubMed]
- Wang, X., Su, H. & Bradley, A.: Molecular mechanisms governing Pcdh-γ gene expression: evidence for a multiple promoter and cis-alternative splicing model. Genes Dev., 16, 1890-1905 (2002)[PubMed]
- Schreiner, D. & Weiner, J. A.: Combinatorial homophilic interaction between γ-protocadherin multimers greatly expands the molecular diversity of cell adhesion. Proc. Natl. Acad. Sci. USA, 107, 14893-14898 (2010)[PubMed]
- Lefebvre, J. L., Kostadinov, D., Chen, W. V. et al.: Protocadherins mediate dendritic self-avoidance in the mammalian nervous system. Nature, 488, 517-521 (2012)[PubMed]
- Esumi, S., Kakazu, N., Taguchi, Y. et al.: Monoallelic yet combinatorial expression of variable exons of the protocadherin-α gene cluster in single neurons. Nat. Genet., 37, 171-176 (2005)[PubMed]
- Kaneko, R., Kato, H., Kawamura, Y. et al.: Allelic gene regulation of Pcdh-α and Pcdh-γ clusters involving both monoallelic and biallelic expression in single Purkinje cells. J. Biol. Chem., 281, 30551-30560 (2006)[PubMed]
- Hirano, K., Kaneko, R., Izawa, T. et al.: Single-neuron diversity generated by Protocadherin-β cluster in mouse central and peripheral nervous systems. Front. Mol. Neurosci., 5, 90 (2012)[PubMed]
- Kawaguchi, M., Toyama, T., Kaneko, R. et al.: Relationship between DNA methylation states and transcription of individual isoforms encoded by the protocadherin-α gene cluster. J. Biol. Chem., 283, 12064-12075 (2008)[PubMed]
- Noguchi, Y., Hirabayashi, T., Katori, S. et al.: Total expression and dual gene-regulatory mechanisms maintained in deletions and duplications of the Pcdhα cluster. J. Biol. Chem., 284, 32002-32014 (2009)[PubMed]
- Okano, M., Bell, D. W., Haber, D. A. et al.: DNA methyltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development. Cell, 99, 247-257 (1999)[PubMed]
著者プロフィール
略歴:2013年 大阪大学大学院生命機能研究科 修了,同年より同 博士研究員.
研究テーマ:ニューロンにおける個性化の機構.
関心事:同一の遺伝情報からいかにして類似性や差異が生じているのか.
八木 健(Takeshi Yagi)
大阪大学大学院生命機能研究科 教授.
研究室URL:http://www.fbs.osaka-u.ac.jp/labs/yagi/index.htm
© 2014 豊田峻輔・八木 健 Licensed under CC 表示 2.1 日本