共通のニューロンに収束する軸索のシナプス接続のパターンは生体において細胞自律的な機構と細胞非自律的な機構との協調作用により確立される
大川 陽久
(米国Washington大学Department of Biological Structure)
email:大川陽久
DOI: 10.7875/first.author.2014.048
Interplay of cell-autonomous and nonautonomous mechanisms tailors synaptic connectivity of converging axons in vivo.
Haruhisa Okawa, Luca Della Santina, Gregory W. Schwartz, Fred Rieke, Rachel O.L. Wong
Neuron, 82, 125-137 (2014)
神経組織が発達する過程において,ニューロンのあいだの正確なシナプス接続が形成されることは神経回路が適切に機能するうえで不可欠である.一般に,ひとつのニューロンには複数のタイプのシナプス前細胞からの入力が収束するが,それぞれのタイプのシナプス前細胞にはタイプに特有なシナプス接続のパターンがみられる.シナプス後細胞を共有する異なったタイプのシナプス前細胞が互いの接続を制御しあい,タイプに特有な接続パターンによりシナプスを形成する分子機構の全容はいまだ明らかではない.筆者らは,網膜の双極細胞と神経節細胞とのあいだの神経回路をモデルとし,神経伝達に依存する機構と依存しない機構とがどのように協調して個々の双極細胞のタイプに特有なシナプス接続のパターンを制御しているかについて解析した.その結果,神経伝達に依存しない機構は双極細胞の同じタイプのあいだおよび異なったタイプのあいだにはたらき,正しい双極細胞のタイプの選択およびそのタイプに特有のシナプスの数を制御するのに対して,個々の双極細胞からの神経伝達は周囲の双極細胞に影響をあたえることなく,自律的に作用してそれ自体のシナプスの数を制御することがわかった.この研究は,ひとつの神経回路において異なる機構がシナプスの形成の異なった局面に協調的にはたらき整然とした接続パターンを構築することを明らかにした.
神経組織の特質のひとつは,多種多様なニューロンが非常に秩序だって接続していることである.たとえば,小脳プルキンエ細胞は平行繊維とよばれる顆粒細胞の軸索と登上繊維とよばれる下オリーブ核ニューロンの軸索からの入力をうけるが,ひとつのプルキンエ細胞に10万本以上の平行繊維が入力するのに対し,登上繊維はたった1本しか入力しない.したがって,全体としては顆粒細胞からのシナプスの数は下オリーブ核からのシナプスの数に比べ圧倒的に多い.ところが,個々のシナプス前細胞からの入力を比較すると,1本の平行繊維はほんの2~3個のシナプスしか形成しないのに対し,1本の登上繊維は約500個ものシナプスを形成する.このようなニューロンのあいだのステレオタイプな接続パターンは神経回路の正常な機能において不可欠であるが,どうやってこのような特異な接続パターンが発生の過程において生じるのかという問題は神経発生学における主要なテーマのひとつである.さらに,そのしくみを理解することは,今後,疾患などにより失われた細胞を外部から補充し正常な接続を回復させるうえで非常に重要である.
近年の研究から,ニューロンが特定のパートナーと選択的にシナプスを形成する分子機構や1-3),複数のパートナーとの接続を制御する分子機構に関して4-7),多くのことが明らかになりつつある.未解明なのは,複数の種類のパートナーからの入力が個々のシナプス前細胞のレベルでどのように制御されているのか,より具体的には,個々のシナプス前細胞によるシナプス接続のパターンは,周囲の同じタイプおよび異なるタイプのシナプス前細胞によりどのような影響をうけるのかという問題である.この問題に答えるためには,ひとつのシナプス後細胞に入力する個々のシナプス前細胞のタイプを同定するとともに,それらのあいだに形成されるシナプスを可視化することが必要であるが,脳の神経回路では多くのニューロンのタイプが不明確なうえ,長距離の軸索投射と広範囲にわたる軸索末端をもつニューロンが多いため,この問題を解決することは技術的に容易ではない.それに対して,この研究においてモデルとして用いた網膜は多くのニューロンの種類が明らかになっており,その機能も比較的よくわかっている8).さらに,コンパクトな網膜の大きさとその整然とした層状の構造は,個々の特定されたニューロンのあいだのシナプス接続を可視化するうえで非常に都合がよい.また,網膜の双極細胞と神経節細胞とのあいだの神経回路は単純ではあるが,ちょうどこの問題に取り組むだけの複雑さを備えている.そこで,筆者らは,双極細胞と神経節細胞とのあいだのシナプス結合をモデルとして,個々のシナプス前細胞(双極細胞)のレベルで接続のパターンがどのように制御されているのか,その細胞レベルにおけるしくみを解明することを試みた.
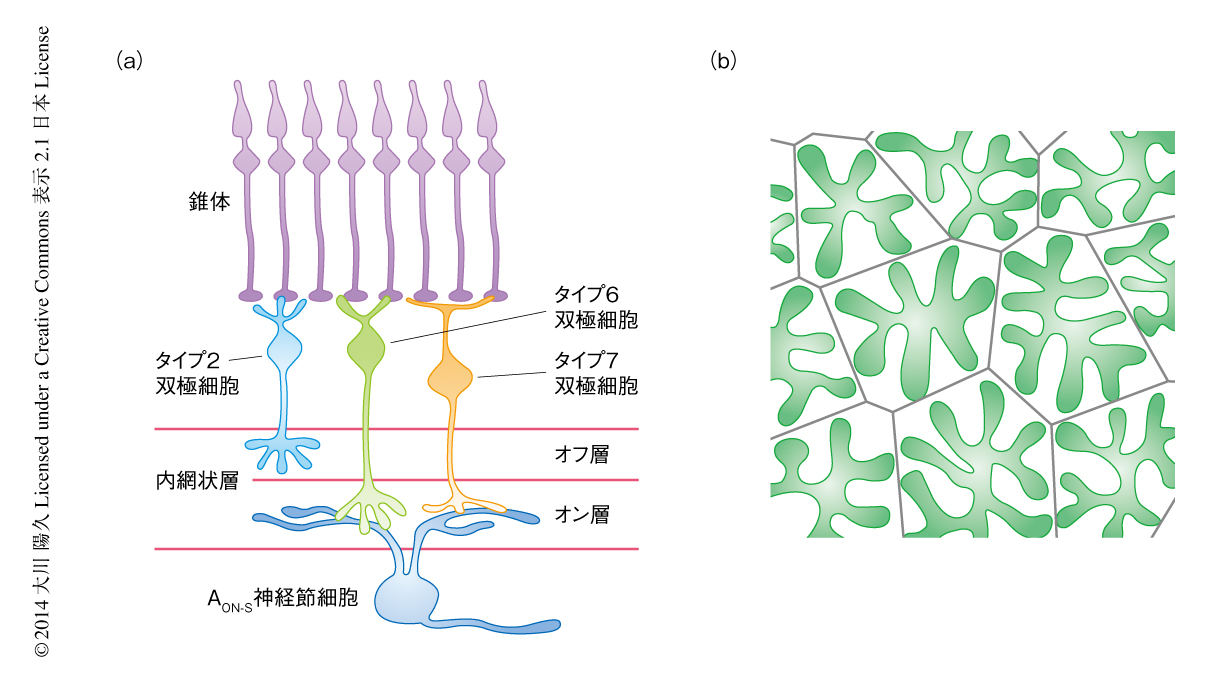
双極細胞は内網状層とよばれるシナプス層において神経節細胞と接続する(図1a).マウスの双極細胞は約13種類に分類される9).そのうち約8種類は光強度の増加にともない興奮するオン型,残りは光強度の減少にともない興奮するオフ型である.オン型の双極細胞とオフ型の双極細胞は,それぞれ,内網状層の内側の半分のオン層と外側の半分のオフ層とで神経節細胞と接続する.一方,神経節細胞においても,オン層に樹状突起を広げオン型の双極細胞のみから入力をうけて光強度の増加に反応するものはオン型の神経節細胞と定義され,同様にオフ型の神経節細胞も定義される.この研究ではとくに,オン型の神経節細胞であるAON-S神経節細胞とよばれるタイプに注目した.この神経節細胞は興奮性の入力の約70%をタイプ6の双極細胞からうけるが(メジャーな入力型),タイプ7の双極細胞からは少量の入力しかうけない(マイナーな入力型)ことが知られている10).
以前の研究から,すべてのオン型の双極細胞において破傷風毒素を発現させることにより神経伝達を阻害した場合,双極細胞および神経節細胞の形態に変化はみられないが,タイプ6の双極細胞とAON-S神経節細胞とのあいだに形成されるシナプスの数が減少することが明らかになっている4,11).しかし,個々のタイプ6の双極細胞あるいはタイプ7の双極細胞が周囲の同じタイプおよび異なるタイプの双極細胞とどのように相互作用しあってAON-S神経節細胞とのシナプスを形成するのかいう点は明らかではなかった.そこで,この研究では,AON-S神経節細胞に対するシナプスの形成の影響について,破傷風毒素の発現により神経伝達を阻害された双極細胞の密度を変えることにより,となりあう双極細胞の神経伝達のレベルの違いが形成されるシナプスの数や特性にあたえる影響を解析し,また,ジフテリア毒素の発現により双極細胞の一部を除去しその密度を操作することにより,神経伝達に依存しない機構がとなりあう双極細胞のシナプスの形成にあたえる影響を明らかにした.
破傷風毒素を発現する(非活動的な)オン型の双極細胞が網膜においてパッチ状に分布するマウスと,網膜においてまばらに分布するマウスの2種類を作製した.まず,パッチ状に分布する網膜において,ひとつのAON-S神経節細胞の樹状突起に存在するすべてのシナプスを可視化し,それらを非活動的なオン型の双極細胞の軸索末端に接するシナプスとそうでない(活動的な)シナプスとに分類した.つぎに,おもに活動的なシナプスがしめる樹状突起のセグメントと,おもに非活動的なシナプスがしめる樹状突起のセグメントとに注目し,シナプスの密度が神経伝達によりどのように変化するかを解析した.その結果,同じAON-S神経節細胞の樹状突起でも非活動的なセグメントでは活動的なセグメントに比べ,つねにシナプスの密度の低いことが明らかになった.したがって,神経伝達によるシナプスの形成の制御は樹状突起の全体ではなく局所的に行われることが示唆された.さらに,活動的なセグメントと非活動的なセグメントとの境界に注目してシナプスの密度の変化を解析したところ,その境界から10μm以内において,それぞれのセグメントのもつシナプスの密度に達することがわかった.10μmという長さはメジャーな入力型であるタイプ6の双極細胞の軸索末端の直径の平均以下であり,シナプスの密度の制御はきわめて局所的に個々の双極細胞のレベルで行われていることが推測された.
そこで,破傷風毒素を発現する双極細胞が網膜においてまばらに散らばるマウスを用いて,非活動的なタイプ6の双極細胞と隣接する活動的なタイプ6の双極細胞とが同じAON-S神経節細胞の樹状突起に接する場合,形成するシナプスの数がどのように変わるかを解析した.となりあう活動的なタイプ6の双極細胞と非活動的なタイプ6の双極細胞は両者とも通常と変わらない領域の軸索末端を維持し,その領域を交錯するAON-S神経節細胞の樹状突起の長さにも変化はみられなかった.ところが,シナプスの数を比較すると,非活動的なタイプ6の双極細胞が形成するシナプスの数が減少した一方で,となりの活動的なタイプ6の双極細胞が形成するシナプスの数に変化はなかった.これまで脊椎動物の神経系において報告されている例では多くの場合,より活発な軸索末端がとなりの不活発な軸索末端の領域やシナプスをうばうことが知られているが12),この結果から,個々の双極細胞からの神経伝達がそれ自体のシナプスの形成を自律的に制御し,周囲の双極細胞のシナプスの形成には影響を及ぼさないことが明らかになった.
となりあう同じタイプの双極細胞の軸索末端は重なることなくタイル状に領域を区分する13)(図1b).このような軸索末端の配置の仕方は,隣接する双極細胞が神経伝達以外の方法により互いのシナプス領域に影響をあたえうることを示す.そのことから,ジフテリア毒素を用いて一部の双極細胞を遺伝的に除去し,残った双極細胞にあたえる変化を解析した.その結果,周囲のタイプ6の双極細胞が除去された場合,残されたタイプ6の双極細胞の軸索末端の領域が拡大し,その領域を交錯するAON-S神経節細胞の樹状突起の長さが増加し形成されるシナプスの数も増加した.おもしろいことに,シナプスの密度(シナプスの数を軸索末端の領域をとおる樹状突起の長さで除した値)に変化はみられなかった.以上の結果を総合すると,となりあう同じタイプの双極細胞は軸索末端の領域を制限しあうことにより互いのシナプスの数を制御するが,その過程に神経伝達はかかわらないと考えられた.
メジャーな入力型(タイプ6の双極細胞)とマイナーな入力型(タイプ7の双極細胞)とが互いのシナプスの形成にあたえる影響について解析した.タイプ6の双極細胞は完全に除去されているがタイプ7の双極細胞の除去は完全ではないAON-S神経節細胞の樹状突起の領域に注目したところ,残ったタイプ7の双極細胞は軸索末端の領域を拡大させシナプスの数を増加させていることがわかった.この変化はタイプ6の双極細胞に起こった変化と類似していたが,タイプ6の双極細胞とは異なり,シナプスの数の増加にくわえシナプスの密度も顕著に増加していた.もし,残ったタイプ7の双極細胞がとなりの除去されたタイプ7の双極細胞が形成するはずだったシナプスの数に相当する分だけシナプスの数を増加させたのなら,シナプスの密度はほとんど変化しなかったはずである.したがって,残ったタイプ7の双極細胞は,ほかのタイプの除去された双極細胞のシナプス(そのほとんどは,タイプ6の双極細胞によるシナプス)の分もある程度までうめあわせたと考えられた.同様のシナプスの数のうめあわせは,タイプ6の双極細胞からの神経伝達を局所的に阻害した場合にはみられなかった.したがって,メジャーな入力型はマイナーな入力型のシナプスの形成を制限するが,その作用はメジャーな入力型の物理的な存在によるものであり,その神経伝達によるものではないと考えられた.
通常,AON-S神経節細胞の樹状突起は内網状層のなかでもオン層に限定されているが,意外にも,オン型の双極細胞が除去された網膜では標識されたAON-S神経節細胞のうち60%以上がいくつかの樹状突起をオフ層へ伸長していた.さらに,オフ層で形成されたシナプスのうち約80%がオフ型のタイプ2の双極細胞の軸索末端に接していた.また,通常のAON-S神経節細胞では光強度の減少ではなく増加に反応して発火するが,オフ層へ樹状突起を伸長したAON-S神経節細胞では光強度が増加したときと減少したときの両方に反応して発火した.さらに,オン型の双極細胞の活動を薬剤により特異的に阻害したところ,光強度の増加に対する反応は阻害されたが光強度の減少に対する反応は阻害されなかった.したがって,オフ層へ伸長した樹状突起はそこでオフ型の双極細胞と機能的なシナプスを形成したと考えられた.このようなAON-S神経節細胞の樹状突起のあやまった投射はオン型の双極細胞からの神経伝達をすべて阻害した場合にはみられないので4),オン型の双極細胞からの神経伝達の不在によりひき起こされたのではなく,オン型の双極細胞の物理的な不在によりひき起こされたと結論づけられた.おもしろい点は,この研究において用いたマウスではオン型の双極細胞がすべて除去されたわけではなくオン型のタイプ5の双極細胞はほぼ完全に残っていることがわかっており,さらに5種類のオフ型の双極細胞がすべて存在するにもかかわらずAON-S神経節細胞が選択的にタイプ2の双極細胞と多くのシナプスを形成したことであった.本来のメジャーな入力型であるタイプ6の双極細胞と,タイプ2の双極細胞は,ともにSynaptotagmin-2を発現しているように13),接続の特異性を決定するタンパク質の発現にも類似性のあることが推測された.同時にこの結果は,もし内網状層にオン層あるいはオフ層という副層構造が存在しなければ,機能的に不適合なタイプ2の双極細胞でもAON-S神経節細胞と多くのシナプスを形成しうる可能性を示唆しており,神経組織の層状構造は適切なパートナーとのあいだの接続を促進するだけでなく14,15),あやまったパートナーとの接続を阻止するうえでも重要であることが示された.
筆者らは,マウスの網膜回路をモデルとして,多種類のシナプス前細胞からの入力が共通のシナプス後細胞に収束する場合,その接続のパターンが個々のシナプス前細胞のレベルにおいてどのように制御されているのか細胞学的なしくみを明らかにした(図2).メジャーな入力型(タイプ6の双極細胞)に関しては,となりあう軸索末端との,おそらく接触を介した相互作用により,それぞれの軸索末端の領域が決定し,同時に,個々の軸索末端がその神経伝達の程度により自律的にシナプスの数を制御する.一方,マイナーな入力型(タイプ7の双極細胞)はメジャーな入力型によりシナプスの数が制限されるが,それはおそらく神経伝達に依存しない未知の分子機構によるものである.そして,メジャーな入力型は神経伝達に依存しない機構により,分子的には適合は可能だが機能的には不適合な入力タイプ(タイプ2の双極細胞)がシナプスを形成するのをふせぐ.
このように,この研究は,神経伝達に依存するしくみと依存しないしくみとがひとつの神経回路においてどのように役割を分担して接続のパターンを構築するのか,その全体像を示した.同時に,いくつかの新しい疑問も提示された.たとえば,ほかの多くのモデルでは,となりあう軸索末端はその活動レベルに依存してシナプスの領域を奪いあうが12),なぜこの研究においてはそのような活動レベルに依存性の競争がみられなかったのか? ほかの多くのモデルでは異なるシナプス前細胞の軸索末端が重なりあい共通のスペースを探索することが可能だが,同じタイプの双極細胞の軸索末端はタイル状に配置する機構によりシナプスの領域の重なりが許容されていない.いまのところ,双極細胞の軸索末端をタイル状に配置するのに必要なタンパク質は報告されていないが,もし,そのようなタンパク質が発見され軸索末端がタイル状の配置の制約から解放されるように操作が行えた場合,活動レベルに依存したシナプスの獲得競争が起こるのかどうか,非常に興味深いところである.
神経伝達の役割における網膜回路とほかの神経回路とのちがいにみるように,筆者らの発見は,必ずしもすべての神経回路にあてはまるわけではない.今後,脳におけるより複雑な神経回路においても,細胞のタイプがより明確に定義され,技術的な進歩が進むとともに,さまざまなタイプのニューロンがどのように影響を及ぼしあって適切な接続のパターンを形成するのか,理解が進むものと期待される.
略歴:2009年 米国Southern California大学大学院博士課程 修了,同年より米国Washington大学 ポスドク.
© 2014 大川 陽久 Licensed under CC 表示 2.1 日本
(米国Washington大学Department of Biological Structure)
email:大川陽久
DOI: 10.7875/first.author.2014.048
Interplay of cell-autonomous and nonautonomous mechanisms tailors synaptic connectivity of converging axons in vivo.
Haruhisa Okawa, Luca Della Santina, Gregory W. Schwartz, Fred Rieke, Rachel O.L. Wong
Neuron, 82, 125-137 (2014)
要 約
神経組織が発達する過程において,ニューロンのあいだの正確なシナプス接続が形成されることは神経回路が適切に機能するうえで不可欠である.一般に,ひとつのニューロンには複数のタイプのシナプス前細胞からの入力が収束するが,それぞれのタイプのシナプス前細胞にはタイプに特有なシナプス接続のパターンがみられる.シナプス後細胞を共有する異なったタイプのシナプス前細胞が互いの接続を制御しあい,タイプに特有な接続パターンによりシナプスを形成する分子機構の全容はいまだ明らかではない.筆者らは,網膜の双極細胞と神経節細胞とのあいだの神経回路をモデルとし,神経伝達に依存する機構と依存しない機構とがどのように協調して個々の双極細胞のタイプに特有なシナプス接続のパターンを制御しているかについて解析した.その結果,神経伝達に依存しない機構は双極細胞の同じタイプのあいだおよび異なったタイプのあいだにはたらき,正しい双極細胞のタイプの選択およびそのタイプに特有のシナプスの数を制御するのに対して,個々の双極細胞からの神経伝達は周囲の双極細胞に影響をあたえることなく,自律的に作用してそれ自体のシナプスの数を制御することがわかった.この研究は,ひとつの神経回路において異なる機構がシナプスの形成の異なった局面に協調的にはたらき整然とした接続パターンを構築することを明らかにした.
はじめに
神経組織の特質のひとつは,多種多様なニューロンが非常に秩序だって接続していることである.たとえば,小脳プルキンエ細胞は平行繊維とよばれる顆粒細胞の軸索と登上繊維とよばれる下オリーブ核ニューロンの軸索からの入力をうけるが,ひとつのプルキンエ細胞に10万本以上の平行繊維が入力するのに対し,登上繊維はたった1本しか入力しない.したがって,全体としては顆粒細胞からのシナプスの数は下オリーブ核からのシナプスの数に比べ圧倒的に多い.ところが,個々のシナプス前細胞からの入力を比較すると,1本の平行繊維はほんの2~3個のシナプスしか形成しないのに対し,1本の登上繊維は約500個ものシナプスを形成する.このようなニューロンのあいだのステレオタイプな接続パターンは神経回路の正常な機能において不可欠であるが,どうやってこのような特異な接続パターンが発生の過程において生じるのかという問題は神経発生学における主要なテーマのひとつである.さらに,そのしくみを理解することは,今後,疾患などにより失われた細胞を外部から補充し正常な接続を回復させるうえで非常に重要である.
近年の研究から,ニューロンが特定のパートナーと選択的にシナプスを形成する分子機構や1-3),複数のパートナーとの接続を制御する分子機構に関して4-7),多くのことが明らかになりつつある.未解明なのは,複数の種類のパートナーからの入力が個々のシナプス前細胞のレベルでどのように制御されているのか,より具体的には,個々のシナプス前細胞によるシナプス接続のパターンは,周囲の同じタイプおよび異なるタイプのシナプス前細胞によりどのような影響をうけるのかという問題である.この問題に答えるためには,ひとつのシナプス後細胞に入力する個々のシナプス前細胞のタイプを同定するとともに,それらのあいだに形成されるシナプスを可視化することが必要であるが,脳の神経回路では多くのニューロンのタイプが不明確なうえ,長距離の軸索投射と広範囲にわたる軸索末端をもつニューロンが多いため,この問題を解決することは技術的に容易ではない.それに対して,この研究においてモデルとして用いた網膜は多くのニューロンの種類が明らかになっており,その機能も比較的よくわかっている8).さらに,コンパクトな網膜の大きさとその整然とした層状の構造は,個々の特定されたニューロンのあいだのシナプス接続を可視化するうえで非常に都合がよい.また,網膜の双極細胞と神経節細胞とのあいだの神経回路は単純ではあるが,ちょうどこの問題に取り組むだけの複雑さを備えている.そこで,筆者らは,双極細胞と神経節細胞とのあいだのシナプス結合をモデルとして,個々のシナプス前細胞(双極細胞)のレベルで接続のパターンがどのように制御されているのか,その細胞レベルにおけるしくみを解明することを試みた.
双極細胞は内網状層とよばれるシナプス層において神経節細胞と接続する(図1a).マウスの双極細胞は約13種類に分類される9).そのうち約8種類は光強度の増加にともない興奮するオン型,残りは光強度の減少にともない興奮するオフ型である.オン型の双極細胞とオフ型の双極細胞は,それぞれ,内網状層の内側の半分のオン層と外側の半分のオフ層とで神経節細胞と接続する.一方,神経節細胞においても,オン層に樹状突起を広げオン型の双極細胞のみから入力をうけて光強度の増加に反応するものはオン型の神経節細胞と定義され,同様にオフ型の神経節細胞も定義される.この研究ではとくに,オン型の神経節細胞であるAON-S神経節細胞とよばれるタイプに注目した.この神経節細胞は興奮性の入力の約70%をタイプ6の双極細胞からうけるが(メジャーな入力型),タイプ7の双極細胞からは少量の入力しかうけない(マイナーな入力型)ことが知られている10).
以前の研究から,すべてのオン型の双極細胞において破傷風毒素を発現させることにより神経伝達を阻害した場合,双極細胞および神経節細胞の形態に変化はみられないが,タイプ6の双極細胞とAON-S神経節細胞とのあいだに形成されるシナプスの数が減少することが明らかになっている4,11).しかし,個々のタイプ6の双極細胞あるいはタイプ7の双極細胞が周囲の同じタイプおよび異なるタイプの双極細胞とどのように相互作用しあってAON-S神経節細胞とのシナプスを形成するのかいう点は明らかではなかった.そこで,この研究では,AON-S神経節細胞に対するシナプスの形成の影響について,破傷風毒素の発現により神経伝達を阻害された双極細胞の密度を変えることにより,となりあう双極細胞の神経伝達のレベルの違いが形成されるシナプスの数や特性にあたえる影響を解析し,また,ジフテリア毒素の発現により双極細胞の一部を除去しその密度を操作することにより,神経伝達に依存しない機構がとなりあう双極細胞のシナプスの形成にあたえる影響を明らかにした.
1.神経伝達は双極細胞のシナプスの形成を自律的に制御しとなりあう双極細胞のあいだのシナプスの獲得競争をひき起こさない
破傷風毒素を発現する(非活動的な)オン型の双極細胞が網膜においてパッチ状に分布するマウスと,網膜においてまばらに分布するマウスの2種類を作製した.まず,パッチ状に分布する網膜において,ひとつのAON-S神経節細胞の樹状突起に存在するすべてのシナプスを可視化し,それらを非活動的なオン型の双極細胞の軸索末端に接するシナプスとそうでない(活動的な)シナプスとに分類した.つぎに,おもに活動的なシナプスがしめる樹状突起のセグメントと,おもに非活動的なシナプスがしめる樹状突起のセグメントとに注目し,シナプスの密度が神経伝達によりどのように変化するかを解析した.その結果,同じAON-S神経節細胞の樹状突起でも非活動的なセグメントでは活動的なセグメントに比べ,つねにシナプスの密度の低いことが明らかになった.したがって,神経伝達によるシナプスの形成の制御は樹状突起の全体ではなく局所的に行われることが示唆された.さらに,活動的なセグメントと非活動的なセグメントとの境界に注目してシナプスの密度の変化を解析したところ,その境界から10μm以内において,それぞれのセグメントのもつシナプスの密度に達することがわかった.10μmという長さはメジャーな入力型であるタイプ6の双極細胞の軸索末端の直径の平均以下であり,シナプスの密度の制御はきわめて局所的に個々の双極細胞のレベルで行われていることが推測された.
そこで,破傷風毒素を発現する双極細胞が網膜においてまばらに散らばるマウスを用いて,非活動的なタイプ6の双極細胞と隣接する活動的なタイプ6の双極細胞とが同じAON-S神経節細胞の樹状突起に接する場合,形成するシナプスの数がどのように変わるかを解析した.となりあう活動的なタイプ6の双極細胞と非活動的なタイプ6の双極細胞は両者とも通常と変わらない領域の軸索末端を維持し,その領域を交錯するAON-S神経節細胞の樹状突起の長さにも変化はみられなかった.ところが,シナプスの数を比較すると,非活動的なタイプ6の双極細胞が形成するシナプスの数が減少した一方で,となりの活動的なタイプ6の双極細胞が形成するシナプスの数に変化はなかった.これまで脊椎動物の神経系において報告されている例では多くの場合,より活発な軸索末端がとなりの不活発な軸索末端の領域やシナプスをうばうことが知られているが12),この結果から,個々の双極細胞からの神経伝達がそれ自体のシナプスの形成を自律的に制御し,周囲の双極細胞のシナプスの形成には影響を及ぼさないことが明らかになった.
2.となりあう双極細胞は軸索末端の領域を制限しあうことにより互いのシナプスの数を制御する
となりあう同じタイプの双極細胞の軸索末端は重なることなくタイル状に領域を区分する13)(図1b).このような軸索末端の配置の仕方は,隣接する双極細胞が神経伝達以外の方法により互いのシナプス領域に影響をあたえうることを示す.そのことから,ジフテリア毒素を用いて一部の双極細胞を遺伝的に除去し,残った双極細胞にあたえる変化を解析した.その結果,周囲のタイプ6の双極細胞が除去された場合,残されたタイプ6の双極細胞の軸索末端の領域が拡大し,その領域を交錯するAON-S神経節細胞の樹状突起の長さが増加し形成されるシナプスの数も増加した.おもしろいことに,シナプスの密度(シナプスの数を軸索末端の領域をとおる樹状突起の長さで除した値)に変化はみられなかった.以上の結果を総合すると,となりあう同じタイプの双極細胞は軸索末端の領域を制限しあうことにより互いのシナプスの数を制御するが,その過程に神経伝達はかかわらないと考えられた.
3.メジャーな入力型の存在がマイナーな入力型のシナプスの形成を制限する
メジャーな入力型(タイプ6の双極細胞)とマイナーな入力型(タイプ7の双極細胞)とが互いのシナプスの形成にあたえる影響について解析した.タイプ6の双極細胞は完全に除去されているがタイプ7の双極細胞の除去は完全ではないAON-S神経節細胞の樹状突起の領域に注目したところ,残ったタイプ7の双極細胞は軸索末端の領域を拡大させシナプスの数を増加させていることがわかった.この変化はタイプ6の双極細胞に起こった変化と類似していたが,タイプ6の双極細胞とは異なり,シナプスの数の増加にくわえシナプスの密度も顕著に増加していた.もし,残ったタイプ7の双極細胞がとなりの除去されたタイプ7の双極細胞が形成するはずだったシナプスの数に相当する分だけシナプスの数を増加させたのなら,シナプスの密度はほとんど変化しなかったはずである.したがって,残ったタイプ7の双極細胞は,ほかのタイプの除去された双極細胞のシナプス(そのほとんどは,タイプ6の双極細胞によるシナプス)の分もある程度までうめあわせたと考えられた.同様のシナプスの数のうめあわせは,タイプ6の双極細胞からの神経伝達を局所的に阻害した場合にはみられなかった.したがって,メジャーな入力型はマイナーな入力型のシナプスの形成を制限するが,その作用はメジャーな入力型の物理的な存在によるものであり,その神経伝達によるものではないと考えられた.
4.オン型の双極細胞はオフ型の双極細胞とオン型の神経節細胞とのあいだの機能的に不整合なシナプスの形成を阻止する
通常,AON-S神経節細胞の樹状突起は内網状層のなかでもオン層に限定されているが,意外にも,オン型の双極細胞が除去された網膜では標識されたAON-S神経節細胞のうち60%以上がいくつかの樹状突起をオフ層へ伸長していた.さらに,オフ層で形成されたシナプスのうち約80%がオフ型のタイプ2の双極細胞の軸索末端に接していた.また,通常のAON-S神経節細胞では光強度の減少ではなく増加に反応して発火するが,オフ層へ樹状突起を伸長したAON-S神経節細胞では光強度が増加したときと減少したときの両方に反応して発火した.さらに,オン型の双極細胞の活動を薬剤により特異的に阻害したところ,光強度の増加に対する反応は阻害されたが光強度の減少に対する反応は阻害されなかった.したがって,オフ層へ伸長した樹状突起はそこでオフ型の双極細胞と機能的なシナプスを形成したと考えられた.このようなAON-S神経節細胞の樹状突起のあやまった投射はオン型の双極細胞からの神経伝達をすべて阻害した場合にはみられないので4),オン型の双極細胞からの神経伝達の不在によりひき起こされたのではなく,オン型の双極細胞の物理的な不在によりひき起こされたと結論づけられた.おもしろい点は,この研究において用いたマウスではオン型の双極細胞がすべて除去されたわけではなくオン型のタイプ5の双極細胞はほぼ完全に残っていることがわかっており,さらに5種類のオフ型の双極細胞がすべて存在するにもかかわらずAON-S神経節細胞が選択的にタイプ2の双極細胞と多くのシナプスを形成したことであった.本来のメジャーな入力型であるタイプ6の双極細胞と,タイプ2の双極細胞は,ともにSynaptotagmin-2を発現しているように13),接続の特異性を決定するタンパク質の発現にも類似性のあることが推測された.同時にこの結果は,もし内網状層にオン層あるいはオフ層という副層構造が存在しなければ,機能的に不適合なタイプ2の双極細胞でもAON-S神経節細胞と多くのシナプスを形成しうる可能性を示唆しており,神経組織の層状構造は適切なパートナーとのあいだの接続を促進するだけでなく14,15),あやまったパートナーとの接続を阻止するうえでも重要であることが示された.
おわりに
筆者らは,マウスの網膜回路をモデルとして,多種類のシナプス前細胞からの入力が共通のシナプス後細胞に収束する場合,その接続のパターンが個々のシナプス前細胞のレベルにおいてどのように制御されているのか細胞学的なしくみを明らかにした(図2).メジャーな入力型(タイプ6の双極細胞)に関しては,となりあう軸索末端との,おそらく接触を介した相互作用により,それぞれの軸索末端の領域が決定し,同時に,個々の軸索末端がその神経伝達の程度により自律的にシナプスの数を制御する.一方,マイナーな入力型(タイプ7の双極細胞)はメジャーな入力型によりシナプスの数が制限されるが,それはおそらく神経伝達に依存しない未知の分子機構によるものである.そして,メジャーな入力型は神経伝達に依存しない機構により,分子的には適合は可能だが機能的には不適合な入力タイプ(タイプ2の双極細胞)がシナプスを形成するのをふせぐ.
このように,この研究は,神経伝達に依存するしくみと依存しないしくみとがひとつの神経回路においてどのように役割を分担して接続のパターンを構築するのか,その全体像を示した.同時に,いくつかの新しい疑問も提示された.たとえば,ほかの多くのモデルでは,となりあう軸索末端はその活動レベルに依存してシナプスの領域を奪いあうが12),なぜこの研究においてはそのような活動レベルに依存性の競争がみられなかったのか? ほかの多くのモデルでは異なるシナプス前細胞の軸索末端が重なりあい共通のスペースを探索することが可能だが,同じタイプの双極細胞の軸索末端はタイル状に配置する機構によりシナプスの領域の重なりが許容されていない.いまのところ,双極細胞の軸索末端をタイル状に配置するのに必要なタンパク質は報告されていないが,もし,そのようなタンパク質が発見され軸索末端がタイル状の配置の制約から解放されるように操作が行えた場合,活動レベルに依存したシナプスの獲得競争が起こるのかどうか,非常に興味深いところである.
神経伝達の役割における網膜回路とほかの神経回路とのちがいにみるように,筆者らの発見は,必ずしもすべての神経回路にあてはまるわけではない.今後,脳におけるより複雑な神経回路においても,細胞のタイプがより明確に定義され,技術的な進歩が進むとともに,さまざまなタイプのニューロンがどのように影響を及ぼしあって適切な接続のパターンを形成するのか,理解が進むものと期待される.
文 献
- Sanes, J. R. & Yamagata, M.: Many paths to synaptic specificity. Annu. Rev. Cell Dev. Biol., 25, 161-195 (2009)[PubMed]
- Shen, K. & Scheiffele, P.: Genetics and cell biology of building specific synaptic connectivity. Annu. Rev. Neurosci., 33, 473-507 (2010)[PubMed]
- Williams, M. E., de Wit, J. & Ghosh, A.: Molecular mechanisms of synaptic specificity in developing neural circuits. Neuron, 68, 9-18 (2010)[PubMed]
- Kerschensteiner, D., Morgan, J. L., Parker, E. D. et al.: Neurotransmission selectively regulates synapse formation in parallel circuits in vivo. Nature, 460, 1016-1020 (2009)[PubMed]
- Hashimoto, K., Yoshida, T., Sakimura, K. et al.: Influence of parallel fiber-Purkinje cell synapse formation on postnatal development of climbing fiber-Purkinje cell synapses in the cerebellum. Neuroscience, 162, 601-611 (2009)[PubMed]
- DeNardo, L. A., de Wit, J., Otto-Hitt, S. et al.: NGL-2 regulates input-specific synapse development in CA1 pyramidal neurons. Neuron, 76, 762-775 (2012)[PubMed]
- Ding, J. B., Oh, W. J., Sabatini, B. L. et al.: Semaphorin 3E-Plexin-D1 signaling controls pathway-specific synapse formation in the striatum. Nat. Neurosci., 15, 215-223 (2012)[PubMed]
- Masland, R. H.: The neuronal organization of the retina. Neuron, 76, 266-280 (2012)[PubMed]
- Helmstaedter, M., Briggman, K. L., Turaga, S. C. et al.: Connectomic reconstruction of the inner plexiform layer in the mouse retina. Nature, 500, 168-174 (2013)[PubMed]
- Schwartz, G. W., Okawa, H., Dunn, F. A. et al.: The spatial structure of a nonlinear receptive field. Nat. Neurosci., 15, 1572-1580 (2012)[PubMed]
- Morgan, J. L., Soto, F., Wong, R. O. et al.: Development of cell type-specific connectivity patterns of converging excitatory axons in the retina. Neuron, 71, 1014-1021 (2011)[PubMed]
- Bleckert, A. & Wong, R. O.: Identifying roles for neurotransmission in circuit assembly: insights gained from multiple model systems and experimental approaches. Bioessays, 33, 61-72 (2011)[PubMed]
- Wassle, H., Puller, C., Muller, F. et al.: Cone contacts, mosaics, and territories of bipolar cells in the mouse retina. J. Neurosci., 29, 106-117 (2009)[PubMed]
- Yamagata, M. & Sanes, J. R.: Dscam and Sidekick proteins direct lamina-specific synaptic connections in vertebrate retina. Nature, 451, 465-469 (2008)[PubMed]
- Matsuoka, R. L., Chivatakarn, O., Badea, T. C. et al.: Class 5 transmembrane semaphorins control selective Mammalian retinal lamination and function. Neuron, 71, 460-473 (2011)[PubMed]
著者プロフィール
略歴:2009年 米国Southern California大学大学院博士課程 修了,同年より米国Washington大学 ポスドク.
© 2014 大川 陽久 Licensed under CC 表示 2.1 日本