乳腺の形成および再生の過程における転写因子Ovol2による上皮間葉移行の制御
渡邉和秀・Xing Dai
(米国California大学Irvine校School of Medicine,Department of Biological Chemistry)
email:渡邉和秀
DOI: 10.7875/first.author.2014.047
Mammary morphogenesis and regeneration require the inhibition of EMT at terminal end buds by Ovol2 transcriptional repressor.
Kazuhide Watanabe, Alvaro Villarreal-Ponce, Peng Sun, Michael L. Salmans, Magid Fallahi, Bogi Andersen, Xing Dai
Developmental Cell, 29, 59-74 (2014)
上皮細胞は顕著な可塑性をもち上皮間葉移行を介して間葉系の細胞になりうるが,この上皮細胞の可塑性がどのように制御されているかは明らかでない.筆者らは,転写因子Ovol2による上皮間葉移行に対する抑制性の制御が乳腺の形成および再生の過程において不可欠であることを明らかにした.Ovol2が乳腺上皮細胞において特異的に欠損すると乳腺の管形成が抑制され,乳腺上皮前駆細胞および乳腺幹細胞が枯渇するとともに,乳腺上皮細胞が上皮間葉移行を起こし非上皮系の細胞へと転換した.Ovol2は上皮間葉移行を促進するタンパク質を抑制し,また,Ovol2の欠損により乳腺上皮細胞のTGFβに対する反応性が増殖の抑制から上皮間葉移行の誘導へと変化した.さらに,Ovol2を転移性乳がん細胞に強制発現させると,間葉系の細胞から上皮系の細胞へと変換した.これらの結果は,上皮細胞における可塑性の制御ががんや発生において重要であることを示唆した.
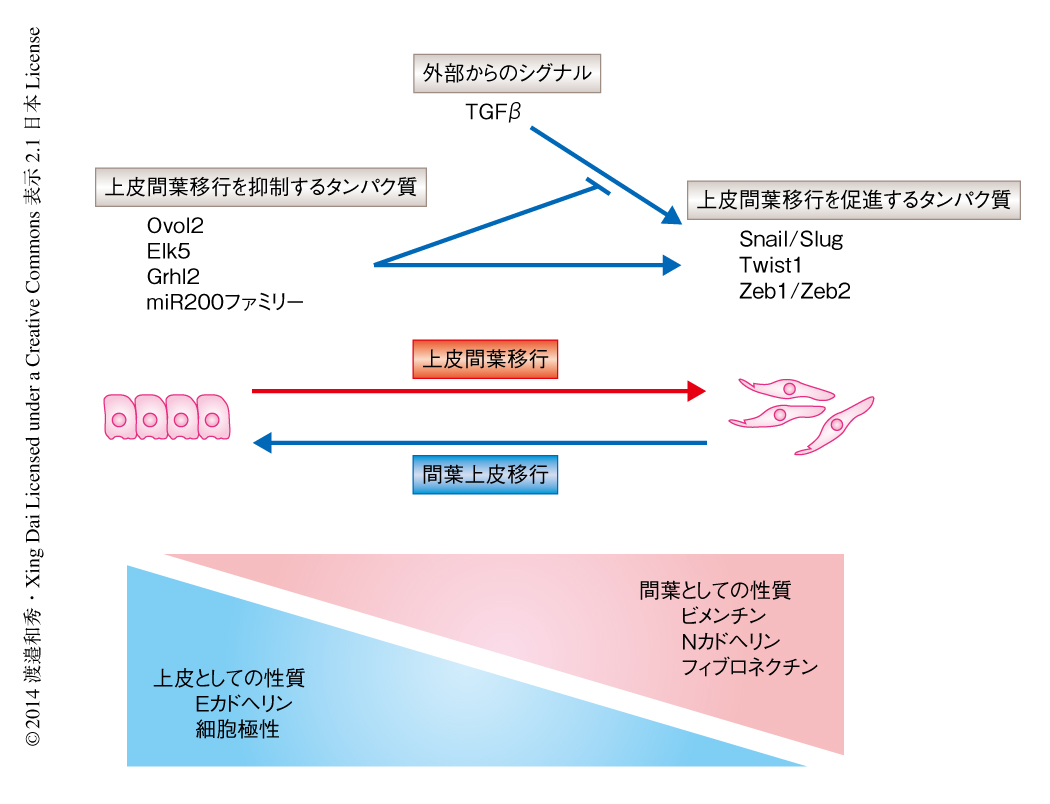
近年の体細胞リプログラミング技術の進歩は再生医療の発展に多大な可能性をもたらしているが,同時に,生物学的なコンテクストにおいて体細胞のもつ顕著な可塑性をほのめかしている.しかしながら,生体においてそのような可塑性をいきすぎないよう制御する機構に関してはほとんど未解明である.上皮系の細胞は上皮間葉移行(epithelial-mesenchymal transition:EMT)を介して間葉系の細胞としての性質を獲得するが,この上皮細胞における可塑性の制御が形態形成にどのようにかかわっているのかはくわしく知られていない.また,上皮間葉移行を促進的に制御するタンパク質に関する研究は多くあるものの,上皮間葉移行に対しブレーキ的な役割をはたす分子機構に関しては報告が限られている(図1).
マウスの乳腺は生後,とくに思春期および妊娠期においてダイナミックな形態変化を示す特異な上皮組織であり,発生における上皮細胞の可塑性の研究に適している1).発生初期の中胚葉や神経堤の形成においては上皮間葉移行を介する間葉系の細胞への移行が完結するのに対し,乳腺の形態形成においては部分的かつ可逆的な上皮間葉移行が起こっていると推測される2,3).とくに,思春期にみられる末梢芽状突起(terminal end bud)とよばれる管腔の末端の特殊な部位の上皮細胞は,上皮細胞のあいだの連結を保ちつつ運動性を獲得することによりダイナミックな形態形成に寄与していると考えられる4).それらの上皮細胞は接着性および極性をふたたび獲得することにより成熟した管腔構造を形成する.さらに,妊娠の前後に生じる顕著な組織の形態変化においても上皮細胞の可塑性が寄与していると考えられる.しかしながら,このような顕著な可塑性をもつ上皮細胞の自己同一性がどのような分子機構により保たれているかについては不明な点が多い.
Ovol2はOvolファミリータンパク質に属するジンクフィンガー型の転写因子であり,ショウジョウバエの表皮の形成,哺乳類の皮膚や精巣の形成を制御していることが知られている5,6).興味深いことに,Ovolファミリータンパク質は上皮間葉移行に対し促進性の転写因子であるSnailやSlugと共通したSnail1/GFP(SNAG)ドメインをもつことから7),上皮間葉移行の制御になんらかの関連があるのではないかと考えられた.この研究では,マウスの遺伝学的な手法およびゲノム解析を用いて,Ovol2が上皮間葉移行に対し促進性の転写因子および間葉系の細胞としての性質を抑制的に制御することにより,乳腺の発生の過程において過剰な上皮間葉移行を抑制し上皮細胞の自己同一性を維持し,乳腺上皮細胞の形態形成に重要な役割をはたしていることを報告した.また,乳がん細胞におけるOvol2の発現はがん細胞の転移能および浸潤能と逆相関し,Ovol2の再発現により転移性乳がん細胞が上皮細胞様の性質をとりもどすことを明らかにした.
乳腺組織においてOvol2は上皮細胞に特異的な発現パターンを示し,間質細胞における発現はほぼ認められなかった.乳腺は基底上皮細胞系および管上皮細胞系の2つの分化系列よりなりたっているが,Ovol2は管上皮細胞系細胞において強く発現し,また,基底上皮細胞系においても部分的に発現が検出された.興味深いことに,乳腺細胞に人為的に上皮間葉移行を起こすと,その進行にともないOvol2の発現は低下した.これらの結果より,Ovol2の発現は細胞の上皮細胞としての性質に強く関連していると考えられた.
乳腺の形成におけるOvol2の役割を調べるため,皮膚および乳腺上皮に特異的なOvol2ノックアウトマウスを作製し解析した.このノックアウトマウスの乳腺組織は生後3週までは明らかな異常は認められないが,生後4~8週の思春期における乳腺の形成がほぼ完全に阻害された.とくに,末梢芽状突起が顕著な退縮を起こし管腔構造の伸長が停止した.また,生後7~8週以降では間質の異常な線維化が認められた.皮膚および乳腺上皮に特異的なOvol2ノックアウトマウスは正常に妊娠し出産するが,乳腺の機能が低下しており,新生仔を養うのに十分なミルクを産生できなかった.このノックアウトマウスの乳腺脂肪組織に野生型のマウスに由来する乳腺上皮細胞を移植すると正常な乳腺を形成したことから,ホルモン環境そのものは正常に保たれていることが推測された.また,ホルモン受容体の発現にも変化はなかった.さらに,乳腺の過形成を起こすことが知られているMMTV-Wnt1マウスにおける過剰な分枝の形成はOvol2の欠損に影響されず,管腔構造の伸長と方向性のみが影響されたことから,Ovol2の欠損は思春期に特有の構造である末梢芽状突起に依存した形態形成に特異的に機能していると考えられた.
生後3.5週の乳腺組織から末梢芽状突起のみを単離して遺伝子発現を解析したところ,皮膚および乳腺上皮に特異的なOvol2ノックアウトマウスの末梢芽状突起において,上皮間葉移行に関連する遺伝子,細胞外マトリックスの制御にかかわる遺伝子,TGFβの標的となる遺伝子などが顕著に高く発現しており,細胞分裂に関与する遺伝子の発現が有意に低下していた.また,単離した末梢芽状突起をマトリゲルの内部で培養すると,野生型マウスに由来する末梢芽状突起は上皮細胞の連結を保ったままゲル内に伸長していく統合的な細胞遊走を起こしたのに対し,皮膚および乳腺上皮に特異的なOvol2ノックアウトマウスに由来する末梢芽状突起は個々の細胞がゲル内にバラバラに浸潤していった.この個別の浸潤は間葉系の細胞に似た形態変化と関連し,Zeb1遺伝子,Zeb2遺伝子,Twist1遺伝子,Snai1遺伝子,Snai2遺伝子,Vim遺伝子,Cdh2遺伝子といった上皮間葉移行に関連する遺伝子の発現上昇をともなった.さらに,乳腺組織においても,末梢芽状突起の内部においてVim遺伝子に陽性の細胞が有意に上昇しており,Ovol2の欠損は上皮間葉移行様の変化を誘導して乳腺の形成を阻害すると推測された.
マウスの乳腺基底上皮細胞系のなかに多分化能をもち単一の細胞から機能的な乳腺を形成しうる幹細胞の存在することが,おもに細胞移植実験により明らかにされている8,9).Ovol2を欠損した基底上皮細胞を宿主となるマウスに同所移植すると,形成不全の乳腺の管腔構造にくわえ,線維芽細胞様の異常な構造が形成された.遺伝学的な細胞系譜の追跡実験により,これらの線維芽細胞様の細胞は間葉系の細胞の混入ではなく上皮系の細胞に由来することが確認された.また,乳腺構造を形成できる幹細胞の割合は皮膚および乳腺上皮に特異的なOvol2ノックアウトマウスの乳腺において有意に減少していた.さらに,遺伝学的な細胞系譜の追跡実験により,生理条件においてこの線維芽細胞様の細胞は,妊娠の経験のないマウスでは検出されなかったが,複数回の妊娠を経験したマウスにおいては高頻度にみられた.これらの結果より,Ovol2の欠損は乳腺幹細胞の機能に影響を及ぼし,また,Ovol2の欠損による上皮間葉移行の促進は移植や妊娠といった組織の再形成の過程をへることにより顕著に現われることが推測された.
Ovol2の機能を分子レベルで解明するため,乳腺上皮細胞株HC11細胞を用いて,次世代シークエンサーによるゲノムワイドのクロマチン-免疫沈降実験を行った.その結果,ゲノムには合計3092箇所のOvol2の結合ピークが同定され,その30%以上は転写開始部位の近傍に認められた.なかでも,Zeb1遺伝子,Zeb2遺伝子,Twist1遺伝子,Snai1遺伝子,Snai2遺伝子,Vim遺伝子,Cdh2遺伝子といった上皮間葉移行に関連する遺伝子のすべてにおいてOvol2の結合ピークが検出された.とくに,Zeb1遺伝子およびVim遺伝子におけるピークは顕著であり,これらは末梢芽状突起に対するマイクロアレイ解析によっても皮膚および乳腺上皮に特異的なOvol2ノックアウトマウスにおいて発現が有意に上昇していた.
Ovol2の結合のみられた遺伝子について,末梢芽状突起における遺伝子発現データをGSEA(gene set enrichment analysis)法により解析したところ,皮膚および乳腺上皮に特異的なOvol2ノックアウトマウスにおいて発現が有意に上昇していた.このことは,Ovol2が転写因子としておもに抑制性に機能していることを示した.そしてこのことは,Ovol2の3つのアイソフォームのうち,抑制性のアイソフォームであるOvol2Aのみが乳腺上皮細胞に発現していることと合致した.実際に,Ovol2の欠損による上皮間葉移行に関連する遺伝子の発現上昇および乳腺の形成異常はOvol2Aの再発現により正常化されたが,ほかのアイソフォームの再発現では正常化されなかった.さらに,Ovol2の欠損による乳腺の形成および上皮間葉移行の促進はZeb1遺伝子のノックダウンあるいはTGFβシグナルの抑制により部分的に正常化された.興味深いことに,Ovol2の欠損によりTGFβシグナルに対する反応性は増殖の抑制から上皮間葉移行の誘導へと変化した.これらの結果は,Ovol2が上皮間葉移行に関連する遺伝子を抑制的に制御しており,とくに,Zeb1遺伝子およびTGFβシグナルがOvol2の下流において重要な役割をはたしていることを示唆した.
上皮間葉移行とがんとの関連性についてはよく知られているため,Ovol2が乳がんの転移および浸潤とどのような関連をもつかについて調べた.その結果,Ovol2の発現は乳がん細胞の転移能と逆相関しており,さらに,Ovol2の標的と同定されたほとんどの上皮間葉移行に関連する遺伝子の発現とは逆相関していた.とくに,転移性乳がん細胞の多くはOvol2を発現していなかった.そのようなOvol2陰性の転移性乳がん細胞にOvol2Aを発現させると,Vim遺伝子やZeb1遺伝子などの上皮間葉移行に関連する遺伝子の発現が抑制され,EカドヘリンをコードするCdh1遺伝子の発現が誘導されると同時に,遊走能および浸潤能も抑制された.また,Ovol2の発現により,ある乳がん細胞では接触障害(contact inhibition)が誘導された.さらに,乳がん患者の臨床データの解析では,Ovol2を高発現する群は転移するまでの期間がOvol2を低発現する群に対し長く,また,全体の生命予後も良好であった.これらの結果より,Ovol2の発現は乳がんにおいても上皮間葉移行あるいは間葉系の細胞としての性質を抑制的に制御し,Ovol2の発現の低下はがんの転移と関連していることが示唆された.
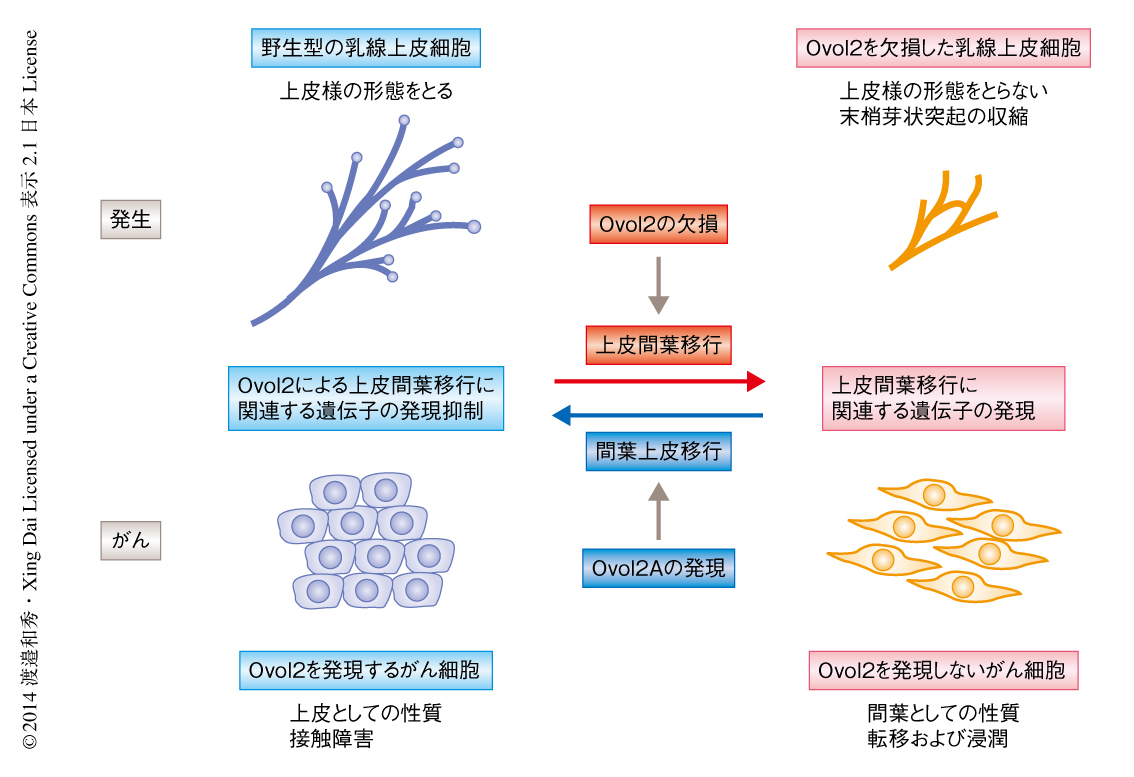
今回,筆者らは,乳腺の形態形成において上皮細胞の自己同一性を維持する分子機構に,転写因子Ovol2が重要な役割をはたすことを解明した(図2).上皮間葉移行が幹細胞の機能に対し促進的にはたらくことは過去の報告により知られていたが10),上皮細胞の自己同一性の破綻が形態形成を完全に阻害し幹細胞の機能を低下させたことは,生理的な発生の過程における上皮間葉移行のいきすぎは逆に幹細胞の機能を低下させることを示唆し,概念的にも興味深い.筆者らの研究室では,この論文と同時に,Ovolファミリータンパク質が皮膚においても同様の役割をはたすことを報告しているが11)(Developmental Cell誌に同時掲載),ほかの上皮組織においても同様な分子機構により上皮細胞の自己同一性が保たれているのかどうか,今後の研究が待たれる.また,乳がん細胞においてもOvol2は細胞の上皮細胞としての性質を維持する転写因子としてはたらいていることが示唆された(図2).とくに,Ovol2の再発現により上皮細胞としての性質が獲得され乳がん細胞の転移能および浸潤能が抑制されたことから,新たな乳がんの治療法の開発につながることが期待される.
略歴:2005年 東北大学大学院医学研究科にて博士号取得,同年 米国NIH National Cancer Institute研究員,2009年 米国California大学Irvine校School of Medicine研究員を経て,2010年より同Project scientist.
研究テーマ:発生の過程およびがんにおける上皮組織細胞の運命決定機構の分子機序.
関心事:研究,ロッククライミング.
Xing Dai
米国California大学Irvine校School of MedicineにてProfessor.
研究室URL:http://mfallahi.biochem.uci.edu/
© 2014 渡邉和秀・Xing Dai Licensed under CC 表示 2.1 日本
(米国California大学Irvine校School of Medicine,Department of Biological Chemistry)
email:渡邉和秀
DOI: 10.7875/first.author.2014.047
Mammary morphogenesis and regeneration require the inhibition of EMT at terminal end buds by Ovol2 transcriptional repressor.
Kazuhide Watanabe, Alvaro Villarreal-Ponce, Peng Sun, Michael L. Salmans, Magid Fallahi, Bogi Andersen, Xing Dai
Developmental Cell, 29, 59-74 (2014)
要 約
上皮細胞は顕著な可塑性をもち上皮間葉移行を介して間葉系の細胞になりうるが,この上皮細胞の可塑性がどのように制御されているかは明らかでない.筆者らは,転写因子Ovol2による上皮間葉移行に対する抑制性の制御が乳腺の形成および再生の過程において不可欠であることを明らかにした.Ovol2が乳腺上皮細胞において特異的に欠損すると乳腺の管形成が抑制され,乳腺上皮前駆細胞および乳腺幹細胞が枯渇するとともに,乳腺上皮細胞が上皮間葉移行を起こし非上皮系の細胞へと転換した.Ovol2は上皮間葉移行を促進するタンパク質を抑制し,また,Ovol2の欠損により乳腺上皮細胞のTGFβに対する反応性が増殖の抑制から上皮間葉移行の誘導へと変化した.さらに,Ovol2を転移性乳がん細胞に強制発現させると,間葉系の細胞から上皮系の細胞へと変換した.これらの結果は,上皮細胞における可塑性の制御ががんや発生において重要であることを示唆した.
はじめに
近年の体細胞リプログラミング技術の進歩は再生医療の発展に多大な可能性をもたらしているが,同時に,生物学的なコンテクストにおいて体細胞のもつ顕著な可塑性をほのめかしている.しかしながら,生体においてそのような可塑性をいきすぎないよう制御する機構に関してはほとんど未解明である.上皮系の細胞は上皮間葉移行(epithelial-mesenchymal transition:EMT)を介して間葉系の細胞としての性質を獲得するが,この上皮細胞における可塑性の制御が形態形成にどのようにかかわっているのかはくわしく知られていない.また,上皮間葉移行を促進的に制御するタンパク質に関する研究は多くあるものの,上皮間葉移行に対しブレーキ的な役割をはたす分子機構に関しては報告が限られている(図1).
マウスの乳腺は生後,とくに思春期および妊娠期においてダイナミックな形態変化を示す特異な上皮組織であり,発生における上皮細胞の可塑性の研究に適している1).発生初期の中胚葉や神経堤の形成においては上皮間葉移行を介する間葉系の細胞への移行が完結するのに対し,乳腺の形態形成においては部分的かつ可逆的な上皮間葉移行が起こっていると推測される2,3).とくに,思春期にみられる末梢芽状突起(terminal end bud)とよばれる管腔の末端の特殊な部位の上皮細胞は,上皮細胞のあいだの連結を保ちつつ運動性を獲得することによりダイナミックな形態形成に寄与していると考えられる4).それらの上皮細胞は接着性および極性をふたたび獲得することにより成熟した管腔構造を形成する.さらに,妊娠の前後に生じる顕著な組織の形態変化においても上皮細胞の可塑性が寄与していると考えられる.しかしながら,このような顕著な可塑性をもつ上皮細胞の自己同一性がどのような分子機構により保たれているかについては不明な点が多い.
Ovol2はOvolファミリータンパク質に属するジンクフィンガー型の転写因子であり,ショウジョウバエの表皮の形成,哺乳類の皮膚や精巣の形成を制御していることが知られている5,6).興味深いことに,Ovolファミリータンパク質は上皮間葉移行に対し促進性の転写因子であるSnailやSlugと共通したSnail1/GFP(SNAG)ドメインをもつことから7),上皮間葉移行の制御になんらかの関連があるのではないかと考えられた.この研究では,マウスの遺伝学的な手法およびゲノム解析を用いて,Ovol2が上皮間葉移行に対し促進性の転写因子および間葉系の細胞としての性質を抑制的に制御することにより,乳腺の発生の過程において過剰な上皮間葉移行を抑制し上皮細胞の自己同一性を維持し,乳腺上皮細胞の形態形成に重要な役割をはたしていることを報告した.また,乳がん細胞におけるOvol2の発現はがん細胞の転移能および浸潤能と逆相関し,Ovol2の再発現により転移性乳がん細胞が上皮細胞様の性質をとりもどすことを明らかにした.
1.Ovol2を欠損すると異常な上皮間葉移行が起こり乳腺の形態形成が阻害される
乳腺組織においてOvol2は上皮細胞に特異的な発現パターンを示し,間質細胞における発現はほぼ認められなかった.乳腺は基底上皮細胞系および管上皮細胞系の2つの分化系列よりなりたっているが,Ovol2は管上皮細胞系細胞において強く発現し,また,基底上皮細胞系においても部分的に発現が検出された.興味深いことに,乳腺細胞に人為的に上皮間葉移行を起こすと,その進行にともないOvol2の発現は低下した.これらの結果より,Ovol2の発現は細胞の上皮細胞としての性質に強く関連していると考えられた.
乳腺の形成におけるOvol2の役割を調べるため,皮膚および乳腺上皮に特異的なOvol2ノックアウトマウスを作製し解析した.このノックアウトマウスの乳腺組織は生後3週までは明らかな異常は認められないが,生後4~8週の思春期における乳腺の形成がほぼ完全に阻害された.とくに,末梢芽状突起が顕著な退縮を起こし管腔構造の伸長が停止した.また,生後7~8週以降では間質の異常な線維化が認められた.皮膚および乳腺上皮に特異的なOvol2ノックアウトマウスは正常に妊娠し出産するが,乳腺の機能が低下しており,新生仔を養うのに十分なミルクを産生できなかった.このノックアウトマウスの乳腺脂肪組織に野生型のマウスに由来する乳腺上皮細胞を移植すると正常な乳腺を形成したことから,ホルモン環境そのものは正常に保たれていることが推測された.また,ホルモン受容体の発現にも変化はなかった.さらに,乳腺の過形成を起こすことが知られているMMTV-Wnt1マウスにおける過剰な分枝の形成はOvol2の欠損に影響されず,管腔構造の伸長と方向性のみが影響されたことから,Ovol2の欠損は思春期に特有の構造である末梢芽状突起に依存した形態形成に特異的に機能していると考えられた.
生後3.5週の乳腺組織から末梢芽状突起のみを単離して遺伝子発現を解析したところ,皮膚および乳腺上皮に特異的なOvol2ノックアウトマウスの末梢芽状突起において,上皮間葉移行に関連する遺伝子,細胞外マトリックスの制御にかかわる遺伝子,TGFβの標的となる遺伝子などが顕著に高く発現しており,細胞分裂に関与する遺伝子の発現が有意に低下していた.また,単離した末梢芽状突起をマトリゲルの内部で培養すると,野生型マウスに由来する末梢芽状突起は上皮細胞の連結を保ったままゲル内に伸長していく統合的な細胞遊走を起こしたのに対し,皮膚および乳腺上皮に特異的なOvol2ノックアウトマウスに由来する末梢芽状突起は個々の細胞がゲル内にバラバラに浸潤していった.この個別の浸潤は間葉系の細胞に似た形態変化と関連し,Zeb1遺伝子,Zeb2遺伝子,Twist1遺伝子,Snai1遺伝子,Snai2遺伝子,Vim遺伝子,Cdh2遺伝子といった上皮間葉移行に関連する遺伝子の発現上昇をともなった.さらに,乳腺組織においても,末梢芽状突起の内部においてVim遺伝子に陽性の細胞が有意に上昇しており,Ovol2の欠損は上皮間葉移行様の変化を誘導して乳腺の形成を阻害すると推測された.
マウスの乳腺基底上皮細胞系のなかに多分化能をもち単一の細胞から機能的な乳腺を形成しうる幹細胞の存在することが,おもに細胞移植実験により明らかにされている8,9).Ovol2を欠損した基底上皮細胞を宿主となるマウスに同所移植すると,形成不全の乳腺の管腔構造にくわえ,線維芽細胞様の異常な構造が形成された.遺伝学的な細胞系譜の追跡実験により,これらの線維芽細胞様の細胞は間葉系の細胞の混入ではなく上皮系の細胞に由来することが確認された.また,乳腺構造を形成できる幹細胞の割合は皮膚および乳腺上皮に特異的なOvol2ノックアウトマウスの乳腺において有意に減少していた.さらに,遺伝学的な細胞系譜の追跡実験により,生理条件においてこの線維芽細胞様の細胞は,妊娠の経験のないマウスでは検出されなかったが,複数回の妊娠を経験したマウスにおいては高頻度にみられた.これらの結果より,Ovol2の欠損は乳腺幹細胞の機能に影響を及ぼし,また,Ovol2の欠損による上皮間葉移行の促進は移植や妊娠といった組織の再形成の過程をへることにより顕著に現われることが推測された.
2.Ovol2は上皮間葉移行に対し促進性の転写因子の発現を直接的に抑制する
Ovol2の機能を分子レベルで解明するため,乳腺上皮細胞株HC11細胞を用いて,次世代シークエンサーによるゲノムワイドのクロマチン-免疫沈降実験を行った.その結果,ゲノムには合計3092箇所のOvol2の結合ピークが同定され,その30%以上は転写開始部位の近傍に認められた.なかでも,Zeb1遺伝子,Zeb2遺伝子,Twist1遺伝子,Snai1遺伝子,Snai2遺伝子,Vim遺伝子,Cdh2遺伝子といった上皮間葉移行に関連する遺伝子のすべてにおいてOvol2の結合ピークが検出された.とくに,Zeb1遺伝子およびVim遺伝子におけるピークは顕著であり,これらは末梢芽状突起に対するマイクロアレイ解析によっても皮膚および乳腺上皮に特異的なOvol2ノックアウトマウスにおいて発現が有意に上昇していた.
Ovol2の結合のみられた遺伝子について,末梢芽状突起における遺伝子発現データをGSEA(gene set enrichment analysis)法により解析したところ,皮膚および乳腺上皮に特異的なOvol2ノックアウトマウスにおいて発現が有意に上昇していた.このことは,Ovol2が転写因子としておもに抑制性に機能していることを示した.そしてこのことは,Ovol2の3つのアイソフォームのうち,抑制性のアイソフォームであるOvol2Aのみが乳腺上皮細胞に発現していることと合致した.実際に,Ovol2の欠損による上皮間葉移行に関連する遺伝子の発現上昇および乳腺の形成異常はOvol2Aの再発現により正常化されたが,ほかのアイソフォームの再発現では正常化されなかった.さらに,Ovol2の欠損による乳腺の形成および上皮間葉移行の促進はZeb1遺伝子のノックダウンあるいはTGFβシグナルの抑制により部分的に正常化された.興味深いことに,Ovol2の欠損によりTGFβシグナルに対する反応性は増殖の抑制から上皮間葉移行の誘導へと変化した.これらの結果は,Ovol2が上皮間葉移行に関連する遺伝子を抑制的に制御しており,とくに,Zeb1遺伝子およびTGFβシグナルがOvol2の下流において重要な役割をはたしていることを示唆した.
3.Ovol2の発現は転移性乳がん細胞の上皮細胞様の性質を誘導する
上皮間葉移行とがんとの関連性についてはよく知られているため,Ovol2が乳がんの転移および浸潤とどのような関連をもつかについて調べた.その結果,Ovol2の発現は乳がん細胞の転移能と逆相関しており,さらに,Ovol2の標的と同定されたほとんどの上皮間葉移行に関連する遺伝子の発現とは逆相関していた.とくに,転移性乳がん細胞の多くはOvol2を発現していなかった.そのようなOvol2陰性の転移性乳がん細胞にOvol2Aを発現させると,Vim遺伝子やZeb1遺伝子などの上皮間葉移行に関連する遺伝子の発現が抑制され,EカドヘリンをコードするCdh1遺伝子の発現が誘導されると同時に,遊走能および浸潤能も抑制された.また,Ovol2の発現により,ある乳がん細胞では接触障害(contact inhibition)が誘導された.さらに,乳がん患者の臨床データの解析では,Ovol2を高発現する群は転移するまでの期間がOvol2を低発現する群に対し長く,また,全体の生命予後も良好であった.これらの結果より,Ovol2の発現は乳がんにおいても上皮間葉移行あるいは間葉系の細胞としての性質を抑制的に制御し,Ovol2の発現の低下はがんの転移と関連していることが示唆された.
おわりに
今回,筆者らは,乳腺の形態形成において上皮細胞の自己同一性を維持する分子機構に,転写因子Ovol2が重要な役割をはたすことを解明した(図2).上皮間葉移行が幹細胞の機能に対し促進的にはたらくことは過去の報告により知られていたが10),上皮細胞の自己同一性の破綻が形態形成を完全に阻害し幹細胞の機能を低下させたことは,生理的な発生の過程における上皮間葉移行のいきすぎは逆に幹細胞の機能を低下させることを示唆し,概念的にも興味深い.筆者らの研究室では,この論文と同時に,Ovolファミリータンパク質が皮膚においても同様の役割をはたすことを報告しているが11)(Developmental Cell誌に同時掲載),ほかの上皮組織においても同様な分子機構により上皮細胞の自己同一性が保たれているのかどうか,今後の研究が待たれる.また,乳がん細胞においてもOvol2は細胞の上皮細胞としての性質を維持する転写因子としてはたらいていることが示唆された(図2).とくに,Ovol2の再発現により上皮細胞としての性質が獲得され乳がん細胞の転移能および浸潤能が抑制されたことから,新たな乳がんの治療法の開発につながることが期待される.
文 献
- Watson, C. J. & Khaled, W. T.: Mammary development in the embryo and adult: a journey of morphogenesis and commitment. Development, 135, 995-1003 (2008)[PubMed]
- Thiery, J. P., Acloque, H., Huang, R. Y. et al.: Epithelial-mesenchymal transitions in development and disease. Cell, 139, 871-890 (2009)[PubMed]
- Godde, N. J., Galea, R. C., Elsum, I. A. et al.: Cell polarity in motion: redefining mammary tissue organization through EMT and cell polarity transitions. J. Mammary Gland Biol. Neoplasia, 15, 149-168 (2010)[PubMed]
- Ewald, A. J., Brenot, A., Duong, M. et al.: Collective epithelial migration and cell rearrangements drive mammary branching morphogenesis. Dev. Cell, 14, 570-581 (2008)[PubMed]
- Dai, X., Schonbaum, C., Degenstein, L. et al.: The ovo gene required for cuticle formation and oogenesis in flies is involved in hair formation and spermatogenesis in mice. Genes Dev., 12, 3452-3463 (1998)[PubMed]
- Payre, F., Vincent, A. & Carreno, S.: ovo/svb integrates Wingless and DER pathways to control epidermis differentiation. Nature, 400, 271-275 (1999)[PubMed]
- Chiang, C. & Ayyanathan, K.: Snail/Gfi-1 (SNAG) family zinc finger proteins in transcription regulation, chromatin dynamics, cell signaling, development, and disease. Cytokine Growth Factor Rev., 24, 123-131 (2013)[PubMed]
- Shackleton, M., Vaillant, F., Simpson, K. J. et al.: Generation of a functional mammary gland from a single stem cell. Nature, 439, 84-88 (2006)[PubMed]
- Stingl, J., Eirew, P., Ricketson, I. et al.: Purification and unique properties of mammary epithelial stem cells. Nature, 439, 993-997 (2006)[PubMed]
- Mani, S. A., Guo, W., Liao, M. J. et al.: The epithelial-mesenchymal transition generates cells with properties of stem cells. Cell, 133, 704-715 (2008)[PubMed]
- Lee, B., Villarreal-Ponce, A., Fallahi, M. et al.: Transcriptional mechanisms link epithelial plasticity to adhesion and differentiation of epidermal progenitor cells. Dev. Cell, 29, 47-58 (2014)[PubMed]
著者プロフィール
略歴:2005年 東北大学大学院医学研究科にて博士号取得,同年 米国NIH National Cancer Institute研究員,2009年 米国California大学Irvine校School of Medicine研究員を経て,2010年より同Project scientist.
研究テーマ:発生の過程およびがんにおける上皮組織細胞の運命決定機構の分子機序.
関心事:研究,ロッククライミング.
Xing Dai
米国California大学Irvine校School of MedicineにてProfessor.
研究室URL:http://mfallahi.biochem.uci.edu/
© 2014 渡邉和秀・Xing Dai Licensed under CC 表示 2.1 日本