SIRT7はユビキチン-プロテアソーム経路の制御を介して肝臓における脂質代謝を制御する
吉澤達也・山縣和也
(熊本大学大学院生命科学研究部 病態生化学分野)
email:吉澤達也,山縣和也
DOI: 10.7875/first.author.2014.045
SIRT7 controls hepatic lipid metabolism by regulating the ubiquitin-proteasome pathway.
Tatsuya Yoshizawa, Md. Fazlul Karim, Yoshifumi Sato, Takafumi Senokuchi, Keishi Miyata, Takaichi Fukuda, Chisa Go, Masayoshi Tasaki, Kohei Uchimura, Tsuyoshi Kadomatsu, Zhe Tian, Christian Smolka, Tomohiro Sawa, Motohiro Takeya, Kazuhito Tomizawa, Yukio Ando, Eiichi Araki, Takaaki Akaike, Thomas Braun, Yuichi Oike, Eva Bober, Kazuya Yamagata
Cell Metabolism, 19, 712-721 (2014)
近年,Sirtuinは代謝を制御するタンパク質として大きな注目をあびているが,SirtuinファミリーのひとつSIRT7の代謝制御における生理的な機能および分子機構については不明であった.今回,筆者らは,SIRT7が肝臓における脂質の蓄積の制御において重要な役割を担っていることを見い出した.SIRT7ノックアウトマウスにおいては,高脂肪食によりひき起こされる脂肪肝,肥満,耐糖能の異常が顕著に軽減されていた.また,肝臓に特異的なSIRT7ノックアウトマウスにおいても,高脂肪食による肝臓への脂肪の蓄積は低下していた.SIRT7は脂質代謝の制御において重要な核内受容体であるTR4のタンパク質安定性を上昇させ,その結果として,TR4の標的遺伝子の活性化を介して脂肪酸の取り込みとトリアシルグリセロールの合成および貯蔵を増加させていた.さらに,生化学的な解析により,SIRT7はDCAF1-DDB1-CUL4Bユビキチンリガーゼ複合体に結合しTR4のタンパク質分解を抑制していることが明らかになった.以上のことから,SIRT7はユビキチン-プロテアソーム経路の制御を介して肝臓における脂質代謝を制御しているものと考えられた.
近年,世界中で急増している糖尿病や肥満といった生活習慣病の成因の解明および治療法の開発は非常に重要になってきている.Sirtuin(哺乳類ではSIRT1~SIRT7の7つからなる)は老化や寿命に影響をあたえていることが知られているが1,2),さまざまな代謝の制御にも関与しており,代謝異常症の創薬における標的としても注目されている.基本的には,Sirtuinは下流の標的となるタンパク質のリジン残基のもつアセチル基をNADに依存的に取り除く(脱アセチル化)ことにより,それらのタンパク質の活性を正あるいは負に制御する.しかし最近では,いくつかのSirtuinにおいて,アセチル基のみならずマロニル基などさまざまなアシル基を取り除く酵素活性が新たに発見されており,Sirtuinは脱アシル化酵素として認識されるようになった.
Sirtuinの研究はSIRT1を中心に進展しており,SIRT7に関する研究はもっとも遅れていた.当初,SIRT7はリボソームDNAの転写の制御にかかわることが報告されたが,その分子機構については不明である.最近,SIRT7の酵素活性とその標的となるタンパク質についてはじめて報告された.SIRT7はヒストンH3の18番目のリジン残基のアセチル基を特異的に脱アセチル化すること,さらに,この特異的な脱アセチル化はがん細胞の基本的な特性と腫瘍形成能の維持において重要であることが明らかになった3).しかし,マウスの個体において証明された生理機能は心筋細胞におけるストレス応答と細胞死の制御(SIRT7ノックアウトマウスは拡張型心筋症の表現型を示す)のみであり4),SIRT7のエネルギー代謝における機能についてはまったく不明であった.
そこで,筆者らは,機能が十分に明らかではないSIRT7に着目し,エネルギー代謝における役割および分子機能の解明を試みた.
SIRT7ノックアウトマウスを用いて脂質代謝について検討した.その結果,SIRT1あるいはSIRT6のノックアウトマウスとは対照的に,SIRT7ノックアウトマウスにおいては高脂肪食により肝臓へ蓄積される脂肪滴が顕著に減少していた.この組織学的な解析の結果と一致して,高脂肪食をあたえたSIRT7ノックアウトマウスの肝臓におけるトリアシルグリセロールの量は,野生型マウスに比べ有意に低下していた.一方,通常食をあたえた場合には顕著な差はみられなかった.そこで,高脂肪食をあたえたSIRT7ノックアウトマウスの肝臓において,脂質代謝に関与する遺伝子の発現について調べた.Cd36遺伝子は脂肪酸の取り込みにかかわるが,SIRT7ノックアウトマウスにおいてはその発現が減少していた.また,トリアシルグリセロールの合成にかかわるMogat1遺伝子,トリアシルグリセロールの貯蔵に重要なCidea遺伝子およびCidec遺伝子の発現も顕著に減少していた.脂肪酸の合成に関与する遺伝子やβ酸化にかかわる遺伝子のいくつかも発現が減少していた.
SIRT7ノックアウトマウスの解析から判明したSIRT7の肝臓における脂質代謝に対する作用は,肝臓のSIRT7の作用によるものか,あるいは,ほかの臓器のSIRT7の作用を介するのかを明らかにするため,肝臓に特異的なSIRT7ノックアウトマウスを作製し解析した.その結果,肝臓に特異的なSIRT7ノックアウトマウスにおいても,高脂肪食による肝臓へのトリアシルグリセロールの蓄積は対照となるマウスに比べ低下していた.そこで,培養細胞系においてSIRT7の肝細胞の脂質代謝に対する作用について解析した.通常食をあたえたSIRT7ノックアウトマウスから得られた初代肝細胞では,Cd36遺伝子,Mogat1遺伝子,Cidea遺伝子などの発現は低下していたが,脂肪酸の合成に関与する遺伝子の発現に変化はなかった.肝細胞株であるAML-12細胞においてsiRNAによりSIRT7をノックダウンした場合にも同様の現象がみられた.つまり,肝臓のSIRT7はおもに脂肪酸の取り込みとトリアシルグリセロールの合成および貯蔵を制御していることが強く示唆された.このことと一致して,AML-12細胞を用いた脂肪酸の取り込み実験では,脂肪酸の短時間での取り込みおよび脂肪滴の蓄積がSIRT7のノックダウンにより顕著に減少した.過剰の脂肪酸を添加しない場合には対照とのあいだに差が認められなかったことはノックアウトマウスの解析の結果とよく相関しており,SIRT7が肝臓において脂肪酸の取り込みを強く制御していることが裏づけられた.
SIRT7ノックアウトマウスでは脂肪肝の軽減のほか,高脂肪食により誘発される肥満および糖尿病が軽減されることも見い出された.具体的には,12週間にわたり高脂肪食をあたえたSIRT7ノックアウトマウスは,野生型マウスに比べ精巣上体脂肪(内臓脂肪)の重量比率が3割以上も減少していた.また,耐糖能試験において,グルコース負荷後30分の血糖値は2割ほど低い値だった.一方,肝臓に特異的なSIRT7ノックアウトマウスと対照となるマウスとのあいだでは,体重,脂肪組織の重量,耐糖能に差は認められなかった.この結果は,肝臓以外の組織に存在するSIRT7が脂肪組織の重量および耐糖能において重要な役割をはたしていることを強く示唆した.
自発運動の活性と食餌の摂取量において,SIRT7ノックアウトマウスと野生型マウスとのあいだに差は認められなかった.したがって,脂肪の蓄積しにくいSIRT7ノックアウトマウスにおいては余分な脂質がどこかで消費されているという可能性が示唆された.そこで,呼気ガス分析によりエネルギー代謝を測定したところ,SIRT7ノックアウトマウスでは呼吸交換率が有意に低いことが明らかになった.つまり,SIRT7ノックアウトマウスでは脂質を燃焼する傾向が強いことがわかった.さらに,SIRT7ノックアウトマウスは体温が高いことも判明した.そこで,褐色脂肪において熱産生にかかわる遺伝子の発現について調べたところ,SIRT7ノックアウトマウスではUcp1遺伝子およびDio2遺伝子の発現が著しく上昇していた.これらの結果は,SIRT7が全身のエネルギー代謝を制御する際には,少なくとも一部は褐色脂肪の機能制御を介している可能性を示唆した.
SIRT7ノックアウトマウスの解析を進めている際に,その表現型および遺伝子発現パターンが脂質代謝に重要な役割をはたす核内受容体TR4のノックアウトマウス5) に非常に似ていることを見い出した.そこで,通常食をあたえたSIRT7ノックアウトマウスの肝臓においてTR4のタンパク質量を調べたところ,野生型マウスに比べ減少していることが明らかになった.また,肝細胞株であるAML-12細胞においてSIRT7をノックダウンした場合にも同様の現象がみられた.さらに,SIRT7をノックダウンしたAML-12細胞にSIRT7を強制発現させると,減少していたTR4のタンパク質量が回復した.このとき,酵素活性をもたないSIRT7の変異体を用いるとその効果はみられなかったことから,SIRT7によるTR4のタンパク質量の制御にはSIRT7のもつなんらかの酵素活性が必要であることが示唆された.
では,SIRT7による脂質代謝の制御において,TR4のタンパク質量の制御が実際にかかわっているのだろうか.TR4を強制発現するアデノウイルスをSIRT7ノックアウトマウスに感染させると,高脂肪食を摂取させたときに軽減した脂肪肝が野生型マウスと同じ程度にまで戻った.さらに,SIRT7をノックダウンしたAML-12細胞に対しTR4を強制発現するアデノウイルスを感染させる実験においても同様の結果が得られた.これらの結果は,肝臓のSIRT7がTR4のタンパク質量の制御を介して脂質代謝を制御することを示すものであった.
SIRT7はどのようにTR4のタンパク質量を制御しているのだろうか.SIRT7ノックアウトマウスの肝臓において,TR4のmRNAの発現量は野生型マウスと差がなかったことから,TR4のタンパク質安定性について解析した.パルスチェイス解析により,TR4はSIRT7をノックダウンしたAML-12細胞においてより早く分解することが見い出された.さらに,TR4は細胞内においてユビキチン化されること,そのユビキチン化はSIRT7の強制発現により低下することが明らかになった.
SIRT7がTR4のユビキチン化を抑制する機構を解明するため,SIRT7とTR4との結合をさまざまな手法により調べたが,その結合は検出できなかった.そこで,SIRT7がなんらかのユビキチン関連タンパク質を制御することにより間接的にTR4を制御しているのではないかと考え,プルダウン法および質量分析法を用いてTR4と結合するタンパク質を網羅的に取得した.その結果,CUL4ユビキチンリガーゼ複合体6,7) の構成タンパク質であるDDB1およびDCAF1が検出された.免疫沈降法により,DCAF1-DDB1-CUL4Bユビキチンリガーゼ複合体はTR4と結合することが示された.さらに,SIRT7をノックダウンしたHepa1-6肝細胞においてCUL4BをsiRNAによりノックダウンすると,対照となるsiRNAを用いたときと比べTR4のタンパク質量が増加することが明らかになった.これらの結果から,肝細胞においてDCAF1-DDB1-CUL4Bユビキチンリガーゼ複合体はTR4と結合し,そのユビキチン化および分解を促進することが強く示唆された.
SIRT7はDCAF1,DDB1,CUL4Bのそれぞれと複合体を形成することも明らかになった.そこで,SIRT7がDCAF1-DDB1-CUL4Bユビキチンリガーゼ複合体に依存的なTR4の分解を制御するかどうかについて解析した.Hepa1-6細胞においてSIRT7をノックダウンするとTR4のタンパク質量は減少したが,同時にCUL4BをノックダウンするとTR4のタンパク質量は減少しなかった.また,SIRT7をノックダウンしたAML-12細胞においてSIRT7を強制発現させるとTR4のタンパク質量は増加したが,同時にCUL4BをノックダウンするとTR4のタンパク質量は増加しなかった.これらの結果は,SIRT7がDCAF1-DDB1-CUL4Bユビキチンリガーゼ複合体と結合し,それによりTR4のユビキチン化および分解を阻害することを示した.
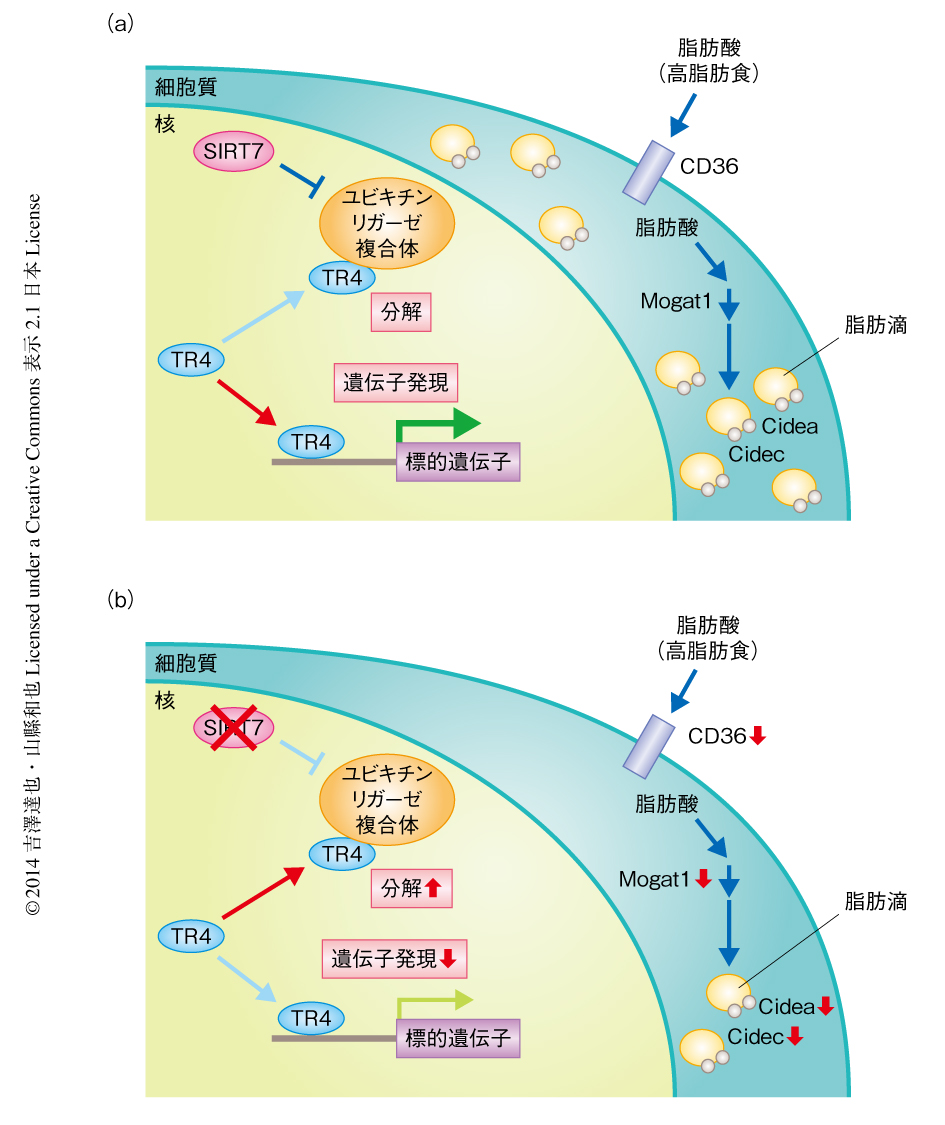
これらの研究の結果より,SIRT7はユビキチン-プロテアソーム経路の制御を介して肝臓における脂質代謝を制御することが明らかになった.肝細胞においてSIRT7はDCAF1-DDB1-CUL4Bユビキチンリガーゼ複合体と結合し,それによりTR4のユビキチン化および分解を阻害する(図1).分解をまぬがれたTR4はCd36遺伝子などの脂質代謝に関連する遺伝子の発現を上昇させる.結果的に,脂肪酸の取り込みおよび貯蔵に機能する経路がはたらき,過剰の脂肪を摂取した場合には肝臓に脂肪が蓄積していくことになる.一方,SIRT7がない場合にはTR4は分解の方向にかたむいて脂肪酸の取り込みおよび貯蔵に機能する経路のはたらきが低下するため,過剰の脂肪を摂取した場合でも肝臓に脂肪が蓄積しにくくなる.したがって,SIRT7に特異的な阻害剤の開発は脂肪肝などの代謝異常症の予防および治療に有効であると考えられる.
筆者らの知るかぎり,Sirtuinがユビキチンリガーゼ複合体に結合しその機能を制御することは,現在までに報告されていない新しい発見である.しかし,SIRT7がどのような機構で,どのような酵素活性により,ユビキチンリガーゼ複合体の機能を制御しているかについては,現時点では不明である.また,白色脂肪細胞あるいは褐色脂肪細胞におけるSIRT7の分子機能は十分に明らかではない.SIRT7のさらなる分子解剖を進めることにより,将来の代謝異常症の予防あるいは治療に貢献することをめざしている.
略歴:1999年 東京大学大学院農学生命科学研究科にて博士号取得,新潟大学歯学部 助手,米国Columbia大学 ポスドク研究員,熊本大学大学院生命科学研究部 助教を経て,2011年より同 講師.
山縣 和也(Kazuya Yamagata)
熊本大学大学院生命科学研究部 教授.
研究室URL:http://srv02.medic.kumamoto-u.ac.jp/dept/biochem2/biochem2.html
© 2014 吉澤達也・山縣和也 Licensed under CC 表示 2.1 日本
(熊本大学大学院生命科学研究部 病態生化学分野)
email:吉澤達也,山縣和也
DOI: 10.7875/first.author.2014.045
SIRT7 controls hepatic lipid metabolism by regulating the ubiquitin-proteasome pathway.
Tatsuya Yoshizawa, Md. Fazlul Karim, Yoshifumi Sato, Takafumi Senokuchi, Keishi Miyata, Takaichi Fukuda, Chisa Go, Masayoshi Tasaki, Kohei Uchimura, Tsuyoshi Kadomatsu, Zhe Tian, Christian Smolka, Tomohiro Sawa, Motohiro Takeya, Kazuhito Tomizawa, Yukio Ando, Eiichi Araki, Takaaki Akaike, Thomas Braun, Yuichi Oike, Eva Bober, Kazuya Yamagata
Cell Metabolism, 19, 712-721 (2014)
要 約
近年,Sirtuinは代謝を制御するタンパク質として大きな注目をあびているが,SirtuinファミリーのひとつSIRT7の代謝制御における生理的な機能および分子機構については不明であった.今回,筆者らは,SIRT7が肝臓における脂質の蓄積の制御において重要な役割を担っていることを見い出した.SIRT7ノックアウトマウスにおいては,高脂肪食によりひき起こされる脂肪肝,肥満,耐糖能の異常が顕著に軽減されていた.また,肝臓に特異的なSIRT7ノックアウトマウスにおいても,高脂肪食による肝臓への脂肪の蓄積は低下していた.SIRT7は脂質代謝の制御において重要な核内受容体であるTR4のタンパク質安定性を上昇させ,その結果として,TR4の標的遺伝子の活性化を介して脂肪酸の取り込みとトリアシルグリセロールの合成および貯蔵を増加させていた.さらに,生化学的な解析により,SIRT7はDCAF1-DDB1-CUL4Bユビキチンリガーゼ複合体に結合しTR4のタンパク質分解を抑制していることが明らかになった.以上のことから,SIRT7はユビキチン-プロテアソーム経路の制御を介して肝臓における脂質代謝を制御しているものと考えられた.
はじめに
近年,世界中で急増している糖尿病や肥満といった生活習慣病の成因の解明および治療法の開発は非常に重要になってきている.Sirtuin(哺乳類ではSIRT1~SIRT7の7つからなる)は老化や寿命に影響をあたえていることが知られているが1,2),さまざまな代謝の制御にも関与しており,代謝異常症の創薬における標的としても注目されている.基本的には,Sirtuinは下流の標的となるタンパク質のリジン残基のもつアセチル基をNADに依存的に取り除く(脱アセチル化)ことにより,それらのタンパク質の活性を正あるいは負に制御する.しかし最近では,いくつかのSirtuinにおいて,アセチル基のみならずマロニル基などさまざまなアシル基を取り除く酵素活性が新たに発見されており,Sirtuinは脱アシル化酵素として認識されるようになった.
Sirtuinの研究はSIRT1を中心に進展しており,SIRT7に関する研究はもっとも遅れていた.当初,SIRT7はリボソームDNAの転写の制御にかかわることが報告されたが,その分子機構については不明である.最近,SIRT7の酵素活性とその標的となるタンパク質についてはじめて報告された.SIRT7はヒストンH3の18番目のリジン残基のアセチル基を特異的に脱アセチル化すること,さらに,この特異的な脱アセチル化はがん細胞の基本的な特性と腫瘍形成能の維持において重要であることが明らかになった3).しかし,マウスの個体において証明された生理機能は心筋細胞におけるストレス応答と細胞死の制御(SIRT7ノックアウトマウスは拡張型心筋症の表現型を示す)のみであり4),SIRT7のエネルギー代謝における機能についてはまったく不明であった.
そこで,筆者らは,機能が十分に明らかではないSIRT7に着目し,エネルギー代謝における役割および分子機能の解明を試みた.
1.SIRT7ノックアウトマウスにおいては高脂肪食によりひき起こされる脂肪肝が軽減される
SIRT7ノックアウトマウスを用いて脂質代謝について検討した.その結果,SIRT1あるいはSIRT6のノックアウトマウスとは対照的に,SIRT7ノックアウトマウスにおいては高脂肪食により肝臓へ蓄積される脂肪滴が顕著に減少していた.この組織学的な解析の結果と一致して,高脂肪食をあたえたSIRT7ノックアウトマウスの肝臓におけるトリアシルグリセロールの量は,野生型マウスに比べ有意に低下していた.一方,通常食をあたえた場合には顕著な差はみられなかった.そこで,高脂肪食をあたえたSIRT7ノックアウトマウスの肝臓において,脂質代謝に関与する遺伝子の発現について調べた.Cd36遺伝子は脂肪酸の取り込みにかかわるが,SIRT7ノックアウトマウスにおいてはその発現が減少していた.また,トリアシルグリセロールの合成にかかわるMogat1遺伝子,トリアシルグリセロールの貯蔵に重要なCidea遺伝子およびCidec遺伝子の発現も顕著に減少していた.脂肪酸の合成に関与する遺伝子やβ酸化にかかわる遺伝子のいくつかも発現が減少していた.
SIRT7ノックアウトマウスの解析から判明したSIRT7の肝臓における脂質代謝に対する作用は,肝臓のSIRT7の作用によるものか,あるいは,ほかの臓器のSIRT7の作用を介するのかを明らかにするため,肝臓に特異的なSIRT7ノックアウトマウスを作製し解析した.その結果,肝臓に特異的なSIRT7ノックアウトマウスにおいても,高脂肪食による肝臓へのトリアシルグリセロールの蓄積は対照となるマウスに比べ低下していた.そこで,培養細胞系においてSIRT7の肝細胞の脂質代謝に対する作用について解析した.通常食をあたえたSIRT7ノックアウトマウスから得られた初代肝細胞では,Cd36遺伝子,Mogat1遺伝子,Cidea遺伝子などの発現は低下していたが,脂肪酸の合成に関与する遺伝子の発現に変化はなかった.肝細胞株であるAML-12細胞においてsiRNAによりSIRT7をノックダウンした場合にも同様の現象がみられた.つまり,肝臓のSIRT7はおもに脂肪酸の取り込みとトリアシルグリセロールの合成および貯蔵を制御していることが強く示唆された.このことと一致して,AML-12細胞を用いた脂肪酸の取り込み実験では,脂肪酸の短時間での取り込みおよび脂肪滴の蓄積がSIRT7のノックダウンにより顕著に減少した.過剰の脂肪酸を添加しない場合には対照とのあいだに差が認められなかったことはノックアウトマウスの解析の結果とよく相関しており,SIRT7が肝臓において脂肪酸の取り込みを強く制御していることが裏づけられた.
2.SIRT7ノックアウトマウスにおいては高脂肪食により誘発される肥満および糖尿病が軽減される
SIRT7ノックアウトマウスでは脂肪肝の軽減のほか,高脂肪食により誘発される肥満および糖尿病が軽減されることも見い出された.具体的には,12週間にわたり高脂肪食をあたえたSIRT7ノックアウトマウスは,野生型マウスに比べ精巣上体脂肪(内臓脂肪)の重量比率が3割以上も減少していた.また,耐糖能試験において,グルコース負荷後30分の血糖値は2割ほど低い値だった.一方,肝臓に特異的なSIRT7ノックアウトマウスと対照となるマウスとのあいだでは,体重,脂肪組織の重量,耐糖能に差は認められなかった.この結果は,肝臓以外の組織に存在するSIRT7が脂肪組織の重量および耐糖能において重要な役割をはたしていることを強く示唆した.
自発運動の活性と食餌の摂取量において,SIRT7ノックアウトマウスと野生型マウスとのあいだに差は認められなかった.したがって,脂肪の蓄積しにくいSIRT7ノックアウトマウスにおいては余分な脂質がどこかで消費されているという可能性が示唆された.そこで,呼気ガス分析によりエネルギー代謝を測定したところ,SIRT7ノックアウトマウスでは呼吸交換率が有意に低いことが明らかになった.つまり,SIRT7ノックアウトマウスでは脂質を燃焼する傾向が強いことがわかった.さらに,SIRT7ノックアウトマウスは体温が高いことも判明した.そこで,褐色脂肪において熱産生にかかわる遺伝子の発現について調べたところ,SIRT7ノックアウトマウスではUcp1遺伝子およびDio2遺伝子の発現が著しく上昇していた.これらの結果は,SIRT7が全身のエネルギー代謝を制御する際には,少なくとも一部は褐色脂肪の機能制御を介している可能性を示唆した.
3.肝臓のSIRT7は核内受容体TR4のタンパク質量の制御を介して脂質代謝を制御する
SIRT7ノックアウトマウスの解析を進めている際に,その表現型および遺伝子発現パターンが脂質代謝に重要な役割をはたす核内受容体TR4のノックアウトマウス5) に非常に似ていることを見い出した.そこで,通常食をあたえたSIRT7ノックアウトマウスの肝臓においてTR4のタンパク質量を調べたところ,野生型マウスに比べ減少していることが明らかになった.また,肝細胞株であるAML-12細胞においてSIRT7をノックダウンした場合にも同様の現象がみられた.さらに,SIRT7をノックダウンしたAML-12細胞にSIRT7を強制発現させると,減少していたTR4のタンパク質量が回復した.このとき,酵素活性をもたないSIRT7の変異体を用いるとその効果はみられなかったことから,SIRT7によるTR4のタンパク質量の制御にはSIRT7のもつなんらかの酵素活性が必要であることが示唆された.
では,SIRT7による脂質代謝の制御において,TR4のタンパク質量の制御が実際にかかわっているのだろうか.TR4を強制発現するアデノウイルスをSIRT7ノックアウトマウスに感染させると,高脂肪食を摂取させたときに軽減した脂肪肝が野生型マウスと同じ程度にまで戻った.さらに,SIRT7をノックダウンしたAML-12細胞に対しTR4を強制発現するアデノウイルスを感染させる実験においても同様の結果が得られた.これらの結果は,肝臓のSIRT7がTR4のタンパク質量の制御を介して脂質代謝を制御することを示すものであった.
4.SIRT7はDCAF1-DDB1-CUL4Bユビキチンリガーゼ複合体に結合してTR4のタンパク質分解を抑制する
SIRT7はどのようにTR4のタンパク質量を制御しているのだろうか.SIRT7ノックアウトマウスの肝臓において,TR4のmRNAの発現量は野生型マウスと差がなかったことから,TR4のタンパク質安定性について解析した.パルスチェイス解析により,TR4はSIRT7をノックダウンしたAML-12細胞においてより早く分解することが見い出された.さらに,TR4は細胞内においてユビキチン化されること,そのユビキチン化はSIRT7の強制発現により低下することが明らかになった.
SIRT7がTR4のユビキチン化を抑制する機構を解明するため,SIRT7とTR4との結合をさまざまな手法により調べたが,その結合は検出できなかった.そこで,SIRT7がなんらかのユビキチン関連タンパク質を制御することにより間接的にTR4を制御しているのではないかと考え,プルダウン法および質量分析法を用いてTR4と結合するタンパク質を網羅的に取得した.その結果,CUL4ユビキチンリガーゼ複合体6,7) の構成タンパク質であるDDB1およびDCAF1が検出された.免疫沈降法により,DCAF1-DDB1-CUL4Bユビキチンリガーゼ複合体はTR4と結合することが示された.さらに,SIRT7をノックダウンしたHepa1-6肝細胞においてCUL4BをsiRNAによりノックダウンすると,対照となるsiRNAを用いたときと比べTR4のタンパク質量が増加することが明らかになった.これらの結果から,肝細胞においてDCAF1-DDB1-CUL4Bユビキチンリガーゼ複合体はTR4と結合し,そのユビキチン化および分解を促進することが強く示唆された.
SIRT7はDCAF1,DDB1,CUL4Bのそれぞれと複合体を形成することも明らかになった.そこで,SIRT7がDCAF1-DDB1-CUL4Bユビキチンリガーゼ複合体に依存的なTR4の分解を制御するかどうかについて解析した.Hepa1-6細胞においてSIRT7をノックダウンするとTR4のタンパク質量は減少したが,同時にCUL4BをノックダウンするとTR4のタンパク質量は減少しなかった.また,SIRT7をノックダウンしたAML-12細胞においてSIRT7を強制発現させるとTR4のタンパク質量は増加したが,同時にCUL4BをノックダウンするとTR4のタンパク質量は増加しなかった.これらの結果は,SIRT7がDCAF1-DDB1-CUL4Bユビキチンリガーゼ複合体と結合し,それによりTR4のユビキチン化および分解を阻害することを示した.
おわりに
これらの研究の結果より,SIRT7はユビキチン-プロテアソーム経路の制御を介して肝臓における脂質代謝を制御することが明らかになった.肝細胞においてSIRT7はDCAF1-DDB1-CUL4Bユビキチンリガーゼ複合体と結合し,それによりTR4のユビキチン化および分解を阻害する(図1).分解をまぬがれたTR4はCd36遺伝子などの脂質代謝に関連する遺伝子の発現を上昇させる.結果的に,脂肪酸の取り込みおよび貯蔵に機能する経路がはたらき,過剰の脂肪を摂取した場合には肝臓に脂肪が蓄積していくことになる.一方,SIRT7がない場合にはTR4は分解の方向にかたむいて脂肪酸の取り込みおよび貯蔵に機能する経路のはたらきが低下するため,過剰の脂肪を摂取した場合でも肝臓に脂肪が蓄積しにくくなる.したがって,SIRT7に特異的な阻害剤の開発は脂肪肝などの代謝異常症の予防および治療に有効であると考えられる.
筆者らの知るかぎり,Sirtuinがユビキチンリガーゼ複合体に結合しその機能を制御することは,現在までに報告されていない新しい発見である.しかし,SIRT7がどのような機構で,どのような酵素活性により,ユビキチンリガーゼ複合体の機能を制御しているかについては,現時点では不明である.また,白色脂肪細胞あるいは褐色脂肪細胞におけるSIRT7の分子機能は十分に明らかではない.SIRT7のさらなる分子解剖を進めることにより,将来の代謝異常症の予防あるいは治療に貢献することをめざしている.
文 献
- Guarente, L.: Sirtuins, aging, and medicine. N. Engl. J. Med., 364, 2235-2244 (2011)[PubMed]
- Houtkooper, R. H., Pirinen, E. & Auwerx, J.: Sirtuins as regulators of metabolism and healthspan. Nat. Rev. Mol. Cell Biol., 13, 225-238 (2012)[PubMed]
- Barber, M. F., Michishita-Kioi, E., Xi, Y. et al.: SIRT7 links H3K18 deacetylation to maintenance of oncogenic transformation. Nature, 487, 114-118 (2012)[PubMed]
- Vakhrusheva, O., Smolka, C., Gajawada, P. et al.: Sirt7 increases stress resistance of cardiomyocytes and prevents apoptosis and inflammatory cardiomyopathy in mice. Circ. Res., 102, 703-710 (2008)[PubMed]
- Kang, H. S., Okamoto, K., Kim, Y. -S. et al.: Nuclear orphan receptor TAK1/TR4-deficient mice are protected against obesity-linked inflammation, hepatic steatosis, and insulin resistance. Diabetes, 60, 177-188 (2011)[PubMed]
- Lee, J. & Zhou, P.: DCAFs, the missing link of the CUL4-DDB1 ubiquitin ligase. Mol. Cell, 26, 775-780 (2007)[PubMed]
- Higa, L. A. & Zhang, H.: Stealing the spotlight: CUL4-DDB1 ubiquitin ligase docks WD40-repeat proteins to destroy. Cell Div., 2, 1-9 (2007)[PubMed]
著者プロフィール
略歴:1999年 東京大学大学院農学生命科学研究科にて博士号取得,新潟大学歯学部 助手,米国Columbia大学 ポスドク研究員,熊本大学大学院生命科学研究部 助教を経て,2011年より同 講師.
山縣 和也(Kazuya Yamagata)
熊本大学大学院生命科学研究部 教授.
研究室URL:http://srv02.medic.kumamoto-u.ac.jp/dept/biochem2/biochem2.html
© 2014 吉澤達也・山縣和也 Licensed under CC 表示 2.1 日本