冠動脈および心外膜前駆細胞の心臓への進入過程におけるBMPシグナルの役割
石井泰雄1・三川 隆2
(1京都産業大学総合生命科学部 生命システム学科,2米国California大学San Francisco校Cardiovascular Research Institute)
email:石井泰雄,三川 隆
DOI: 10.7875/first.author.2010.017
BMP signals promote proepicardial protrusion necessary for recruitment of coronary vessel and epicardial progenitors to the heart.
Yasuo Ishii, Robert J. Garriock, Alicia M. Navetta, Laura E. Coughlin, Takashi Mikawa
Developmental Cell, 19, 307-316 (2010)
たえず拍動をつづける心臓は酸素の消費量のきわめて多い臓器であり,その維持には冠動脈による酸素と栄養分の供給とが必要である.冠動脈は,心臓表面を覆う心外膜とともに,発生の特定の時期に心臓の外から移動してくる細胞によってつくられる.これらの細胞は,肝臓の近くに生じる中胚葉性の突起であるproepicardiumに由来する.proepicardiumは心臓にむかって成長し心臓表面に接着する.それは,冠動脈の形成およびそののちの心機能に必要不可欠なイベントであるが,そのしくみはよくわかっていない.筆者らは,鳥類胚をモデルとして用い,心臓の一部に高いレベルで発現するBMP2がproepicardiumの心臓へとむかう成長を促進することを明らかにした.これは,心臓からの分泌性シグナルがproepicardiumの心臓への融合を制御するというモデルを支持している.
動物のからだを構成する器官は多種の細胞が秩序正しく統合されてできており,その統合を制御する分子機構の解明は発生生物学の重要なテーマのひとつである.心臓は発生過程でもっとも早くから機能する器官であるが,初期の心臓は心筋と心内膜とからなるごく単純な一本の管にすぎない.心臓の筋肉組織に血液を供給する冠動脈とその表面を覆う心外膜はともに,心臓が拍動しはじめたのち,心臓の外から移動してくる細胞が新たにつけ加わることによって生じる.しかし,これらの細胞を心臓へと導く分子機構はこれまで明らかにされてこなかった.筆者らは,鳥類胚を用いたin vivo解析,in vitro解析により,BMPファミリーのメンバーがこれら細胞の心臓への移動を制御していることを明らかにした.ここでは,この結果を中心に,冠動脈および心外膜の起源であるproepicardiumの心臓への統合について概説する.
脊椎動物の冠動脈および心外膜は,心臓の外から移動してくる細胞によってつくられる.その起源であるproepicardiumは,哺乳類から軟骨魚類にいたるさまざまな生物種でみつかっている.鳥類胚のproepicardiumは,表面に多くの絨毛様の突起をもつ最大直径200μm程度のカリフラワー状の突起であり,肝臓原基の近傍に形成される1-3)(図1a).心臓のループ形成が進むにつれて,proepicardiumは心臓の房室接合部(atrioventricular junction)にむかって成長し,その部位に接着したのち,心臓表面を覆う上皮組織である心外膜を形成する3).その細胞の一部は上皮-間充織転換をへて心筋層に潜り込み4),冠動脈を形成する4,5)(図1b).proepicardiumの心臓への接着を物理的に阻害すると冠動脈と心外膜を欠く心臓が生じ,胚は発生の途中で死亡する6).このことは,proepicardiumが冠動脈と心外膜のおもな起源であり,proepicardiumが正しく心臓へと統合されることがのちの心機能に必要であることを示している.
proepicardiumの形成には周囲の組織による誘導が関与しているものと考えられる.筆者らは,本来はproepicardiumを形成しない領域に移植した肝臓原基が,周囲の中皮組織に対してproepicardiumマーカー遺伝子の発現を誘導することを明らかにしている1).肝臓からの誘導因子に関してはin vitro培養系を用いた解析によりいくつかの候補があげられているが1),in vivo系において移植した肝臓と同様の作用を示す単一の誘導因子は現在のところみつかっていない.
ニワトリ胚では,proepicardium細胞は隣接する心房静脈洞(sinoatrium)からではなく,囲心腔を隔てた房室接合部から心臓へ進入する(図1b).proepicardium細胞の心臓への移動に関してはつぎの2つの様式が観察されている.ラット,ニワトリ,ウズラ,アフリカツメガエルなどの胚では,proepicardiumが直接に心臓表面に接着し,その細胞が心臓表面とのあいだに“橋”を形成して心臓へ進入する3,7,8).一方,マウスや軟骨魚類のトラザメでは,proepicardium細胞からなる小胞が遊離し,囲心腔をただよったのち心臓表面に接着するものと考えられている9,10).しかし近年,マウス胚でもproepicardium細胞が心臓への直接の接着を介して心臓へ移動するとの観察結果も報告されている11).
哺乳類では,proepicardiumで発現するα4インテグリンと心筋で発現するVCAM-1がともに,proepicardiumの心臓への移動に必要であることがわかっており,両者の相互作用の関与が示唆されている11).しかし,VCAM-1は心筋全体で発現するため,proepicardium細胞が心臓の特定の部位から進入するしくみをこれらのタンパク質の機能のみから説明することはできない.
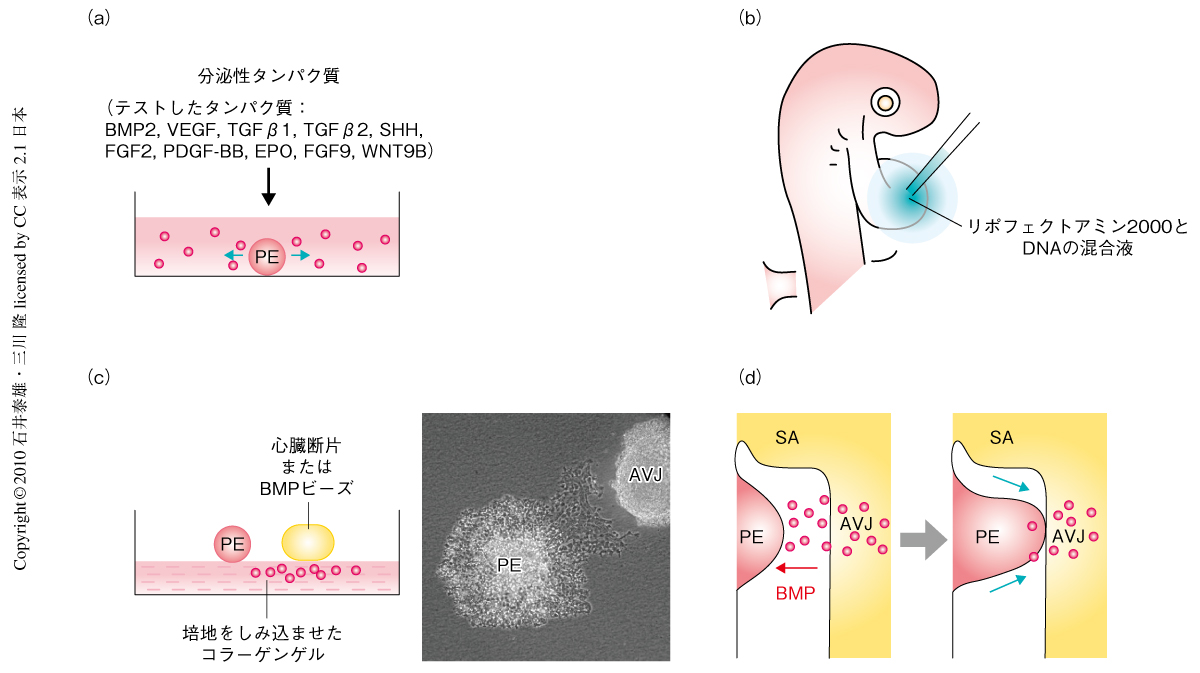
筆者らは,まず,Tbx18をマーカーとして用いてproepicardiumの発生過程を観察した.その結果,proepicardiumは心房静脈洞のすぐ後方に生じるが,心房静脈洞ではなく囲心腔を隔てた房室接合部にむかって突起を成長させ,その部位から心臓へ進入することを明らかにした(図1b).このことは,proepicardiumを房室接合部にむけて成長させるしくみの存在する可能性を示唆している.そこでつぎに,in vitro培養したproepicardiumにさまざまな分泌性シグナルタンパク質をくわえ,proepicardiumの成長を促進するタンパク質を探索した(図2a).その結果,試験したタンパク質のなかでBMP2のみが,間充織転換をひき起こすことなくproepicardiumの成長を有意に促進する作用を示した.in situハイブリダイゼーションおよびRT-PCR法を用いてBMPファミリー遺伝子の発現を調べたところ,Bmp2遺伝子が房室接合部に特異的に高いレベルで発現していることがわかった.Bmp2遺伝子と相同性の高いBmp4遺伝子の発現は心臓では検出されなかった.一方,proepicardium細胞ではBMP受容体の発現が検出され,房室接合部からproepicardiumへのBMPを介したシグナル伝達の存在する可能性が示された.
BMPシグナルがproepicardiumの心臓への融合に関与しているかどうかを調べるため,リポフェクションを用いた遺伝子導入によるin vivo解析を行った(図2b).BMPの拮抗阻害タンパク質であるNogginを心臓で強制発現させると,proepicardiumの成長および心臓への融合が抑制された.一方,Bmp2遺伝子を強制発現させると,本来はproepicardiumの接着が起こらない心臓のループ外側へのproepicardiumの接着が認められた.これは,心臓におけるBmp2遺伝子の発現の局在がproepicardiumの正常な心臓への融合に必要であることを示唆している.
このin vivo遺伝子導入の結果は,proepicardiumの成長および心臓への融合にBMPシグナルの関与していることを示唆しているが,BMPが直接にproepicardiumに作用するのか,それとも,ほかの組織への作用を介して間接的にproepicardiumに作用しているのかはわからない.そこで,in vitro共培養を用い,房室接合部およびBMPが直接にproepicardiumに作用してその成長の方向性に影響を及ぼすのかどうかを調べた.組織片あるいはビーズから放出されたタンパク質が自由に拡散するのを抑えるため,培地をしみ込ませたコラーゲンゲルを培養基質として用いた(図2c).proepicardiumを単独で培養した場合,proepicardiumの成長に明らかな方向性は認められなかった.一方,proepicardiumを房室接合部とともに培養した場合,proepicardiumは房室接合部にむかって著しく成長した(図2c).この房室接合部のproepicardiumに対する作用はNogginによって濃度依存的に阻害され,BMPを介した作用であることが示唆された.実際,BMP2をしみ込ませたビーズと共培養すると,proepicardiumはそのビーズにむかって成長した.これらの結果は,in vitroの系において,房室接合部およびBMP2が直接にproepicardiumに作用し,proepicardiumの形態形成を制御することを示している.
このように,BMPシグナルがproepicardiumの心臓への融合に関与していることが示され,心臓の冠動脈および心外膜の発生におけるBMPの新たな役割が明らかになった.BMP2がproepicardiumの成長を促進することを示したこの実験結果は,心臓からの局所的なBMPシグナルがproepicardiumの成長を房室接合部へ方向づけるというモデルを支持している(図2d).囲心腔に分泌されたBMPが,すでに拍動を開始している心臓の近傍で,proepicardiumの成長の方向指示因子としてどのようにはたらくのかという点に関しては今後の研究を待たねばならないが,ヘパラン硫酸やフィブロネクチンを含む細胞外基質が局所的に放出されたBMPの保持にはたらいている可能性は十分に考えられる3).近年,哺乳類,鳥類のproepicardiumが心筋へと分化するポテンシャルをもっていること2,12,13),魚類の成体の心外膜が損傷をうけた心臓の血管を再生すること14),が示されており,proepicardiumおよびproepicardiumに由来する細胞は再生医学の観点からも注目されつつある.proepicardiumの形成およびその心臓への統合に関して得られる知見が,今後の心疾患の新規治療法の開発に貢献することが期待される.
略歴:1998年 東京都立大学理学研究科博士課程 修了,国立精神神経センター神経研究所 流動研究員,英国Nottingham大学Institute of Geneticsリサーチアソシエイト,米国Cornell大学Weill Medical College博士研究員,米国California大学San Francisco校 博士研究員,同 アソシエイトスペシャリストを経て,2010年より京都産業大学総合生命科学部 助教.
研究テーマ:心臓,眼,消化器の形成機構.
関心事:器官形成のときのダイナミックかつ調和のとれた細胞の振る舞いをもたらすしくみに興味がある.
三川 隆(Takashi Mikawa)
略歴:京都大学大学院理学研究科博士課程 修了,米国Cornell大学Weill Medical College客員助教授,同 教授を経て,2006年より米国California大学San Francisco校Cardiovascular Research Institute教授.
研究テーマ:形態形成.
© 2010 石井泰雄・三川 隆 Licensed under CC 表示 2.1 日本
(1京都産業大学総合生命科学部 生命システム学科,2米国California大学San Francisco校Cardiovascular Research Institute)
email:石井泰雄,三川 隆
DOI: 10.7875/first.author.2010.017
BMP signals promote proepicardial protrusion necessary for recruitment of coronary vessel and epicardial progenitors to the heart.
Yasuo Ishii, Robert J. Garriock, Alicia M. Navetta, Laura E. Coughlin, Takashi Mikawa
Developmental Cell, 19, 307-316 (2010)
要 約
たえず拍動をつづける心臓は酸素の消費量のきわめて多い臓器であり,その維持には冠動脈による酸素と栄養分の供給とが必要である.冠動脈は,心臓表面を覆う心外膜とともに,発生の特定の時期に心臓の外から移動してくる細胞によってつくられる.これらの細胞は,肝臓の近くに生じる中胚葉性の突起であるproepicardiumに由来する.proepicardiumは心臓にむかって成長し心臓表面に接着する.それは,冠動脈の形成およびそののちの心機能に必要不可欠なイベントであるが,そのしくみはよくわかっていない.筆者らは,鳥類胚をモデルとして用い,心臓の一部に高いレベルで発現するBMP2がproepicardiumの心臓へとむかう成長を促進することを明らかにした.これは,心臓からの分泌性シグナルがproepicardiumの心臓への融合を制御するというモデルを支持している.
はじめに
動物のからだを構成する器官は多種の細胞が秩序正しく統合されてできており,その統合を制御する分子機構の解明は発生生物学の重要なテーマのひとつである.心臓は発生過程でもっとも早くから機能する器官であるが,初期の心臓は心筋と心内膜とからなるごく単純な一本の管にすぎない.心臓の筋肉組織に血液を供給する冠動脈とその表面を覆う心外膜はともに,心臓が拍動しはじめたのち,心臓の外から移動してくる細胞が新たにつけ加わることによって生じる.しかし,これらの細胞を心臓へと導く分子機構はこれまで明らかにされてこなかった.筆者らは,鳥類胚を用いたin vivo解析,in vitro解析により,BMPファミリーのメンバーがこれら細胞の心臓への移動を制御していることを明らかにした.ここでは,この結果を中心に,冠動脈および心外膜の起源であるproepicardiumの心臓への統合について概説する.
1.proepicardiumは心臓の冠動脈および心外膜を形成する
脊椎動物の冠動脈および心外膜は,心臓の外から移動してくる細胞によってつくられる.その起源であるproepicardiumは,哺乳類から軟骨魚類にいたるさまざまな生物種でみつかっている.鳥類胚のproepicardiumは,表面に多くの絨毛様の突起をもつ最大直径200μm程度のカリフラワー状の突起であり,肝臓原基の近傍に形成される1-3)(図1a).心臓のループ形成が進むにつれて,proepicardiumは心臓の房室接合部(atrioventricular junction)にむかって成長し,その部位に接着したのち,心臓表面を覆う上皮組織である心外膜を形成する3).その細胞の一部は上皮-間充織転換をへて心筋層に潜り込み4),冠動脈を形成する4,5)(図1b).proepicardiumの心臓への接着を物理的に阻害すると冠動脈と心外膜を欠く心臓が生じ,胚は発生の途中で死亡する6).このことは,proepicardiumが冠動脈と心外膜のおもな起源であり,proepicardiumが正しく心臓へと統合されることがのちの心機能に必要であることを示している.
proepicardiumの形成には周囲の組織による誘導が関与しているものと考えられる.筆者らは,本来はproepicardiumを形成しない領域に移植した肝臓原基が,周囲の中皮組織に対してproepicardiumマーカー遺伝子の発現を誘導することを明らかにしている1).肝臓からの誘導因子に関してはin vitro培養系を用いた解析によりいくつかの候補があげられているが1),in vivo系において移植した肝臓と同様の作用を示す単一の誘導因子は現在のところみつかっていない.
ニワトリ胚では,proepicardium細胞は隣接する心房静脈洞(sinoatrium)からではなく,囲心腔を隔てた房室接合部から心臓へ進入する(図1b).proepicardium細胞の心臓への移動に関してはつぎの2つの様式が観察されている.ラット,ニワトリ,ウズラ,アフリカツメガエルなどの胚では,proepicardiumが直接に心臓表面に接着し,その細胞が心臓表面とのあいだに“橋”を形成して心臓へ進入する3,7,8).一方,マウスや軟骨魚類のトラザメでは,proepicardium細胞からなる小胞が遊離し,囲心腔をただよったのち心臓表面に接着するものと考えられている9,10).しかし近年,マウス胚でもproepicardium細胞が心臓への直接の接着を介して心臓へ移動するとの観察結果も報告されている11).
哺乳類では,proepicardiumで発現するα4インテグリンと心筋で発現するVCAM-1がともに,proepicardiumの心臓への移動に必要であることがわかっており,両者の相互作用の関与が示唆されている11).しかし,VCAM-1は心筋全体で発現するため,proepicardium細胞が心臓の特定の部位から進入するしくみをこれらのタンパク質の機能のみから説明することはできない.
2.BMPはproepicardiumの成長を促すユニークな活性をもつ
筆者らは,まず,Tbx18をマーカーとして用いてproepicardiumの発生過程を観察した.その結果,proepicardiumは心房静脈洞のすぐ後方に生じるが,心房静脈洞ではなく囲心腔を隔てた房室接合部にむかって突起を成長させ,その部位から心臓へ進入することを明らかにした(図1b).このことは,proepicardiumを房室接合部にむけて成長させるしくみの存在する可能性を示唆している.そこでつぎに,in vitro培養したproepicardiumにさまざまな分泌性シグナルタンパク質をくわえ,proepicardiumの成長を促進するタンパク質を探索した(図2a).その結果,試験したタンパク質のなかでBMP2のみが,間充織転換をひき起こすことなくproepicardiumの成長を有意に促進する作用を示した.in situハイブリダイゼーションおよびRT-PCR法を用いてBMPファミリー遺伝子の発現を調べたところ,Bmp2遺伝子が房室接合部に特異的に高いレベルで発現していることがわかった.Bmp2遺伝子と相同性の高いBmp4遺伝子の発現は心臓では検出されなかった.一方,proepicardium細胞ではBMP受容体の発現が検出され,房室接合部からproepicardiumへのBMPを介したシグナル伝達の存在する可能性が示された.
3.BMPシグナルはproepicardiumの心臓への融合を制御する
BMPシグナルがproepicardiumの心臓への融合に関与しているかどうかを調べるため,リポフェクションを用いた遺伝子導入によるin vivo解析を行った(図2b).BMPの拮抗阻害タンパク質であるNogginを心臓で強制発現させると,proepicardiumの成長および心臓への融合が抑制された.一方,Bmp2遺伝子を強制発現させると,本来はproepicardiumの接着が起こらない心臓のループ外側へのproepicardiumの接着が認められた.これは,心臓におけるBmp2遺伝子の発現の局在がproepicardiumの正常な心臓への融合に必要であることを示唆している.
4.BMPは直接にproepicardiumに作用する
このin vivo遺伝子導入の結果は,proepicardiumの成長および心臓への融合にBMPシグナルの関与していることを示唆しているが,BMPが直接にproepicardiumに作用するのか,それとも,ほかの組織への作用を介して間接的にproepicardiumに作用しているのかはわからない.そこで,in vitro共培養を用い,房室接合部およびBMPが直接にproepicardiumに作用してその成長の方向性に影響を及ぼすのかどうかを調べた.組織片あるいはビーズから放出されたタンパク質が自由に拡散するのを抑えるため,培地をしみ込ませたコラーゲンゲルを培養基質として用いた(図2c).proepicardiumを単独で培養した場合,proepicardiumの成長に明らかな方向性は認められなかった.一方,proepicardiumを房室接合部とともに培養した場合,proepicardiumは房室接合部にむかって著しく成長した(図2c).この房室接合部のproepicardiumに対する作用はNogginによって濃度依存的に阻害され,BMPを介した作用であることが示唆された.実際,BMP2をしみ込ませたビーズと共培養すると,proepicardiumはそのビーズにむかって成長した.これらの結果は,in vitroの系において,房室接合部およびBMP2が直接にproepicardiumに作用し,proepicardiumの形態形成を制御することを示している.
おわりに
このように,BMPシグナルがproepicardiumの心臓への融合に関与していることが示され,心臓の冠動脈および心外膜の発生におけるBMPの新たな役割が明らかになった.BMP2がproepicardiumの成長を促進することを示したこの実験結果は,心臓からの局所的なBMPシグナルがproepicardiumの成長を房室接合部へ方向づけるというモデルを支持している(図2d).囲心腔に分泌されたBMPが,すでに拍動を開始している心臓の近傍で,proepicardiumの成長の方向指示因子としてどのようにはたらくのかという点に関しては今後の研究を待たねばならないが,ヘパラン硫酸やフィブロネクチンを含む細胞外基質が局所的に放出されたBMPの保持にはたらいている可能性は十分に考えられる3).近年,哺乳類,鳥類のproepicardiumが心筋へと分化するポテンシャルをもっていること2,12,13),魚類の成体の心外膜が損傷をうけた心臓の血管を再生すること14),が示されており,proepicardiumおよびproepicardiumに由来する細胞は再生医学の観点からも注目されつつある.proepicardiumの形成およびその心臓への統合に関して得られる知見が,今後の心疾患の新規治療法の開発に貢献することが期待される.
文 献
- Ishii, Y., Langberg, J. D., Hurtado, R. et al.: Induction of proepicardial marker gene expression by the liver bud. Development, 134, 3627-3637 (2007)[PubMed]
- Ishii, Y., Langberg, J., Rosborough, K. et al.: Endothelial cell lineages of the heart. Cell Tissue Res., 335, 67-73 (2007)[PubMed]
- Nahirney, P. C., Mikawa, T., Fischman, D. A.: Evidence for an extracellular matrix bridge guiding proepicardial cell migration to the myocardium of chick embryos. Dev. Dyn., 227, 511-523 (2003)[PubMed]
- Dettman, R. W., Denetclaw, W. Jr., Ordahl, C. P. et al.: Common epicardial origin of coronary vascular smooth muscle, perivascular fibroblasts, and intermyocardial fibroblasts in the avian heart. Dev. Biol., 193, 169-181 (1998)[PubMed]
- Mikawa T. & Gourdie, R. G.: Pericardial mesoderm generates a population of coronary smooth muscle cells migrating into the heart along with ingrowth of the epicardial organ. Dev. Biol., 174, 221-232 (1996)[PubMed]
- Pennisi, D. J., Ballard, V. L. T., Mikawa, T.: Epicardium is required for the full rate of myocyte proliferation and levels of expression of myocyte mitogenic factors FGF2 and its receptor, FGFR-1, but not for transmural myocardial patterning in the embryonic chick heart. Dev. Dyn., 228, 161-172 (2003)[PubMed]
- Nesbitt, T., Lemley, A., Davis, J. et al.: Epicardial development in the rat: a new perspective. Microsc. Microanal., 12, 390-398 (2006)[PubMed]
- Jahr, M., Schlueter, J., Brand, T. et al.: Development of the proepicardium in Xenopus laevis. Dev. Dyn., 237, 3088-3096 (2008)[PubMed]
- Sengbusch, J. K., He, W., Pinco, K. A. et al.: Dual functions of α4β1 integrin in epicardial development: initial migration and long-term attachment. J. Cell Biol., 157, 873-882 (2002)[PubMed]
- Munoz-Chapuli, R., Macias, D., Ramoset, C. et al.: Development of the epicardium in the dogfish (Scyliorhinus canicula). Acta Zool., 78, 39-46 (1997)
- Rodgers, L. S., Lalani, S., Runyan, R. B. et al.: Differential growth and multicellular villi direct proepicardial translocation to the developing mouse heart. Dev. Dyn., 237, 145-152 (2008)[PubMed]
- Cai, C. -L.: A myocardial lineage derives from Tbx18 epicardial cells. Nature, 454, 104-109 (2008)[PubMed]
- Zhou, B., Ma, Q., Rajagopal, S. et al.: Epicardial progenitors contribute to the cardiomyocyte lineage in the developing heart. Nature, 454, 109-113 (2008)[PubMed]
- Lepilina, A., Coon, A. N., Kikuchi, K. et al.: A dynamic epicardial injury response supports progenitor cell activity during zebrafish heart regeneration. Cell, 127, 607-619 (2006)[PubMed]
著者プロフィール
略歴:1998年 東京都立大学理学研究科博士課程 修了,国立精神神経センター神経研究所 流動研究員,英国Nottingham大学Institute of Geneticsリサーチアソシエイト,米国Cornell大学Weill Medical College博士研究員,米国California大学San Francisco校 博士研究員,同 アソシエイトスペシャリストを経て,2010年より京都産業大学総合生命科学部 助教.
研究テーマ:心臓,眼,消化器の形成機構.
関心事:器官形成のときのダイナミックかつ調和のとれた細胞の振る舞いをもたらすしくみに興味がある.
三川 隆(Takashi Mikawa)
略歴:京都大学大学院理学研究科博士課程 修了,米国Cornell大学Weill Medical College客員助教授,同 教授を経て,2006年より米国California大学San Francisco校Cardiovascular Research Institute教授.
研究テーマ:形態形成.
© 2010 石井泰雄・三川 隆 Licensed under CC 表示 2.1 日本