がん遺伝子産物Mycによる細胞競合はp53を介した代謝ステータスの変化により協調的に制御される
松田 七美
(早稲田大学理工学術院先進理工学研究科 生命医科学科分子生化学研究室)
email:松田七美
DOI: 10.7875/first.author.2014.043
Supercompetitor status of Drosophila Myc cells requires p53 as a fitness sensor to reprogram metabolism and promote viability.
Claire de la Cova, Nanami Senoo-Matsuda, Marcello Ziosi, D. Christine Wu, Paola Bellosta, Catarina M. Quinzii, Laura A. Johnston
Cell Metabolism, 19, 470-483 (2014)
筆者らは,ショウジョウバエにおいてがん遺伝子産物Mycがその発現量の差異により細胞競合を誘導し,器官の発生におけるさまざまな細胞の運命を制御し,器官の最終的な大きさおよびかたちを正しく制御していることを報告してきた.今回,細胞競合が生じる際にMycの発現量の高いMyc高発現細胞とMycの発現量の低いMyc低発現細胞とが互いを感知し,細胞非自律的にそれぞれの細胞特性が決定づけられるしくみにおいて,Mycおよびp53によるエネルギー代謝の協調的な制御が重要な役割をはたすことが明らかにされた.競合条件下におけるMyc高発現細胞では,Mycおよびp53により細胞非自律的に好気的な解糖が亢進し,増殖能および生存能がより高まり,勝ち組としての細胞特性を獲得することが示された.Myc低発現細胞においては,p53は細胞死などを介して,負け組としての細胞特性を得るため重要な役割をはたすことが示された.このような代謝の変化による細胞運命の制御は,がん化およびがんの悪性化,また,iPS細胞の初期化における代謝のリプログラミングとも類似していた.今後,がんや再生の分野において,細胞競合の概念に注視しその普遍的な分子機構が解明されることにより,新たな知見の得られることが期待される.
細胞競合とは,増殖が速く生存能の高い,あるいは,適応度の高い細胞(勝ち組)と,増殖が遅く細胞死により排除される,あるいは,適応度の低い細胞(負け組)とが,互いに細胞非自律的に競合して増殖,生存,分化が統合的に制御されることにより,最終的に一定の大きさと機能をもつ器官が形成される現象として定義される.その機構は,多細胞生物の組織構築の過程における種々の細胞の運命決定ばかりでなく,がんの発症初期におけるがん前駆細胞の排除,成熟したがん細胞の優勢な増殖,幹細胞ニッチにおける適応性の高い幹細胞の選択,などにおいて,広く重要な役割をはたすと考えられている.
筆者らは,この論文において,がん遺伝子産物Mycにより制御される細胞競合において,勝ち組あるいは負け組となる細胞が互いを認知し細胞非自律的にそれぞれの細胞特性(適応度)を決定づけるため,Mycとp53によるエネルギー代謝の協調的な制御が重要な役割をはたしていることを明らかにした.
筆者らはこれまでに,ショウジョウバエの幼虫の翅原基(将来,成虫の翅になる組織)から成虫の翅まで発生するところを解析するin vivoのモデル,および,ショウジョウバエの培養細胞株であるS2細胞を用いた共培養系によるin vitroのモデルを構築し,Mycの発現量の高いMyc高発現細胞が勝ち組となり,Mycの発現量の低い(すなわち,野生型の)Myc低発現細胞が負け組となって,互いに競合することを見い出していた1,2).Mycは,その発現量の差異により細胞の成長と増殖,細胞死,細胞周期を統合的に制御することより,器官の発生においてさまざまな細胞の運命を制御し,器官の最終的な大きさおよびかたちを正しく制御していた.
予備的な検討から,Mycによる細胞競合が生じる際に,とくに勝ち組となるMyc高発現細胞におけるエネルギー代謝の変化がWarburg効果と類似していることが見い出された.多細胞組織におけるがん化あるいはがんの悪性化にかかわるエネルギー代謝の変化として,Mycをはじめとした多くのがん遺伝子産物によりWarburg効果として知られる代謝ステータスの変化をともなう細胞特性の変化,とくに好気的な解糖の亢進の生じることが報告されている3).しかしながら,がん細胞における代謝ステータスの制御の詳細についてはほとんど不明である.
興味深いことに,多能性幹細胞であるES細胞においても,その代謝は解糖系に依存するという特徴がある4).また,iPS細胞の樹立において多能性を獲得する初期化の過程においては,ミトコンドリア代謝から解糖系を中心とした代謝への移行がみられ,iPS細胞もES細胞と同様に解糖系への依存性を示す.つまり,多能性を獲得する初期化の過程において,代謝についてもリプログラミングが起こり,解糖系に依存する代謝の変化は多能性マーカーの発現にさきだって起こることが知られている5).MycはiPS細胞の樹立に必要な山中4因子のひとつであり,このような代謝のリプログラミングにおいて,Warburg効果と類似したしくみを利用して細胞特性の変化を制御している可能性が示唆される.
Mycにより,グルコーストランスポーターであるGLUT1および解糖系にかかわる10の酵素のうちの9つの酵素の発現,また,ミトコンドリア代謝への最初のステップであるピルビン酸からアセチルCoAへの変換を触媒するピルビン酸脱水素酵素の阻害酵素であるPDK1の発現が亢進することが報告されている6).すなわち,Mycにより解糖系が亢進し,ミトコンドリア代謝が抑制される方向で代謝が制御されることが示されているが,これだけでは,好気的な解糖の亢進という代謝ステータスを得るしくみを説明することはできなかった.
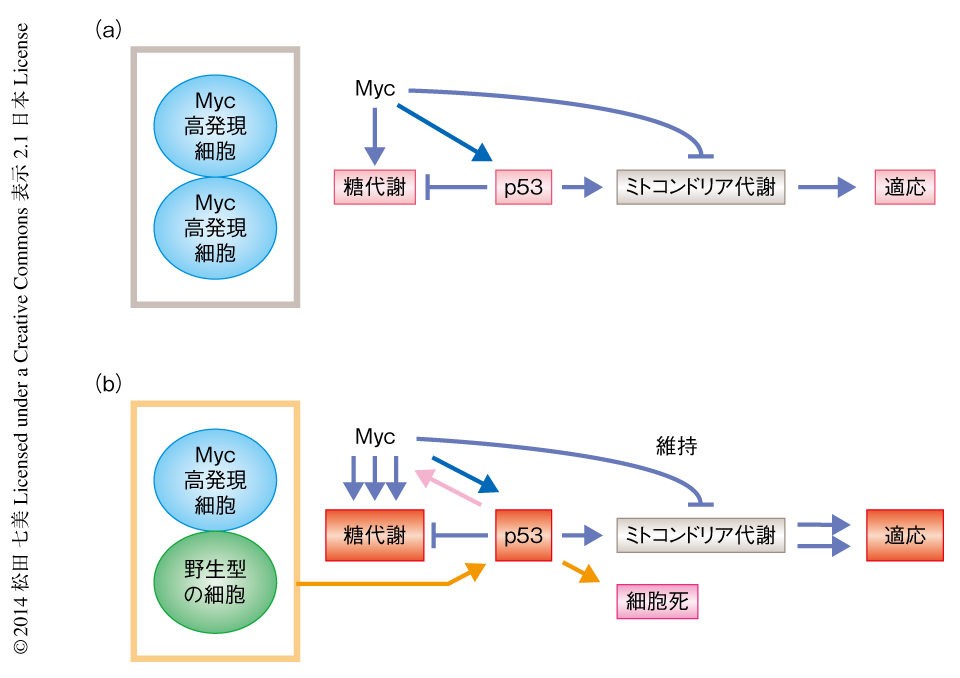
非競合条件下(単培養系)において,Mycにより誘導される代謝の変化について解析した.その結果,Myc高発現細胞においては.Myc低発現細胞である野生型の細胞と比較して,糖代謝に関連する酵素の発現が上昇し,グルコースの取り込みの上昇,および,解糖系の亢進のみられることが明らかになった.また興味深いことに,非競合条件下においてMyc高発現細胞では,ミトコンドリア代謝に関連するピルビン酸デヒドロゲナーゼ複合体のE1のαサブユニット,電子伝達系複合体IIのIpサブユニット,電子伝達系複合体IIIのSCO2サブユニットの発現が上昇し,電子伝達系複合体IIの酵素活性は有意に上昇したのに対し,電子伝達系複合体IVの酵素活性およびATPの量は低下することが示された(図1a).
これまでに筆者らは,Mycにより細胞競合が生じる際に,勝ち組および負け組となる細胞が互いを認知し細胞非自律的にそれぞれの細胞特性を変化させること,すなわち,勝ち組(Myc高発現細胞)では増殖能および生存能がより高くなり,負け組(Myc低発現細胞)では増殖能および生存能がより低くなることを報告してきた1,2).
競合条件下(間接共培養系)において勝ち組となるMyc高発現細胞の代謝を,非競合条件下における代謝と比較したところ,グルコーストランスポーターであるGLUT1およびGLUT3の発現の顕著な上昇,ヘキソキナーゼや乳酸デヒドロゲナーゼなど解糖系に関連する酵素の発現の有意な上昇がみられるとともに,グルコースの取り込みの顕著な上昇がみられ,糖代謝が大きく亢進していることが示された.また,競合条件下においてMyc高発現細胞では,非競合条件下と比較して電子伝達系複合体IIIのSCO2サブユニットの発現が有意に上昇し,ミトコンドリア代謝は低下が認められたものの維持され,より顕著な好気的な糖代謝の亢進のみられることが明らかになった(図1b).
Mycにより発現の上昇する,ミトコンドリア代謝に関連する電子伝達系複合体IIIのSCO2サブユニットに着目した7).このタンパク質はがん抑制遺伝子産物p53によりミトコンドリア代謝を維持するため正方向に制御され,がん化や老化などの細胞特性の変化にともないミトコンドリア代謝を活性化して糖代謝を抑制することにより,代謝のバランスを制御する重要な役割をはたすことが報告されている8,9).Myc遺伝子など細胞増殖を誘導するがん遺伝子を高く発現させた細胞ではp53の発現が強く誘導され,p53を介する迅速な応答としてアポトーシスが誘導される10).また,活性型の変異をもつrasがん遺伝子を強制発現させた細胞では,p53の活性化に依存して細胞に老化が生じ増殖が停止する11).すなわち,p53はがん遺伝子により異常な増殖速度を示すようになった細胞をアポトーシスや老化により排除することでがん化を抑制すると考えられている12).p53の活性化は,Myc遺伝子をはじめ種々のがん遺伝子を正常な細胞に導入することにより観察されるが,これは細胞増殖の促進にともなうDNA複製ストレス,および,がん化誘導ストレスにより惹起されるDNA損傷への応答であると考えられている12,13).
細胞競合の解析系において,エネルギー代謝,細胞死,ゲノム不安定性などに関して,Mycとp53とのあいだに協調的な制御が存在するかどうか興味がもたれた.筆者らの細胞競合の解析系ではMycの過剰な発現による細胞自律的な細胞死を排除するため,in vivo解析系およびin vitro解析系のいずれも,Myc高発現細胞において野生型の細胞と比較して約2~3倍の発現量というおだやかな増加となるよう条件を設定しており,Mycによる細胞自律的な細胞死は認められない1,2).これらの解析系は,細胞競合のかかわる組織の発生および再生,また,がんなどの疾患のしくみを解析するため,より生理的な条件を反映したモデルとなっているものと考えている.
in vivoおよびin vitroの細胞競合の解析系において,p53の発現はMycにより野生型の細胞の約2~3倍におだやかに上昇することが確認された.また,p53の発現を抑制した場合には電子伝達系複合体IIIのSCO2サブユニットの発現は有意に低下し,ミトコンドリア代謝が低下して糖代謝を中心とするエネルギー代謝に変化することが明らかにされた.
Mycにより誘導される細胞競合におけるp53の役割について解析した.興味深いことに,in vivoおよびin vitroの細胞競合の解析系においてp53の機能を抑制すると,勝ち組であったMyc高発現細胞の増殖能および生存能は顕著に低下して負け組に転じ,一方,負け組であったMyc低発現細胞は増殖能および生存能が相対的に高まり勝ち組に転じた.すなわち,Myc高発現細胞とMyc低発現細胞それぞれの細胞特性が逆転することが明らかになった.そこで,p53の機能抑制によるMyc高発現細胞における代謝の変化を解析したところ,勝ち組の細胞特性として観察されていたGLUT1,GLUT3,電子伝達系複合体IIIのSCO2サブユニットの発現の顕著な上昇がいずれも抑制されていた.このことから,p53はMycと協調して,勝ち組においてミトコンドリア代謝を維持した糖代謝の亢進(すなわち,好気的な解糖の亢進)を誘導するために重要な役割をはたしていることが示された.p53の機能抑制により,Myc高発現細胞においては糖代謝およびミトコンドリア代謝が抑制されて細胞内のATP量が顕著に低下し,Myc低発現細胞においては相対的に糖代謝の亢進およびミトコンドリア代謝の維持がみられたことから,前者は勝ち組から負け組に,後者は負け組から勝ち組に,それぞれ転じたものと考えられた.
さらに,p53を欠損した遺伝学的な背景において,Myc高発現細胞でうめつくされた幼虫の翅原基にMyc低発現細胞のクローンを作出したところ,競合する2種類の細胞の境界にあるMyc高発現細胞において,アポトーシスの有意な増加,および,DNAを損傷した細胞の有意な増加がみられた.このような細胞死およびゲノム不安定性の増大は,勝ち組から負け組に転じたp53欠損Myc高発現細胞における特異的かつ細胞非自律的な反応であり,非競合条件下にあるp53欠損Myc高発現細胞においては観察されなかった.
これらの結果から,勝ち組となるMyc高発現細胞では,p53の活性化により細胞非自律的に好気的な糖代謝が亢進するという代謝ステータスの変化が観察され,この変化により生存能の亢進,および,ゲノム不安定性の抑制が制御されることが示された(図1b).さらに,Gal80を用いたモザイク解析によりp53欠損のありなしの条件を詳細に変化させて解析した結果,p53はMyc高発現細胞が勝ち組としての特性を得るために必要であるだけでなく,Myc低発現細胞である野生型の細胞が細胞死などを介し負け組としての特性を得るための制御にもかかわっていることが示された(図1b).
これまでの解析から,細胞競合という新たな生命原理の概念として,ある細胞の運命は近接する細胞との特性の差により決定される,単独で集団を形成すれば生存可能な細胞であってもより適応度の高い細胞に出会うと積極的に排除される,まわりの細胞との相対的な関係に依存してある環境で負け組となる細胞が別の環境においては勝ち組になりうる,といった可能性が示唆されてきた.今回,筆者らは,Mycによる細胞競合のモデルにおいて,Warburg効果に類似した代謝ステータスの変化がMycおよびp53により協調的に制御され,p53の機能を抑制した場合には勝ち組と負け組の細胞特性(適応度)が逆転するという現象を見い出した.ここで見い出された代謝ステータスの制御は,発生,再生,発がんなど種々の生命現象において共通する細胞競合の普遍的な原理を解明するための手がかりになるものと考えられる.今後はさらに,細胞の適応度の決定にかかわる新規のタンパク質の同定と機能解析,および,細胞どうしが細胞非自律的に適応度の差を感知する分子機構の解明をめざすことが課題である.
略歴:2002年 東海大学大学院医学研究科にて博士号取得,理化学研究所脳科学総合研究センター 研究員,2003年 東京大学大学院薬学系研究科 研究員,2004年 米国Columbia大学Postdoctoral Research Scientist,2009年 早稲田大学理工学術院先進理工学研究科 講師を経て,2012年より同 客員准教授.
研究テーマ:発生,再生,がん,老化といった高次生命現象において細胞の特性を決定する普遍的な機構と,エネルギー代謝あるいはミトコンドリアの機能との関係に興味をもっている.
© 2014 松田 七美 Licensed under CC 表示 2.1 日本
(早稲田大学理工学術院先進理工学研究科 生命医科学科分子生化学研究室)
email:松田七美
DOI: 10.7875/first.author.2014.043
Supercompetitor status of Drosophila Myc cells requires p53 as a fitness sensor to reprogram metabolism and promote viability.
Claire de la Cova, Nanami Senoo-Matsuda, Marcello Ziosi, D. Christine Wu, Paola Bellosta, Catarina M. Quinzii, Laura A. Johnston
Cell Metabolism, 19, 470-483 (2014)
要 約
筆者らは,ショウジョウバエにおいてがん遺伝子産物Mycがその発現量の差異により細胞競合を誘導し,器官の発生におけるさまざまな細胞の運命を制御し,器官の最終的な大きさおよびかたちを正しく制御していることを報告してきた.今回,細胞競合が生じる際にMycの発現量の高いMyc高発現細胞とMycの発現量の低いMyc低発現細胞とが互いを感知し,細胞非自律的にそれぞれの細胞特性が決定づけられるしくみにおいて,Mycおよびp53によるエネルギー代謝の協調的な制御が重要な役割をはたすことが明らかにされた.競合条件下におけるMyc高発現細胞では,Mycおよびp53により細胞非自律的に好気的な解糖が亢進し,増殖能および生存能がより高まり,勝ち組としての細胞特性を獲得することが示された.Myc低発現細胞においては,p53は細胞死などを介して,負け組としての細胞特性を得るため重要な役割をはたすことが示された.このような代謝の変化による細胞運命の制御は,がん化およびがんの悪性化,また,iPS細胞の初期化における代謝のリプログラミングとも類似していた.今後,がんや再生の分野において,細胞競合の概念に注視しその普遍的な分子機構が解明されることにより,新たな知見の得られることが期待される.
はじめに
細胞競合とは,増殖が速く生存能の高い,あるいは,適応度の高い細胞(勝ち組)と,増殖が遅く細胞死により排除される,あるいは,適応度の低い細胞(負け組)とが,互いに細胞非自律的に競合して増殖,生存,分化が統合的に制御されることにより,最終的に一定の大きさと機能をもつ器官が形成される現象として定義される.その機構は,多細胞生物の組織構築の過程における種々の細胞の運命決定ばかりでなく,がんの発症初期におけるがん前駆細胞の排除,成熟したがん細胞の優勢な増殖,幹細胞ニッチにおける適応性の高い幹細胞の選択,などにおいて,広く重要な役割をはたすと考えられている.
筆者らは,この論文において,がん遺伝子産物Mycにより制御される細胞競合において,勝ち組あるいは負け組となる細胞が互いを認知し細胞非自律的にそれぞれの細胞特性(適応度)を決定づけるため,Mycとp53によるエネルギー代謝の協調的な制御が重要な役割をはたしていることを明らかにした.
1.Mycにより誘導される細胞競合
筆者らはこれまでに,ショウジョウバエの幼虫の翅原基(将来,成虫の翅になる組織)から成虫の翅まで発生するところを解析するin vivoのモデル,および,ショウジョウバエの培養細胞株であるS2細胞を用いた共培養系によるin vitroのモデルを構築し,Mycの発現量の高いMyc高発現細胞が勝ち組となり,Mycの発現量の低い(すなわち,野生型の)Myc低発現細胞が負け組となって,互いに競合することを見い出していた1,2).Mycは,その発現量の差異により細胞の成長と増殖,細胞死,細胞周期を統合的に制御することより,器官の発生においてさまざまな細胞の運命を制御し,器官の最終的な大きさおよびかたちを正しく制御していた.
2.エネルギー代謝の制御におけるMycの役割
予備的な検討から,Mycによる細胞競合が生じる際に,とくに勝ち組となるMyc高発現細胞におけるエネルギー代謝の変化がWarburg効果と類似していることが見い出された.多細胞組織におけるがん化あるいはがんの悪性化にかかわるエネルギー代謝の変化として,Mycをはじめとした多くのがん遺伝子産物によりWarburg効果として知られる代謝ステータスの変化をともなう細胞特性の変化,とくに好気的な解糖の亢進の生じることが報告されている3).しかしながら,がん細胞における代謝ステータスの制御の詳細についてはほとんど不明である.
興味深いことに,多能性幹細胞であるES細胞においても,その代謝は解糖系に依存するという特徴がある4).また,iPS細胞の樹立において多能性を獲得する初期化の過程においては,ミトコンドリア代謝から解糖系を中心とした代謝への移行がみられ,iPS細胞もES細胞と同様に解糖系への依存性を示す.つまり,多能性を獲得する初期化の過程において,代謝についてもリプログラミングが起こり,解糖系に依存する代謝の変化は多能性マーカーの発現にさきだって起こることが知られている5).MycはiPS細胞の樹立に必要な山中4因子のひとつであり,このような代謝のリプログラミングにおいて,Warburg効果と類似したしくみを利用して細胞特性の変化を制御している可能性が示唆される.
Mycにより,グルコーストランスポーターであるGLUT1および解糖系にかかわる10の酵素のうちの9つの酵素の発現,また,ミトコンドリア代謝への最初のステップであるピルビン酸からアセチルCoAへの変換を触媒するピルビン酸脱水素酵素の阻害酵素であるPDK1の発現が亢進することが報告されている6).すなわち,Mycにより解糖系が亢進し,ミトコンドリア代謝が抑制される方向で代謝が制御されることが示されているが,これだけでは,好気的な解糖の亢進という代謝ステータスを得るしくみを説明することはできなかった.
3.非競合条件下におけるMyc高発現細胞の代謝ステータス
非競合条件下(単培養系)において,Mycにより誘導される代謝の変化について解析した.その結果,Myc高発現細胞においては.Myc低発現細胞である野生型の細胞と比較して,糖代謝に関連する酵素の発現が上昇し,グルコースの取り込みの上昇,および,解糖系の亢進のみられることが明らかになった.また興味深いことに,非競合条件下においてMyc高発現細胞では,ミトコンドリア代謝に関連するピルビン酸デヒドロゲナーゼ複合体のE1のαサブユニット,電子伝達系複合体IIのIpサブユニット,電子伝達系複合体IIIのSCO2サブユニットの発現が上昇し,電子伝達系複合体IIの酵素活性は有意に上昇したのに対し,電子伝達系複合体IVの酵素活性およびATPの量は低下することが示された(図1a).
4.競合条件下におけるMyc高発現細胞の代謝ステータス
これまでに筆者らは,Mycにより細胞競合が生じる際に,勝ち組および負け組となる細胞が互いを認知し細胞非自律的にそれぞれの細胞特性を変化させること,すなわち,勝ち組(Myc高発現細胞)では増殖能および生存能がより高くなり,負け組(Myc低発現細胞)では増殖能および生存能がより低くなることを報告してきた1,2).
競合条件下(間接共培養系)において勝ち組となるMyc高発現細胞の代謝を,非競合条件下における代謝と比較したところ,グルコーストランスポーターであるGLUT1およびGLUT3の発現の顕著な上昇,ヘキソキナーゼや乳酸デヒドロゲナーゼなど解糖系に関連する酵素の発現の有意な上昇がみられるとともに,グルコースの取り込みの顕著な上昇がみられ,糖代謝が大きく亢進していることが示された.また,競合条件下においてMyc高発現細胞では,非競合条件下と比較して電子伝達系複合体IIIのSCO2サブユニットの発現が有意に上昇し,ミトコンドリア代謝は低下が認められたものの維持され,より顕著な好気的な糖代謝の亢進のみられることが明らかになった(図1b).
5.Myc高発現細胞においてp53の発現は上昇する
Mycにより発現の上昇する,ミトコンドリア代謝に関連する電子伝達系複合体IIIのSCO2サブユニットに着目した7).このタンパク質はがん抑制遺伝子産物p53によりミトコンドリア代謝を維持するため正方向に制御され,がん化や老化などの細胞特性の変化にともないミトコンドリア代謝を活性化して糖代謝を抑制することにより,代謝のバランスを制御する重要な役割をはたすことが報告されている8,9).Myc遺伝子など細胞増殖を誘導するがん遺伝子を高く発現させた細胞ではp53の発現が強く誘導され,p53を介する迅速な応答としてアポトーシスが誘導される10).また,活性型の変異をもつrasがん遺伝子を強制発現させた細胞では,p53の活性化に依存して細胞に老化が生じ増殖が停止する11).すなわち,p53はがん遺伝子により異常な増殖速度を示すようになった細胞をアポトーシスや老化により排除することでがん化を抑制すると考えられている12).p53の活性化は,Myc遺伝子をはじめ種々のがん遺伝子を正常な細胞に導入することにより観察されるが,これは細胞増殖の促進にともなうDNA複製ストレス,および,がん化誘導ストレスにより惹起されるDNA損傷への応答であると考えられている12,13).
細胞競合の解析系において,エネルギー代謝,細胞死,ゲノム不安定性などに関して,Mycとp53とのあいだに協調的な制御が存在するかどうか興味がもたれた.筆者らの細胞競合の解析系ではMycの過剰な発現による細胞自律的な細胞死を排除するため,in vivo解析系およびin vitro解析系のいずれも,Myc高発現細胞において野生型の細胞と比較して約2~3倍の発現量というおだやかな増加となるよう条件を設定しており,Mycによる細胞自律的な細胞死は認められない1,2).これらの解析系は,細胞競合のかかわる組織の発生および再生,また,がんなどの疾患のしくみを解析するため,より生理的な条件を反映したモデルとなっているものと考えている.
in vivoおよびin vitroの細胞競合の解析系において,p53の発現はMycにより野生型の細胞の約2~3倍におだやかに上昇することが確認された.また,p53の発現を抑制した場合には電子伝達系複合体IIIのSCO2サブユニットの発現は有意に低下し,ミトコンドリア代謝が低下して糖代謝を中心とするエネルギー代謝に変化することが明らかにされた.
6.p53はMycにより誘導される細胞競合のため必要である
Mycにより誘導される細胞競合におけるp53の役割について解析した.興味深いことに,in vivoおよびin vitroの細胞競合の解析系においてp53の機能を抑制すると,勝ち組であったMyc高発現細胞の増殖能および生存能は顕著に低下して負け組に転じ,一方,負け組であったMyc低発現細胞は増殖能および生存能が相対的に高まり勝ち組に転じた.すなわち,Myc高発現細胞とMyc低発現細胞それぞれの細胞特性が逆転することが明らかになった.そこで,p53の機能抑制によるMyc高発現細胞における代謝の変化を解析したところ,勝ち組の細胞特性として観察されていたGLUT1,GLUT3,電子伝達系複合体IIIのSCO2サブユニットの発現の顕著な上昇がいずれも抑制されていた.このことから,p53はMycと協調して,勝ち組においてミトコンドリア代謝を維持した糖代謝の亢進(すなわち,好気的な解糖の亢進)を誘導するために重要な役割をはたしていることが示された.p53の機能抑制により,Myc高発現細胞においては糖代謝およびミトコンドリア代謝が抑制されて細胞内のATP量が顕著に低下し,Myc低発現細胞においては相対的に糖代謝の亢進およびミトコンドリア代謝の維持がみられたことから,前者は勝ち組から負け組に,後者は負け組から勝ち組に,それぞれ転じたものと考えられた.
さらに,p53を欠損した遺伝学的な背景において,Myc高発現細胞でうめつくされた幼虫の翅原基にMyc低発現細胞のクローンを作出したところ,競合する2種類の細胞の境界にあるMyc高発現細胞において,アポトーシスの有意な増加,および,DNAを損傷した細胞の有意な増加がみられた.このような細胞死およびゲノム不安定性の増大は,勝ち組から負け組に転じたp53欠損Myc高発現細胞における特異的かつ細胞非自律的な反応であり,非競合条件下にあるp53欠損Myc高発現細胞においては観察されなかった.
これらの結果から,勝ち組となるMyc高発現細胞では,p53の活性化により細胞非自律的に好気的な糖代謝が亢進するという代謝ステータスの変化が観察され,この変化により生存能の亢進,および,ゲノム不安定性の抑制が制御されることが示された(図1b).さらに,Gal80を用いたモザイク解析によりp53欠損のありなしの条件を詳細に変化させて解析した結果,p53はMyc高発現細胞が勝ち組としての特性を得るために必要であるだけでなく,Myc低発現細胞である野生型の細胞が細胞死などを介し負け組としての特性を得るための制御にもかかわっていることが示された(図1b).
おわりに
これまでの解析から,細胞競合という新たな生命原理の概念として,ある細胞の運命は近接する細胞との特性の差により決定される,単独で集団を形成すれば生存可能な細胞であってもより適応度の高い細胞に出会うと積極的に排除される,まわりの細胞との相対的な関係に依存してある環境で負け組となる細胞が別の環境においては勝ち組になりうる,といった可能性が示唆されてきた.今回,筆者らは,Mycによる細胞競合のモデルにおいて,Warburg効果に類似した代謝ステータスの変化がMycおよびp53により協調的に制御され,p53の機能を抑制した場合には勝ち組と負け組の細胞特性(適応度)が逆転するという現象を見い出した.ここで見い出された代謝ステータスの制御は,発生,再生,発がんなど種々の生命現象において共通する細胞競合の普遍的な原理を解明するための手がかりになるものと考えられる.今後はさらに,細胞の適応度の決定にかかわる新規のタンパク質の同定と機能解析,および,細胞どうしが細胞非自律的に適応度の差を感知する分子機構の解明をめざすことが課題である.
文 献
- de la Cova, C., Abril, M., Bellosta, P. et al.: Drosophila myc regulates organ size by inducing cell competition. Cell, 117, 107-116 (2004)[PubMed]
- Senoo-Matsuda, N. & Johnston, L. A.: Soluble factors mediate competitive and cooperative interactions between cells expressing different levels of Drosophila Myc. Proc. Natl. Acad. Sci. USA, 104, 18543-18348 (2007)[PubMed]
- Warburg, O.: On respiratory impairment in cancer cells. Science, 124, 269-270 (1956)[PubMed]
- Panopoulos, A. D., Yanes, O., Ruiz, S. et al.: The metabolome of induced pluripotent stem cells reveals metabolic changes occurring in somatic cell reprogramming. Cell Res., 22,168-177 (2012)[PubMed]
- Hansson J., Rafiee, M. R., Reiland, S. et al.: Highly coordinated proteome dynamics during reprogramming of somatic cells to pluripotency. Cell Rep., 2, 1579-1592 (2012)[PubMed]
- Yeung, S. J., Pan, J. & Lee, M. H.: Roles of p53, MYC and HIF-1 in regulating glycolysis - the seventh hallmark of cancer. Cell. Mol. Life Sci., 65, 3981-3999 (2008)[PubMed]
- Porcelli, D., Oliva, M., Duchi, S. et al.: Genetic, functional and evolutionary, characterization of scox, the Drosophila melanogaster ortholog of the human SCO1 gene. Mitochondrion, 10, 433-448 (2010)[PubMed]
- Matoba, S., Kang, J. G., Patino, W. D. et al.: p53 regulates mitochondrial, respiration. Science, 312, 1650-1653 (2006)[PubMed]
- Vousden, K. H. & Ryan, K. M.: p53 and metabolism. Nat. Rev. Cancer, 9, 691-700 (2009)[PubMed]
- Lowe, S. W., Ruley, H. E., Jacks, T. et al.: p53-dependent apoptosis modulates the cytotoxicity of anticancer agents. Cell, 74, 957-967 (1993)[PubMed]
- Serrano, M., Lin, A. W., McCurrach M. E. et al.: Oncogenic ras provokes premature cell senescence associated with accumulation of p53 and p16INK4a. Cell, 88, 593-602 (1997)[PubMed]
- Lowe, S. W., Cepero E. & Evan, G.: Intrinsic tumour suppression. Nature, 432, 307-315 (2004)[PubMed]
- Reimann, M., Loddenkemper, C., Rudolph, C. et al.: The Myc-evoked DNA damage response accounts for treatment resistance in primary lymphomas in vivo. Blood, 110, 2996-3004 (2007)[PubMed]
著者プロフィール
略歴:2002年 東海大学大学院医学研究科にて博士号取得,理化学研究所脳科学総合研究センター 研究員,2003年 東京大学大学院薬学系研究科 研究員,2004年 米国Columbia大学Postdoctoral Research Scientist,2009年 早稲田大学理工学術院先進理工学研究科 講師を経て,2012年より同 客員准教授.
研究テーマ:発生,再生,がん,老化といった高次生命現象において細胞の特性を決定する普遍的な機構と,エネルギー代謝あるいはミトコンドリアの機能との関係に興味をもっている.
© 2014 松田 七美 Licensed under CC 表示 2.1 日本