大腸菌におけるエステル合成経路の拡張
田代洋平・渥美正太
(米国California大学Davis校Department of Chemistry)
email:田代洋平,渥美正太
DOI: 10.7875/first.author.2014.041
Expanding ester biosynthesis in Escherichia coli.
Gabriel M. Rodriguez, Yohei Tashiro, Shota Atsumi
Nature Chemical Biology, 10, 259-265 (2014)
炭素数4から12の低分子エステルは揮発性をもち,その用途は食品や飲料の香味料,化粧品に含まれる芳香,工業的な溶剤,塗料,燃料まで多岐にわたる.筆者らは,望みのエステルの生物生産を可能にするため,遺伝子工学的な手法により大腸菌の生体触媒としての機能を拡張することを試みた.アルコールO-アシル転移酵素はアシルCoAとアルコールとを縮合しエステルを合成する.この反応ではCoAの放出により発生する自由エネルギーがエステル合成における駆動力となる.さまざまなアシルCoA合成経路およびアルコール合成経路が発見あるいは構築されているなか,アシルCoA合成経路とアルコール合成経路との組合せにより大腸菌におけるエステル合成経路を拡張した.とくに,グルコースからの酢酸イソブチルの生産においては高い生産性を達成することができた.また,同様のアプローチにより,酢酸テトラデシルや数種のイソブチル酸エステルなど,多様なエステルの生物生産にも成功した.
炭素数4から12の低分子エステルは揮発性をもち,自然界ではおもに果実や花などから発せられ動物や虫の誘引や病原菌からの防衛などにおいて重要な役割をはたしている1).ワインやビールに含まれる香りの主成分のひとつもまたエステルである2).エステルはその特徴から,食品や飲料の香味料,化粧品の芳香成分,さらには,溶剤,ペンキ,燃料などの工業的な目的など,用途は多岐にわたっている.
一般に,エステルはアルコールと有機酸との脱水的な縮合により化学合成される(図1).エステル合成反応は常温,水相において,その逆反応である加水分解反応が熱力学的に有利である(図1).エステルを合成するためには,高温条件において,さらに酸触媒などにより,平衡をエステル合成反応へとシフトさせる必要がある3).エステラーゼやリパーゼなどの酵素触媒を利用しても,化学的なプロセスと同様に,熱力学的な不利が問題となる4).
生体触媒は大腸菌や酵母といった微生物を利用した触媒であり,有用な化合物や燃料を再生可能な条件において合成するうえで注目をあつめている5).生体触媒による合成は化学合成と比較して,1)高いエナンチオ選択性や位置選択性をもつ,2)多段階あるいは複数の反応を並列に触媒できる,3)常温,常圧,水相においてさまざまな反応を触媒できる,などの点において有利である.
細胞は補酵素などを利用することにより高いエステル合成能を実現している.細胞においては,アルコールO-アシル転移酵素,ワックスエステル合成酵素,ジアシルグリセロールO-アシル転移酵素などがエステル合成反応を触媒している.それらの酵素は,エステルの有機酸ユニットとして有機酸ではなくアシルCoAを用いている(図1).この反応では,アシルCoAにチオエステル結合として蓄えられたエネルギーがエステルの合成を大きく促進するため,エステルを効率的に合成することができる.同様の原理は,これまでおもにワックスエステルの生産に利用されてきた6,7).筆者らは,この反応を用いて炭素数4から16までの揮発性の低分子エステルを生物生産することを試みた.
細胞においてもっとも豊富なアシルCoAは炭素数2のアセチルCoAである.アルコールO-アシル転移酵素の存在下において,アセチルCoAはアルコールの水酸基をアセチル基へと変換するための基質になる.このエステル合成反応は,イソ酪酸CoAや酪酸CoAといった炭素数が2よりも多く複雑な構造をもつアシルCoAへも応用可能である.自然界において,いくつかの分岐アシルCoAの合成経路が知られている.分岐アミノ酸の分解経路やイソプレノイドの代謝経路においては中間体として分岐アシルCoAが合成される6,8).これら分岐アシルCoAを供給する経路を利用できれば,より大きなエステルの合成も可能となる.このことは,細胞においてアルコールとアシルCoAとのコンビナトリアルアプローチによるエステル合成経路のデザインが可能なことを意味する.
大腸菌にはアセチルCoAが豊富に存在することから,大腸菌においてアセチルCoAとアルコールから酢酸エステルを合成する経路をデザインした.エタノール,イソプロパノール,イソブタノール,そして1-ブタノールなどいくつかのアルコールに関しては,すでに高収量かつ高収率の合成経路が確立されている.高収量かつ高収率で合成されたアルコールをエステルに変換できれば,エステルの商業化レベルでの生物生産が可能になる.
まず,ケト酸を前駆体とするアルコール合成経路に着目した.この経路は,広い基質選択性をもつケト酸脱炭酸酵素とアルコールデヒドロゲナーゼを用いることにより,望みのアルコールをそれに対応するケト酸から高い効率で得ることができる9).そこで,ケト酸から酢酸エステルまでの3ステップの経路を大腸菌にデザインした.大腸菌はアルコールデヒドロゲナーゼをコードするadh遺伝子をいくつかゲノムにコードしており,さまざまなアルデヒドをアルコールへと変換する機能を備えている.大腸菌に乳酸菌に由来するケト酸脱炭酸酵素をコードするkdc遺伝子,および,出芽酵母に由来するアルコールO-アシル転移酵素をコードするATF1遺伝子を導入した.この大腸菌の培養液にさまざまなケト酸をくわえ培養したところ,それぞれケト酸に対応するエステルが高収量で生産された.これは,ATF1のアルコールアセチル化活性が非常に高く分岐アルコールへの基質選択性が広いことを示した.
つぎに,アルコールO-アシル転移酵素ATF1の直鎖アルコールに対する活性を調べるため,さきほどと同じ大腸菌の培養液に炭素数2から10の直鎖アルコールを添加しエステルの合成量を調べた.酢酸エチルや酢酸ブチルなどの短い直鎖アルコールに対する酢酸エステルの合成量は低かったものの,炭素数が6より長い直鎖アルコールに対しては高い活性を示した.この結果は,炭素数6以上の直鎖アルコールはエステル化のよい標的となることを示した.近年,逆β酸化経路や脂肪酸の合成経路などを利用し,炭素数4から10の直鎖アルコールを高い効率で合成することが可能になりつつある.これらのアルコール合成経路とATF1との組合せでもエステルの合成が可能であることが示された.
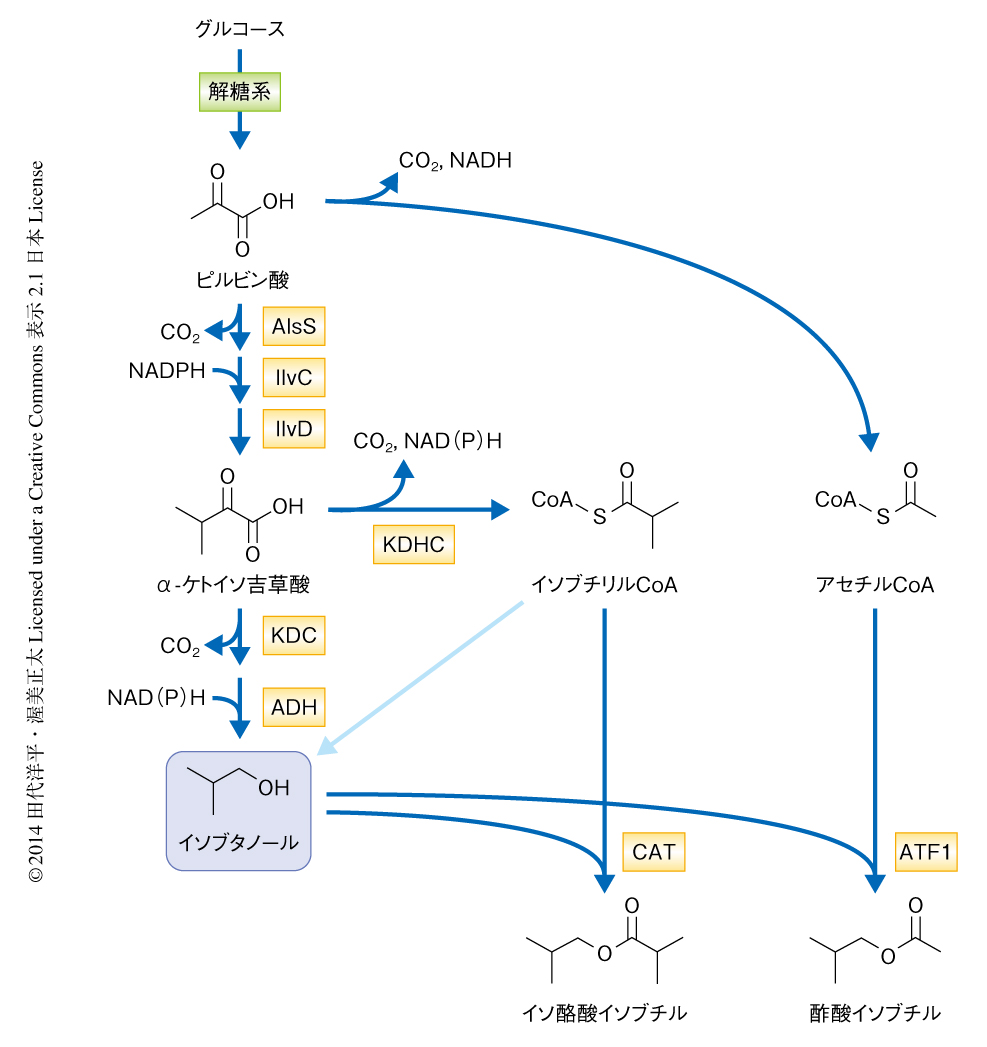
大腸菌において,ケト酸-エステル経路を拡張し,再生可能な炭素源であるグルコースから酢酸エステルを合成する経路を構築した.酢酸エステルとしては酢酸イソブチルを選択した.既存の研究において,酢酸イソブチルの前駆体であるイソブタノールはグルコースからほぼ最大理論収率で変換できることが示されており,高収量かつ高収率での酢酸イソブチルの生産が期待できたからである.イソブタノールに対応するケト酸であるα-ケトイソ吉草酸については,alsS遺伝子,ilvC遺伝子,ilvD遺伝子の3つの遺伝子を導入することによりグルコースからの収量および収率を大幅に向上させることができる.ここに,乳酸菌に由来するケト酸脱炭酸酵素をコードするkdc遺伝子およびアルコールデヒドロゲナーゼをコードするadh遺伝子を追加で導入することにより,イソブタノールの高収量かつ高収率での合成経路が完成した(図2).
このイソブタノール合成経路にさらに出芽酵母に由来するアルコールO-アシル転移酵素をコードするATF1遺伝子を導入することにより,酢酸イソブチルの生産を試みた.大腸菌株としては競合するイソブタノール合成経路がノックアウトされている株を利用した.この株は24時間で2.7 mg/mlの酢酸イソブチルを生産した.しかし,24時間のちにはその生産性は大きく低下した.また,最終的な細胞密度は24時間の時点と比較して20%も減少した.大腸菌の酢酸イソブチルに対する耐性濃度は約3 mg/mlであることから,生産性の低下は酢酸イソブチルの毒性によることが示唆された.そこで,酢酸イソブチルをin situで除去することにより毒性を軽減することにより収量および収率の向上をめざした.すなわち,抽出相として大腸菌の培養液にヘキサデカンを重層した.この2層培養法は培養液から3-メチル-1-ブタノールなど毒性の高い物質を抽出するときに用いられる方法である.ヘキサデカンを選択した理由は,水素結合を形成する官能基をもたないからである.この2層培養においては,イソブタノールはその高い水溶性のため培養液に多く存在するが,酢酸イソブチルへ変換されると疎水性が高くなりヘキサデカン相へと移動する.ヘキサデカンを重層した2層培養法では,24時間の培養により3.9 mg/mlの酢酸イソブチルが合成された,これは,培地のみ単層での培養と比べ44%の増加であった.95%以上の酢酸イソブチルはヘキサデカン層,85%以上のイソブタノールは培養液に存在していた.そののち,72時間の培養では酢酸イソブチルの合成量は17.2 mg/mlに達した.さらに,収率は理論最高収率のおよそ80%であった.
このエステル合成の戦略により,直鎖アルコールのエステルへの変換も可能であった.アルキル鎖の鎖長が14から18の酢酸エステルは化粧品の潤滑剤として利用され,また,その高いエネルギー密度から燃料としても期待されている.ここでは,グルコースから酢酸テトラデシルの合成を試みた.前駆体となるテトラデカノールの供給のためには細菌Vibrio harveyiの発光経路を用いた.この経路ではLuxCDE酵素複合体が炭素数14のアルデヒドを合成する.大腸菌においてLuxCDE酵素複合体を発現させるとテトラデシルアルデヒドが合成され10),さらに,大腸菌のもつアルコールデヒドロゲナーゼによりテトラデカノールへと変換される.このテトラデカノール合成経路にさらに出芽酵母に由来するアルコールO-アシル転移酵素をコードするATF1遺伝子を導入することにより,酢酸テトラデシルの生物生産に成功した.その収量はバイオ燃料として期待される脂肪酸エチルの収量と同等であった.
このエステル合成の戦略は,アセチルCoAを有機酸ユニットとして用いた場合,さまざまなアルコールからのエステルの生産を可能した.エステル合成経路を拡張するため,より大きなアシル鎖をもつCoAを供給する経路の構築を試みた.大腸菌においては,直鎖アシルCoAの合成経路は知られているが,分岐アシルCoAの合成経路は知られていない.自然界において,分岐アシルCoAは細菌や菌類などにおいてバリンやロイシンなどの分解経路の中間体として合成されることが知られている8).これらの経路では,分岐ケト酸デヒドロゲナーゼ複合体によりケト酸から分岐アシルCoAが合成される.そこで,細菌Pseudomonas putidaに由来する分岐ケト酸デヒドロゲナーゼ複合体をコードするKDHC遺伝子オペロンを大腸菌に導入し,その活性をin vitroおよびin vivoにおいて調べた.その結果,P. putidaの分岐ケト酸デヒドロゲナーゼ複合体は,α-ケト酪酸,α-ケト吉草酸,α-ケトイソ吉草酸,α-ケト-3-メチル吉草酸,α-ケト-4-メチル吉草酸などピルビン酸よりも大きなケト酸に対しより高い活性を示した.in vivoにおいては,それぞれのケト酸に対応するアルコールが検出された.分岐アシルCoAからアルコールの合成される経路の詳細は未解明だが,これらの結果は,大腸菌に分岐ケト酸デヒドロゲナーゼ複合体をコードするKDHC遺伝子オペロンを導入することにより,ケト酸からそれらに対応する分岐アシルCoAとアルコールを合成する経路を構築できたことを示した.
この分岐アシルCoA合成経路を利用し,酢酸エステルよりも高級なエステルであるイソ酪酸エステルの合成を試みた.まずは,分岐ケト酸デヒドロゲナーゼ複合体をコードするKDHC遺伝子オペロンを発現させた大腸菌に,さらに出芽酵母に由来するアルコールO-アシル転移酵素をコードするATF1遺伝子を発現させ,より高級なエステルが生産されるかどうかを調べた.しかし,ATF1は基質としてアセチルCoAを強く好むことからか,高級なエステルの合成には適していなかった.そこで,別のアルコールO-アシル転移酵素であるEEB1およびEHT1,そして,クロラムフェニコールアセチル転移酵素の3つの酵素について,分岐アシルCoAに対する活性をin vivoにおいて比較した.その結果,イソ酪酸イソブチルの合成にはクロラムフェニコールアセチル転移酵素が,イソ酪酸3-メチルブチル,イソ酪酸2-フェニルエチル,酪酸ブチルの合成にはEHT1が,それぞれ適していることがわかり,大腸菌においてグルコースからイソ酪酸イソブチルを生産することができた(図2).また,EHT1はエタノールヘキサノイルCoA転移酵素として知られているが,この結果から,EHT1はエタノールに対する高い選択性をもつわけではなく,より長鎖のアルコールも基質として受け入れることが明らかになった.合成を試みたエステルの10倍量のアルコールが未反応で残っていたことから,この系における律速はエステル化反応であると考えられた.
アシルCoAのチオエステル結合は反応を熱力学的に有利とすることによりエステルの合成を可能にする.洗練されたアルコール合成経路とアシルCoA合成経路とを組み合わせることにより,多様なエステルの生物生産が可能となった.アルコールO-アシル転移酵素の反応機構は,炭素数が2から18のアルコールの合成経路と相性がよい.組み合わせるアルコール合成経路の生産物に対する選択性が高い場合,特定のエステルを選択的に合成することが可能であった.以前から,微生物におけるワックスエステルの合成は同様の化学反応を利用していることが知られていたが,この研究は,ワックスエステルの化学反応が低分子エステルへも応用可能であることをはじめて証明した.
商業化レベルの収量および収率を達成するためには,経路全体のデザイン,それぞれの酵素の反応機構,そして,それぞれの酵素の活性を注意深く選択する必要がある.とくに,不可逆反応の有無は重要な要素のひとつである.実際に,効率の高いイソブタノール合成経路においては,アセト乳酸合成酵素AlsSおよびケト酸脱炭酸酵素という2つの酵素がともに高い活性をもち,さらに,脱炭酸をともなう不可逆反応であることが,高収率および高収量の大きな要因であると考えられた(図2).この研究において重要な前駆体であったアセチルCoAは,細胞においてはピルビン酸から不可逆な脱炭酸反応により合成される(図2).さらに,エステル化反応において,アセチルCoAはチオエステル結合として保存されたエネルギーを駆動力として利用している(図1).これらの経路のデザインにより,酢酸イソブチルの合成は高収率かつ高収量に達したものと思われた.
略歴:2012年 千葉大学大学院工学研究科 修了,同年より米国California大学Davis校 ポスドク研究員.
研究テーマ:バイオ燃料のための代謝工学.
抱負:誠実なサイエンスを続けていく.
渥美 正太(Shota Atsumi)
米国California大学Davis校Assistant Professor.
研究室URL:http://chemgroups.ucdavis.edu/~atsumi/home.html
© 2014 田代洋平・渥美正太 Licensed under CC 表示 2.1 日本
(米国California大学Davis校Department of Chemistry)
email:田代洋平,渥美正太
DOI: 10.7875/first.author.2014.041
Expanding ester biosynthesis in Escherichia coli.
Gabriel M. Rodriguez, Yohei Tashiro, Shota Atsumi
Nature Chemical Biology, 10, 259-265 (2014)
要 約
炭素数4から12の低分子エステルは揮発性をもち,その用途は食品や飲料の香味料,化粧品に含まれる芳香,工業的な溶剤,塗料,燃料まで多岐にわたる.筆者らは,望みのエステルの生物生産を可能にするため,遺伝子工学的な手法により大腸菌の生体触媒としての機能を拡張することを試みた.アルコールO-アシル転移酵素はアシルCoAとアルコールとを縮合しエステルを合成する.この反応ではCoAの放出により発生する自由エネルギーがエステル合成における駆動力となる.さまざまなアシルCoA合成経路およびアルコール合成経路が発見あるいは構築されているなか,アシルCoA合成経路とアルコール合成経路との組合せにより大腸菌におけるエステル合成経路を拡張した.とくに,グルコースからの酢酸イソブチルの生産においては高い生産性を達成することができた.また,同様のアプローチにより,酢酸テトラデシルや数種のイソブチル酸エステルなど,多様なエステルの生物生産にも成功した.
はじめに
炭素数4から12の低分子エステルは揮発性をもち,自然界ではおもに果実や花などから発せられ動物や虫の誘引や病原菌からの防衛などにおいて重要な役割をはたしている1).ワインやビールに含まれる香りの主成分のひとつもまたエステルである2).エステルはその特徴から,食品や飲料の香味料,化粧品の芳香成分,さらには,溶剤,ペンキ,燃料などの工業的な目的など,用途は多岐にわたっている.
一般に,エステルはアルコールと有機酸との脱水的な縮合により化学合成される(図1).エステル合成反応は常温,水相において,その逆反応である加水分解反応が熱力学的に有利である(図1).エステルを合成するためには,高温条件において,さらに酸触媒などにより,平衡をエステル合成反応へとシフトさせる必要がある3).エステラーゼやリパーゼなどの酵素触媒を利用しても,化学的なプロセスと同様に,熱力学的な不利が問題となる4).
生体触媒は大腸菌や酵母といった微生物を利用した触媒であり,有用な化合物や燃料を再生可能な条件において合成するうえで注目をあつめている5).生体触媒による合成は化学合成と比較して,1)高いエナンチオ選択性や位置選択性をもつ,2)多段階あるいは複数の反応を並列に触媒できる,3)常温,常圧,水相においてさまざまな反応を触媒できる,などの点において有利である.
細胞は補酵素などを利用することにより高いエステル合成能を実現している.細胞においては,アルコールO-アシル転移酵素,ワックスエステル合成酵素,ジアシルグリセロールO-アシル転移酵素などがエステル合成反応を触媒している.それらの酵素は,エステルの有機酸ユニットとして有機酸ではなくアシルCoAを用いている(図1).この反応では,アシルCoAにチオエステル結合として蓄えられたエネルギーがエステルの合成を大きく促進するため,エステルを効率的に合成することができる.同様の原理は,これまでおもにワックスエステルの生産に利用されてきた6,7).筆者らは,この反応を用いて炭素数4から16までの揮発性の低分子エステルを生物生産することを試みた.
1.エステル合成経路のコンビナトリアルデザイン
細胞においてもっとも豊富なアシルCoAは炭素数2のアセチルCoAである.アルコールO-アシル転移酵素の存在下において,アセチルCoAはアルコールの水酸基をアセチル基へと変換するための基質になる.このエステル合成反応は,イソ酪酸CoAや酪酸CoAといった炭素数が2よりも多く複雑な構造をもつアシルCoAへも応用可能である.自然界において,いくつかの分岐アシルCoAの合成経路が知られている.分岐アミノ酸の分解経路やイソプレノイドの代謝経路においては中間体として分岐アシルCoAが合成される6,8).これら分岐アシルCoAを供給する経路を利用できれば,より大きなエステルの合成も可能となる.このことは,細胞においてアルコールとアシルCoAとのコンビナトリアルアプローチによるエステル合成経路のデザインが可能なことを意味する.
2.大腸菌における酢酸エステル合成経路の構築
大腸菌にはアセチルCoAが豊富に存在することから,大腸菌においてアセチルCoAとアルコールから酢酸エステルを合成する経路をデザインした.エタノール,イソプロパノール,イソブタノール,そして1-ブタノールなどいくつかのアルコールに関しては,すでに高収量かつ高収率の合成経路が確立されている.高収量かつ高収率で合成されたアルコールをエステルに変換できれば,エステルの商業化レベルでの生物生産が可能になる.
まず,ケト酸を前駆体とするアルコール合成経路に着目した.この経路は,広い基質選択性をもつケト酸脱炭酸酵素とアルコールデヒドロゲナーゼを用いることにより,望みのアルコールをそれに対応するケト酸から高い効率で得ることができる9).そこで,ケト酸から酢酸エステルまでの3ステップの経路を大腸菌にデザインした.大腸菌はアルコールデヒドロゲナーゼをコードするadh遺伝子をいくつかゲノムにコードしており,さまざまなアルデヒドをアルコールへと変換する機能を備えている.大腸菌に乳酸菌に由来するケト酸脱炭酸酵素をコードするkdc遺伝子,および,出芽酵母に由来するアルコールO-アシル転移酵素をコードするATF1遺伝子を導入した.この大腸菌の培養液にさまざまなケト酸をくわえ培養したところ,それぞれケト酸に対応するエステルが高収量で生産された.これは,ATF1のアルコールアセチル化活性が非常に高く分岐アルコールへの基質選択性が広いことを示した.
つぎに,アルコールO-アシル転移酵素ATF1の直鎖アルコールに対する活性を調べるため,さきほどと同じ大腸菌の培養液に炭素数2から10の直鎖アルコールを添加しエステルの合成量を調べた.酢酸エチルや酢酸ブチルなどの短い直鎖アルコールに対する酢酸エステルの合成量は低かったものの,炭素数が6より長い直鎖アルコールに対しては高い活性を示した.この結果は,炭素数6以上の直鎖アルコールはエステル化のよい標的となることを示した.近年,逆β酸化経路や脂肪酸の合成経路などを利用し,炭素数4から10の直鎖アルコールを高い効率で合成することが可能になりつつある.これらのアルコール合成経路とATF1との組合せでもエステルの合成が可能であることが示された.
3.グルコースからの酢酸イソブチルおよび酢酸テトラデシルの生産
大腸菌において,ケト酸-エステル経路を拡張し,再生可能な炭素源であるグルコースから酢酸エステルを合成する経路を構築した.酢酸エステルとしては酢酸イソブチルを選択した.既存の研究において,酢酸イソブチルの前駆体であるイソブタノールはグルコースからほぼ最大理論収率で変換できることが示されており,高収量かつ高収率での酢酸イソブチルの生産が期待できたからである.イソブタノールに対応するケト酸であるα-ケトイソ吉草酸については,alsS遺伝子,ilvC遺伝子,ilvD遺伝子の3つの遺伝子を導入することによりグルコースからの収量および収率を大幅に向上させることができる.ここに,乳酸菌に由来するケト酸脱炭酸酵素をコードするkdc遺伝子およびアルコールデヒドロゲナーゼをコードするadh遺伝子を追加で導入することにより,イソブタノールの高収量かつ高収率での合成経路が完成した(図2).
このイソブタノール合成経路にさらに出芽酵母に由来するアルコールO-アシル転移酵素をコードするATF1遺伝子を導入することにより,酢酸イソブチルの生産を試みた.大腸菌株としては競合するイソブタノール合成経路がノックアウトされている株を利用した.この株は24時間で2.7 mg/mlの酢酸イソブチルを生産した.しかし,24時間のちにはその生産性は大きく低下した.また,最終的な細胞密度は24時間の時点と比較して20%も減少した.大腸菌の酢酸イソブチルに対する耐性濃度は約3 mg/mlであることから,生産性の低下は酢酸イソブチルの毒性によることが示唆された.そこで,酢酸イソブチルをin situで除去することにより毒性を軽減することにより収量および収率の向上をめざした.すなわち,抽出相として大腸菌の培養液にヘキサデカンを重層した.この2層培養法は培養液から3-メチル-1-ブタノールなど毒性の高い物質を抽出するときに用いられる方法である.ヘキサデカンを選択した理由は,水素結合を形成する官能基をもたないからである.この2層培養においては,イソブタノールはその高い水溶性のため培養液に多く存在するが,酢酸イソブチルへ変換されると疎水性が高くなりヘキサデカン相へと移動する.ヘキサデカンを重層した2層培養法では,24時間の培養により3.9 mg/mlの酢酸イソブチルが合成された,これは,培地のみ単層での培養と比べ44%の増加であった.95%以上の酢酸イソブチルはヘキサデカン層,85%以上のイソブタノールは培養液に存在していた.そののち,72時間の培養では酢酸イソブチルの合成量は17.2 mg/mlに達した.さらに,収率は理論最高収率のおよそ80%であった.
このエステル合成の戦略により,直鎖アルコールのエステルへの変換も可能であった.アルキル鎖の鎖長が14から18の酢酸エステルは化粧品の潤滑剤として利用され,また,その高いエネルギー密度から燃料としても期待されている.ここでは,グルコースから酢酸テトラデシルの合成を試みた.前駆体となるテトラデカノールの供給のためには細菌Vibrio harveyiの発光経路を用いた.この経路ではLuxCDE酵素複合体が炭素数14のアルデヒドを合成する.大腸菌においてLuxCDE酵素複合体を発現させるとテトラデシルアルデヒドが合成され10),さらに,大腸菌のもつアルコールデヒドロゲナーゼによりテトラデカノールへと変換される.このテトラデカノール合成経路にさらに出芽酵母に由来するアルコールO-アシル転移酵素をコードするATF1遺伝子を導入することにより,酢酸テトラデシルの生物生産に成功した.その収量はバイオ燃料として期待される脂肪酸エチルの収量と同等であった.
4.分岐アシルCoA合成経路の構築
このエステル合成の戦略は,アセチルCoAを有機酸ユニットとして用いた場合,さまざまなアルコールからのエステルの生産を可能した.エステル合成経路を拡張するため,より大きなアシル鎖をもつCoAを供給する経路の構築を試みた.大腸菌においては,直鎖アシルCoAの合成経路は知られているが,分岐アシルCoAの合成経路は知られていない.自然界において,分岐アシルCoAは細菌や菌類などにおいてバリンやロイシンなどの分解経路の中間体として合成されることが知られている8).これらの経路では,分岐ケト酸デヒドロゲナーゼ複合体によりケト酸から分岐アシルCoAが合成される.そこで,細菌Pseudomonas putidaに由来する分岐ケト酸デヒドロゲナーゼ複合体をコードするKDHC遺伝子オペロンを大腸菌に導入し,その活性をin vitroおよびin vivoにおいて調べた.その結果,P. putidaの分岐ケト酸デヒドロゲナーゼ複合体は,α-ケト酪酸,α-ケト吉草酸,α-ケトイソ吉草酸,α-ケト-3-メチル吉草酸,α-ケト-4-メチル吉草酸などピルビン酸よりも大きなケト酸に対しより高い活性を示した.in vivoにおいては,それぞれのケト酸に対応するアルコールが検出された.分岐アシルCoAからアルコールの合成される経路の詳細は未解明だが,これらの結果は,大腸菌に分岐ケト酸デヒドロゲナーゼ複合体をコードするKDHC遺伝子オペロンを導入することにより,ケト酸からそれらに対応する分岐アシルCoAとアルコールを合成する経路を構築できたことを示した.
5.大腸菌におけるより高級なエステルの合成
この分岐アシルCoA合成経路を利用し,酢酸エステルよりも高級なエステルであるイソ酪酸エステルの合成を試みた.まずは,分岐ケト酸デヒドロゲナーゼ複合体をコードするKDHC遺伝子オペロンを発現させた大腸菌に,さらに出芽酵母に由来するアルコールO-アシル転移酵素をコードするATF1遺伝子を発現させ,より高級なエステルが生産されるかどうかを調べた.しかし,ATF1は基質としてアセチルCoAを強く好むことからか,高級なエステルの合成には適していなかった.そこで,別のアルコールO-アシル転移酵素であるEEB1およびEHT1,そして,クロラムフェニコールアセチル転移酵素の3つの酵素について,分岐アシルCoAに対する活性をin vivoにおいて比較した.その結果,イソ酪酸イソブチルの合成にはクロラムフェニコールアセチル転移酵素が,イソ酪酸3-メチルブチル,イソ酪酸2-フェニルエチル,酪酸ブチルの合成にはEHT1が,それぞれ適していることがわかり,大腸菌においてグルコースからイソ酪酸イソブチルを生産することができた(図2).また,EHT1はエタノールヘキサノイルCoA転移酵素として知られているが,この結果から,EHT1はエタノールに対する高い選択性をもつわけではなく,より長鎖のアルコールも基質として受け入れることが明らかになった.合成を試みたエステルの10倍量のアルコールが未反応で残っていたことから,この系における律速はエステル化反応であると考えられた.
おわりに
アシルCoAのチオエステル結合は反応を熱力学的に有利とすることによりエステルの合成を可能にする.洗練されたアルコール合成経路とアシルCoA合成経路とを組み合わせることにより,多様なエステルの生物生産が可能となった.アルコールO-アシル転移酵素の反応機構は,炭素数が2から18のアルコールの合成経路と相性がよい.組み合わせるアルコール合成経路の生産物に対する選択性が高い場合,特定のエステルを選択的に合成することが可能であった.以前から,微生物におけるワックスエステルの合成は同様の化学反応を利用していることが知られていたが,この研究は,ワックスエステルの化学反応が低分子エステルへも応用可能であることをはじめて証明した.
商業化レベルの収量および収率を達成するためには,経路全体のデザイン,それぞれの酵素の反応機構,そして,それぞれの酵素の活性を注意深く選択する必要がある.とくに,不可逆反応の有無は重要な要素のひとつである.実際に,効率の高いイソブタノール合成経路においては,アセト乳酸合成酵素AlsSおよびケト酸脱炭酸酵素という2つの酵素がともに高い活性をもち,さらに,脱炭酸をともなう不可逆反応であることが,高収率および高収量の大きな要因であると考えられた(図2).この研究において重要な前駆体であったアセチルCoAは,細胞においてはピルビン酸から不可逆な脱炭酸反応により合成される(図2).さらに,エステル化反応において,アセチルCoAはチオエステル結合として保存されたエネルギーを駆動力として利用している(図1).これらの経路のデザインにより,酢酸イソブチルの合成は高収率かつ高収量に達したものと思われた.
文 献
- Beekwilder, J., Alvarez-Huerta, M., Neef, E. et al.: Functional characterization of enzymes forming volatile esters from strawberry and banana. Plant Physiol., 135, 1865-1878 (2004)[PubMed]
- Verstrepen, K. J., Van Laere, S. D., Vanderhaegen, B. M. et al.: Expression levels of the yeast alcohol acetyltransferase genes ATF1, Lg-ATF1, and ATF2 control the formation of a broad range of volatile esters. Appl. Environ. Microbiol., 69, 5228-5237 (2003)[PubMed]
- Liu, Y. J., Lotero, E. & Goodwin, J. G.: Effect of water on sulfuric acid catalyzed esterification. J. Mol. Catal. Chem., 245, 132-140 (2006)
- Stergiou, P. Y., Foukis, A., Filippou, M. et al.: Advances in lipase-catalyzed esterification reactions. Biotechnol. Adv., 31, 1846-1859 (2013)[PubMed]
- Rabinovitch-Deere, C. A., Oliver, J. W., Rodriguez, G. M. et al.: Synthetic biology and metabolic engineering approaches to produce biofuels. Chem. Rev., 113, 4611-4632 (2013)[PubMed]
- Holtzapple, E. & Schmidt-Dannert, C.: Biosynthesis of isoprenoid wax ester in Marinobacter hydrocarbonoclasticus DSM 8798: identification and characterization of isoprenoid coenzyme A synthetase and wax ester synthases. J. Bacteriol., 189, 3804-3812 (2007)[PubMed]
- Barney, B. M., Wahlen, B. D., Garner, E. et al.: Differences in substrate specificities of five bacterial wax ester synthases. Appl. Environ. Microbiol., 78, 5734-5745 (2012)[PubMed]
- Mooney, B. P., Miernyk, J. A. & Randall, D. D.: The complex fate of α-ketoacids. Annu. Rev. Plant Biol., 53, 357-375 (2002)[PubMed]
- Atsumi, S., Hanai, T. & Liao, J. C.: Non-fermentative pathways for synthesis of branched-chain higher alcohols as biofuels. Nature, 451, 86-89 (2008)[PubMed]
- Meighen, E. A.: Bacterial bioluminescence: organization, regulation, and application of the lux genes. FASEB J., 7, 1016-1022 (1993)[PubMed]
著者プロフィール
略歴:2012年 千葉大学大学院工学研究科 修了,同年より米国California大学Davis校 ポスドク研究員.
研究テーマ:バイオ燃料のための代謝工学.
抱負:誠実なサイエンスを続けていく.
渥美 正太(Shota Atsumi)
米国California大学Davis校Assistant Professor.
研究室URL:http://chemgroups.ucdavis.edu/~atsumi/home.html
© 2014 田代洋平・渥美正太 Licensed under CC 表示 2.1 日本