転写コアクチベーターPGC-1αは血管内皮において糖尿病性の血管障害の原因となる
澤田直樹1・Zolt Arany 2
(1東京医科歯科大学 歯と骨のグローバルCOE,2米国Beth Israel Deaconess Medical Center,Cardiovascular Institute and Center for Vascular Biology Research)
email:澤田直樹
DOI: 10.7875/first.author.2014.035
Endothelial PGC-1α mediates vascular dysfunction in diabetes.
Naoki Sawada, Aihua Jiang, Fumihiko Takizawa, Adeel Safdar, Andre Manika, Yevgenia Tesmenitsky, Kyu-Tae Kang, Joyce Bischoff, Hermann Kalwa, Juliano L. Sartoretto, Yasutomi Kamei, Laura E. Benjamin, Hirotaka Watada, Yoshihiro Ogawa, Yasutomi Higashikuni, Chase W. Kessinger, Farouc A. Jaffer, Thomas Michel, Masataka Sata, Kevin Croce, Rica Tanaka, Zolt Arany
Cell Metabolism, 19, 246-258 (2014)
血管内皮の機能の障害は糖尿病の主徴候であり,糖尿病における心血管合併症の多発の基盤をなす.しかし,なぜ糖尿病において高い率で血管内皮の機能が障害されるのか,機序は明らかではなく,その解明は治療法の開発の鍵となる.転写コアクチベーターであるPGC-1αはさまざまな細胞においてエネルギー産生の制御に機能し,肝臓および骨格筋においては糖尿病の病態にも関与する.しかし,血管内皮におけるPGC-1αの役割については未解明である.複数の糖尿病モデルマウスや糖尿病の患者から分離した血管内皮細胞および血管内皮前駆細胞においてPGC-1αの発現が上昇しており,一方,細胞の遊走能は低下していた.PGC-1αを血管内皮細胞に強制発現させると,糖尿病と同様に細胞の遊走および毛細血管の形成の低下が認められ,これはNotchシグナル伝達経路の活性化によるVEGF抵抗性の獲得に起因していた.マウスの生体において血管内皮細胞にPGC-1αを強制発現させたところ,ワイヤーにより傷害した血管の再内皮化,皮膚創傷の治癒,下肢虚血後の血流回復の速度が抑制された.逆に,血管内皮細胞においてPGC-1αを欠失させると,糖尿病による皮膚創傷の治癒および下肢虚血後の血流回復の遅延をほぼ完全に予防することができた.以上の結果から,糖尿病にともなう血管内皮の機能の障害および血管新生能の異常の原因が,高血糖によるPGC-1αの増加によることが明らかにされた.
糖尿病においては高率に血管内皮の機能の障害が合併し,そのため,一般の集団に比べ心血管病を高頻度に発症する1).重症の下肢虚血は糖尿病の患者の10~15%に認められ,下肢の切断の原因において首位をしめる病態であり,予後がきわめて不良であるため有効な治療法の開発が社会的な急務となっている.糖尿病の患者において下肢虚血をきたし重症化しやすい背景には,虚血に反応して新たな血管をつくり血流を回復させるための血管新生能が大きく減弱していることが関与しているが,その主要な機序は明らかにされていない.虚血におちいった組織ではVEGF(vascular endothelial growth factor,血管内皮増殖因子)を中心とする血管新生を促進する因子が産生される.2型糖尿病の患者の虚血組織ではVEGFの産生は認められるものの,なんらかの原因により血管がVEGFに反応しなくなるVEGF抵抗性のため,正常な血管の新生が起こらない.したがって,糖尿病において血管内皮がどのようにしてVEGF抵抗性を獲得するのかを明らかにすることが,減弱した血管新生能を回復させる有効な治療法の開発への鍵であるといえる2).
PGC-1αは核内受容体を中心とするさまざまな転写因子と結合し標的遺伝子の発現を制御する転写コアクチベーターであり,従来は,骨格筋,心筋,脂肪,脳などの臓器においてミトコンドリアの生合成および酸化的リン酸化を促進するなど細胞のエネルギー産生を制御する役割が知られてきたが,血管における役割は明確ではない3).一方,糖尿病では肝臓におけるPGC-1αの発現が持続的に上昇し糖新生の亢進および高血糖の持続につながること,骨格筋においてPGC-1αの機能が減弱しインスリン抵抗性が増強する原因となることなどが報告されており,糖尿病の病態に全身の臓器においてPGC-1αが重要な役割を担う可能性が示唆されている3).今回,筆者らは,糖尿病により血管内皮においてPGC-1αが持続的に増加して血管内皮のVEGF抵抗性を誘導すること,この機序により,PGC-1αが血管内皮において糖尿病における血管新生の障害をきたす主要な原因となることをつきとめた.
ストレプトゾシンの負荷による1型糖尿病のモデルマウス,高脂肪食の負荷による2型糖尿病のモデルマウス,遺伝的な2型糖尿病のモデルマウス(db/dbマウスおよびob/obマウス)のおのおのから採取した血管内皮細胞すべてにおいて,PGC-1αをコードするmRNAの量は糖尿病ではない対照マウスと比較して1.5~3倍に増加していた.2型糖尿病の患者の末梢血に存在する血管内皮前駆細胞を多く含むCD34陽性細胞,および,採取ののち培養して分化させた血管内皮前駆細胞においても同様に,健常者に比べPGC-1αのmRNAの量は増加していた.正常なマウスの血管内皮細胞に高濃度のグルコースを負荷するとPGC-1αのmRNAの量が増加することから,糖尿病においてはおもに高血糖が原因となり血管内皮におけるPGC-1αの発現が上昇すると考えられた.
糖尿病マウスに由来する培養血管内皮細胞および糖尿病の患者に由来する培養血管内皮前駆細胞では,PGC-1αの増加が認められるとともに,血管内皮細胞の遊走能は低下していた.一方,糖尿病ではない正常な血管内皮細胞に遺伝子導入によりPGC-1αを強制的に発現させると血管内皮細胞の遊走能は低下した.また,PGC-1αの強制発現により,VEGFやスフィンゴシン1-リン酸など血管新生を促進する因子により誘導されるAktなどの細胞内シグナルの活性化,および,これら因子によるラメリポディアの形成や細胞膜の直下のアクチン重合網の形成などの形態変化は認められず,糖尿病におけるVEGF抵抗性と類似する病態を呈した.PGC-1αを強制的に発現させた血管内皮細胞において,細胞遊走の阻害作用をもつ細胞膜タンパク質Notchをウェスタンブロット法により,および,Notchシグナル伝達経路の下流の遺伝子の発現量を定量的RT-PCR法により検討したところ,PGC-1αによるNotchシグナル伝達経路の強力な活性化が認められた4).PGC-1αによる血管内皮細胞の遊走および血管片からの毛細血管の形成の抑制は,Notchシグナル伝達経路の阻害により完全に消失し,PGC-1αによる血管新生の抑制作用およびVEGF抵抗性のほとんどはNotchを介する効果と判断された.
非糖尿病ではない正常な血管内皮をVEGFなど血管新生を促進する因子により刺激すると,数時間のうちにPGC-1αが著明に減少した.この所見から,血管新生を促進する因子に反応して血管内皮細胞が遊走する際に,細胞内においてPGC-1αの量が減少することが重要な役割をはたす可能性が示唆された.実際に,PGC-1αを欠損したマウスの血管内皮は,血管新生を促進する因子による刺激がない状態でも著明な細胞遊走能を呈し,毛細血管の形成能も上昇した.
血管機能の制御におけるPGC-1αの役割を生体内の血管内皮において検討するため,血管内皮細胞においてPGC-1αを過剰に発現するトランスジェニックマウスを作製した.このトランスジェニックマウスでは,頸動脈の血管内皮をワイヤーにより機械的に擦過傷害したのちの血管内皮の再生の減弱,背部に小さな皮膚の欠損を作製したのちの創傷治癒の抑制,下肢虚血術ののちの血流の回復の減弱が認められた.糖尿病モデルマウスおよび糖尿病の患者においてもこれらと同様の病態が認められることから,血管内皮におけるPGC-1αの発現の上昇が糖尿病性の血管障害の原因である可能性が示唆された.
糖尿病性の血管障害における血管内皮のPGC-1αの役割を直接的に検討するため,血管内皮細胞においてPGC-1αが正常の3割程度にまで減少しているノックアウトマウスを作製し,皮膚創傷モデル実験および下肢虚血モデル実験を施行した.糖尿病を発症した野生型マウスでは糖尿病を発症していない場合に比べ皮膚の創傷治癒能が低下したが,ノックアウトマウスでは糖尿病を発症しても糖尿病を発症していない場合と同様に健常な速度で創傷が治癒した.同様に,下肢虚血後の血流回復は糖尿病を発症した野生型マウスにおいて顕著に低下したが,ノックアウトマウスでは糖尿病の発症の有無にかかわらず血流は正常に回復した.
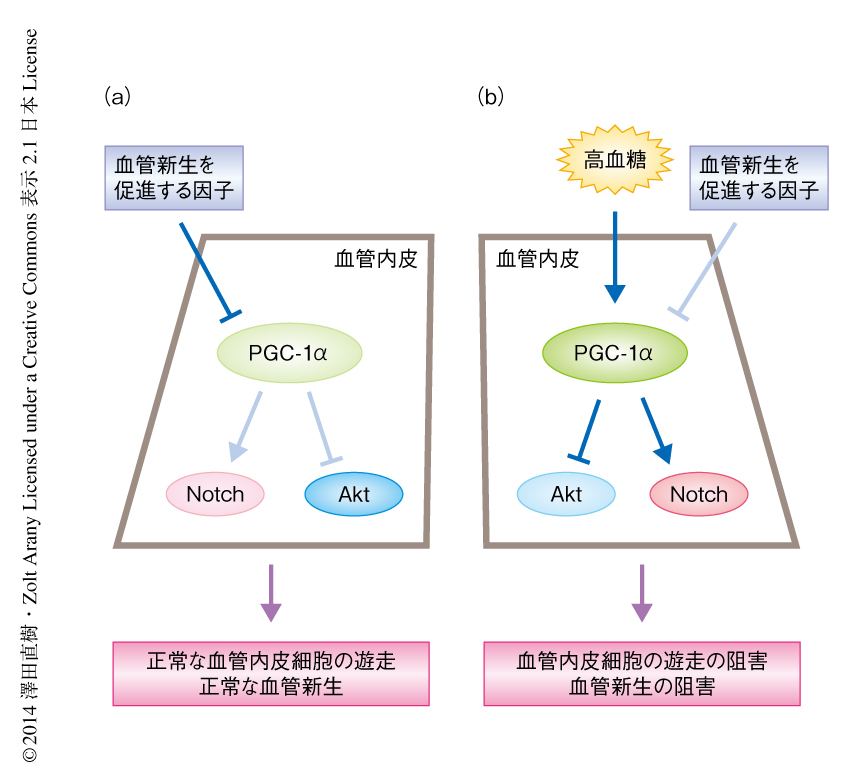
糖尿病の患者の多くで認められる血管内皮の機能の異常および血管新生能の低下の発症機序には,いまなお不明な点が多く,有効な治療法は確立されていない.そのため,重症の下肢虚血や難治性の皮膚潰瘍がもたらされ,下肢の切断にまでいたるケースが少なくない.この研究の結果から,糖尿病による高血糖により血管内皮においてPGC-1αのはたらきが亢進する結果,血管新生を促進する因子に対する血管内皮細胞の反応が低下し,新しく血管をつくりだす能力が損なわれることが解明された(図1).糖尿病における血管新生の異常は,重症の下肢虚血にくわえ,心筋梗塞を起こしたのちの心機能の悪化にも深く関与する.この研究の成果は,血管内皮のPGC-1αを標的とすることにより,糖尿病による血管合併症の新たな治療法の開発に道を拓くものである.
略歴:2001年 京都大学大学院医学研究科博士課程 修了,2003年 米国Brigham and Women’s Hospital博士研究員,2008年 米国Beth Israel Deaconess Medical Center博士研究員,2009年 東京医科歯科大学 歯と骨のグローバルCOE特任講師を経て,2013年より米国Chicago大学 准教授.
研究テーマ:代謝と血管の機能とをむすぶシグナル,血管内皮前駆細胞,代謝性疾患のエピゲノム制御.
関心事:医師研究者として少しでも“病気を治す”ことに近づくための研究をめざしたい,という思いが,最近,とくに強くなってきました.
Zolt Arany
米国Beth Israel Deaconess Medical CenterにてAssociate Professor.
© 2014 澤田直樹・Zolt Arany Licensed under CC 表示 2.1 日本
(1東京医科歯科大学 歯と骨のグローバルCOE,2米国Beth Israel Deaconess Medical Center,Cardiovascular Institute and Center for Vascular Biology Research)
email:澤田直樹
DOI: 10.7875/first.author.2014.035
Endothelial PGC-1α mediates vascular dysfunction in diabetes.
Naoki Sawada, Aihua Jiang, Fumihiko Takizawa, Adeel Safdar, Andre Manika, Yevgenia Tesmenitsky, Kyu-Tae Kang, Joyce Bischoff, Hermann Kalwa, Juliano L. Sartoretto, Yasutomi Kamei, Laura E. Benjamin, Hirotaka Watada, Yoshihiro Ogawa, Yasutomi Higashikuni, Chase W. Kessinger, Farouc A. Jaffer, Thomas Michel, Masataka Sata, Kevin Croce, Rica Tanaka, Zolt Arany
Cell Metabolism, 19, 246-258 (2014)
要 約
血管内皮の機能の障害は糖尿病の主徴候であり,糖尿病における心血管合併症の多発の基盤をなす.しかし,なぜ糖尿病において高い率で血管内皮の機能が障害されるのか,機序は明らかではなく,その解明は治療法の開発の鍵となる.転写コアクチベーターであるPGC-1αはさまざまな細胞においてエネルギー産生の制御に機能し,肝臓および骨格筋においては糖尿病の病態にも関与する.しかし,血管内皮におけるPGC-1αの役割については未解明である.複数の糖尿病モデルマウスや糖尿病の患者から分離した血管内皮細胞および血管内皮前駆細胞においてPGC-1αの発現が上昇しており,一方,細胞の遊走能は低下していた.PGC-1αを血管内皮細胞に強制発現させると,糖尿病と同様に細胞の遊走および毛細血管の形成の低下が認められ,これはNotchシグナル伝達経路の活性化によるVEGF抵抗性の獲得に起因していた.マウスの生体において血管内皮細胞にPGC-1αを強制発現させたところ,ワイヤーにより傷害した血管の再内皮化,皮膚創傷の治癒,下肢虚血後の血流回復の速度が抑制された.逆に,血管内皮細胞においてPGC-1αを欠失させると,糖尿病による皮膚創傷の治癒および下肢虚血後の血流回復の遅延をほぼ完全に予防することができた.以上の結果から,糖尿病にともなう血管内皮の機能の障害および血管新生能の異常の原因が,高血糖によるPGC-1αの増加によることが明らかにされた.
はじめに
糖尿病においては高率に血管内皮の機能の障害が合併し,そのため,一般の集団に比べ心血管病を高頻度に発症する1).重症の下肢虚血は糖尿病の患者の10~15%に認められ,下肢の切断の原因において首位をしめる病態であり,予後がきわめて不良であるため有効な治療法の開発が社会的な急務となっている.糖尿病の患者において下肢虚血をきたし重症化しやすい背景には,虚血に反応して新たな血管をつくり血流を回復させるための血管新生能が大きく減弱していることが関与しているが,その主要な機序は明らかにされていない.虚血におちいった組織ではVEGF(vascular endothelial growth factor,血管内皮増殖因子)を中心とする血管新生を促進する因子が産生される.2型糖尿病の患者の虚血組織ではVEGFの産生は認められるものの,なんらかの原因により血管がVEGFに反応しなくなるVEGF抵抗性のため,正常な血管の新生が起こらない.したがって,糖尿病において血管内皮がどのようにしてVEGF抵抗性を獲得するのかを明らかにすることが,減弱した血管新生能を回復させる有効な治療法の開発への鍵であるといえる2).
PGC-1αは核内受容体を中心とするさまざまな転写因子と結合し標的遺伝子の発現を制御する転写コアクチベーターであり,従来は,骨格筋,心筋,脂肪,脳などの臓器においてミトコンドリアの生合成および酸化的リン酸化を促進するなど細胞のエネルギー産生を制御する役割が知られてきたが,血管における役割は明確ではない3).一方,糖尿病では肝臓におけるPGC-1αの発現が持続的に上昇し糖新生の亢進および高血糖の持続につながること,骨格筋においてPGC-1αの機能が減弱しインスリン抵抗性が増強する原因となることなどが報告されており,糖尿病の病態に全身の臓器においてPGC-1αが重要な役割を担う可能性が示唆されている3).今回,筆者らは,糖尿病により血管内皮においてPGC-1αが持続的に増加して血管内皮のVEGF抵抗性を誘導すること,この機序により,PGC-1αが血管内皮において糖尿病における血管新生の障害をきたす主要な原因となることをつきとめた.
1.糖尿病を発症すると血管内皮においてPGC-1αの発現が上昇する
ストレプトゾシンの負荷による1型糖尿病のモデルマウス,高脂肪食の負荷による2型糖尿病のモデルマウス,遺伝的な2型糖尿病のモデルマウス(db/dbマウスおよびob/obマウス)のおのおのから採取した血管内皮細胞すべてにおいて,PGC-1αをコードするmRNAの量は糖尿病ではない対照マウスと比較して1.5~3倍に増加していた.2型糖尿病の患者の末梢血に存在する血管内皮前駆細胞を多く含むCD34陽性細胞,および,採取ののち培養して分化させた血管内皮前駆細胞においても同様に,健常者に比べPGC-1αのmRNAの量は増加していた.正常なマウスの血管内皮細胞に高濃度のグルコースを負荷するとPGC-1αのmRNAの量が増加することから,糖尿病においてはおもに高血糖が原因となり血管内皮におけるPGC-1αの発現が上昇すると考えられた.
2.PGC-1αは血管内皮においてNotchシグナル伝達経路を活性化させ血管内皮細胞の遊走および毛細血管の形成を抑制する
糖尿病マウスに由来する培養血管内皮細胞および糖尿病の患者に由来する培養血管内皮前駆細胞では,PGC-1αの増加が認められるとともに,血管内皮細胞の遊走能は低下していた.一方,糖尿病ではない正常な血管内皮細胞に遺伝子導入によりPGC-1αを強制的に発現させると血管内皮細胞の遊走能は低下した.また,PGC-1αの強制発現により,VEGFやスフィンゴシン1-リン酸など血管新生を促進する因子により誘導されるAktなどの細胞内シグナルの活性化,および,これら因子によるラメリポディアの形成や細胞膜の直下のアクチン重合網の形成などの形態変化は認められず,糖尿病におけるVEGF抵抗性と類似する病態を呈した.PGC-1αを強制的に発現させた血管内皮細胞において,細胞遊走の阻害作用をもつ細胞膜タンパク質Notchをウェスタンブロット法により,および,Notchシグナル伝達経路の下流の遺伝子の発現量を定量的RT-PCR法により検討したところ,PGC-1αによるNotchシグナル伝達経路の強力な活性化が認められた4).PGC-1αによる血管内皮細胞の遊走および血管片からの毛細血管の形成の抑制は,Notchシグナル伝達経路の阻害により完全に消失し,PGC-1αによる血管新生の抑制作用およびVEGF抵抗性のほとんどはNotchを介する効果と判断された.
3.血管内皮において内因性のPGC-1αの発現は血管新生を促進する因子の刺激により減少する
非糖尿病ではない正常な血管内皮をVEGFなど血管新生を促進する因子により刺激すると,数時間のうちにPGC-1αが著明に減少した.この所見から,血管新生を促進する因子に反応して血管内皮細胞が遊走する際に,細胞内においてPGC-1αの量が減少することが重要な役割をはたす可能性が示唆された.実際に,PGC-1αを欠損したマウスの血管内皮は,血管新生を促進する因子による刺激がない状態でも著明な細胞遊走能を呈し,毛細血管の形成能も上昇した.
4.血管内皮におけるPGC-1αの活性の上昇が糖尿病における下肢虚血後の血流回復および皮膚創傷の治癒速度の低下の原因となる
血管機能の制御におけるPGC-1αの役割を生体内の血管内皮において検討するため,血管内皮細胞においてPGC-1αを過剰に発現するトランスジェニックマウスを作製した.このトランスジェニックマウスでは,頸動脈の血管内皮をワイヤーにより機械的に擦過傷害したのちの血管内皮の再生の減弱,背部に小さな皮膚の欠損を作製したのちの創傷治癒の抑制,下肢虚血術ののちの血流の回復の減弱が認められた.糖尿病モデルマウスおよび糖尿病の患者においてもこれらと同様の病態が認められることから,血管内皮におけるPGC-1αの発現の上昇が糖尿病性の血管障害の原因である可能性が示唆された.
糖尿病性の血管障害における血管内皮のPGC-1αの役割を直接的に検討するため,血管内皮細胞においてPGC-1αが正常の3割程度にまで減少しているノックアウトマウスを作製し,皮膚創傷モデル実験および下肢虚血モデル実験を施行した.糖尿病を発症した野生型マウスでは糖尿病を発症していない場合に比べ皮膚の創傷治癒能が低下したが,ノックアウトマウスでは糖尿病を発症しても糖尿病を発症していない場合と同様に健常な速度で創傷が治癒した.同様に,下肢虚血後の血流回復は糖尿病を発症した野生型マウスにおいて顕著に低下したが,ノックアウトマウスでは糖尿病の発症の有無にかかわらず血流は正常に回復した.
おわりに
糖尿病の患者の多くで認められる血管内皮の機能の異常および血管新生能の低下の発症機序には,いまなお不明な点が多く,有効な治療法は確立されていない.そのため,重症の下肢虚血や難治性の皮膚潰瘍がもたらされ,下肢の切断にまでいたるケースが少なくない.この研究の結果から,糖尿病による高血糖により血管内皮においてPGC-1αのはたらきが亢進する結果,血管新生を促進する因子に対する血管内皮細胞の反応が低下し,新しく血管をつくりだす能力が損なわれることが解明された(図1).糖尿病における血管新生の異常は,重症の下肢虚血にくわえ,心筋梗塞を起こしたのちの心機能の悪化にも深く関与する.この研究の成果は,血管内皮のPGC-1αを標的とすることにより,糖尿病による血管合併症の新たな治療法の開発に道を拓くものである.
文 献
- Rask-Madsen, C. & King, G. L.: Mechanisms of Disease: endothelial dysfunction in insulin resistance and diabetes. Nat. Clin. Pract. Endocrinol .Metab., 3, 46-56 (2007)[PubMed]
- Sasso, F. C., Torella, D., Carbonara, O. et al.: Increased vascular endothelial growth factor expression but impaired vascular endothelial growth factor receptor signaling in the myocardium of type 2 diabetic patients with chronic coronary heart disease. J. Am. Coll. Cardiol., 46, 827-834 (2005)[PubMed]
- Rowe, G. C., Jiang, A. & Arany, Z.: PGC-1 coactivators in cardiac development and disease. Circ. Res., 107, 825-838 (2011)[PubMed]
- Roca, C. & Adams, R. H.: Regulation of vascular morphogenesis by Notch signaling. Genes Dev., 21, 2511-2524 (2007)[PubMed]
著者プロフィール
略歴:2001年 京都大学大学院医学研究科博士課程 修了,2003年 米国Brigham and Women’s Hospital博士研究員,2008年 米国Beth Israel Deaconess Medical Center博士研究員,2009年 東京医科歯科大学 歯と骨のグローバルCOE特任講師を経て,2013年より米国Chicago大学 准教授.
研究テーマ:代謝と血管の機能とをむすぶシグナル,血管内皮前駆細胞,代謝性疾患のエピゲノム制御.
関心事:医師研究者として少しでも“病気を治す”ことに近づくための研究をめざしたい,という思いが,最近,とくに強くなってきました.
Zolt Arany
米国Beth Israel Deaconess Medical CenterにてAssociate Professor.
© 2014 澤田直樹・Zolt Arany Licensed under CC 表示 2.1 日本