平面内細胞極性経路とセプチンはアクトミオシンの区画化を介して組織形成における細胞運動を制御する
進藤 麻子
(米国Texas大学Austin校Department of Molecular Biosciences)
email:進藤麻子
DOI: 10.7875/first.author.2014.031
PCP and septins compartmentalize cortical actomyosin to direct collective cell movement.
Asako Shindo, John B. Wallingford
Science, 343, 649-652 (2014)
胚の発生において細胞が集団を維持しながら適切な形態変化および移動を行うことは,組織および器官の形成において根幹となる.細胞の形態変化あるいは移動の動力としてアクチンとミオシンとの複合体であるアクトミオシンがよく知られているが,脊椎動物の発生における組織の形成において,個々の細胞におけるアクトミオシンの制御と細胞集団の維持とがどのように協調して制御されているのかについてはよくわかっていない.筆者らは,この点を明らかにするため,アフリカツメガエルの原腸胚における脊索の形成をモデルに細長い組織をかたちづくる細胞運動として知られる収斂伸長運動について解析した.その結果,平面内細胞極性経路と細胞骨格タンパク質であるセプチンによる制御のもと,アクトミオシンが限局した細胞辺に蓄積し,その細胞辺を短縮させるための収縮力を発動していることを発見した.これまで,脊索における収斂伸長運動においてはラメリポディアによる細胞の牽引がその動力であると考えられてきたが,今回の発見は,それとは別に,空間的に限局した細胞どうしの結合面の収縮が細胞集団として方向性をもつ移動の動力となっていることを示した.また,その駆動の機構はほかの種の上皮系組織における収斂伸長運動と類似しており,活性化したアクトミオシンによる細胞どうしの結合面の収縮は,種および組織をこえた収斂伸長運動において共通の機構として機能していることが示唆された.
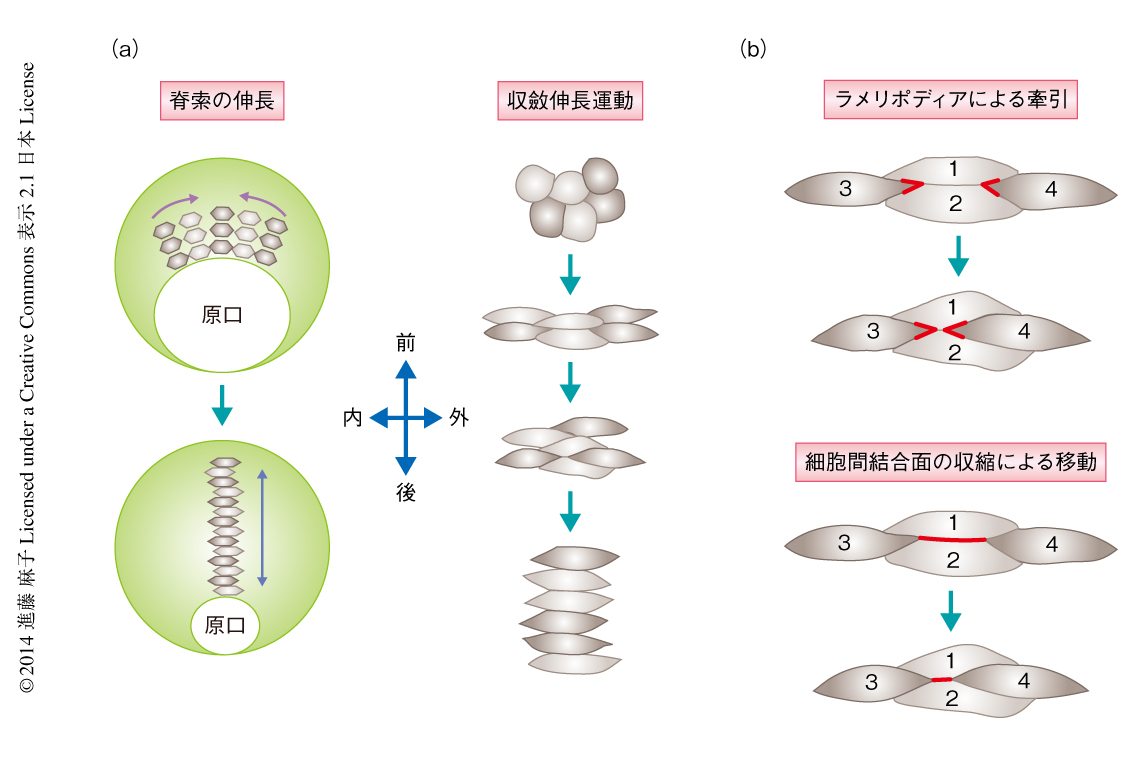
収斂伸長運動は胚の発生における組織の形態形成の基礎となる細胞集団の運動として知られており,その異常は神経管閉鎖の異常や先天性腎嚢胞など深刻な形態異常につながる1,2).収斂伸長運動のモデルとして古くから用いられてきたアフリカツメガエルの原腸胚では,原腸陥入の際に背側に形成される脊索を構成する細胞が,胚の前後軸に垂直の軸(= 内外側軸)にそって伸長し,互いに入り込むように移動することにより組織として幅が狭まり長くなる3,4)(図1a).このとき,伸長した細胞の両端に位置するラメリポディアが隣接する細胞にからみついて,互いに引っ張りあうことが細胞の動力であると考えられてきた5)(図1b).このラメリポディアは脊索での収斂伸長運動における細胞極性の象徴とも考えられ,収斂伸長運動に必須である平面内細胞極性(planar cell polarity:PCP)経路はアクチンを制御してこのラメリポディアを正しく配置させることがおもな機能であると理解されてきた6).
平面内細胞極性経路は脊索のみならず上皮系組織における収斂伸長運動においても必要であることが知られている.上皮系組織では細胞の両端に発達したラメリポディアによる細胞の牽引ではなく,アクトミオシンの活性化による細胞どうしの結合面の収縮と,細胞間の接合点の再構成が細胞の動力となっている(図1b).これは,アフリカツメガエルの胚の前腎管の伸長,および,ニワトリの胚の神経上皮の伸長において共通してみられる,収斂伸長運動の機構である2,7).これら上皮系組織の収斂伸長運動は,さきに述べた脊索におけるラメリポディアによる収斂伸長運動とは機構を異にするものであり,組織により異なる独立した機構が存在すると理解されてきた8).しかし,実際のところ,脊索における収斂伸長運動では活性化アクトミオシンの局在すら確認されたことはなく,さらには,収斂伸長運動にとり重要な制御機構で,かつ,ミオシンリン酸化酵素の活性化(アクトミオシンの活性化と同義)に必要であるとされている平面内細胞極性経路が9),実際に細胞のどの部位でミオシンリン酸化酵素を活性化しているかについても明らかではなかった.筆者らは,これらの点を明らかにするため,脊索での収斂伸長運動における活性化アクトミオシンの局在を解明することから研究にとりかかった.
脊索において収斂伸長運動をしている細胞における活性化アクトミオシンの局在を抗リン酸化ミオシン抗体により検出したところ,これまで,細胞の動力と考えられてきた細胞の両端に位置するラメリポディアにおいて特異的な染色はみられず,ラメリポディアが存在しないとされる胚の内外側軸とほぼ平行に配置する細胞辺において多く局在していた(図1b).これは意外な結果であり,1細胞において細胞の動力であると証明されてきた活性化アクトミオシンは,これまで考えられてきた脊索における収斂伸長運動の動力となる領域とは別の領域に存在していることが示された(図1b).
活性化アクトミオシンが検出された細胞辺において,実際に収縮力が発生しているかどうかについて検討した.レーザーアブレーション法により胚の内外側軸に平行に配置する細胞辺を切断し,その両端にある頂点の反動距離を測定したところ,内外側軸と平行に配置していない細胞辺と比較して有意に大きいことがわかった.これは,内外側軸にそった細胞辺により大きな張力のかかっていることを意味した.また,内外側軸に平行な細胞辺が短くなるにつれ,隣接した細胞との角度が小さくなっていくこともわかった.これは,隣接した細胞が細胞辺の収縮によりひきずられていると仮定すると納得することができた.これらの結果は,内外側軸にそった細胞辺がアクトミオシンの活性化により収縮し,隣接する細胞がそれにひきずられ,実際の入り込み運動の動力となっていることを示唆した.
内外側軸にそった細胞辺におけるアクチンの動態をライブイメージング法を用いてより詳細に解析したところ,アクチンのパルス状の蓄積とそれと同時に起こる細胞辺の短縮が観察された.アクトミオシンが活性化する領域においてアクチンの一過性の蓄積が観察されることが知られており,この結果は,細胞辺に存在する活性化アクトミオシンが細胞辺を収縮させていることを支持した.また,ミオシン軽鎖に対するライブイメージング法によっても,同様の結果が得られた.
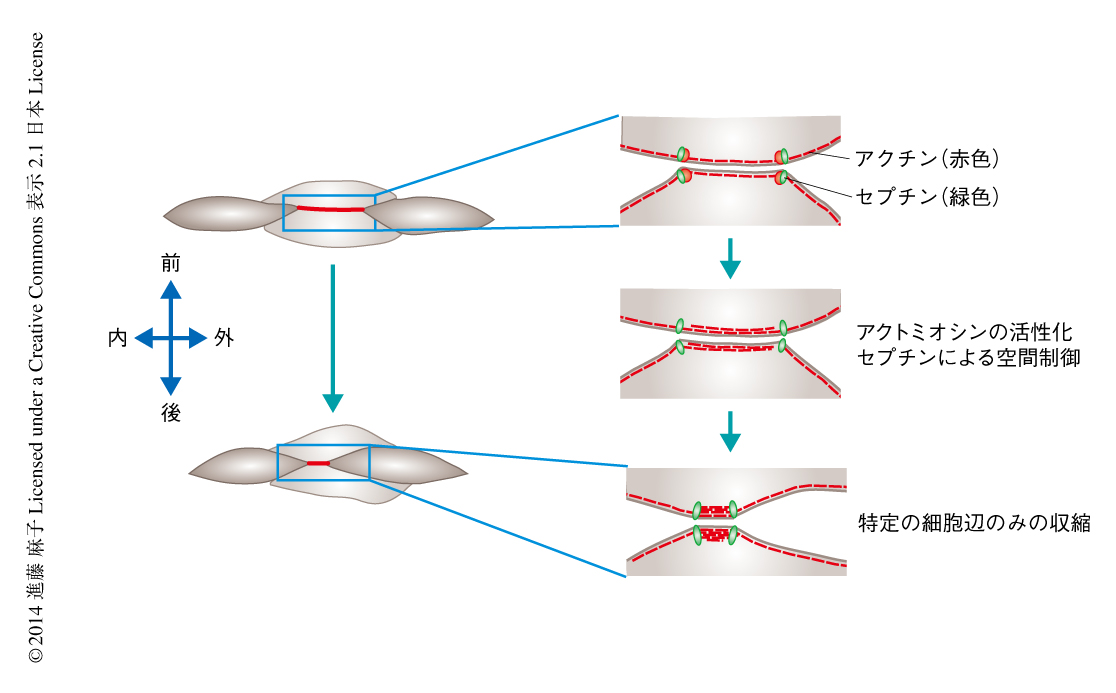
活性化アクトミオシンはなぜひとつの細胞において限局した領域のみにとどまるのだろうか.この点を解明するため,細胞皮質を区画化する機能をもつ細胞骨格タンパク質であるセプチンに着目した10).セプチンのひとつSeptin7の局在について調べたところ,GFPを結合させたSeptin7は細胞間の接合点に局在しており,アクチンは細胞皮質の全体にくわえ,Septin7の局在する部位により多く蓄積していた.Septin7をノックダウンするとアクチンの局在が乱れ,さらに,光活性化GFPを結合させたアクチンの動態を観察したところ,Septin7と共局在している細胞間の接合点では活性化させたGFPはそこから広がることなく,Septin7と共局在していない細胞辺においては広がりの速いことがわかった.この結果は,セプチンがアクチンの局在する場を空間的に制限している可能性を示唆した.また,Septin7をノックダウンするとリン酸化ミオシンの示す極性は阻害され,特定の細胞辺を収縮させるような空間配置を失うことがわかった.これらから,Septin7による細胞皮質におけるアクチンおよびミオシンの区画化が特定の細胞辺における活性化アクトミオシンの維持に貢献していることが示唆された.
平面内細胞極性経路は特定の細胞辺の収縮にどのようにかかわっているのだろうか.平面内細胞極性経路を構成するタンパク質のひとつDishevelled(Dvl)の機能を阻害すると,Septin7は細胞間の接合点のみでなく,細胞辺にも異所的に局在した.また,このときリン酸化ミオシンの示す極性も阻害されており,これらから,平面内細胞極性経路はセプチンを介して活性化アクトミオシンを特定の細胞辺において効率的に機能させ,方向性をもつ細胞の入り込み運動を可能にしていると示唆された(図2).
今回,筆者らは,アフリカツメガエルの脊索での収斂伸長運動において,これまで考えられてきた機序とは異なる細胞の動力の制御機構を示した.このモデルにより,既存のモデルでは説明の困難であった複数の事象の解明にむけて一歩前進したといえる.まず,収斂伸長運動における平面内細胞極性にかかわるタンパク質の役割の解明に近づいたことがあげられる.アフリカツメガエルの脊索において平面内細胞極性にかかわるタンパク質の局在については不明な点が多いが,ゼブラフィッシュやホヤの胚においてはリン酸化ミオシンの局在と同様に,内外側軸に平行な辺にそって局在することが示されている11,12).平面内細胞極性にかかわるタンパク質はミオシンリン酸化酵素の活性化に必要であることが示されていることから9),リン酸化ミオシンの局在は平面内細胞極性経路を構成するタンパク質の局在と一致する可能性が高い.平面内細胞極性経路によるアクトミオシンの活性化がどのタイミングで行われているかが今後の重要な課題となる.つぎに,活性化アクトミオシンによる細胞どうしの結合面の収縮が,収斂伸長運動の種および組織をこえた共通の機構であると示唆されたことがあげられる.さきに述べたように,アフリカツメガエルの胚の前腎管の伸長,および,ニワトリの胚の神経上皮の伸長,さらには,平面内細胞極性経路に依存しないと考えられているショウジョウバエの胚帯の伸長においても,細胞どうしの結合面の収縮と再構成が組織の伸長の動力となっていることが示されていた2,8,13).それと機序を異にすると考えられていたアフリカツメガエルの脊索において同様の細胞どうしの結合面の収縮のみられたことは,種および組織をこえた収斂伸長運動の機序の存在することを示し,その意義は大きい.最後に,収斂伸長運動の共通の機構と考えられるアクトミオシンの活性化による細胞どうしの結合面の収縮に,細胞皮質を区画化する能力をもつセプチンが重要な役割を担うことを示したことがあげられる.セプチンは酵母などの単細胞生物が分裂する際にその分裂面に蓄積し,活性化したアクトミオシンが分裂面のみに蓄積することを可能としていると考えられている14).収斂伸長運動におけるセプチンの動態の詳細な制御機構は今後の課題のひとつであるが,セプチンによる細胞皮質の区画化の機能が,単細胞生物の分裂の制御から多細胞生物の細胞集団の移動の制御まで保存されていることは興味深い.
今回,アクトミオシンの活性化が特定の細胞辺のみで維持される機構の一端を解明したが,いまだ,アクトミオシンの活性化の機構は解明されていない.これまでにほかの研究で示されてきた平面内細胞極性経路を構成するタンパク質の局在から,おそらく,平面内細胞極性経路がなんらかのきっかけをあたえることにより,その領域においてアクトミオシンの活性化をひき起こしている可能性は考えられるものの,その詳細は不明である.今後は,平面内細胞極性にかかわるタンパク質のアクトミオシンの活性化に対する実質的な役割を解明することが必要となる.
略歴:2008年 総合研究大学院大学生命科学研究科博士課程 修了,同年 基礎生物学研究所 研究員を経て,2009年より米国Texas大学Austin校 ポスドク.
研究テーマ:組織の形成における細胞動態の制御の機序.
抱負:医学はもっと発生生物学的な思考と知識を取り込む必要があるのではないかという意識をもち獣医学から発生生物学に転向した経緯から,“病気”とよばれる状態はおのおのの細胞のどのような変化によりひき起こされるのか,なぜ秩序が乱れるのか,その解明に少しでも貢献できるよう,正常な組織および器官における形態形成の機構を明らかにしていきたいと考えている.
© 2014 進藤 麻子 Licensed under CC 表示 2.1 日本
(米国Texas大学Austin校Department of Molecular Biosciences)
email:進藤麻子
DOI: 10.7875/first.author.2014.031
PCP and septins compartmentalize cortical actomyosin to direct collective cell movement.
Asako Shindo, John B. Wallingford
Science, 343, 649-652 (2014)
要 約
胚の発生において細胞が集団を維持しながら適切な形態変化および移動を行うことは,組織および器官の形成において根幹となる.細胞の形態変化あるいは移動の動力としてアクチンとミオシンとの複合体であるアクトミオシンがよく知られているが,脊椎動物の発生における組織の形成において,個々の細胞におけるアクトミオシンの制御と細胞集団の維持とがどのように協調して制御されているのかについてはよくわかっていない.筆者らは,この点を明らかにするため,アフリカツメガエルの原腸胚における脊索の形成をモデルに細長い組織をかたちづくる細胞運動として知られる収斂伸長運動について解析した.その結果,平面内細胞極性経路と細胞骨格タンパク質であるセプチンによる制御のもと,アクトミオシンが限局した細胞辺に蓄積し,その細胞辺を短縮させるための収縮力を発動していることを発見した.これまで,脊索における収斂伸長運動においてはラメリポディアによる細胞の牽引がその動力であると考えられてきたが,今回の発見は,それとは別に,空間的に限局した細胞どうしの結合面の収縮が細胞集団として方向性をもつ移動の動力となっていることを示した.また,その駆動の機構はほかの種の上皮系組織における収斂伸長運動と類似しており,活性化したアクトミオシンによる細胞どうしの結合面の収縮は,種および組織をこえた収斂伸長運動において共通の機構として機能していることが示唆された.
はじめに
収斂伸長運動は胚の発生における組織の形態形成の基礎となる細胞集団の運動として知られており,その異常は神経管閉鎖の異常や先天性腎嚢胞など深刻な形態異常につながる1,2).収斂伸長運動のモデルとして古くから用いられてきたアフリカツメガエルの原腸胚では,原腸陥入の際に背側に形成される脊索を構成する細胞が,胚の前後軸に垂直の軸(= 内外側軸)にそって伸長し,互いに入り込むように移動することにより組織として幅が狭まり長くなる3,4)(図1a).このとき,伸長した細胞の両端に位置するラメリポディアが隣接する細胞にからみついて,互いに引っ張りあうことが細胞の動力であると考えられてきた5)(図1b).このラメリポディアは脊索での収斂伸長運動における細胞極性の象徴とも考えられ,収斂伸長運動に必須である平面内細胞極性(planar cell polarity:PCP)経路はアクチンを制御してこのラメリポディアを正しく配置させることがおもな機能であると理解されてきた6).
平面内細胞極性経路は脊索のみならず上皮系組織における収斂伸長運動においても必要であることが知られている.上皮系組織では細胞の両端に発達したラメリポディアによる細胞の牽引ではなく,アクトミオシンの活性化による細胞どうしの結合面の収縮と,細胞間の接合点の再構成が細胞の動力となっている(図1b).これは,アフリカツメガエルの胚の前腎管の伸長,および,ニワトリの胚の神経上皮の伸長において共通してみられる,収斂伸長運動の機構である2,7).これら上皮系組織の収斂伸長運動は,さきに述べた脊索におけるラメリポディアによる収斂伸長運動とは機構を異にするものであり,組織により異なる独立した機構が存在すると理解されてきた8).しかし,実際のところ,脊索における収斂伸長運動では活性化アクトミオシンの局在すら確認されたことはなく,さらには,収斂伸長運動にとり重要な制御機構で,かつ,ミオシンリン酸化酵素の活性化(アクトミオシンの活性化と同義)に必要であるとされている平面内細胞極性経路が9),実際に細胞のどの部位でミオシンリン酸化酵素を活性化しているかについても明らかではなかった.筆者らは,これらの点を明らかにするため,脊索での収斂伸長運動における活性化アクトミオシンの局在を解明することから研究にとりかかった.
1.活性化アクトミオシンは胚の内外側軸に平行な方向に配置する細胞辺に蓄積する
脊索において収斂伸長運動をしている細胞における活性化アクトミオシンの局在を抗リン酸化ミオシン抗体により検出したところ,これまで,細胞の動力と考えられてきた細胞の両端に位置するラメリポディアにおいて特異的な染色はみられず,ラメリポディアが存在しないとされる胚の内外側軸とほぼ平行に配置する細胞辺において多く局在していた(図1b).これは意外な結果であり,1細胞において細胞の動力であると証明されてきた活性化アクトミオシンは,これまで考えられてきた脊索における収斂伸長運動の動力となる領域とは別の領域に存在していることが示された(図1b).
2.活性化アクトミオシンは局在した細胞辺に収縮力を発生させる
活性化アクトミオシンが検出された細胞辺において,実際に収縮力が発生しているかどうかについて検討した.レーザーアブレーション法により胚の内外側軸に平行に配置する細胞辺を切断し,その両端にある頂点の反動距離を測定したところ,内外側軸と平行に配置していない細胞辺と比較して有意に大きいことがわかった.これは,内外側軸にそった細胞辺により大きな張力のかかっていることを意味した.また,内外側軸に平行な細胞辺が短くなるにつれ,隣接した細胞との角度が小さくなっていくこともわかった.これは,隣接した細胞が細胞辺の収縮によりひきずられていると仮定すると納得することができた.これらの結果は,内外側軸にそった細胞辺がアクトミオシンの活性化により収縮し,隣接する細胞がそれにひきずられ,実際の入り込み運動の動力となっていることを示唆した.
3.細胞辺へのアクチンの一過性の蓄積は細胞辺の短縮と同時に生じる
内外側軸にそった細胞辺におけるアクチンの動態をライブイメージング法を用いてより詳細に解析したところ,アクチンのパルス状の蓄積とそれと同時に起こる細胞辺の短縮が観察された.アクトミオシンが活性化する領域においてアクチンの一過性の蓄積が観察されることが知られており,この結果は,細胞辺に存在する活性化アクトミオシンが細胞辺を収縮させていることを支持した.また,ミオシン軽鎖に対するライブイメージング法によっても,同様の結果が得られた.
4.セプチンは細胞皮質のアクチンおよびミオシンを区画化している
活性化アクトミオシンはなぜひとつの細胞において限局した領域のみにとどまるのだろうか.この点を解明するため,細胞皮質を区画化する機能をもつ細胞骨格タンパク質であるセプチンに着目した10).セプチンのひとつSeptin7の局在について調べたところ,GFPを結合させたSeptin7は細胞間の接合点に局在しており,アクチンは細胞皮質の全体にくわえ,Septin7の局在する部位により多く蓄積していた.Septin7をノックダウンするとアクチンの局在が乱れ,さらに,光活性化GFPを結合させたアクチンの動態を観察したところ,Septin7と共局在している細胞間の接合点では活性化させたGFPはそこから広がることなく,Septin7と共局在していない細胞辺においては広がりの速いことがわかった.この結果は,セプチンがアクチンの局在する場を空間的に制限している可能性を示唆した.また,Septin7をノックダウンするとリン酸化ミオシンの示す極性は阻害され,特定の細胞辺を収縮させるような空間配置を失うことがわかった.これらから,Septin7による細胞皮質におけるアクチンおよびミオシンの区画化が特定の細胞辺における活性化アクトミオシンの維持に貢献していることが示唆された.
5.平面内細胞極性にかかわるタンパク質はセプチンの局在および活性化アクトミオシンの極性において必要である
平面内細胞極性経路は特定の細胞辺の収縮にどのようにかかわっているのだろうか.平面内細胞極性経路を構成するタンパク質のひとつDishevelled(Dvl)の機能を阻害すると,Septin7は細胞間の接合点のみでなく,細胞辺にも異所的に局在した.また,このときリン酸化ミオシンの示す極性も阻害されており,これらから,平面内細胞極性経路はセプチンを介して活性化アクトミオシンを特定の細胞辺において効率的に機能させ,方向性をもつ細胞の入り込み運動を可能にしていると示唆された(図2).
おわりに
今回,筆者らは,アフリカツメガエルの脊索での収斂伸長運動において,これまで考えられてきた機序とは異なる細胞の動力の制御機構を示した.このモデルにより,既存のモデルでは説明の困難であった複数の事象の解明にむけて一歩前進したといえる.まず,収斂伸長運動における平面内細胞極性にかかわるタンパク質の役割の解明に近づいたことがあげられる.アフリカツメガエルの脊索において平面内細胞極性にかかわるタンパク質の局在については不明な点が多いが,ゼブラフィッシュやホヤの胚においてはリン酸化ミオシンの局在と同様に,内外側軸に平行な辺にそって局在することが示されている11,12).平面内細胞極性にかかわるタンパク質はミオシンリン酸化酵素の活性化に必要であることが示されていることから9),リン酸化ミオシンの局在は平面内細胞極性経路を構成するタンパク質の局在と一致する可能性が高い.平面内細胞極性経路によるアクトミオシンの活性化がどのタイミングで行われているかが今後の重要な課題となる.つぎに,活性化アクトミオシンによる細胞どうしの結合面の収縮が,収斂伸長運動の種および組織をこえた共通の機構であると示唆されたことがあげられる.さきに述べたように,アフリカツメガエルの胚の前腎管の伸長,および,ニワトリの胚の神経上皮の伸長,さらには,平面内細胞極性経路に依存しないと考えられているショウジョウバエの胚帯の伸長においても,細胞どうしの結合面の収縮と再構成が組織の伸長の動力となっていることが示されていた2,8,13).それと機序を異にすると考えられていたアフリカツメガエルの脊索において同様の細胞どうしの結合面の収縮のみられたことは,種および組織をこえた収斂伸長運動の機序の存在することを示し,その意義は大きい.最後に,収斂伸長運動の共通の機構と考えられるアクトミオシンの活性化による細胞どうしの結合面の収縮に,細胞皮質を区画化する能力をもつセプチンが重要な役割を担うことを示したことがあげられる.セプチンは酵母などの単細胞生物が分裂する際にその分裂面に蓄積し,活性化したアクトミオシンが分裂面のみに蓄積することを可能としていると考えられている14).収斂伸長運動におけるセプチンの動態の詳細な制御機構は今後の課題のひとつであるが,セプチンによる細胞皮質の区画化の機能が,単細胞生物の分裂の制御から多細胞生物の細胞集団の移動の制御まで保存されていることは興味深い.
今回,アクトミオシンの活性化が特定の細胞辺のみで維持される機構の一端を解明したが,いまだ,アクトミオシンの活性化の機構は解明されていない.これまでにほかの研究で示されてきた平面内細胞極性経路を構成するタンパク質の局在から,おそらく,平面内細胞極性経路がなんらかのきっかけをあたえることにより,その領域においてアクトミオシンの活性化をひき起こしている可能性は考えられるものの,その詳細は不明である.今後は,平面内細胞極性にかかわるタンパク質のアクトミオシンの活性化に対する実質的な役割を解明することが必要となる.
文 献
- Wallingford, J. B., Niswander, L. A., Shaw, G. M. et al.: The continuing challenge of understanding, preventing, and treating neural tube defects. Science, 339, 1222002 (2013)[PubMed]
- Lienkamp, S. S., Liu, K., Karner, C. M. et al.: Vertebrate kidney tubules elongate using a planar cell polarity-dependent, rosette-based mechanism of convergent extension. Nat. Genet., 44, 1382-1387 (2012)[PubMed]
- Wilson, P. A., Oster, G. & Keller, R.: Cell rearrangement and segmentation in Xenopus: direct observation of cultured explants. Development, 105, 155-166 (1989)[PubMed]
- Wilson, P. & Keller, R.: Cell rearrangement during gastrulation of Xenopus: direct observation of cultured explants. Development, 112, 289-300 (1991)[PubMed]
- Shih, J. & Keller, R.: Cell motility driving mediolateral intercalation in explants of Xenopus laevis. Development, 116, 901-14 (1992)[PubMed]
- Wallingford, J. B., Rowning, B. A., Vogeli, K. M. et al.: Dishevelled controls cell polarity during Xenopus gastrulation. Nature, 405, 81-85 (2000)[PubMed]
- Nishimura, T., Honda, H. & Takeichi, M.: Planar cell polarity links axes of spatial dynamics in neural-tube closure. Cell, 149, 1084-1097 (2012)[PubMed]
- Zallen, J. A.: Planar polarity and tissue morphogenesis. Cell, 129, 1051-1063 (2007)[PubMed]
- Winter, C. G., Wang, B., Ballew, A. et al.: Drosophila Rho-associated kinase (Drok) links Frizzled-mediated planar cell polarity signaling to the actin cytoskeleton. Cell, 105, 81-91 (2001)[PubMed]
- Mostowy, S. & Cossart, P.: Septins: the fourth component of the cytoskeleton. Nat. Rev. Mol. Cell Biol., 13, 183-194 (2012)[PubMed]
- Yin, C., Kiskowski, M., Pouille, P. A. et al.: Cooperation of polarized cell intercalations drives convergence and extension of presomitic mesoderm during zebrafish gastrulation. J. Cell Biol., 180, 221-232 (2008)[PubMed]
- Jiang, D., Munro, E. M., Smith, W. C. et al.: Ascidian prickle regulates both mediolateral and anterior-posterior cell polarity of notochord cells. Curr. Biol., 15, 79-85 (2005)[PubMed]
- Zallen, J. A. & Wieschaus, E.: Patterned gene expression directs bipolar planar polarity in Drosophila. Dev. Cell, 6, 343-355 (2004)[PubMed]
- Kinoshita, M., Field, C. M., Coughlin, M. L. et al.: Self- and actin-templated assembly of mammalian septins. Dev. Cell, 3, 791-802 (2002)[PubMed]
著者プロフィール
略歴:2008年 総合研究大学院大学生命科学研究科博士課程 修了,同年 基礎生物学研究所 研究員を経て,2009年より米国Texas大学Austin校 ポスドク.
研究テーマ:組織の形成における細胞動態の制御の機序.
抱負:医学はもっと発生生物学的な思考と知識を取り込む必要があるのではないかという意識をもち獣医学から発生生物学に転向した経緯から,“病気”とよばれる状態はおのおのの細胞のどのような変化によりひき起こされるのか,なぜ秩序が乱れるのか,その解明に少しでも貢献できるよう,正常な組織および器官における形態形成の機構を明らかにしていきたいと考えている.
© 2014 進藤 麻子 Licensed under CC 表示 2.1 日本